Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Epidemiologia e Serviços de Saúde
Print version ISSN 1679-4974On-line version ISSN 2237-9622
Epidemiol. Serv. Saúde vol.32 no.2 Brasília 2023 Epub Apr 24, 2023
http://dx.doi.org/10.1590/s2237-96222023000200009
ARTIGO ORIGINAL
Avaliação de indicadores de monitoramento do rastreamento do câncer de mama na população do sexo feminino atendida no Sistema Único de Saúde, Brasil, 2018-2019: estudo descritivo
1Instituto Nacional de Câncer, Divisão de Pesquisa Populacional, Rio de Janeiro, RJ, Brasil
2Instituto Nacional de Câncer, Divisão de Detecção Precoce e Apoio à Organização de Rede, Rio de Janeiro, RJ, Brasil
3Hospital Quinta D’Or, Rio de Janeiro, RJ, Brasil
Objetivo:
analisar indicadores de monitoramento do rastreamento do câncer de mama na população feminina usuária do Sistema Único de Saúde, Brasil, no período 2018-2019.
Métodos:
estudo descritivo, a partir do Sistema de Informação do Câncer; foram calculados indicadores de rastreamento após relacionamento determinístico das bases de dados de mamografia e histopatologia.
Resultados:
em 2018, 807.430 mulheres na faixa etária de 50-69 anos foram rastreadas, e dessas, 91% apresentaram resultado benigno, 1,8% provavelmente benigno, 6,7% inconclusivo e 0,5% sugestivo de câncer; a taxa de mamografia positiva foi de 9,0%; estimou- -se indicação de biópsia para 1,6% das mulheres, resultado maligno para 33,9% delas, e taxa de confirmação de câncer de 5,4 por 1 mil mulheres.
Conclusão:
identificou-se elevada perda de seguimento das lesões benignas; a taxa de mamografias positivas foi inferior ao parâmetro internacional; contudo, a taxa de detecção de câncer foi adequada, e o percentual de mamografias inconclusivas, aceitável.
Palavras-chave: Neoplasias de Mama; Programas de Rastreamento; Sistema Único de Saúde; Indicadores (Estatística); Estudos Populacionais em Saúde Pública
| Contribuições do estudo | |
|---|---|
| Principais resultados | Os resultados BI-RADS® 0, 4 e 5 (7,2%) e a taxa de detecção de câncer (5,4/1 mil mulheres) por rastreamento mamográfico no Brasil apresentaram padrão semelhante ao descrito na literatura, enquanto a taxa de mamografia positiva (9,0%) foi inferior. |
| Implicações para os serviços | Os indicadores do rastreamento do câncer de mama são influenciados pela qualidade dos dados. Assim, no monitoramento dos serviços de mamografia, nos diferentes níveis, deve-se acompanhar a qualidade dos dados informados por esses serviços. |
| Perspectivas | A análise nacional apresentada pode servir de referência para análises locais. Respaldada por indicadores e critérios de qualidade, a identificação de lacunas e problemas no rastreamento do câncer de mama auxiliará na redução de sua mortalidade. |
INTRODUÇÃO
O câncer de mama é o tipo de neoplasia mais incidente na população feminina, no Brasil, excetuando-se o câncer de pele não melanoma. No país, estimou-se a ocorrência anual de 66.280 casos novos de câncer de mama no triênio 2020-2022, e um risco de 61,6 casos a cada 100 mil mulheres.1 Entre 1980 e 2018, a mortalidade por esse câncer aumentou 50,6%, revelando o desafio do controle da doença no âmbito nacional.2
Alguns países, como Inglaterra e Canadá, implantaram programas organizados de rastreamento, estratégia de detecção precoce do câncer dirigida às mulheres sem sinais e sintomas suspeitos.3,4 O monitoramento das ações de controle de câncer de mama é realizado com base em indicadores, como cobertura de rastreamento, taxas de reconvocação, resultados de mamografia alterados, biópsia e detecção de câncer, que possibilitam acompanhar e avaliar o desempenho desses programas.3,4
No Brasil, a detecção precoce do câncer de mama é prioridade para o Ministério de Saúde;5 o rastreamento, entretanto, é oportunístico, ou seja, as mulheres são rastreadas quando procuram o serviço de saúde espontaneamente.6
Desde a implementação do Sistema de Informação do Câncer de Mama (Sismama) no Sistema Único de Saúde (SUS), no ano de 2009, o cálculo dos indicadores de detecção precoce desse câncer era realizado com base nos dados relativos aos exames, dada a ausência de um identificador único, como o Cartão Nacional de Saúde (CNS), que possibilitasse a análise de dados individualizados de monitoramento da população. Em 2013, com a implantação do Sistema de Informação do Câncer (Siscan), a identificação dos usuários que realizaram exames tornou-se possível a partir do número do CNS, permitindo melhor acompanhamento das ações do programa.7
No Brasil, a maioria dos estudos publicados que analisam indicadores de detecção precoce do câncer de mama na população brasileira foram realizados com base em dados relativos aos resultados dos exames de mamografia.5,8,9 O presente estudo busca preencher essa lacuna analisando indicadores obtidos a partir dos registros individuais das mulheres rastreadas cadastradas no Siscan. A avaliação do seguimento dessa população pode contribuir para a qualificação do monitoramento e do rastreamento do câncer de mama no Brasil.
O objetivo deste estudo foi analisar indicadores de monitoramento do rastreamento do câncer de mama na população feminina usuária do SUS no Brasil, de 2018 a 2019.
MÉTODOS
Foi realizado um estudo descritivo para análise de indicadores do rastreamento do câncer de mama na população feminina do Brasil, a partir dos dados do Siscan. Utilizou-se o CNS (identificador unívoco) para realizar o relacionamento determinístico dos exames de mamografia e histopatológicos das bases de dados do Siscan e, assim, identificar as mulheres rastreadas no ano de 2018, e aquelas com exames subsequentes entre 2018 e 2019.
No Brasil, o rastreamento do câncer de mama cumpre as diretrizes nacionais, estabelecidas pelo Ministério da Saúde,10 que recomenda o método, a periodicidade e a faixa etária para sua realização. A mamografia é o exame indicado para identificar o câncer de mama em seus estágios iniciais e deve ser registrada no Siscan, quando realizada no SUS.
O Ministério da Saúde recomenda o monitoramento dos indicadores relacionados à detecção precoce do câncer de mama a partir dos dados disponíveis nos sistemas de informações. Entretanto, até a disponibilização de dados públicos do Siscan, em 2018, essa análise era limitada a dados de exames e não de pessoas examinadas.5
No Siscan, os resultados de mamografia são classificados de acordo com o Breast Imaging and data System (BI-RADS®), publicado pelo Colégio Americano de Radiologia [American College of Radiology (ACR)],11 e há condutas de investigação diagnóstica específicas para cada categoria BI-RADS®: as categorias BI-RADS® 1 e 2 indicam a ausência de lesões suspeitas de malignidade, sendo as mulheres orientadas a realizar o rastreamento bienal, conforme diretrizes nacionais;10 e as categorias BI-RADS® 0, 3, 4 e 5 são definidas como resultados anormais, demandando investigação por meio de exames de imagem, controle radiológico, entre outros procedimentos diagnósticos.11,12 Nas mamografias com resultado BI-RADS® 3, recomenda-se o controle radiológico mediante a realização de nova mamografia em um período de seis meses a um ano, enquanto para aquelas classificadas como BI-RADS® 4 ou 5 recomenda-se investigação diagnóstica por biópsia e exame histopatológico.
A categoria BI-RADS® 0 corresponde à mamografia com resultado inconclusivo, que necessita de comparação com exames anteriores, realização de incidências de mamografias e manobras adicionais, ou a realização de ultrassonografia mamária.13 A comparação com exames anteriores, novas imagens de incidências e manobras devem ser realizadas pelo serviço de radiologia, antes da emissão do resultado BI-RADS® definitivo.14 Assim, em conformidade com o que é preconizado para esse resultado, a recomendação disponível no Siscan é a realização da ultrassonografia.
Para este estudo, foram selecionados os registros das usuárias do sexo feminino, na idade de 50 a 69 anos, que realizaram rastreamento de câncer de mama no ano de 2018 e cuja indicação clínica da mamografia foi “rastreamento na população-alvo”. Foram excluídos os registros nas seguintes condições: (i) informação de risco elevado para câncer de mama na anamnese; (ii) nódulos maiores que 20 mm nos achados radiológicos (consideradas lesões clinicamente palpáveis); (iii) registro de mamografia com resultado anterior BI-RADS® 3, 4, 5 ou 6 (considerou-se o ano de 2017); e (iv) resultado BI-RADS® 0 em mamografia anterior, realizada em 2017 ou 2018 (considerado possível erro no seguimento).
Nos casos com mais de uma mamografia realizada no ano de 2018, selecionou-se o exame com resultado de maior suspeição, de acordo com a seguinte ordem de categorias BI-RADS®: 5, 4, 3, 2, 1 e 0. A categoria de resultado BI-RADS® 0 foi definida como última na ordenação, por ser inconclusiva e demandar esclarecimento diagnóstico pelos métodos de imagem e não tissular.11
Os resultados de exames histopatológicos de mama registrados no Siscan, nos anos de 2018 e 2019, foram utilizados para obter informação de confirmação diagnóstica. Foram selecionados os registros de usuárias do sexo feminino, entre 50 e 69 anos de idade, provenientes de biópsia e com informação na anamnese de “detecção por imagem”, ou seja, lesão não palpável identificada pelo rastreamento. Exames classificados como insatisfatórios foram excluídos. Quando havia mais de um laudo histopatológico com a mesma data, manteve-se o laudo de maior gravidade, na seguinte ordem: positivo para malignidade > core biópsia suspeita > core biópsia indeterminada > benigno.
As variáveis de estudo foram:
Cartão Nacional de Saúde (CNS) - campo numérico de identificação unívoca;
sexo (feminino; masculino);
idade (em anos);
tipo de exame (mamografia; histopatológico);
indicação clínica da mamografia (rastreamento; diagnóstica);
tipo de mamografia de rastreamento (população-alvo; população de alto risco; pessoa já tratada para câncer de mama);
risco elevado para câncer de mama (sim; não; não sabe);
nódulo (sim; não);
tamanho do nódulo - campo descritivo numérico;
categoria BI-RADS® - referente ao resultado da mamografia: 0, 1, 2, 3, 4, 5 e 6;
resultado do exame histopatológico (benigno; maligno); e
data de realização do exame.
Os dados relativos à mamografia e ao exame histopatológico, incluindo a identificação unívoca pelo CNS, foram obtidos no primeiro trimestre de 2020, correspondendo aos exames registrados no Siscan entre janeiro de 2018 e setembro de 2019.
Visando assegurar a excelência dos resultados dos exames, foram aplicados critérios de qualidade para a seleção dos serviços que realizaram exames de mamografia e histopatológicos de mama. Para mamografia, foram incluídos os serviços que atendessem aos critérios definidos pelos pesquisadores:
Realização de número maior ou igual a 1 mil mamografias por ano em 2018, volume anual considerado adequado para garantir expertise dos profissionais na análise das imagens.3,4
Atendimento a mais de 500 mulheres para realização de mamografias em 2018, buscando-se excluir serviços com alta produção mas com repetição de exames nas mesmas mulheres.
Distribuição dos resultados de acordo com parâmetros aceitáveis, segundo o Colégio Americano de Radiologia, (i) categoria BI-RADS® 0 inferior a 12% (desejável de 5% a 12%)11 e (ii) categoria BI-RADS® 1 ou 2 abaixo de 75%.5,6,8
Para os laboratórios que realizaram exames histopatológicos de mama, foram selecionados aqueles que apresentaram produção anual igual ou superior a 75 exames/ano, definida a partir da mediana de produção observada. Considerou-se que tais serviços possuíam maior escala e expertise na realização desses exames.
Para evitar viés na seleção da indicação clínica, assegurando que a primeira mamografia fosse de rastreamento, foram excluídas aquelas mulheres com informação de risco elevado para câncer de mama, com exames anteriores que indicassem anormalidade, e aquelas com lesões clinicamente palpáveis, conforme critérios de elegibilidade já descritos.
Para usuárias com mamografia de rastreamento na categoria BI-RADS® 3, cuja recomendação é o controle radiológico,11 foi verificado o registro de nova mamografia na base de dados disponível. Mamografias realizadas em intervalo menor que 60 dias não foram consideradas como controle e não foram incluídas no estudo. Como a recomendação para mamografia com resultado na categoria BI-RADS® 0 pressupõe avaliação com ultrassonografia, considerou-se que todas as mulheres com esse resultado deveriam realizar ultrassonografia mamária.
Foi calculada a distribuição percentual dos resultados das mamografias de rastreamento, de seguimento (categoria BI-RADS® 3) e dos exames histopatológicos de mama. Como a ultrassonografia mamária não é registrada no Siscan, foram utilizados os resultados obtidos por Zanello et al.15, visando estimar a distribuição dos resultados de ultrassonografia provenientes de mulheres com mamografia de rastreamento BI-RADS® 0. Para tanto, os percentuais observados nos laudos de ultrassonografia (46,1% para BI-RADS® 1 ou 2; 39,4% para BI-RADS® 3; e 14,5% para BI-RADS® 4 e 5)15 foram multiplicados pelo percentual de usuárias com resultado de BIRADS® 0 na mamografia de rastreamento do presente estudo.
A proporção de usuárias que realizaram biópsia após o rastreamento foi estimada considerando-se os percentuais obtidos nas seguintes situações: (i) mamografias de rastreamento categorias 4 ou 5; (ii) seguimento da categoria BI-RADS® 3 quando a mamografia subsequente era BI-RADS® 4 ou 5; e (iii) seguimento da mamografia BI-RADS® 0 quando o resultado da ultrassonografia era BI-RADS® 4 ou 5.
Neste estudo, a partir dos resultados obtidos, foram calculados os seguintes indicadores: (i) percentual de mamografias BI-RADS 0, 4 e 5, estimado pela divisão do número de usuárias rastreadas com resultado BI-RADS® 0, 4 e 5 pelo total de usuárias rastreadas, multiplicado por 100; (ii) taxa de indicação de biópsia, estimada pelo número de usuárias com resultado BI-RADS® 4 e 5 dividido pelo total de usuárias rastreadas em um ano, multiplicado por 100; (iii) taxa de detecção de câncer, estimada pelo quantitativo de casos de câncer de mama detectados no rastreamento dividido pelo total de usuárias rastreadas em um ano, multiplicado por 1.000;11 e (iv) taxa de mamografia positiva, estimada pelo número de usuárias rastreadas que necessitaram de investigação diagnóstica ou controle (BI-RADS® 0, 3, 4 e 5) em relação ao total de usuárias rastreadas em um ano, multiplicado por 100.11
Foram determinadas as frequências absolutas e relativas, e calculou-se o intervalo de confiança de 95% (IC95%) das categorias BI-RADS®. No relacionamento entre as bases de dados, assim como nas análises, utilizou-se o programa R (http://www.r-project.org), v.3.5.0, com o pacote tidyverse.
O projeto do estudo foi aprovado pelo Comitê de Ética em Pesquisa do Instituto Nacional de Câncer José Alencar Gomes da Silva (CEP/INCA), mediante Certificado de Apresentação para Apreciação Ética (CAAE) no 6944219.5.0000.5274.
RESULTADOS

a) Serviços que apresentaram mais de 75% dos resultados de mamografia de rastreamento com BI-RADS® 1 ou com BI-RADS® 2: b) Serviços que apresentaram mais de 12% dos resultados de mamografia de rastreamento com BI-RADS® 0.
Figura 1 - Fluxograma de seleção da população feminina rastreada para câncer de mama no Sistema Único de Saúde, Brasil, 2018
Em 2018, foram registradas 2.791.421 mamografias no Siscan e, após a aplicação dos critérios de inclusão e exclusão, obteve-se um total de 807.430 usuárias, na faixa etária de 50 a 69 anos, que realizaram mamografia de rastreamento em 382 serviços de radiologia, no Brasil (Figura 1). Entre 2018 e 2019, foram registrados 49.791 exames histopatológicos, pelos quais foram identificadas 7.452 usuárias na mesma faixa etária, com exames realizados por 110 laboratórios (Figura 2).

Figura 2 - Fluxograma de seleção dos registros da população feminina com idade de 50 a 69 anos que realizou exame histopatológico para diagnóstico de câncer de mama no Sistema Único de Saúde, Brasil, 2018-2019
Das 807.430 mulheres rastreadas em 2018, 91% tiveram resultado BI-RADS® 1 ou 2, sendo-lhes indicada a rotina de rastreamento bienal; 1,8% BI-RADS® 3, sendo-lhes indicado o controle radiológico semestral ou anual; 0,5% BI-RADS® 4 ou 5, necessitando de investigação diagnóstica com exame histopatológico; e 6,7% BI-RADS® 0, demandando a realização de ultrassonografia (Figura 3). O percentual de mamografias 0, 4 e 5 foi de 7,2%; e a taxa de mamografia positiva, de 9,0%.
Foram identificadas 14.221 mulheres com resultado da mamografia de rastreamento BI-RADS® 3; dessas, 30,5% tiveram controle radiológico identificado no SUS, com nova mamografia, conforme recomendado pelas diretrizes vigentes. Os resultados das mamografias de controle foram: 51,9% das mulheres com exames sem alterações ou achados benignos (BI-RADS® 1 ou 2); 30,7% novo BI-RADS® 3; 1,6% BI-RADS® 4 ou 5; e 15,8% BI-RADS® 0 (Tabela 1).
Tabela 1 - Distribuição dos resultados de exames de mamografia de rastreamento e de seguimento da categoria BI-RADS® 3, na população feminina de 50 a 69 anos de idade, realizados pelo Sistema Único de Saúde, Brasil, 2018-2019
| Categoria BI-RADS® | N | % (IC95% a) |
|---|---|---|
| Rastreamento (n = 807.430) | ||
| 0 | 54.368 | 6,7 (6,7;6,8) |
| 1 | 307.649 | 38,1 (38,0;38,2) |
| 2 | 427.369 | 52,9 (52,8;53,0) |
| 3 | 14.221 | 1,8 (1,7;1,8) |
| 4 | 3.362 | 0,4 (0,4;0,4) |
| 5 | 461 | 0,1 (0,1;0,1) |
| Seguimentob,c (n = 4.332) | ||
| 0 | 683 | 15,8 (14,7;16,9) |
| 1 | 745 | 17,2 (16,1; 18,3) |
| 2 | 1.503 | 34,7 (33,3;36,1) |
| 3 | 1.332 | 30,7 (29,4;32,1) |
| 4 | 66 | 1,5 (1,2;1,9) |
| 5 | 2 | 0,1 (0,0;0,1) |
| 6 | 1 | 0,0 (0,0;0,1) |
a) IC95%: Intervalo de confiança de 95%; b) Mamografia de controle; c) Considerando-se apenas as usuárias com categoria BI-RADS® 3 com informação de nova mamografia no Siscan.
O acompanhamento das mulheres rastreadas identificou que, após o seguimento com ultrassonografia e mamografia a partir do rastreamento inicial em um ano, 7,0% das mulheres de 50 a 69 anos necessitaram de ultrassonografia e 1,8% de mamografia diagnóstica para o controle radiológico.
Das 7.452 mulheres com exames anatomopatológicos, 33,9% tiveram resultados malignos e 66,1% benignos. Com a distribuição dos resultados de mamografia, ultrassonografia e de confirmação diagnóstica por exame histopatológico, a taxa de indicação de biópsias foi estimada em 1,6%; e o percentual de casos com confirmação diagnóstica de câncer, em 0,5% (Figura 3). A taxa de detecção de câncer foi de 5,4 casos por 1 mil mulheres rastreadas.
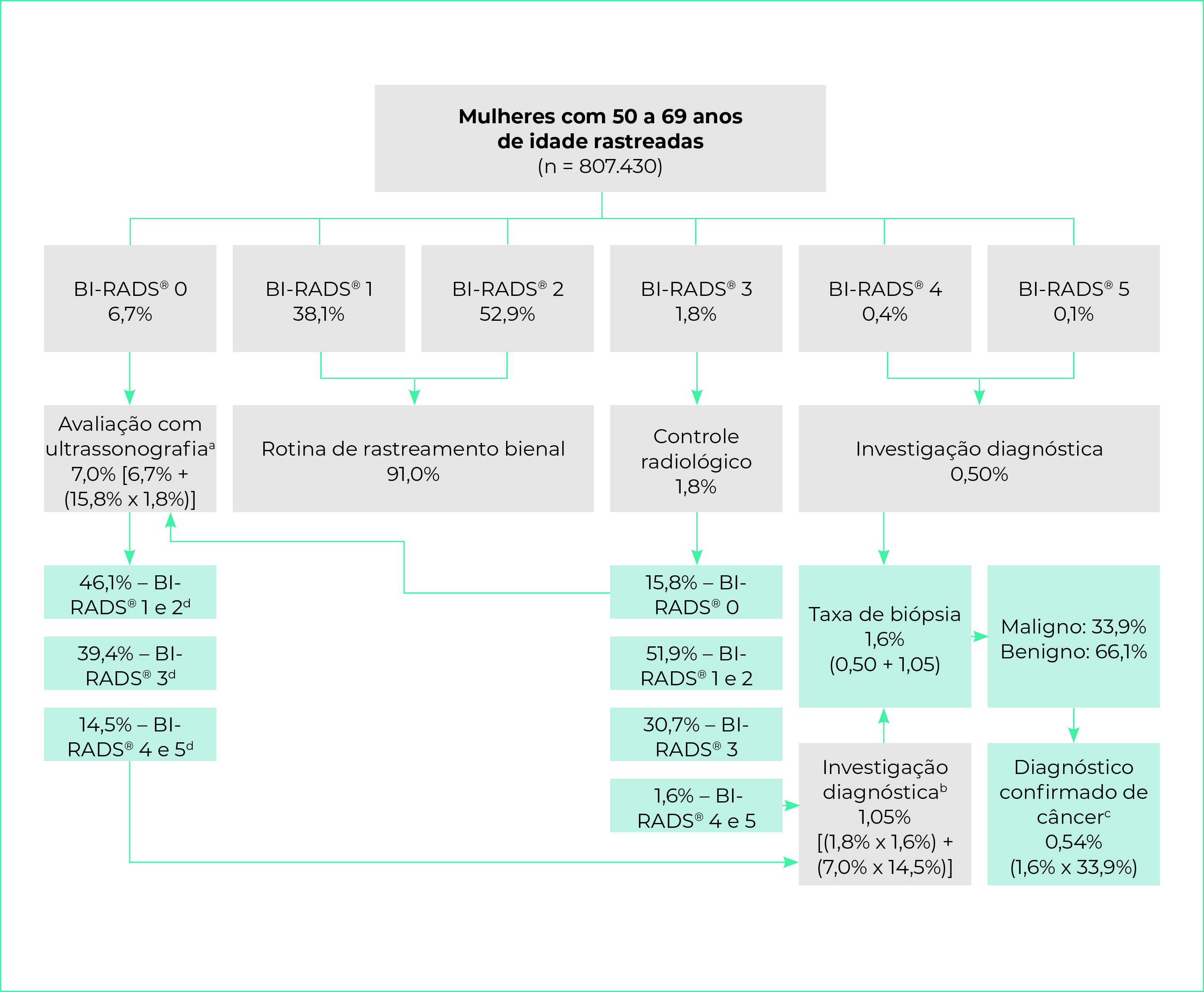
a) 6,7% de BIRADS® 0 da mamografia de rastreamento somado a 0,284% de BIRADS® 0, proveniente do controle radiológico de mamografia de rastreamento BIRADS® 3 (1,8% x 15,8%); b) 1,02% de BI-RADS® 4 e 5 pós-ultrassonografia (7,0% x 14,5%) somado a 0,03% de BI-RADS® 4 e 5 após controle radiológico de BIRADS® 3 (1,8% x 1,6%); c) 1,6% das mulheres que necessitaram de biópsia multiplicado pelo percentual de biópsias com resultado de malignidade (33,9%); d) Distribuição dos resultados de ultrassonografia de mama conforme estudo de Zanello et al.15.
Figura 3 - Fluxo para o cálculo dos indicadores de rastreamento do câncer de mama na população feminina de 50 a 69 anos de idade atendida no Sistema Único de Saúde, Brasil, 2018-2019
DISCUSSÃO
A análise dos indicadores mostrou que a taxa de mamografias positivas no rastreamento do câncer de mama no Brasil, de 9,0%, foi inferior ao parâmetro internacional recomendado pelo Colégio Americano de Radiologia, enquanto a taxa de indicação de biópsias (1,6%) e a taxa de detecção de câncer (5,4 casos/1 mil mulheres rastreadas) foram próximas aos valores de referência internacionais.12,16-18
Os resultados BI-RADS® 1 e 2 foram predominantes e próximos aos dados de rastreamento apresentados no relatório National Mammography Database (NMD) de 2019, do ACR (89,9%),16 que incluem mulheres de todas as idades. A proporção de resultados BI-RADS® 0 ficou dentro do parâmetro aceitável (5% a 12%),11 sendo inferior à apresentada no relatório NMD (9,6%).16 Estudos com dados do Sismama para o Brasil e a capital do estado de Goiás, Goiânia, referentes ao ano de 2010, apontam predomínio de BI-RADS® 1 e 2 e proporção de exames com resultado BI-RADS® 0 próxima ao limite superior referido na literatura, acima da proporção aqui estimada para mulheres.8,19 No Brasil, observa-se, na prática, uma tendência em substituir incidências mamográficas e manobras pela ultrassonografia, o que poderia aumentar a ocorrência de BI-RADS® 0 no rastreamento. Apesar de os dados do Sismama terem por referência os exames, eram também relativos ao SUS, e a comparação com o Siscan indica que há coerência, em parte, entre os resultados. Vale lembrar que o presente estudo excluiu serviços com problemas na qualidade da informação ou da mamografia.
A proporção de BI-RADS® 3 observada, de 1,8%, foi inferior à encontrada em 2011, no estado do Rio de Janeiro (RJ), de 3,0%;20 e superior à do ACR, esta de 0,22%.16 As diferenças podem estar relacionadas à incidência de câncer de mama no território fluminense acima da média nacional,1 à diferença de faixas etárias entre os estudos, e à recomendação do ACR de não concluir mamografias de rastreamento com BI-RADS® 3.11 Para estar de acordo com o ACR, é mister, nesse caso, uma avaliação diagnóstica completa, reiterando a referência do Medicare, o sistema de saúde estadunidense, de que a proporção de mamografias de rastreamento BI-RADS® 3 seja próxima de zero.11
No Brasil, a proporção de exames com BI-RADS® 3 ficou abaixo de 3% em 2010;8 e em Minas Gerais, ligeiramente acima de 3% em 2010, e próxima de 4% em 2011.6 Estudo realizado em uma instituição privada de São Paulo, sobre o período 2010-2011, encontrou 8,3% de resultados na categoria BI-RADS® 3 em mulheres com idade média de 66 anos.21 Possivelmente, estudos que utilizaram dados de exames sem delimitar se para uma mesma mulher, e sem adotar critérios de avaliação de qualidade dos dados, tenham elevado artificialmente a proporção de BI-RADS® 3, assim como estudos que abordam mulheres mais idosas.
A taxa de mamografias positivas (11,6%) foi inferior à referência do ACR11 (10,6%) e do consórcio de vigilância de câncer de mama dos Estados Unidos, o Breast Cancer Surveillance Consortium (BCSC), embora esta última seja definida a partir de mamografias digitais com 60,9% de mulheres na faixa etária de 50 a 74 anos, realizadas entre 2007 e 2013.12 Esse indicador é mais influenciado pela proporção de BI-RADS® 0, sendo assim, o critério de elegibilidade no presente estudo, com ponto de corte para BI-RADS® 0, pode explicar em parte essa diferença.
O programa de controle de câncer de mama do Canadá, que não utiliza o sistema de classificação BI-RADS®, define, por meta, taxas de resultados anormais menores que 10% (primeira vez) e 5% (subsequente), sendo que, em 2011-2012, essas proporções estavam definidas como 15,3% para mamografias de primeira vez e 7,2% para mamografias subsequentes.22
Diferenças encontradas entre os diversos estudos podem ser atribuídas à expertise profissional e ao volume de exames demandados ao serviço.23 Deve-se considerar a alteração na definição de mamografias positivas nas versões do Atlas do ACR,11,24 em que se consideravam, até então, apenas os resultados BI-RADS® 0, 4 e 5, e excluiu-se a categoria 3. Tais diferenças podem causar confusão na comparação entre estudos - a título de exemplo, nos 12,1% correspondentes à proporção de reconvocação por resultado anormal (BI-RADS® 0, 4 e 5) no SUS, no período 2010-2011.5
O total de BI-RADS® 4 e 5 nas mamografias de rastreamento, que indicam biópsia, foi inferior ao do BCSC12 (1,71%) e ao estudo de São Paulo21 (1,61%). A distribuição dessas categorias no NMD,16 em 2019, foi de 0,08%, incluindo todas as idades. Observa-se uma variação importante nesses resultados.
Em relação ao seguimento das mulheres, a proporção de BI-RADS® 3 foi próxima à do estudo do Rio de Janeiro, realizado com mulheres rastreadas em qualquer faixa etária (29,5%), assim como à distribuição em quase todas as demais categorias - exceto a BI-RADS® 4, com maior proporção.20 No presente estudo, houve quase 70% de perda de seguimento de mulheres com resultado BI-RADS® 3, fenômeno também identificado no estudo sobre o RJ.20 Importante notar que 1,6% dessas mulheres em controle radiológico apresentou, posteriormente, suspeita de malignidade que exigiu investigação anatomopatológica. Esse achado reforça a necessidade de dedicar especial atenção às mulheres que superaram a barreira inicial de acesso aos serviços mas ainda necessitam ter garantida a continuidade de seu cuidado.
A taxa de indicação de biópsia foi próxima à esperada pelo programa da Irlanda (≤ 2,0%),17 à registrada no relatório de 2019 do ACR16 (1,66%), e em programas de condados da Noruega (1,4%);18 e ainda, com valor intermediário se se consideram os resultados do Canadá.22 Segundo o programa canadense, em 2011-2012, entre as mulheres com alteração no rastreamento mamográfico (15,3% rastreadas pela 1ª vez e 7,2% com rastreamento subsequente), 14,9% realizaram core biópsia e 1,7% biópsia cirúrgica, correspondendo, respectivamente, a 2,27% e a 0,26%, de necessidade de biópsia. Portanto, 2,53% das mulheres que realizaram o primeiro rastreamento mamográfico foram submetidas à biópsia. Quanto às mulheres que realizaram o rastreamento subsequente, a taxa de biópsia foi de 1,2%, correspondendo a 1,1% de core biópsia e 0,1% de biópsia cirúrgica.
Estudos locais apontam taxas de biópsia diferentes: 2,2% na África do Sul;25 1% no município de Monteiro, estado da Paraíba;26 e 1,7% em um centro de referência de Campinas, estado de São Paulo, com base em 35.041 mamografias.14 A idade e o tipo de mamógrafo (digital ou não) devem ser considerados, por influenciarem a taxa de biópsia.18 Verificam-se, outrossim, particularidades nos estudos e programas consultados, e a taxa de biópsia estimada no presente estudo é geralmente próxima às reportadas em programas nacionais de rastreamento.
A taxa de detecção de câncer por 1 mil mulheres rastreadas foi próxima à da Noruega18 (5,6), aos parâmetros referidos pelo ACR11 (4,7) e à encontrada pelo BCSC12 (5,1); contudo, foi inferior à da África do Sul (10,0).25 Burnside et al.,27 ao trabalharem sobre dados do programa de rastreamento do câncer de mama do Serviço Nacional de Saúde do Reino Unido (NHS), também encontraram taxa superior (8,1). No Canadá, em 2011-2012, essa taxa foi de 4,9/1 mil mulheres rastreadas pela primeira vez e 3,7 no rastreio subsequente, enquanto são previstas taxas de 5,0 e 3,0 respectivamente.22 No Reino Unido, a periodicidade trienal do rastreamento pode ser uma das causas da maior taxa de detecção de câncer.
Estudo da Paraíba,26 com mulheres de 40 a 69 anos de idade, observou taxa de detecção de câncer de 3,4/1 mil mulheres rastreadas. No estudo de São Paulo, com mulheres na idade média de 66 anos, essa taxa foi de 4,8.21 No estudo de Campinas citado, apresentou-se uma taxa de 0,3%, possivelmente explicada por ter incluído 42,2% de mulheres com menos de 50 anos e apenas 93% de rastreamento subsequente.14 Em geral, apesar da variabilidade na distribuição de BI-RADS® 4 e 5, a taxa de detecção aqui estimada aproximou-se da referida em diversos programas e estudos.
Uma possível limitação do presente estudo é a utilização de dados de um sistema de informações com grau de implantação heterogêneo no país, cuja expansão gradual alcançou cerca de 74% de cobertura para exames mamográficos pelo SUS, em 2019.28 O volume expressivo de dados e sua abrangência nacional, por sua vez, são aspectos positivos, pois reduzem a chance de os indicadores calculados se distanciarem do cenário real do Brasil. Além disso, o ineditismo da análise de indicadores do rastreamento do câncer de mama com base no registro de mulheres e não de exames é um avanço importante, em relação aos estudos realizados no país.5,6
Os critérios de qualidade na seleção de clínicas radiológicas e laboratórios visaram mitigar falhas no preenchimento das informações para conclusão diagnóstica, detectadas anteriormente no Sismama19,29 e em avaliação de serviços radiológicos do SUS.30 Se, por um lado, esses critérios podem restringir os resultados ao que seria esperado em um cenário de qualidade dos exames de rastreamento - o que não acontece de maneira uniforme no Brasil -, por outro lado, em se tratando de um estudo de base populacional, os resultados obtidos fornecem parâmetros para a avaliação e o planejamento das ações de rastreamento do câncer de mama. Os critérios de elegibilidade apresentados ainda podem ser úteis aos gestores no monitoramento dos serviços.
Espera-se que os indicadores apresentados sirvam de referência a futuros estudos avaliativos com acompanhamento longitudinal de mulheres que realizaram a mamografia, com critérios de qualidade, contribuindo para o avanço na organização da linha de cuidado do câncer de mama no Brasil.
REFERENCES
1. Ministério da Saúde (BR). Instituto Nacional de Câncer José Alencar Gomes da Silva. Coordenação de Prevenção e Vigilância. Estimativa 2020: incidência de câncer no Brasil [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José Alencar Gomes da Silva; 2020 [citado 19/05/2022]. Disponível em: Disponível em: https://www.inca.gov.br/estimativa [ Links ]
2. Ministério da Saúde (BR). Instituto Nacional de Câncer José Alencar Gomes da Silva. Taxas de mortalidade por câncer, brutas e ajustadas por idade pelas populações mundial e brasileira, por 100.000, segundo sexo, faixa etária, localidade e por período selecionado. - Atlas On-line de Mortalidade [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José Alencar Gomes da Silva ; 2020 [citado 19/05/2022]. Disponível em: Disponível em: https://www.gov.br/inca/pt-br/centrais-de-conteudo/aplicativos/atlas-de-mortalidade-por-cancer [ Links ]
3. Canadian Partnership Against Cancer (CA). Organized Breast Cancer Screening Programs in Canada: Report on Program Performance in 2007 and 2008 [Internet]. Toronto: Canadian Partnership Against Cancer; 2013 [citado 25/05/2022] 68 p. Available from: Available from: https://www.cancercare.mb.ca/export/sites/default/screening/.galleries/files/breastcheck/b-rep-pro-perf-07-08.pdf [ Links ]
4. Perry N, Broeders M, Wolf C, Törnberg S, Holland R, Von Karsa L, et al. European guidelines for quality assurance in breast cancer screening and diagnosis. 4th ed-summary document. Annals of Oncology. 2008;19(4):614-22. doi: 10.1093/annonc/mdm481 [ Links ]
5. Tomazelli JG, Migowski A, Ribeiro CM, Assis M, Abreu DMF. Avaliação das ações de detecção precoce do câncer de mama no Brasil por meio de indicadores de processo: estudo descritivo com dados do Sismama, 2010-2011. Epidemiol Serv Saude. 2017;26(1):61-70. doi:10.5123/S1679-49742017000100007 [ Links ]
6. Corrêa CSL, Pereira LC, Leite ICG, Fayer VA, Guerra MR, Bustamante-Teixeira MT, et al. Rastreamento do câncer de mama em Minas Gerais: avaliação a partir de dados dos sistemas de informações do Sistema Único de Saúde. Epidemiol Serv Saude. 2017;26(3):481-92. doi:10.5123/S1679-49742017000300006 [ Links ]
7. Brasil. Ministério da Saúde. Portaria no 3.394, de 30 de dezembro de 2013. Institui o Sistema de Informação de Câncer (SISCAN) no âmbito do Sistema Único de Saúde (SUS) [Internet]. Diário Oficial da União, Brasília (DF), 2013 Dez 31 [citado 19/05/2022], Seção 1:253. Disponível em: Disponível em: https://bvsms.saude.gov.br › bvs › prt3394_30_12_2013.html [ Links ]
8. Azevedo e Silva G, Bustamante-Teixeira MT, Aquino EML, Tomazelli JG, Santos-Silva I. Acesso à detecção precoce do câncer de mama no Sistema Único de Saúde brasileiro: uma análise a partir dos dados do Sistema de Informações de Saúde. Cad Saude Pub. 2014;30(7):1537-50. doi:10.1590/0102-311X00156513 [ Links ]
9. Alcantara LLM, Tomazelli J, Zeferino FRG, Oliveira BFA, Azevedo e Silva G. Tendência Temporal da Cobertura de Mamografias no Sistema Único de Saúde, Brasil, 2010-2019. Rev Bras Cancerol. 2022;68(3):e-052407. doi: 10.32635/2176-9745.RBC.2022v68n3.2407 [ Links ]
10. Migowski A, Silva GA, Dias MBK, Diz MDPE, Sant’Ana DR, Nadanovsky P, et al. Diretrizes para detecção precoce do câncer de mama no Brasil. II - Novas recomendações nacionais, principais evidências e controvérsias. Cad Saude Pub. 2018;34(6):e00074817. doi:10.1590/0102-311X00074817 [ Links ]
11. Colégio Americano de Radiologia (EUA). Atlas BI-RADS do ACR: Sistema de laudos e registro de laudos de imagem. 2 ed. São Paulo: Manole; 2016. 575 p. [ Links ]
12. Lehman CD, Arao RF, Sprague BL, Lee JM, Buist DSM, Kerlikowske K, et al. National Performance Benchmarks for Modern Screening Digital Mammography: Update from the Breast Cancer Surveillance Consortium. Radiology. 2017;283(1):49-58. doi: 10.1148/radiol.2016161174 [ Links ]
13. Ministério da Saúde (BR). Instituto Nacional de Câncer José de Alencar Gomes da Silva. Mamografia: da prática ao controle. Recomendações para profissionais de saúde [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José de Alencar Gomes da Silva; 2007 [citado 31/05/2022] 109 p. Disponível em: Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//mamografia-pratica-controle-2007.pdf [ Links ]
14. Camargo Junior HSA, Camargo MMA, Teixeira SRC, Arruda MS, Azevedo J. Apresentação de resultados de um serviço de rastreamento mamográfico com ênfase na auditoria epidemiológica. Rev Bras Ginecol Obstet. 2009;31(10):508-12. doi:10.1590/S0100-72032009001000007 [ Links ]
15. Zanello PA, Robim AFC, Oliveira TMG, Elias Junior J, Andrade JM, Monteiro CR, et al. Breast ultrasound diagnostic performance and outcomes for mass lesions using Breast Imaging Reporting and Data System category 0 mammogram. Clinics. 2011;66(3):443-8. doi: 10.1590/S1807-59322011000300014 [ Links ]
16. American College of Radiology (USA). National Mammography Database - National Radiology Data Registry [Internet]. Reston: American College of Radiology; 2023 [citado 20/05/2022]. Available from: Available from: https://www.acr.org [ Links ]
17. Fitzpatrick PE, Greehy G, Mooney MT, Flanagan F, Larke A, Connors A, et al. Evolution of the National Breast Screening Programme in Ireland: Two-year interval analysis (2004-2013) of BreastCheck. J Med Screen. 2018;25(4):191-6. doi:10.1177/0969141317738034 [ Links ]
18. Hofvind S, Skaane P, Elmore JG, Sebuødegård S, Hoff SR, Lee CI, et al. Mammographic Performance in a Population-based Screening Program: Before, during, and after the Transition from Screen-Film to Full-Field Digital Mammography. Radiology. 2014;272(1):52-62. doi:10.1148/radiol.14131502 [ Links ]
19. Rodrigues DCN, Freitas-Junior R, Corrêa RS, Peixoto JE, Tomazelli JG, Rahal RMS, et al. Avaliação do desempenho dos centros de diagnóstico na classificação dos laudos mamográficos em rastreamento oportunista do Sistema Único de Saúde (SUS). Radiol Bras. 2013;46(3):149-55. doi: 10.1590/S0100-39842013000300008 [ Links ]
20. Santos JA, Girianelli VR, Azevedo e Silva G. Seguimento de mulheres rastreadas para o câncer de mama com lesões provavelmente benignas no estado do Rio de Janeiro (prelo). Cad Saude Col. https://www.bdtd.uerj.br:8443/handle/1/3991 [ Links ]
21. Badan GM, Roveda Junior D, Ferreira CAP, Noronha Junior OA. Auditoria interna completa do serviço de mamografia em uma instituição de referência em imaginologia mamária. Radiol Bras. 2014;47(2):74-78. doi:10.1590/S0100-39842014000200007 [ Links ]
22. Canadian Partnership Against Cancer (CA). Breast Cancer Screening in Canada: Monitoring and Evaluation of Quality Indicators - Results Report, January 2011 to December 2012 [internet]. Toronto: Canadian Partnership Against Cancer ; 2017 [citado 25/05/2022] 66 p. Available from: Available from: https://s22457.pcdn.co/wp-content/uploads/2019/01/Breast-Cancer-Screen-Quality-Indicators-Report-2012-EN.pdf [ Links ]
23. Canadian Partnership Against Cancer (CA). Report from the evaluation indicators working group: guidelines for monitoring breast cancer screening program performance [internet]. Toronto: Canadian Partnership Against Cancer ; 2013 [citado 25/05/2022] 50 p. Available from: Available from: https://www.cancercare.mb.ca/export/sites/default/screening/.galleries/files/breastcheck/b-rep-gdlnmonitor.pdf [ Links ]
24. American College of Radiology. Breast imaging reporting and data system (BI-RADS). 4th ed. Reston: American College of Radiology; 2003. [ Links ]
25. Apffelstaedt JP, Steenkamp V, Baatjes KJ. Surgeon-Read Screening Mammography: An Analysis of 11,948 Examinations. Ann Surg Oncol. 2010;17(Supl 3):249-54. doi: 10.1245/s10434-010-1241-7 [ Links ]
26. Barreto ASB, Mendes MFM, Thuler LCS. Avaliação de uma estratégia para ampliar a adesão ao rastreamento do câncer de mama no Nordeste brasileiro. Rev Bras Ginecol Obstet. 2012;34(2):86-91. doi:10.1590/S0100-72032012000200008 [ Links ]
27. Burnside ES, Vulkan D, Blanks RG, Duffy SW. Association between Screening Mammography Recall Rate and Interval Cancers in the UK Breast Cancer Service Screening Program: A Cohort Study. Radiology. 2018;288(1):47-54. doi:10.1148/radiol.2018171539 [ Links ]
28. Ministério da Saúde (BR). Instituto Nacional de Câncer José de Alencar Gomes da Silva. Informativo Detecção Precoce. Monitoramento das ações de controle dos cânceres do colo do útero e da mama. Ano 11, no 1 [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José de Alencar Gomes da Silva ; 2020 [citado 2020 Set 29] 4 p. Disponível em: Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//informativo_numero1_2020.pdf [ Links ]
29. Passman LJ, Farias AMRO, Tomazelli JG, Abreu DMF, Dias MBK, Assis M, et al. SISMAMA - Implementation of an information system for breast cancer early detection programs in Brazil. The Breast. 2011;20(Supl 2):35-9. doi:10.1016/j.breast.2011.02.001 [ Links ]
30. Ministério da Saúde (BR). Instituto Nacional de Câncer José de Alencar Gomes da Silva. Informativo Detecção Precoce. Monitoramento das ações de controle dos cânceres do colo do útero e da mama. Ano 4, no 3 [Internet]. Rio de Janeiro: Instituto Nacional de Câncer José de Alencar Gomes da Silva ; 2013 [citado 19/05/2022] 8 p. Disponível em: Disponível em: https://www.inca.gov.br/sites/ufu.sti.inca.local/files//media/document//informativo-deteccao-precoce-3-2013.pdf [ Links ]
Recebido: 01 de Agosto de 2022; Aceito: 23 de Novembro de 2022











 text in
text in 


