Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
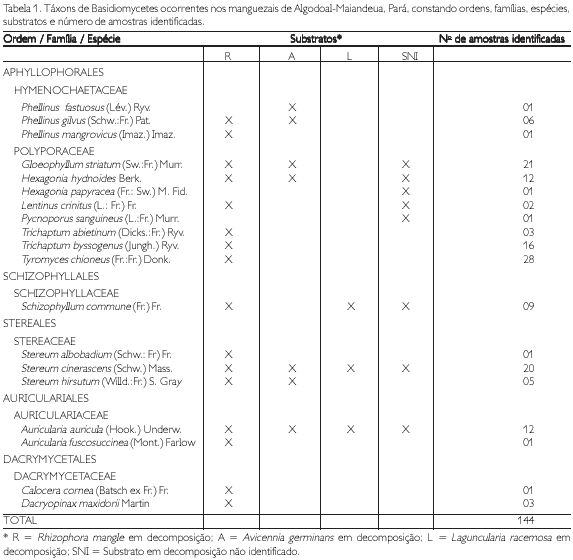
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.1 n.1 Belém abr. 2006
Considerações ecológicas sobre o zooplâncton do lago Bolonha, Belém, Pará, Brasil
Ecological considerations on the lake Bolonha zooplankton, Belém, Pará, Brazil
Nuno Filipe Alves Correia de MeloI; Rosildo Santos Paiva II; Mauro Márcio Tavares da SilvaIII
IUniversidade Federal Rural da Amazônia. Centro de Geociências. Professor. Belém, Pará, Brasil (nunomelo@ufra.br)
IIUniversidade Federal do Pará. Centro de Ciências Biológicas. Departamento de Biologia. Professor. Belém, Pará, Brasil (rpaiva@ufpa.br)
IIISecretaria de Estado de Educação. Professor e Biólogo. Belém, Pará, Brasil (nunomelo@ufra.br)
RESUMO
As populações zooplanctônicas do lago Bolonha foram amostradas em três estações de coleta no mês de setembro de 1993. O objetivo foi determinar as características básicas das populações, como a composição e a densidade de espécies, além dos parâmetros ambientais. Cinqüenta e seis espécies foram determinadas, trinta delas foram de Rotifera, dezenove de Cladocera e sete de Copepoda. Entre os Rotifera, os organismos mais freqüentes foram o Brachionus zahniseri gessneri, Polyarthra vulgaris e Tricocerca similis, enquanto que entre os Cladocera, Bosminopsis deitersi e Bosmina hagmanni foram os mais importantes em termos de densidade. Para os Copepoda, os náuplios e copepoditos foram os que apresentaram as maiores densidades, mas Oithona amazonica e Notodiaptomus amazonicus merecem ser registrados por também terem apresentado um grande número de indivíduos. O lago Bolonha apresentou-se com uma grande diversidade de organismos zooplanctônicos, precisando, entretanto, de estudos mais intensivos, pois esses números, em termos de biodiversidade, deve aumentar consideravelmente.
Palavras-chave: Zooplâncton. Amazônia. Lago Bolonha. Utinga. Limnologia.
ABSTRACT
Zooplankton population of the lake Bolonha were sampled in three stations in September of 1993. The objective was to determine the basic characteristics of the populations, as the composition and density of species, besides some environmental parameters. Fifty six species were determined, thirty of them were of Rotifera, nineteen Cladocera and seven Copepoda. Among Rotifera, the most frequent organisms were Brachionus zahniseri gessneri, Polyarthra vulgaris and Tricocerca similis, while enter Cladocera, Bosminopsis deitersi and Bosmina hagmanni were the most important in density terms. For Copepoda, the nauplii and copepodits they were the ones that presented the largerst densities, but Oithona amazonica and Notodiaptomus amazonicus deserve to be registered for they have also presented a great density. The lake Bolonha came with a great diversity of zooplanktonic organisms, needing, meantime of more intensive studies, because that number in biodiversity terms should increase considerable.
Keywords: Zooplankton. Amazon. Bolonha lake. Utinga. Limnology.
INTRODUÇÃO
A água é um dos fatores mais importantes na natureza amazônica e ocupa uma área considerável nesta região. Sioli (1951) afirmou que "para a compreensão da região amazônica como um todo, a água deve ser considerada como o fator mais característico no conjunto da Hiléia", uma vez que tem papel decisivo na formação e transformação da paisagem regional.
A diversidade de vida aquática na Amazônia está sendo drasticamente alterada pelo rápido e irreversível aumento das atividades humanas. Esta afirmação, tão usada e de certa forma vulgarizada em inúmeros locais e ocasiões, precisa ser definitivamente verificada e estudada adequadamente. É do conhecimento geral que, na Amazônia, o rápido aumento e intensificação das atividades humanas estão causando a destruição física, poluição e, desta forma, alterando profundamente a paisagem regional, como lagos, rios, igarapés e muitos outros habitats e ecossistemas aquáticos, tal qual represas em grandes e pequenos rios, mineração, concentração populacional em grandes e pequenas cidades, indústria, desmatamento etc. Assim, a exploração está levando a um impressionante declínio de animais e plantas comercialmente importantes.
Uma avaliação da escala e das conseqüências destas mudanças é seriamente comprometida pelo crítico e inadequado conhecimento dos padrões e processos naturais que originaram, controlam e, ainda, mantém a diversidade da vida aquática na Amazônia.
Os reservatórios urbanos apresentam restrições quanto ao seu tamanho e oscilam desde pequenos açudes até outros com milhões de metros cúbicos; eles estão submetidos a grandes pressões pelas populações existentes no seu entorno e a qualidade das águas está intimamente ligada às condições higiênicas e econômicas ali presentes (STRAŠKRABA; TUNDISI, 2000).
O estudo da composição e distribuição zooplanctônica de reservatórios é de grande interesse, pois fornece dados sobre os mecanismos de transferência de energia, regeneração e transporte de nutrientes, sendo a estruturação dessa comunidade resultante dos processos de colonização e de seleção de espécies (ARMENGOL, 1980; CASABIANCA; SENDACZ, 1985).
Os estudos sobre a comunidade zooplanctônica na região amazônica foram intensificados a partir da década de 70 do século passado, com as pesquisas realizadas na sua maioria em lagos naturais, principalmente os de várzea, de rios de água branca. Os lagos de terra firme (água preta), os rios e os reservatórios têm sido pouco investigados. Dentro dos trabalhos pioneiros para a Amazônia, pode-se citar os trabalhos de Andrade e Brandorff (1975), Bozelli (1992, 1998); Brandorff (1972, 1973a, 1973b, 1976), Carvalho (1983), Castro (1994), Cipóli e Carvalho (1973), Fim (1992), Fisher et al., (1983), Hardy (1978, 1989, 1992), Koste (1972, 1974), Koste e Robertson (1983), Koste e Hardy (1984), Robertson (1980, 1981), Robertson e Hardy (1984) e Hardy et al., (1984).
O presente estudo tem como objetivo fornecer informações preliminares sobre a composição e abundância relativa do zooplâncton no lago Bolonha.
Descrição da área de estudo
A mata do Utinga é uma floresta tropical úmida perenifolia, de terra firme, com alguns pontos sujeitos à inundação. Está situada na região metropolitana de Belém, no estado do Pará, e abriga o Parque Ambiental de Belém, com cerca de 1.348 ha, e os mananciais hídricos que abastecem a cidade, lagos Bolonha e Água Preta. Segundo Köppen, seu clima é do tipo Af, com umidade média anual de 70% (SECTAM, 1992).
O lago Bolonha (Figura 1), construído em 1902 e ampliado em 1951, tem capacidade de armazenamento de 2.000.000 m3 de água, área de 512.540 m2 e nível máximo de 7,64 m (SECTAM, 1992). Este lago faz parte do Parque Ambiental do Utinga, que engloba toda a bacia do Utinga, localizada no quadrante 48o11'00" e 48o13'48" W e 1o21'32" e 1o24'54" S, no município de Belém, estado do Pará (DIAS, 1991).

Em função de suas características próprias, foram determinadas três estações de coleta:
BO-01: Situa-se a cerca de 50 m da Estação de Tratamento de Água (ETA), com uma profundidade local de 4,9 m, água límpida, esverdeada e sem vegetação sobrenadante.
BO-02: Situa-se no braço direito do lago, com uma profundidade local de 0,8 m, sendo um ponto de despejo de esgoto doméstico, com água suja, marrom-acizentada, espuma e vegetação sobrenadante (mururé, aguapé, barba de bode), odor nauseabundo e favelas próximas.
BO-03: Situa-se no braço esquerdo do lago, com profundidade local de 1,6 m, água bége-marrom, muitas macrófitas, porém bem menos do que na estação BO-02, e margeado por vegetação de grande porte.
MATERIAL E MÉTODOS
Os dados aqui apresentados são resultados de coletas realizadas em setembro de 1993.
Parâmetros físico-químicos
A temperatura foi determinada no campo, utilizando-se um termômetro graduado em graus (±1oC); a transparência foi determinada utilizando-se um disco de Secchi, de 30 cm de diâmetro; o potencial Hidrogeniônico (pH) foi determinado em laboratório, utilizando-se um pHmetro; e oxigênio dissolvido (OD) foi determinado pelo método de Winkler, modificado pela ázida sódica.
Composição e ocorrência de zooplâncton
As amostras para a determinação da composição do zooplâncton foram obtidas usando-se uma rede de nylon cônica, com diâmetro de 30 cm e abertura de malha de 64 µm, em arrastos horizontais na coluna da água. Depois de coletadas, foram acondicionadas em frascos de polipropileno e fixadas com formol neutro, a uma concentração final de 4-6%. No laboratório foi procedida a análise qualitativa dos organismos, usando-se um microscópio estereoscópio e um microscópio ótico. Cada amostra foi analisada identificando-se os organismos a nível específico quando possível, sendo essa a identificação baseada nos trabalhos de Brandorff (1976), Brandorff, Koste e Smirnov (1982), Cipólli e Carvalho (1973), Elmoor-Loureiro (1997), Hardy (1978), Korovchinscky (1992), Koste (1978), Paggi (1979, 1995), Reid (1985), Robertson (1980), Santos-Silva et al., (1989), Smirnov (1992), entre outros.
Densidade zooplanctônica
As amostras para a determinação da densidade foram obtidas filtrando-se 100 l de água de cada estação de amostragem. Para a fixação foi utilizado o mesmo procedimento descrito no item anterior.
A amostra foi contada em sua totalidade, quando possível, ou em sub-amostras de 1 ml, contadas em câmara de Segdwich-Rafter, e os resultados expressos em org/l.
RESULTADOS
Os resultados aqui apresentados constituem as primeiras informações sobre os organismos zooplanctônicos do lago Bolonha. As análises das amostras revelaram que a comunidade zooplanctônica apresenta-se bem diversificada e os parâmetros abióticos analisados apresentaram-se com alguma variabilidade entre os pontos de coleta.
Fatores abióticos
O valor mínimo da transparência foi registrado na estação BO-02, com 0,6 m, e o máximo na BO- 03, com 0,9 m (Tabela 1). A menor temperatura foi registrada na estação BO-02, com 29,5oC, e a maior foi registrada na estação BO-03, com 31oC. A profundidade máxima apresentada pelo lago Bolonha foi de 4,9 m, e valores mínimos na estação BO-0,2 com 0,8 m.
O oxigênio dissolvido na estação de coleta BO-02 apresentou um valor crítico, 2,13 mg/l, bem abaixo dos padrões aceitáveis, segundo a resolução 20 do Conselho Nacional de Meio Ambiente (CONAMA, 1986). Enquanto que, nas estações BO-01 e BO-02, os valores foram bem elevados, acima dos 6,5 mg/l. O pH do lago Bolonha apresentou valores máximos na estação BO-01, com 7,33, e mínimos na estação BO-03.
Zooplâncton
Para os três grupos estudados (Rotifera, Cladocera e Copepoda), 56 táxons foram identificados (Tabelas 2 e 3). O maior número de táxons foi registrado para os Rotifera (30 táxons), que foram representados por 11 famílias, sendo Brachionidae a que apresentou o maior número de gêneros. Dentre os Cladocera (19 táxons), ocorreram 7 famílias, com os Chidoridae, apresentando o maior número de gêneros. Para os Copepoda (7 táxons), houve um equilíbrio entre os Calanoida e os Cyclopoida, com 4 e 3 gêneros, respectivamente.
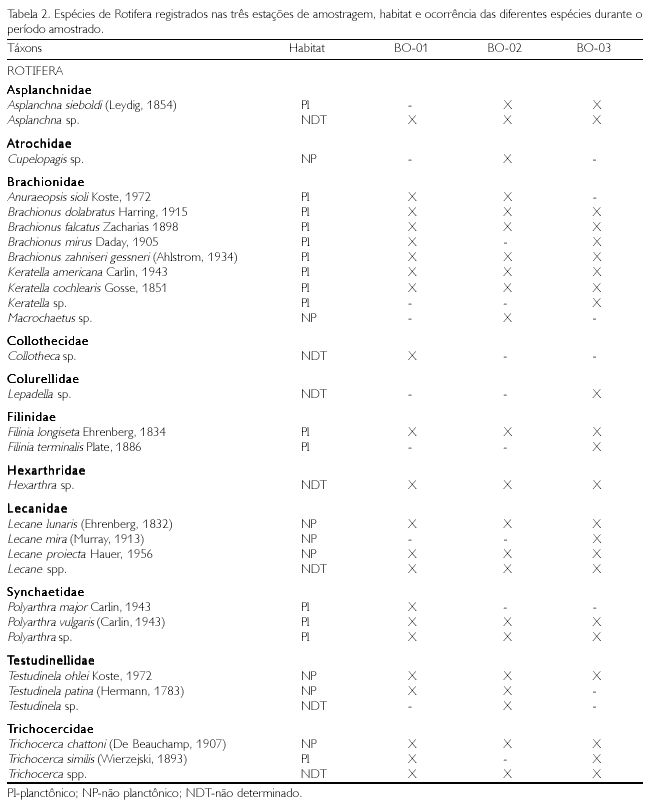
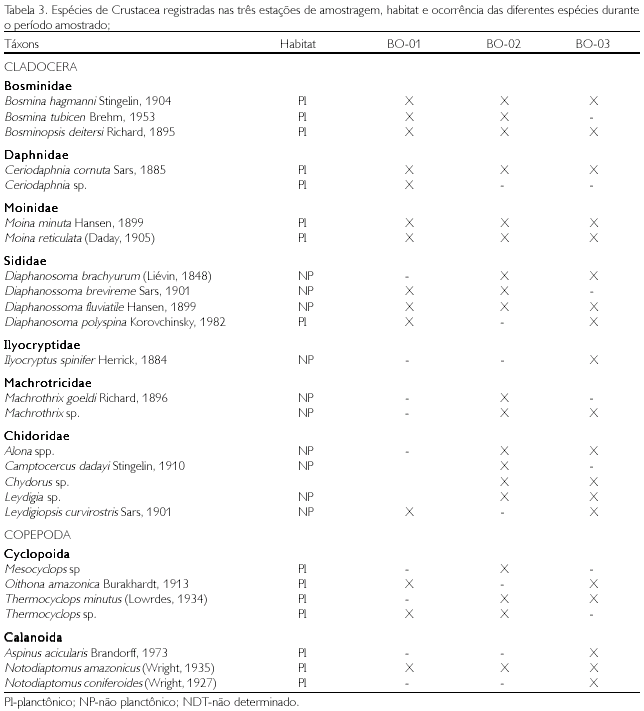
Os Rotifera e os Cladocera apresentaram as maiores densidades na estação BO-01, com 6.000 e 3.650 org/l, enquanto que os Copepoda apresentaram as maiores densidades na estação BO-03, com 2.000 org/l (Figura 2). As espécies de Rotifera, Polyarthra vulgaris, Tricocerca similis e Brachionus zahniseri gessneri, foram as que apresentaram maiores densidades; entretanto, dentre os microcrustáceos, os Cladocera apresentaram as maiores densidades na estação BO-01, com 3.650 org/l. Bosmina hagmanni e Bosminospsis deitersi foram as espécies de Cladocera que apresentaram as maiores densidades, e Notodiaptomus amazonicus e Oithona amazonica apresentaram as maiores densidades entre os Copepoda. Em geral, os Rotifera foram mais abundantes, seguidos dos Copepoda e dos Cladocera.
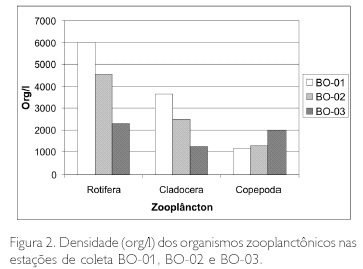
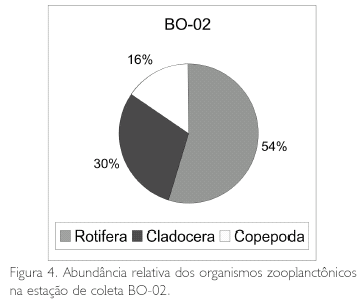
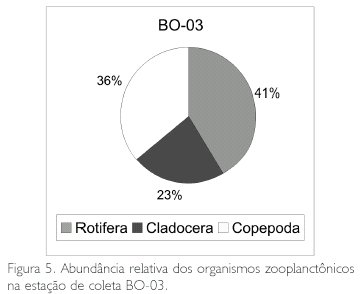
Em termos de porcentagem, observa-se na Figura 3 que os Rotifera corresponderam a 55% dos organismos encontrados na estação BO-01, os Cladocera a 34% e os Copepoda a 11%. Na Figura 4 estão as porcentagens da estação BO-02, observando-se que os Rotifera corresponderam a 54%, os Cladocera a 30% e os Copepoda a 16%; já na estação de coleta BO-03 (Figura 5), os Rotifera corresponderam a 41%, os Copepoda a 36% e os Cladocera a 23%.

DISCUSSÃO E CONCLUSÃO
Fatores abióticos
O reservatório Bolonha, semelhante aos demais reservatórios formados na Amazônia ou em outros países tropicais, inundou extensas áreas de florestas tropicais úmidas. O intenso processo de decomposição dessa fitomassa (folhas e liter), juntamente com as características hidrodinâmicas do reservatório, pode ter determinado as principais características físico-químicas das suas águas e o conseqüente desenvolvimento biológico posterior.
A transparência medida pelo disco de Secchi mostrou que, de maneira geral, o lago Bolonha apresenta baixa transparência, o que pode ser explicado pela grande quantidade de material em suspensão, dificultando a penetração de luz e, conseqüentemente, reduzindo a zona fotossintética.
A variação das temperaturas superficiais de um reservatório é igual à de um lago, dependendo principalmente das condições geográficas e do tamanho e profundidade do corpo hídrico (STRAŠKRABA; TUNDISI, 2000). Os valores registrados para a temperatura demonstram uma estabilidade térmica que, segundo Sectam (1992), é regida pelos ventos E e NE do anticiclone subtropical semifixo do Atlântico Sul e do anticiclone subtropical dos Açores, mas que também pode ter como influência a baixa profundidade do reservatório, o que provocaria uma estabilidade térmica.
A profundidade do Lago Bolonha é variável de acordo com as estações do ano, no período mais chuvoso (janeiro a março) a profundidade aumenta, alcançando o máximo de 7,64 m (SECTAM, 1992), pois está associada à elevação do nível do rio Guamá e do atual estágio de assoreamento dos lagos e igarapés, acarretando a formação de extensas áreas de inundação, ultrapassando em mais de 1 m o nível médio de profundidade do lago. Em setembro, nos três pontos de amostragem a profundidade máxima não ultrapassou 4,9 m.
O oxigênio dissolvido na estação de coleta BO-02 apresentou um valor crítico, 2,13 mg/l, bem abaixo dos padrões aceitáveis (CONAMA, 1986). Na superfície de reservatórios, concentrações baixas de oxigênio indicam poluição orgânica vinda do exterior, uma vez que a decomposição da matéria orgânica importada prevalece sobre a produção fotossintética (STRAŠKRABA; TUNDISI, 2000). Isto possivelmente pode estar relacionado com o fato de haver zona de ocupação urbana desprovida de serviço de esgotos nas proximidades.
Toda a superfície hídrica, durante períodos de baixa atividade fotossintética, apresenta pH entre 6 e 7,2. No que se refere ao potencial hidrogeniônico (pH), o lago Bolonha apresenta-se como um corpo de água homogêneo, ligeiramente ácido, com exceção da estação de coleta BO-01, que se apresentou neutra.
Os parâmetros físico-químicos analisados mostraram que o lago Bolonha é um corpo de água pouco profundo, com águas ligeiramente ácidas, pouca transparência e com problemas de anoxia em suas águas, principalmente na estação BO-02.
Zooplâncton
O maior número de táxons registrados para os Rotifera (30) em relação aos outros grupos do zooplâncton, na região neotropical, também é observado por diversos autores nas planícies de inundação da Amazônia (KOSTE; ROBERTSON, 1983; HARDY et al., 1984; HARDY, 1978; BOZELLI, 1992; KOSTE; ROBERTSON, 1998).
A composição de Cladocera observada neste estudo vai de encontro com o que foi descrito por Robertson e Hardy (1984) para a região amazônica. Essas autoras mostraram que algumas espécies dominam numericamente a bacia amazônica, como B. deitersi, C. cornuta, M. minuta e M. reticulata, Daphnia gessneri e algumas espécies de Bosmina e Diaphanosoma. No presente estudo, apenas D. gessneri não apareceu nas amostras, e Bosminopsis deitersi e Bosmina hagmanni dominaram numericamente as amostras. Na Venezuela, pesquisas em ambientes similares aos encontrados neste estudo reforçam a importância do gênero Bosmina e das espécies C. cornuta, M. minuta e D. Birgei (TWOMBLY; LEWIS JR., 1987; HAMILTON et al., 1990; SAUNDERS; LEWIS, 1989) na composição desses ecossistemas.
Os Copepoda apresentaram uma baixa riqueza de espécies e a abundância observada foi, sobretudo, devido aos estágios juvenis de náuplios e copepoditos, sendo raros os representantes na forma adulta, ao contrário de outros estudos. Exceções a isso são as espécies Oithona amazonica e Notodiaptomus amazonicus, que apresentaram uma relativa densidade.
Os registros de 56 táxons são superiores aos trabalhos verificados por Bozzelli (1992) no Pará, com 53 táxons; e Zoppi de Rôa et al. (1990) na Venezuela, com 25 táxons; e inferior aos trabalhos realizados por Serafim Jr. (1997), com 263 táxons, no alto rio Paraná; Koste e Böttger (1989) com 161, para o Equador; Campos et al. (1996), com 135 táxons, na planície de inundação do alto rio Paraná; e Bonecker et al. (1996) com 74 táxons, no rio Doce (MG).
Robertson e Hardy (1984), baseadas nos dados amazônicos, estimaram que devem ser encontradas 250 espécies de rotíferos, 40 espécies de copépodos e 20 de cladóceros (exceto os Macrothricidae e Chydoridae) na bacia Amazônica. Rocha, Tundissi, T. e Tundissi, J. (1994) relataram que a diversidade total do zooplâncton na bacia Amazônica é a maior no Brasil, apresentando 344 espécies (268 Rotifera, 28 Cladocera e 48 Copepoda), seguida pela bacia do Paraguai, Paraná e São Francisco.
O número total de espécies num componente trófico ou numa comunidade como um todo mostra que uma pequena porcentagem relativamente pequena é dominante e uma porcentagem grande é de espécies raras (ODUM, 1988). Os resultados encontrados neste estudo corroboram a afirmativa de Odum.
A ocorrência de espécies não planctônicas em número elevado nas amostras, provavelmente, está ligado à presença de macrófitas aquáticas, amplamente distribuídas nas estações BO-02 e BO-03, como foram visto por Lima, Lansac-Tôha e Bonecken (1996) para diferentes ambientes da planície de inundação do alto rio Paraná. Mas esse número pode ser bem diferente, pois nesse estudo não foram analisadas amostras das macrófitas aquáticas, fator que certamente deverá aumentá-lo de forma substancial.
A ocorrência de espécies caracteristicamente litorâneas ou que vivem próximas ao sedimento, em regiões pelágicas, tem sido observado por vários autores, relacionando-as com a influência dos ventos, enchentes (flood pulse) ou precipitação (PAGGI, J.; PAGGI, S., 1974; HARDY, 1978; SANTOS, 1980; ROBERTSON, 1980; SEIXAS, 1981), que provocam o deslocamento das macrófitas ou retiram as espécies desses vegetais aquáticos ou, então, provocam a mistura de água com ressurgimento em regiões menos profundas, como é o caso das estações BO-02 e BO-03. Das 56 espécies encontradas neste estudo, 26 são espécies consideradas não-planctônicas ou não determinado o tipo de vida.
O zooplâncton foi bastante semelhante aos verificados na planície de inundação da Amazônia, como também no Paraná, embora o lago Bolonha tenha apresentado diversidade menor, justificado pela ausência de nichos apropriados associados à instabilidade do ecossistema causados pelas flutuações no nível da água no lago, nesse tipo de ecossistema, influenciam notavelmente nos processos ecológicos e, conseqüentemente, no sucesso de estabelecimento de populações aquáticas.
REFERÊNCIAS
ANDRADE, E. R. L.; BRANDORFF, G. O. 1975. Uma nova espécie de Diaptomidae (Crustacea, Copepoda) "Diaptomus" negrensis das águas pretas perto de Manaus. Acta Amazonica, v. 5, n. 1, p. 97-103.
ARMENGOL, J. 1980. Colonización de los embalses español por crustáceos planctônicos y evolución de la estructura de sus comunidades. Oecol. Aquat., Paris, v. 4, p. 45-70.
BONECKER, C. C. et al. 1996. Zooplankton composition under the influence of liquid wastes from a pulp mill in the middle doce river (Belo Oriente, MG, Brazil). Arq. Biol. Tecnol., v. 39, n. 4, p. 893-901.
BOZELLI, R. L. 1992. Composition of the zooplankton community of Batata and Mussurá lakes and the Trombeta river, State of Pará, Brazil. Amazoniana., v. 12, n. 2, p. 239-261.
BOZELLI R. L. 1998. Influences of suspended inorganic matter on carbon ingestion and incorporation rates of two tropical cladocerans, Diaphanosoma birgei and Moina minuta. Arch. Hydrobiol., v. 142, p. 451-465.
BRANDORFF, G. O.; KOSTE, W.; SMIRNOV, N. N. 1982. The composition and structure of Rotiferan and Crustacean communities of the lower Rio Nhamundá, Amazonas-Brazil. Stud. Neotrop. Fauna Environ., v. 17, p. 69-121.
BRANDORFF, G. O. 1972. Ein Beitrag zur Calanidenfauna (Crustacea, Copepoda) des Amazonasgebiets, mit einem Überblick über die Diaptomiden (Crustacea, Copepoda) Südamerikas. 57 f. Thesis (M.Sc.) – University of Kiel.
BRANDORFF, G. O. 1973a. Die Neotropischer Gattung Rhacodiaptomus Kiefer (Crustacea, Copepoda) mit der Beschreibung von zwei neuen Arten. Amazoniana, v. 4, n. 4, p. 341-365.
BRANDORFF, G. O. 1973b. Neue freilebende Calanoide Copepoden (Crustacea) aus den Amazonasgebiet. Amazoniana, v. 4, n. 2, p. 205-218.
BRANDORFF, G. O. 1976. The geographic distribution of the Diaptomidae in South America (Crustacea, Copepoda). Revista Brasileira de Biologia, v. 36, n. 3, p. 613-627.
CAMPOS, J. R. C. et al. 1996. Composição da comunidade zooplanctônica de três lagoas da Ilha Porto Rico na Planície de Inundação do Alto Rio Paraná. Acta Limnol. Brasil., v. 8, p. 183-194.
CARVALHO, M. L. 1983. Efeitos da flutuação do nível da água sobre a densidade e composição do zooplâncton em um lago de várzea da Amazônia, Brasil. Acta Amazonica, v. 13, n. 5-6, p. 715-724.
CASABIANCA, M. A. A.; SENDACZ, S. 1985. Limnologia do Reservatório do Borba (Pindamonhangaba, SP) II Zooplâncton. Bol. Inst. Pesca, v. 12, p. 83-95.
CASTRO, J. G. D. 1993. História de vida de Moina micrura (Crustacea-Cladocera) alimentada com três espécies de algas, no laboratório. 78 f. Dissertação (Mestrado) – INPA, FUA.
CIPÓLLI, M. N.; CARVALHO, M. A. J. 1973. Levantamento de Calanoida e Cyclopoida (Copepoda, Crustacea) das águas da região do Guamá, Capim e Tocantins, com nota sobre a fauna acompanhante . Pap. Avul. Zool., v. 27, n. 8, p. 95-110.
CONAMA. 1986. Considerando ser a classificação das águas doces, salobras e salinas essencial à defesa de seus níveis de qualidade, avaliados por parâmetros e indicadores específicos, de modo a assegurar seus usos preponderantes. Diário Oficial da União, Brasília, DF, 30 jul.
DIAS, S. F. (Coord.). 1991. Estudo ambiental no Utinga: vida útil do sistema de abastecimento de aguia de Belém. Belém: IDESP. 118 p. (Relatórios de Pesquisa, 19).
ELMOOR-LOUREIRO, L. M. A. 1997. Manual de identificação de cladóceros límnicos do Brasil. Brasília: Universa. 156 p.
FIM. J. D. I. 1992. Influência da alimentação no ciclo de vida de Moina micrura (Crustacea-Cladocera) em viveiros de peixes. 145 f. Dissertação (Mestrado) – PPG-BTRN, INPA, FUA.
FISHER, T. R. et al. 1983. vertical distribution of zooplankton and physico-chemical conditions during a 24-hour period in an Amazon floodplain lake - Lago Calado, Brazil. Acta Amazonica, v. 13, n. 3/4, p. 475-487.
HAMILTON, S. K. F. 1990. Zooplankton abundance and evidence for its reduction by macrophyte mats in two Orinoco floodplain lakes. J. Plankton Res., v. 12, n. 2, p. 345-363.
HARDY, E. R. 1978. Composição do zooplâncton em cinco lagos da Amazônia Central. 149 f. Dissertação (Mestrado) – Universidade Federal de São Carlos, São Paulo.
HARDY, E. R. 1992. Changes in species composition of Cladocera and food availability in a floodplain lake, Lago Jacaretinga, Central Amazon. Amazoniana, v. 12, n. 2, p. 155-168.
HARDY, E. R. 1989. Effects of temperature, food concentration and turbidity on life cycle characteristics of planktonic cladocerans in a tropical lake, Central Amazon: field and experimental work. 337 f. Thesis (Ph.D.) – Royal and Bedford New College, London.
HARDY, E. R.; ROBERTSON, B.; KOSTE, W. 1984. About the relationship between the zooplankton and fluctuating water levels of Lago Camaleão, a Central Amazonian várzea lake. Amazoniana, v. 9, n. 1, p. 43-52.
HARDY, E. R., ADIS, J.; BRANDORFF, G. O. 1984. Lectotype designation for Amazonian Diaptomidae and Bosminidae (Crustacea: Copepoda, Cladocera). Acta Amazonica, v. 14, n. 3/4, p. 529- 531.
KOROVCHINSKY, N. M. 1992. Sididae and Holopedidae: (Crustacea: Daphniiformes). The Hague: SPB Academic Publishing. 82 p.
KOSTE, W.; BÖTTGER, 1989. Rotatorien aus Gewässern Ecuadors. Amazoniana., v. 10, n. 4, p. 407-438.
KOSTE, W. 1972. Rotatorien aus gewassern Amazoniens. Amazoniana, v. 3, n. 3/4, p. 258-505.
KOSTE, W. 1974. Rotatorien aus einem Ufersee des unteren Rio Tapajós, dem Lago Paroni (Amazonien). Gewässer und Abwässer, v. 53/54, p. 43-68.
KOSTE, W. 1978. Rotatoria Die Rodertiere Mitteleleuropas Begrundet von Max voigt – Monogononta: Auflage neubearbeitet von Walter Koste. Berlin: Gebrüder Borntrager. v. 2. 234 p.
KOSTE, W.; HARDY, E. R. 1984. Taxonomic studies and new distribution records of Rotifera (Phylum Aschelminthes) from Rio Jatapú and Uatumã, Amazonas, Brazil. Amazoniana, v. 9, n. 1, p. 17-29.
KOSTE, W.; ROBERTSON, B. A. 1983. Taxonomics studies of the rotifera (phylum Aschelminthes) from a Central Amazonian varzea lake, Lago Camaleão (Ilha de Marchantaria, Rio Solimões, Amazonas, Brazil). Amazoniana, v. 8, n. 2, p. 225-254.
KOSTE, W.; ROBERTSON, B. A. 1998. The Rotifera of Shallow waters of the Ilha de Maracá. In : MILLIKEN, W.; RATTER, J. A. The Biodiversity and Environment of an Amazonian Rainforest. [S.l. :s.n.]. p. 399-401.
LIMA, A. F.; LANSAC-TÔHA, F. A.; BONECKER, C. C. 1996. The microcrustacean fauna of floodplain lake and tributary of the High river Paraná, in Mato Grosso do Sul, Brasil. Stud. Neotrop. Fauna Environ., v. 31, n. 2, p. 112-116.
ODUM, E. P. 1988. Ecologia. Rio de Janeiro: Guanabara. 434 p.
PAGGI, J. C. 1979. Revision de las especies Argentinas del género Bosmina Baird agrupadas en el subgénero Neobosmina Lieder (Crustacea: Cladocera). Acta Zool. Lilloana, v. 35, p. 137-162.
PAGGI, J. C. 1995. Ecosistemas de águas continentais: Metodologías para su estudio, Crustacea, Cladocera. Argentina: La plata. p. 909-949. Ediciones Sur.
PAGGI, J. C.; PAGGI, S. J. 1974. Primeiros estudios sobre el zooplancton de las águas lóticas del Paraná Medio. Physis, v. 33, n. 86, p. 91-114.
REID, J. W. 1985. Chave de identificação e lista de referências bibliográficas para as espécies continentais sulamericanas de vida livre da ordem Cyclopoida (Crustacea, Copepoda). Bol. Zool., Univ. São Paulo, v. 9, p. 17-143.
ROBERTSON, B. A. 1980. Composição, abundância e distribuição de Cladocera (Crustacea) na região de água livre da represa de Curuá-Una, Pará. 105 f. Dissertação (Mestrado) – INPA, FUA.
ROBERTSON, B. A. 1981. Associação congenérica de Ceriodaphnia cornuta Sars 1886 e Ceriodaphnia reticulata (Jurine) 1820 (Crustacea, Cladocera) na represa de Curuá-Una, Pará, Brasil. Acta Amazonica, v. 11, n. 4, p. 717-722.
ROBERTSON, B.; HARDY, E. R. 1984. Zooplankton of Amazonian lakes and rivers. In: SIOLI, H. The Amazon: limnology and landscape ecology of a mighty tropical river and its basin. [S.l.]: The Hague, Dr. W. Junk. p. 337-352.
ROCHA, O.; TUNDISI, T. M.; TUNDISI, J. G. 1994. Latitudinal trends of zooplankton diversity in the Neotropical Region: Present Knowledge and future needs. An. Acad. Bras. Cie., v. 66, supl. 1, p. 41-45.
SANTOS, L. C. dos. 1980. Estudo das populações de Cladocera em cinco lagos naturais (Parque Florestal do Rio Doce-MG), que se encontram em diferentes estágios de evolução. 260 f. Dissertação (Mestrado) – UFSCAR, São Carlos.
SANTOS-SILVA, E. N. DOS et al. 1989. Atlas dos copépodos planctônicos, Calanoida e Cyclopoida (Crustácea), da Amazônia Brasileira, I. Represa de Curuá-Uma, Pará. Rev. Bra. Zool., v. 6, n. 4, p. 725-758.
SAUNDERS, J. F.; LEWIS, W. M. 1989. Zooplankton abundance in the lower Orinoco river, Venezuela. Limnol. Oceanogr., v. 34, n. 2, p. 397-409.
SECTAM. 1992. Parque Estadual do Utinga: estudo ambiental. Belém: Secretaria de Estado de Ciência Tecnologia e Meio Ambiente. 107 p. Relatório Técnico SOFREL-018/92.
SEIXAS, M. H. 1981. Aspectos ecológicos das populações de Cladocera (Crustácea) na represa do Lobo (Broa). 156 f. Dissertação (Mestrado) – UFSCAR, São Carlos, SP.
SERAFIN JR., M. 1997. Heterogeneidade espacial e temporal da comunidade zooplanctônica do sistema rio Ivinhema - Lagoa dos Patos, Planície de inundação do Alto Rio Paraná (MS). 44 f. Dissertação (Mestrado), Maringá, Paraná.
SIOLI, H. 1951. Alguns resultados e problemas da limnologia amazônica: I.A.N. Boletim Técnico Técnico, n. 24.
SMIRNOV, N. N. 1992. The Macrothricidae of the world. [S.l.]: The Hague, SPB Academic Publishing. (Guides to the identification of the macroinvertebrates of the continental waters of the world, 3). 143 p.
STRAŠKRABA, M.; TUNDISI, J. G. 2000. Gerenciamento da qualidade de água de represas. São Carlos, SP: [s.n.]. 280 p.
TWOMBLY, S.; LEWIS JR., W. M. 1987. Zooplankton abundance and species composition in Laguna la Orsinera, a Venezuelan floodplain lake. Arch. Hydrobiol./Suppl., v. 79, n. 1, p. 87-107.
ZOPPI DE RÔA, E. et al. 1990. Composicion preliminar Del zooplankton Del rio Churun (Auyantepuy, Venezuela). Memoria: sociedade de ciencias naturales la salle, Tomo 49/50, n. 131-134.
 Endereço para correspondência:
Endereço para correspondência:
Editora do Museu Paraense Emílio Goeldi
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91-3219-3317
E-mail:boletim@museu-goeldi.br













