Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.1 n.3 Belém dez. 2006
Taxas de filtração e ingestão de Thalassiosira weissflogii (Bacillariophyta) por Euterpina acutifrons Dana (Copepoda)
Filtration and ingestion rates of Thalassiosira Weissflogii (Bacillariophyta) by Euterpina acutifrons Dana (Copepoda)
Vanessa Oliveira LemosI; Rauquírio Marinho da CostaI; Luci Cajueiro Carneiro PereiraII
IUniversidade Federal do Pará. Campus de Bragança. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil (vanessa.cast@zipmail.com.br) (raucosta@ufpa.br)
IIUniversidade Federal do Pará. Campus de Bragança. Instituto de Estudos Costeiros. Laboratório de Oceanografia Costeira e Estuarina. Bragança, Pará, Brasil (cajueiro@ufpa.br)
RESUMO
Experimentos de curta duração foram realizados para determinar a eficiência alimentar do copépodo Euterpina acutifrons, alimentado com Thalassiosira weissflogii. Quatro fêmeas adultas de Euterpina acutifrons foram selecionadas e transferidas para recipientes experimentais de vidro, com volume de 15 ml, preenchidas com diferentes diluições de cultivos desta diatomácea, com concentrações celulares de 7,5; 10,0; 12,5; 15,0; 17,5; 20,0; 22,5 e 25,0 x 103 células.ml-1 (8 tratamentos, 3 réplicas, 4 copépodos/réplica). As concentrações inicial e final do controle e dos recipientes experimentais foram determinadas utilizando uma câmara de Neubauer. As taxas de filtração e ingestão foram medidas a partir de experimentos de herbivoria realizados em laboratório sob condições controladas. As taxas de filtração de Euterpina cutifrons oscilaram entre 0,81 e 2,92 ml.copépodo-1 .h-1, demonstrando valores significativamente mais elevados (p<0,05) para concentração de 7,5 x 103células.ml-1. As taxas de ingestão variaram entre 1,8 e 8,13 x 103 células.copépodo-1 .h-1, demonstrando a existência de diferenças significativas (p<0,05) entre os tratamentos com baixos (7,5 x 103 células.ml-1) e elevados números de células (22,0 x 103 células.ml-1). As taxas de alimentação de Euterpina acutifrons alimentadas com Thalassiosira weissUogiirevehram o importante papel desta espécie de copépodo nas teias tróficas aquáticas dos ecossistemas costeiros da região amazônica, especialmente no nordeste do Pará, local em que são comumente encontrados.
Palavras-chave: Taxas de alimentação. Copépodos. Ditomáceas.
ABSTRACT
Short-term experiments were carried out to study the feeding performances of the copepod Euterpina acutifrons fed on Thalassiosira weissiogii. Four adult females of this species were sorted and transferred to 15 ml glass bottles filled with different dilutions of the diatom cultures to obtain cell concentrations of 7.5, 10.0, 12.5, 15.0, 17.5, 20.0, 22.5 and 25.0 x 103 cell.ml-1 (8 treatments, 3 replicates, 4 copepods/replicate). Initial and final cell concentrations of control and experimental bottles were determined using a Neubauer Chamber. Filtration and ingestion rates were measured thought 1 hour grazing trials performed under controlled laboratory conditions. Filtration rates of Euterpina acutifrons oscillated from 0.81 to 2.92 ml. copepod-1 .h-1 and they significantly higher (p<0.05) on 7.5 x 103 cell.ml-1 concentration. Ingestion rates varied between 1.8 and 8.13 x 103 cell.copepod-1.h-1, showing significative differences (p<0.05) between treatments with low (7.5 x 103 cell.ml-1) and high (22.0 x 103 cell.ml-1) number of cells. The feeding rates of Euterpina acutifrons fed on Thalassiosira weissüogii revealed the important hole of this species of copepod on the aquatic food web of coastal ecosystems of the Amazonian region, especially on the northeast of Pará where it is commonly found.
Keywords: Feeding rates. Copepods. Diatoms.
INTRODUÇÃO
O zooplâncton constitui uma das comunidades mais abundantes e diversificadas dos ecossistemas costeiros, uma vez que possui espécies pertencentes a quase todos os filos de invertebrados (RAYMONT 1980) e, como segundo nível trófico, exerce papel central na formação, transformação e exportação de partículas biogênicas.
Dentre os organismos que compõem o zooplâncton costeiro e estuarino, os copépodos constituem o grupo mais representativo, representando cerca de 80% ou mais do número total de indivíduos desta comunidade (OMORI; IKEDA, 1984; SANKARANKUTTY et al., 1995; GÓMEZ-GUTIÉRREZ, et al., 1999). Os copépodos são extremamente importantes devido ao papel que exercem nos processos de reciclagem de nutrientes e na regulação de populações fitoplanctônicas, através do aumento da taxa de consumo sobre estes organismos. Funcionam como elo na transferência de energia e matéria orgânica dos produtores primários para os principais consumidores do sistema, incluindo muitas espécies de peixes de interesse comercial (PARSONS; TAKAHASHI; HARGRAVE, 1984), além de apresentar importância central na teia alimentar pelágica (KAMIYAMA, 1994).
Os experimentos de herbivoria (grazing), realizados em campo ou laboratório, são indispensáveis para compreensão da transferência de energia dentro dos diferentes níveis tróficos das teias alimentares aquáticas, podendo, a partir destes, ser estabelecida a influência da biomassa fitoplanctônica sobre a cadeia alimentar e, concomitantemente, determinar o efeito dos consumidores primários sobre a comunidade fitoplanctônica local.
Huntley et al. (1986), Uye (1986) e Turner e Tester (1989) determinaram que as interações de grazing são altamente específicas e que os efeitos do grazing de copépodos sobre o fitoplâncton e, em especial, sobre as proliferações de dinoflagelados, dependem da composição de espécies presentes no ecossistema em questão.
Euterpina acutifrons Dana é um pequeno copépodo pelágico haparcticóide, normalmente encontrado em zonas neríticas do mar Mediterrâneo e do oceano Atlântico extremamente abundante em águas costeiras (NEUNES; PONGOLINI, 1965; MOREIRA; VERNBERG, 1968; VALDÉS et al., 1990; COSTA; FERNANDEZ, 2002), comumente registrado em amostras coletadas no estuário do rio Caeté e zonas costeiras adjacentes. Poucos são os experimentos de grazing realizados com esta espécie, embora os dados existentes na literatura demonstrem elevadas taxas de filtração e ingestão de Euterpina acutifrons sobre diferentes espécies de dinoflagelados (COSTA; FERNANDEZ, 2002; COSTA et al., 2005). Outros experimentos demonstraram a existência de uma relação direta entre o tamanho e números de ovos desta espécie de copépodo em indivíduos submetidos a diferentes concentrações alimentares (GUISANDE et al., 1996).
O presente trabalho tem por objetivo determinar as taxas de filtração e ingestão de Euterpina acutifrons, alimentada com diferentes concentrações de Thalassiosira weissflogii, com o intuito de compreender parte da trofodinâmica do estuário do rio Caeté, a partir de dados concernentes à transferência de energia entre os elos iniciais da cadeia trófica aquática local, visto a importância deste copépodo no ecossistema em estudo e o papel dos produtores primários e secundários na manutenção e avaliação de estoques pesqueiros.
MATERIAL E MÉTODOS
Coletas de campo e identificação das espécies zooplanctônicas dominantes
Nas coletas de plâncton, realizadas no furo Grande (estuário do rio Caeté), foi utilizada uma rede cônico-cilíndrica de 1 m de comprimento, 30 cm de diâmetro de boca e 150 µm de abertura de malha. As amostras foram coletadas durante os meses de dezembro de 2004 (período seco) e janeiro (início do período chuvoso) de 2005, utilizando arrastos horizontais, realizados no período de preamar, com duração de 5 a 10 min. Após os arrastos, as amostras foram acondicionadas em recipientes plásticos, armazenadas em um recipiente térmico provido de ice packs e transportadas ao Laboratório de Plâncton e Cultivo de Microalgas da Universidade Federal do Pará (UFPA), Campus de Bragança.
No laboratório, as amostras foram analisadas para identificação dos organismos zooplanctônicos dominantes e determinação da espécie a ser utilizada nos experimentos.
A espécie Euterpina acutifrons foi selecionada devido a sua elevada abundância no estuário do rio Caeté e zonas costeira adjacentes e, também, pela facilidade de isolamento e manutenção em laboratório. Os espécimes de Euterpina acutifrons isolados foram mantidos em recipientes plásticos contendo água do mar com salinidade similar à observada no ponto de coleta (28 psu).
Experimentos de alimentação
Para os experimentos de grazing foram separadas, com o auxílio de uma pipeta pauster, 96 fêmeas de Euterpina acutifrons, as quais foram aclimatadas em laboratório às condições de cultivo (temperatura constante e alimentação com Thalassiosira weiisflogii) e transferidas posteriormente para diferentes recipientes plásticos, devidamente tampados e identificados, contendo 15 ml de água do mar filtrada com salinidade de 28 sp.
Para cada tratamento foram utilizadas três réplicas, cada uma contendo 4 fêmeas. As concentrações de células correspondentes a cada tratamento (7,5; 10,0; 12,5; 15,0; 17,5; 20,0; 22,5 e 25,0 x 103 células.ml-1) foram determinadas através da contagem de subamostras de um cultivo denso de Thalassiosira weissflogii, utilizando uma câmara de Neubauer dupla espelhada e um microscópio binocular Leica 2000.
Os experimentos foram realizados em uma sala climatizada desprovida de irradiação luminosa, durante o período de 1 h, o qual foi determinado em função das respostas alimentares dos copépodos (observadas em experimentos prévios), de modo a fornecer informações que não sejam mascaradas pelo efeito do tempo de experimento sobre as taxas de filtração. Após o período de incubação (1 h) foram retiradas alíquotas de cada tratamento, fixadas em formol neutro (tetraborato de sódio) a 4% para posterior contagem do número final de células. Os valores registrados foram aplicados nas fórmulas descritas por Frost (1972):

Análise estatística
Os dados obtidos foram testados quanto a sua homogeneidade e normalidade segundo os testes de Bartlett (SOKAL; ROHLF 1969) e Lilliefors (CONOVER, 1971), respectivamente, sendo transformados quando tais pressupostos não foram verificados (log x +1). Posteriormente, para avaliar a existência de diferenças entre as taxas de alimentação de Euterpina acutifrons sobre os diversos tratamentos empregados, realizou-se uma análise de variância unifatorial (ANOVA), seguida do teste de significância Post-hoc PLSD de Fisher (p<0,05).
RESULTADOS E DISCUSSÃO
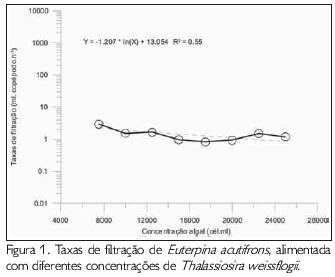
Para a filtração foi possível observar uma taxa de saturação a partir da concentração de 15 x 103 células.ml-1, embora tenha sido registrada uma pequena elevação nas taxas de filtração obtidas nas últimas três concentrações.
As taxas de filtração de Euterpina acutifrons alimentadas com Thalassiosira weissflogii foram significativamente mais elevadas (p<0,05) na concentração de 7,5 x 103 células.ml-1 que nas demais concentrações utilizadas, apresentando valores que oscilaram entre 0,81 e 2,92 ml.copépodo-1 .h-1 (Figura 1). Não foram observadas diferenças significativas entre os demais tratamentos.
Quando alimentadas com Thalassiosira weissflogii. os copépodos apresentaram taxas de ingestão que oscilaram entre 1,806 a 8,131 células. copépodo-1.h-1, sendo o valor observado para a concentração de 7,5 x 103 células.ml-1, significativamente inferior (p< 0,05) ao registrado para as concentrações superiores a 20 x 103 células.ml-1 (Figura 2). Não houve diferenças significativas entre os tratamentos constituídos por concentrações superiores a 20 x 103 células.ml-1, confirmando a saturação da taxas de ingestão a estas concentrações.
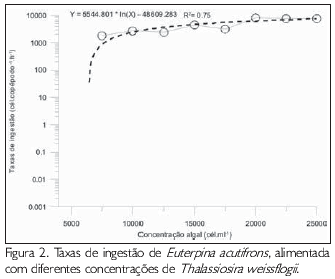
Nos diferentes tratamentos empregados para Euterpina acutifrons, foi possível observar que as taxas de filtração tendem a diminuir com o aumento das concentrações alimentares, enquanto as taxas de ingestão, de uma forma geral, são mais elevadas na presença de uma maior disponibilidade de alimento. Este padrão alimentar foi também observado por diversos autores em trabalhos de alimentação realizados com diferentes espécies de copépodos (FROST, 1972; KIORBØE; MØHLENBERG; NICOLAGSEN, 1982; UYE; KUWATA; ENDO, 1987; COSTA, 2002; COSTA; FERNÁNDEZ, 2002). Nos experimentos realizados com Euterpina acutifrons, assim como nos experimentos realizados por Calbet e Alcaraz (1997) e Dutz (1998), foi possível observar taxas saturantes de filtração e ingestão, demonstrando que as concentrações utilizadas foram adequadas aos objetivos propostos pelo trabalho.
Euterpina acutifrons apresentou taxas saturantes de ingestão inferiores às observadas por Costa (2002), ao empregar diferentes espécies de dinoflagelados como fonte de alimento. As taxas máximas de filtração de Acartia grani alimentada, in situ, com populações fitoplanctônicas naturais (BAUTISTA, RODRIGUEZ, JIMÉNEZ, 1988) foram superiores às obtidas para E. acutifrons. Estas diferenças podem, possivelmente, ser explicadas pelas diferenças dimensionais entre estes copépodos, como observado por Lam e Frost (1976) e Costa (2002), ou pelas diferentes estratégias alimentares utilizadas por ambas as espécies, como comprovado para outras espécies (PAFFENHÖFER, 1984).
Costa e Fernández (2002), realizando trabalhos de grazing com a mesma espécie de copépodo, alimentada com Alexandrum minutum, Gyrodinium corsicum e Rhodomonas baltica, obtiveram taxas de filtração e ingestão inferiores às observadas no presente experimento. A dependência dos processos alimentares dos copépodos em relação às dimensões, forma e concentrações celulares do fitoplâncton (FROST, 1972, 1975; NIVAL, P.; NIVAL, S., 1976; FERNÁNDEZ, 1979a, 1979b) poderiam explicar estes resultados, visto que Thalassiosira weissflogii apresenta menores dimensões que as observadas nas espécies empregadas por estes autores. Por outro lado, as diferenças existentes entre as taxas de filtração e ingestão de Euterpina acutifrons em relação a outras espécies de copépodos poderiam ser explicadas por outros fatores, tais como ritmo de alimentação e estresse devido ao manejo dos copépodos (BAARS; OOSTERHUIS, 1984), ou pela redução da ingestão na presença de células não apetecíveis (LANDRY 1981).
A existência de diferenças na qualidade nutritiva de diferentes espécies algais (concentrações de proteínas, de nitrogênio e de carbono) poderia também explicar as diferentes taxas de filtração e ingestão registradas para Euterpina acutifrons , visto que, nos estudos de Libourel Houde e Roman (1987), foi possível observar que as taxas de ingestão de Acartia tonsa são inversamente proporcionais às concentrações celulares de proteínas, carbono e nitrogênio.
As taxas de ingestão registradas nos experimentos realizados com Thalassiosira weissflogii indicam que Euterpina acutifrons poderia exercer um importante papel no consumo de células desta espécie e de outras espécies de diatomáceas de dimensões similares no ecossistema estuarino do rio Caeté e zonas costeiras adjacentes, atuando como controlador do crescimento populacional de espécies de pequenas dimensões, principalmente durante o período seco (outubro a dezembro) e início do período chuvoso (janeiro), no qual este copépodo constitui uma das espécies dominantes da comunidade zooplanctônica local (PERES, 1999; PINHEIRO, 2005). Neste período, a presença de proliferações de espécies fitoplanctônicas de grandes dimensões (Coscinodiscus centralis e outras espécies do gênero) e coloniais (Skeletonema costatum, Chaetoceros peruvianusI etc.), em detrimento de espécies de pequenas dimensões, como algumas espécies do gênero Thalassiosira sp (CARMONA, 2005), reforçam a importância de Euterpina acutifrons nas teias tróficas aquáticas dos ecossistemas costeiros do nordeste do Pará.
Dados sobre as taxas de ingestão de Euterpina acutifrons são muito escassos na literatura, o que impede uma melhor discussão destes resultados. Por outro lado, este fato destaca a importância de estudos desta natureza para o entendimento das relações tróficas existentes entre os produtores e os consumidores primários de ecossistemas costeiros e estuarinos.
AGRADECIMENTOS
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão da bolsa de Iniciação Científica (CNPq/PIBIC), que possibilitou a realização deste trabalho, e de recursos financeiros concedidos através do Projeto Milênio/NEC.
REFERÊNCIAS
BAARS, M. A.; OOSTERHUIS, S. S. 1984. Diurnal feeding rhythms in North Sea copepods measured by gut fluorescence, digestive enzyme activity and grazing on labeled food. Netherlands Journal of Sea Research, v. 18, p. 97-119.
BAUTISTA, B.; RODRIGUEZ, V.; JIMENEZ, F. 1988. Short-term feeding rates of Acartia grani in natural conditions: diurnal variations. Journal Plankton Research, v. 10, p. 907-920.
CALBET, A.; ALCARAZ, M. 1997. Growth and survival rates of early developmental stages of Acartia grani (Copepoda: Calanoida) in relation to food concentration and fluctuations in food supply. Marine Ecology Progress Series, v. 147, p. 181-186.
CARMONA, P. A. 2005. Distribuição Espaço/Temporal, Biodiversidade e Biomassa da Comunidade Planctônica do Estuário do Rio Caeté (Pará-Brasil). 58 f. Monografia (Trabalho de Conclusão de Curso - Universidade Federal do Pará.
CONOVER, W. J. 1971. Practical nonparametric statistics. London: Sidney, Wiley & Sons. 462 p.
COSTA, R. M.; FERNANDEZ, F. 2002. Feeding and survival rates of the copepods Euterpina acutifrons Dana and Acartia grani Sars on the dinoflagellates Alexandrium minutum Balech and Gyrodinium corsicum Paulmier and the Chryptophyta Rhodomonas baltica. Journal of Experimental Marine Biology and Ecology, v. 273, p. 131-142.
COSTA, R. M. 2002. Relaciones tróficas y ecotoxicológicas entre los copépodos Acartia grani y Euterpina acutifrons y diversas especies de dinoflagelados planctônicos marinos. 148 f. Tesis (Doctoral) - Universitat de Barcelona.
COSTA, R. M. et al. 2005. Toxin content and toxic effects of the dinoflagellate Gyrodinium corsicum (Paulmier) on the ingestion and survival rates of the copepods Acartia grani and Euterpina acutifrons. Journal of Experimental Marine Biology and Ecology, v. 322, p. 177-183.
DUTZ, J. 1998. Repression of fecundity in the neritic copepod Acartia clausi exposed to the toxic dinoflagellate Alexandrium lusitanicum: relationship between feeding and egg production. Marine Ecology Progress Series, v. 175, p. 97-107.
FERNANDEZ, F. 1979a. Nutrition Studies in the nauplius larva of Calanuspacifcus (Copepoda: Calanoida). Marine Biology, v. 53, p. 805-817.
FERNANDEZ, F. 1979b. Particle Selection in the nauplius of Calanus pacificus. Journal of Plankton Research, v. 1, n. 4, p. 313-328.
FROST, B. W. 1972. Effects of size and concentration of food particles on the feeding behaviour of the marine planktonic copepod Calanus pacificus. Limnology and Oceanography, v. 17, p. 805-817.
FROST, B. W. 1975. A Threshold Feeding behavior in Calanus pacificus. Limnology Oceanography, v. 20, p. 263-266.
GÓMEZ-GUTIÉRREZ, J. et al. 1999. Copepod daily egg production and growth rates in Bahía Magdalena, México. Journal of Plankton Research, v. 21, n. 12, p. 2227-2244.
GUISANDE, C. et al. 1996. Trade off between offspring number and offspring size in the marine coppod Euterpina acutifrons at different food concentrations. Marine Ecology Progress Series, v. 143, p. 37-44.
HUNTLEY, M. E. et al. 1986. Chemically-mediated rejection of dinoflagellate prey by the copepods Calanus pacificus and Paracalanus parvus: mechanism, occurrence and significance. Marine Ecology Progress Series, v. 28, p. 105-120.
KAMIYAMA, T. 1994. The impact of grazing by microzooplankton in northern Hiroshima Bay, the Seto Inland Sea, Japan. Marine Biology, v. 119, p. 77-88.
KIØRBOE, T.; MØHLENBERG, F.; NICOLAJSEN, H. 1982. Ingestion rate and gut clearance in the planktonic copepod Centropages hamatus (Lilljeborg) in relation to food concentration and temperature. ophelia, v. 21, n. 2, p. 181-194.
LAM, R. K.; FROST, B. W. 1976. Model of copepod filtering response to changes in size and concentration of food. Limnology and Oceanography, v. 21, p. 490-500.
LANDRY, M. R. 1981. Switching between herbivory and carnivory by the planktonic marine copepod Calanus pacifcus. Marine Biology, v. 67, p. 77-82.
LIBOUREL HOUDE, S. E.; ROMAN, M. R. 1987. Effects of food quality on the functional ingestion response of the copepod Acartia tonsa. Marine Ecology Progress Series, v. 40, p. 69-77.
MOREIRA, G. S.; VERNBERG, W. B. 1968. Comparative thermal metabolic patterns in Euterpina acutifrons dimorphic males. Marine Biology, v. 1, p. 282-284.
NEUNES, H. W.; PONGOLINI, G. F. 1965. Breeding a pelagic copepod, Euterpina acutifrons (Dana) in the laboratory. Nature, v. 5010, p. 571-573.
NIVAL, P.; NIVAL, S. 1976. Particle retention efficiencies of an herbivorous copepod, Acartia clausi (adult and copepodit stages): effects on grazing. Limnology Oceanography, v. 21, p. 24-38.
OMORI, M. J.; IKEDA, T. 1984. Methods in Marine Zooplankton Ecology. New York: John Wiley & Sons. 332 p.
PAFFENHÖFER, G. A. 1984. Food ingestion by the marine planktonic copepod Paracalanus in relation to abundance and size distribution of food. Marine Biology, v. 80, p. 323-333.
PARSONS, T. R.; TAKAHASHI, M.; HARGRAVE, B. 1984. Biological Oceanographic Processes. Oxford: Pergamon Press. 332 p.
PERES, A. C. 1999. A comunidade zooplanctônica em um canal de maré no estuário do rio Caeté, Bragança (Pará, Brasil). Dissertação (Mestrado) - Universidade Federal do Pará, Museu Paraense Emílio Goeldi. 121 p.
PINHEIRO, S. C. C. 2005. Dinâmica e estrutura populacional do zooplâncton na planície costeira bragantina (nordeste paraense-Brasil). Monografia (Trabalho de Conclusão de Curso) -Universidade Federal do Pará. 58 p.
RAYMONT, J. E. G. 1980. Plankton and productivity in the oceans: Zooplankton. Oxford, New York, Toronto: Pergamon Press. 824 p.
SANKARANKUTTY, C. et al. 1995. Further observations on Zooplankton of the Potengi Estuary (Natal, Rio Grande do Norte, Brazil) with special reference to the larvae of Brachyura (Crustacea, Decapoda). Ver. Bra. Zôo., v. 12, n. 2, p. 273-301.
SOKAL, R. R.; ROHLF, F. J. 1969. Biometry: the principles and practice of numerical classification in biological research. San Francisco, California: W. H. Freeman. 776 p.
TURNER, J. T.; TESTER, P. A. 1989. Zooplankton feeding ecology: copepod grazing during an expatriate red tide. Spring Verlag, Berlin: Heidelberg. p. 359-374. Novel Phytoplankton Blooms. Causes and Impacts of Recurrent Brown Tides and Other Unusual Blooms. (Coastal and Estuarine Studies, 35).
UYE, S. 1986. Impact of copepod grazing on the red tide flagellate Chattonella antiqua. Marine Biology, v. 92, p. 35-43.
UYE, S.; KUWATA, H.; ENDO, T. 1987. Standing stocks and production rates of phytoplankton and planktonic copepods in the Inland Sea of Japan. Journal of Oceanography Society of Japan, v. 42, p. 421-434.
VALDÉS, M. R. et al. 1990. Zooplankton composition and distribution off the coast of Galicia, Spain. Journal of Plankton Research, v. 12, p. 629-643.
 Endereço para correspondência:
Endereço para correspondência:
Editora do Museu Paraense Emílio Goeldi
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91-3219-3317
E-mail: boletim@museu-goeldi.br
Recebido: 10/03/2005
Aprovado: 18/10/2006













