Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.2 n.1 Belém abr. 2007
Osteología craniana de Bucconidae
Cranial osteology of Bucconidae
Lílian Marian Coelho Escobar Bueno LadeiraI; Elizabeth HöflingII
IUniversidade de São Paulo. Instituto de Biociências. Departamento de Zoologia. São Paulo, Brasil lilianladeira@terra.com.br
IIUniversidade de São Paulo. Instituto de Biociências. Departamento de Zoologia. São Paulo, Brasil ehofling@ib.usp.br
RESUMO
O artigo descreve a osteologia craniana de nove espécies pertencentes aos gêneros Monasa, Malacoptila, Chelidoptera, Nonnula, Bucco, Notharchus e Nystalus da família Bucconidae, um grupo de aves Neotropicais, incluído na ordem Piciformes. A anatomia craniana foi comparada principalmente com a das famílias Galbulidae, Picidae, Ramphastidae, Capitonidae e Indicatoridae. As estruturas ósseas foram descritas e, com base nos resultados, podem-se verificar algumas características comuns às espécies da família, além de variações interessantes entre aquelas estudadas. A presença de um processo pós-orbital bastante desenvolvido, assim como o processo zigomático evidente e afilado, entre outros, são caracteres comuns entre as espécies pertencentes à família Bucconidae. Nota-se claramente que, quanto ao tipo de fossa temporal, quanto às variações no osso lacrimal e à estrutura dos ossos do palato, os gêneros Monasa, Malacoptila, Nonnulae Chelidopteradistinguem-se dos gêneros Bucco, Notharchus e Nystalus, sempre acompanhando um padrão que os separa em dois grupos distintos.
Palavras-chave: Aves. Bucconidae. Crânio. Osteologia.
ABSTRACT
This paper describes the skull osteology of nine species which belong to Monasa, Malacoptila, Chelidoptera, Nonnula, Bucco, Notharchus and Nystalus genera within the family Bucconidae, a Neotropical avian group, traditionally included in the order Piciformes. The skull anatomy was compared to, mainly, among the families Galbulidae, Picidae, Ramphastidae, Capitonidae and Indicatoridae. The bone structures are also described based on the results which can be verified in some common family characteristics; besides that, some outstanding variation among the species studied are also pointed out. The presence of a well-developed posorbital process, as well as evident and slim zigomatic process, among others, are common characteristics of species belonging to the family Bucconidae. It is clearly noticeable that, regarding the temporal depression, lachrymal bone and palate bone structure, the Monasa, Malacoptila, Nonnula and Chelidoptera genera distinguish themselves from the Bucco, Notharchus and Nystalus by following a pattern that separates them in two distinct groups.
Keywords: Birds. Bucconidae. Skull. Osteology.
INTRODUÇÃO
A família Bucconidae é um grupo de aves Neotropicais pertencente à ordem Piciformes. Os buconídeos distribuem-se desde o sul do México (Oaxaca) até a Argentina, sem registros no Uruguai, sendo encontrados somente em áreas continentais; são mais comuns na bacia Amazônica, em terras baixas quentes, embora ocorram em regiões de 2900 m (Hapaloptila castanea) no centro e no norte dos Andes (HARRISON, 1978; TYNE; BERGER, 1976; STILES; SKUTCH, 1989; FJELDSA; KRABE, 1990; SIBLEY; AHLQUIST, 1990; STOTZ et al., 1996).
Fazem parte da família Bucconidae os gêneros Notharchus, Bucco, Nystalus, Malacoptila, Micromonacha, Hypnelus, Hapaloptila, Nonnula, Monasae Chelidoptera. O número total de espécies varia de 30 a 34 de acordo com os diferentes autores considerados. Van Tyne e Berger (1976), Campbell (1983), Austin (1988), Stiles e Skutch (1989) e Starck (1993) citam 30 espécies. Meyer de Schauensee (1970), Harrison (1978), Fjeldsa e Krabbe (1990), Howard e Moore (1994), Farneret al. (1994) e Stotz et al. (1996) consideram 32 espécies, enquanto Sibley e Monroe (1990), Sibley e Ahlquist (1990), Monroe e Sibley (1993), 33 e Morony et al. (1975), 34. Pinto (1978) e Sick (1987, 1993, 1997) citam oito gêneros e 22 espécies com ocorrência no Brasil.
A maioria das espécies possui a cabeça grande e larga, o pescoço curto, a plumagem abundante, grossa e eriçada, com cerdas proeminentes, aparentando ter o corpo maior e mais pesado do que na realidade é. As penas da cabeça ficam usualmente arrepiadas. A cauda, as asas e as pernas são geralmente curtas e, juntamente com a plumagem, dão à ave a aparência fofa que originou o nome puffbirds, em inglês. Os pés são zigodáctilos, como em todos os Piciformes.
Os buconídeos alimentam-se de insetos (adultos e larvas), diplópodes, chilópodes, opiliões, escorpiões, pequenos lagartos, anuros e Peripatus, que foi encontrado no estômago de Nystalus (SICK, 1985; 1993; 1997) e de Malacoptila striata minor (SCHUBART et al., 1965). Ocasionalmente, ou raramente, alimentam-se de frutos. A maioria usa a copa das árvores como estrato de forrageiro. Ficam a maior parte do tempo pousados nas extremidades dos galhos, de onde fazem vôos curtos em intervalos não freqüentes, para se alimentarem (SKUTCH, 1973; HARRISON, 1978; SICK, 1985, 1993, 1997; HILTY; BROWN, 1986; GILL, 1995).
Nidificam em tocas, buracos no solo, em barrancos ou em cupinzeiros arborícolas que são escavados pelo macho e pela fêmea. Como nos Galbulidae, o túnel pode chegar a 1,5 m (TYNE; BERGER, 1976). Ocasionalmente, podem ocupar outras cavidades já existentes. Tanto o macho quanto a fêmea incubam os ovos. O jovem nasce sem penas e com os olhos fechados, sendo alimentado tanto pelo pai como pela mãe (SKUTCH, 1972; HILTY; BROWN, 1986; SICK, 1987, 1993, 1997).
O arranjo tradicional da ordem Piciformes, incluindo as famílias Galbulidae, Bucconidae, Picidae, Indicatoridae, Ramphastidae e Capitonidae é aceito por vários autores (VERHEYEN, 1955; BEECHER, 1953; SCHAUENSEE, 1970; TYNE; BERGER, 1976; HARRISON, 1978; WEBB et al., 1979; CRACRAFT, 1981; SWIERCZEWISKY; RAIKOW, 1981; SIMPSON; OLSON, 1982, 1983; RAIKOW; CAMPBELL; LACK, 1985; LANYON; ZINK, 1987; GILL, 1989; FJELDSA; KRABBE, 1990; HOWARD; MOORE, 1994; STOTZ et al., 1996).
Beddard (1898), estudando estrutura e classificação de Aves, coloca a família Bucconidae provisoriamente na ordem Piciformes, juntamente com os Galbulidae, Picidae, Ramphastidae, Capitonidae e Indicatoridae, apesar de apresentarem caracteres anatômicos que os distinguem.
Existem outras divergências sistemáticas entre os autores, quanto à inclusão da família Bucconidae na ordem Piciformes. Webb et al. (1979) divide esta ordem em duas subordens: Galbulae, que engloba as famílias Galbulidae, Bucconidae, Capitonidae, Indicatoridae e Ramphastidae; e Pici, com a família Picidae.
A relação entre as famílias da ordem Piciformes é indicada por certos caracteres anatômicos comuns a todas, que incluem pés zigodáctilos com um arranjo distinto do tendão flexor, ausência de plúmulas em qualquer idade (exceto em Galbulidae), bico com forma especializada, característica de cada família, ossos do palato e aparência de aves arborícolas, podendo ser aparentados aos Passeriformes (CAMPBELL; LACK, 1985).
Sibley e Ahlquist (1986, 1990), Sibley et al, (1988) e Sibley (1990), com base nos dados de hibridação de DNA, colocaram a família Bucconidae na ordem Galbuliformes, juntamente com os Galbulidae, que pertencem à superordem Galbulimorphae e parvclass Coraciae, enquanto na parvclass Picae está a ordem Piciformes subdividida em duas infra-ordens, que são Picides, com as famílias Indicatoridae e Picidae; e Ramphastide, com três superfamílias: Megalaimoidea com a família Megalaimidae, Lybioidea com a família Lybiidae e Ramphastoidea com a família Ramphastidae, que inclui os Capitoninae e Ramphastinae
Neste trabalho foi feita uma descrição da osteologia craniana de espécimes da família Bucconidae, comparando-a com aquela encontrada em trabalhos relativos às famílias consideradas mais próximas filogeneticamente.
MATERIAL E MÉTODOS
O estudo foi feito com base no crânio de 15 espécimes de aves incluídas em sete gêneros entre os dez reconhecidos pertencentes a nove espécies da família Bucconidae.
O material utilizado é proveniente do Museu Paraense Emílio Goeldi (MPEG), Belém, Pará, Brasil; do Museu de História Natural de Taubaté, SP Brasil (MHNT); do Museu de Zoologia da Universidade de São Paulo, São Paulo, SP Brasil (MZ) e do Departamento de Zoologia (AZ), Instituto de Biociências (IB), Universidade de São Paulo, SP Brasil.
O material pertencente ao Museu de Zoologia (USP) foi fixado em formol 4% v/v e posteriormente preservado em etanol 70% v/v. A partir daí a cabeça foi separada do corpo na altura das primeiras vértebras cervicais, lavada com água abundantemente para a retirada do etanol e seca na estufa. Foi colocada em caixa com colônia de Dermestes sp. (Coleoptera) do Departamento de Zoologia, IB-USP para a retirada das partes carnosas. Os crânios foram colocados em peróxido de hidrogênio a 5% para clarear e limpar, etapa após a qual foram colocados novamente na estufa para secar. A ranfoteca foi retirada manualmente. O quadrado das aves foi mergulhado em água para ser desarticulado da caixa craniana.
O material proveniente do Museu Paraense Emílio Goeldi e do Museu de História Natural de Taubaté encontrava-se preparado.
Depois de preparados, os crânios foram observados e descritos utilizando-se estereoscópio Wild M3 (9,6x - 60x), fotografados e, posteriormente, desenhados.
A nomenclatura utilizada na descrição das unidades ósseas foi baseada na Nomina Anatomica Avium (BAUMEL et al., 1993) e basicamente aquela seguida por Höfling e Gasc (1984), Höfling (1995), Donatelli (1987, 1991, 1992, 1996), Marceliano (1996), Méndez (1998) e Silveira (1999).
Nas aves adultas, os ossos cranianos são precocemente anquilosados nas primeiras semanas de vida, desaparecendo as suturas entre os ossos. Devido a este fato, geralmente, são consideradas as regiões relativas aos ossos (HÖFLING; GASC, 1984; KING; MCLELLAND, 1984; GENNIP 1986; PROCTOR; LYNCH, 1993). Portanto, neste trabalho foi seguido o critério de denominá-los por regiões, como nos trabalhos de Donatelli (1987, 1991, 1992, 1996),Höfling (1988, 1995) e Marceliano (1996).
A nomenclatura das espécies é aquela proposta por Meyer de Schauensee (1982), Sibley e Monroe (1990) e Stotz et al. (1996).
A relação do material com número de indivíduos, sexo, coleção e procedência encontra-se no Apêndice.
RESULTADOS
Crânio
A região dos ossos frontais (F: Figuras 1-3, 4-6 e 7-9) formam a parte rostral do teto da caixa craniana e a margem superior da órbita, fundindo-se caudalmente aos ossos parietais (P: Figuras 1-3, 4-6 e 7-9).
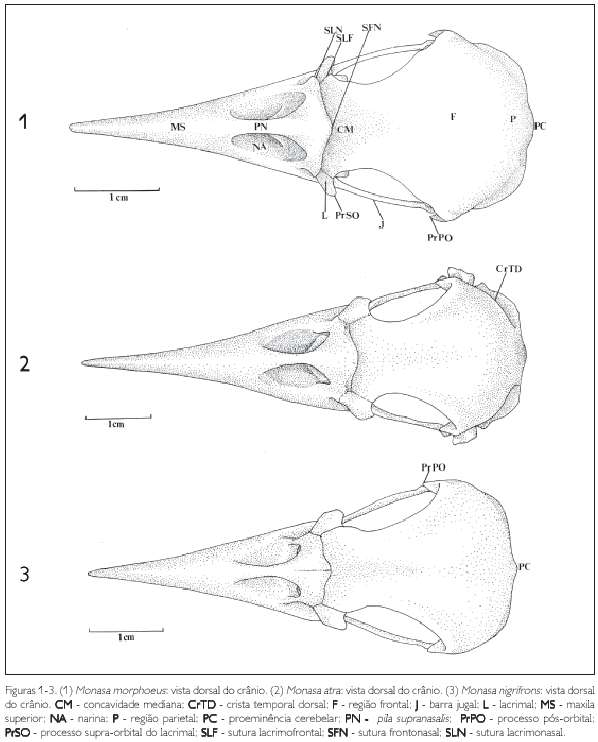
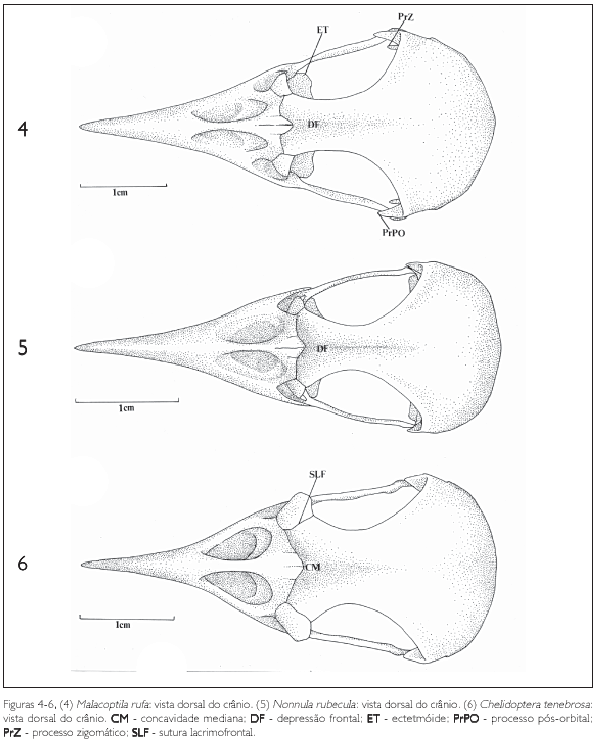
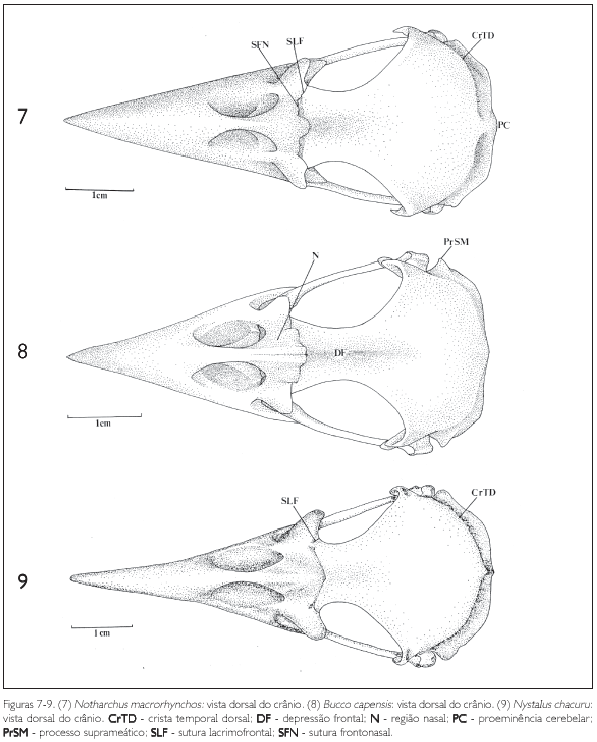
A região frontal (F:Figuras 1-3, 4-6 e 7-9) articulase rostralmente com a região nasal através da sutura frontonasal (SFN:Figuras 1-3, 4-6 e 7-9), bem evidente na maioria das espécies de Bucconidae aqui estudadas. Na região da sutura frontonasal, pode-se observar uma concavidade situada no eixo rostrocaudal do crânio, a concavidade mediana (CM: Figuras 1-3, 4-6 e 7-9). Em quase todas as espécies de Bucconidae estudadas há uma concavidade mediana bem delimitada, exceto em Nystalus chacuru, onde é pouco evidente (Figura 9). Na porção mediana da região frontal encontra-se uma concavidade longitudinal que Baumel et al. (1993) denominaram depressão frontal (DF). Pode-se observar essa estrutura em Nonnula rubecula (Figura 5) e em Bucco capensis (Figura 8). Dorsocaudalmente, a região frontal encontra a região parietal (P: Figuras 1-3, 4-6 e 7-9) e a sua porção rostrolateral é limitada pelos ossos lacrimais (L) através da sutura lacrimofrontal (SLF).
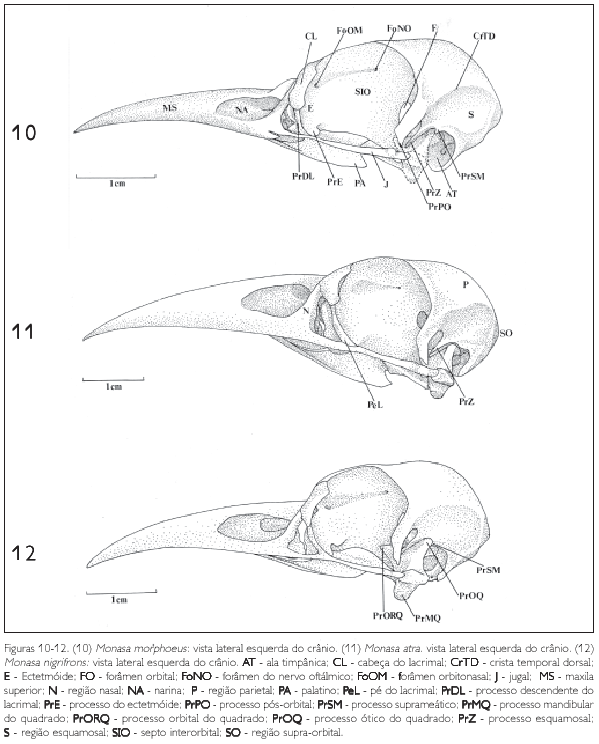
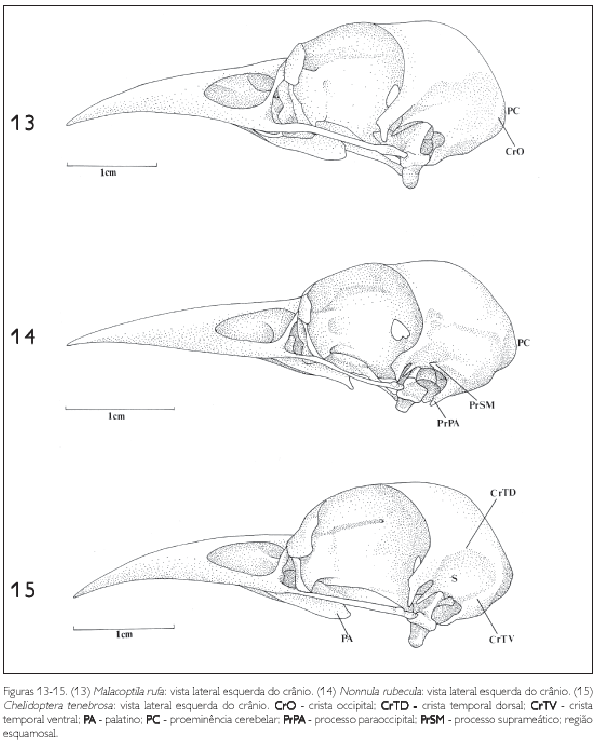
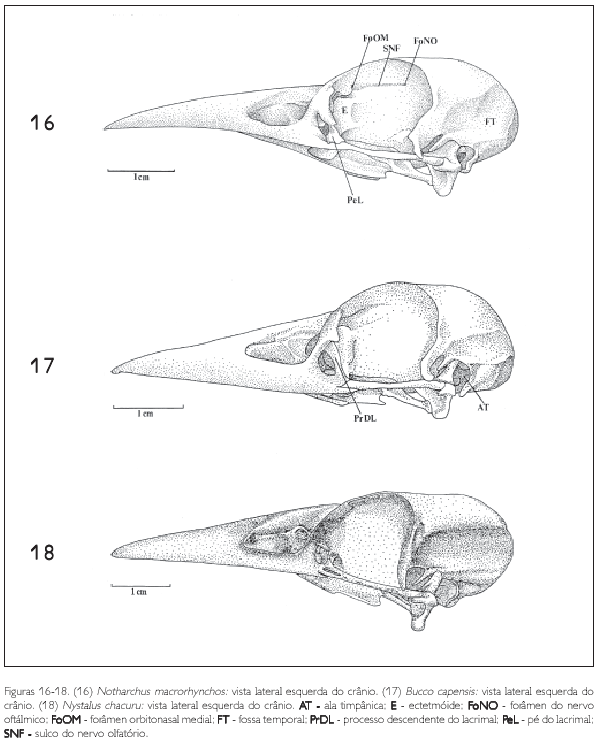
O osso lacrimal (L: Figuras 1-3, 4-6, 7-9, 10-12, 13-15, e 16-18) ocupa a porção rostrolateral da órbita e articula-se rostralmente com o osso nasal por meio da sutura lacrimonasal (SLN: Figuras 1-3 e 4-6). Lateralmente articula-se com a região frontal (F: Figuras 1-3, 4-6 e 7-9) através da sutura lacrimofrontal (SLF: Figuras 1-3 e 4-6). Pode-se observar nos Bucconidae as três partes que constituem o lacrimal: a cabeça do lacrimal (CL: Figuras 10-12, 13-15 e 16-18), porção mais alargada e articulada com a caixa craniana por meio da sutura frontonasal; o processo descendente do lacrimal (PrDL: Figuras 10-12, 13-15 e 16-18) projetado ventralmente a partir da cabeça do lacrimal, aproximando-se da barra jugal (J: Figuras 10-12, 13-15 e 16-18); e uma estrutura com aspecto de 'L', junto à extremidade distal do processo descendente, denominada pé do lacrimal (PeL: Figuras 11, 12, 13-15 e 16-18). Na maioria dos crânios observa-se uma constrição evidente entre a cabeça e o processo descendente.
Além das principais subdivisões acima descritas, outro processo é encontrado no lacrimal: o processo supra-orbital (PrSO: Figuras 1-3, 7-9). Esta estrutura é formada por uma projeção do lacrimal que passa caudalmente sobre a órbita ao nível da borda lateral do osso frontal. Pode ser observado em Monasa morphoeus, M. nigrifrons e M. atra (Figuras 1-3). É bastante evidente em Nystalus chacuru, Notharchus macrorhynchos e Bucco capensis (Figuras 7-9), não tendo sido observado nas demais espécies.
Nos buconídeos foi encontrada uma variação quanto à forma e ao tamanho das três principais subdivisões do lacrimal (cabeça, processo descendente e pé). Em Monasa morphoeus, M. nigrifrons, M. atra, Malacoptila rufa e Nonnula rubecula (Figuras 10-12, 13 e 14), a cabeça do lacrimal é evidente e delimitada, enquanto em Chelidoptera tenebrosa (Figura 15) é reduzida. Em Notharchus macrorhynchos (Figuras 7 e 16), Bucco capensis (Figuras 8 e 17) e Nystalus chacuru (Figuras 9 e 18) a cabeça do lacrimal é bastante desenvolvida, projetada lateralmente, ocorrendo fusão desta estrutura, na sua porção rostral, com o osso nasal (Figuras 7-9). O processo descendente do lacrimal (PrDL: Figuras 10-12, 13-15 e 16-18), em todas as espécies aqui estudadas, distingue-se da cabeça por uma constrição bastante acentuada e projeta-se ventrolateralmente em direção à barra jugal. De maneira geral é longo e fino, semelhante em quase todas as espécies observadas, com exceção de Notharchus macrorhynchos, Bucco capensis e Nystalus chacuru (Figuras 16-18), onde é um pouco mais robusto. Em Notharchus macrorhynchos (Figura 16) projeta-se ventrorrostralmente em direção à porção caudal da maxila superior, não em direção à barra jugal. Quanto ao pé do lacrimal (PeL: Figuras 11, 12, 13-15 e 16-18), ele apresenta um padrão geral entre as espécies de Bucconidae. Não ocorre fusão do pé do lacrimal com a barra jugal em nenhuma das espécies observadas; nota-se em Chelidoptera tenebrosa (Figura 15) e em Notharchus macrorhynchos (Figura 16) que, na área de contato do pé do lacrimal com a barra jugal, existe uma área de sutura, isto é, esta estrutura alcança a barra jugal, mas não há uma fusão total destes ossos. Já em Nystalus chacuru (Figura 18), o pé do lacrimal funde-se à porção caudal da maxila superior e à barra jugal, uma condição bastante diferente de todas as outras espécies.
Nas espécies da família Bucconidae também se observou uma variação quanto ao grau de fusão do lacrimal com os ossos adjacentes a ele. Em Monasa morphoeus, M. atra e M. nigrifrons (Figuras 1-3), o lacrimal não se encontra fundido ao frontal nem ao nasal. Este padrão também é observado em Malacoptila rufa, Chelidoptera tenebrosa e Nonnula rubecula (Figuras 4-6). Em Notharchus macrorhynchos, Bucco capensis e Nystalus chacuru (Figuras 7-9) a cabeça do lacrimal funde-se ao nasal, mas não ao frontal. Na região onde não há fusão destes ossos forma-se uma área de articulação.
O osso ectetmóide (E: Figuras 10-12, 13-15 e 16-18) é representado por uma projeção da parte rostrolateral do septo interorbital (SIO: Figuras 10-12, 13-15 e 16-18) e posiciona-se perpendicular a ele. A região do etmóide (ectetmóide + mesetmóide) separa-se da região do osso frontal pelo sulco do nervo olfatório (SNF: Figuras 10-12, 13-15 e 16-18). Nas espécies de Bucconidae aqui estudadas, o ectetmóide tem a forma bulbosa e não se funde ao lacrimal, formando uma parede rostral da órbita descontínua. O ectetmóide projeta-se ventralmente em direção ao palatino através do processo lateral do ectetmóide (PrE: Figuras 10-12, 13-15 e 16-18), que se apresenta bem pronunciado, com a forma bulbosa, e dirige-se ventrolaterorrostralmente formando uma expansão arredondada na sua porção distal em todas as espécies observadas. Em Chelidoptera tenebrosa (Figura 15) o ectetmóide não apresenta um processo como nas outras espécies, formando uma estrutura contínua mais alargada na sua porção ventral. Em quase todas as espécies o ectetmóide forma uma região de sutura com a porção ventral do osso frontal, facilmente delimitada por um sulco, como pode ser visualizado em Bucco capensis (Figura 17).
Um processo pós-orbital (PrPO: Figuras 10-12, 13-15 e 16-18) bem desenvolvido é característico dos Bucconidae e forma a borda caudoventral da órbita. De maneira geral, é largo na base, longo e afilado na extremidade ventral (Monasa morphoeus, M. atra, M. nigrifrons, Chelidoptera tenebrosa e Nystalus chacuru) (Figuras 10-12, 15 e 18), projetando-se em direção à barra jugal (J: Figuras 1-3, 4-6, 7-9, 10-12, 13-15, 16-18, 19-21, 22-24 e 25-27). Em Bucco capensis (Figura 17) o processo pós-orbital é largo na base, projeta-se ventralmente e adelgaça-se na extremidade, onde forma uma expansão voltada caudalmente e apoiada na barra jugal. Em Malacoptila rufa (Figura 13) esta estrutura, também alargada, projeta-se ventralmente e bifurca-se na extremidade distal; uma parte volta-se à barra jugal, sem encontrá-la, e outra, bem menor, volta-se rostralmente.
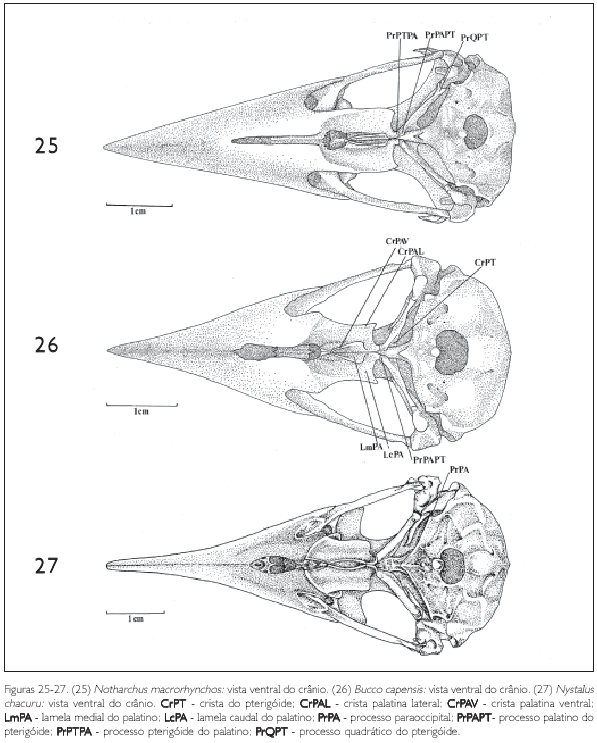
Os ossos parietais, junto com os ossos occipitais, formam o teto da porção caudal da caixa craniana. A região parietal (P: Figuras 1-3, 4-6, 7-9 e 11) estende-se da região frontal (F: Figuras 1-3, 4-6 e 7-9) até a região occipital onde faz divisa com a região supra-occipital (SO: Figuras 11, 28-30, 31-33 e 34-36) no seu limite mediocaudal. A região parietal, ainda na sua porção caudal, encontra a região exoccipital formando a crista occipital (CrO: Figuras 28-30, 31-33 e 34-36). Lateralmente encontra a região exoccipital formando a crista temporal dorsal (CrTD: Figuras 28-30, 31-33 e 34-36) e, mais caudalmente, a crista temporal ventral (CrTV: Figuras 15), que, juntamente com a crista occipital, delimitam a fossa temporal (FT), que, por sua vez, se localiza caudalmente ao processo pós-orbital (PrPO).
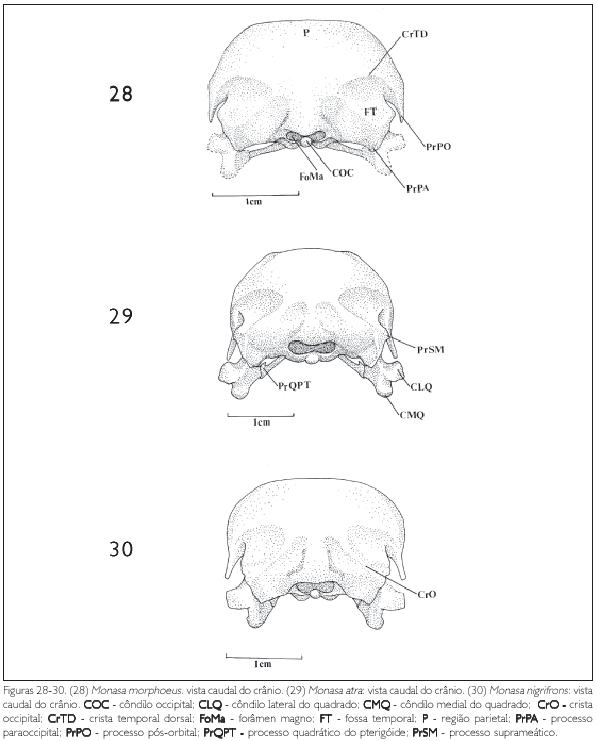
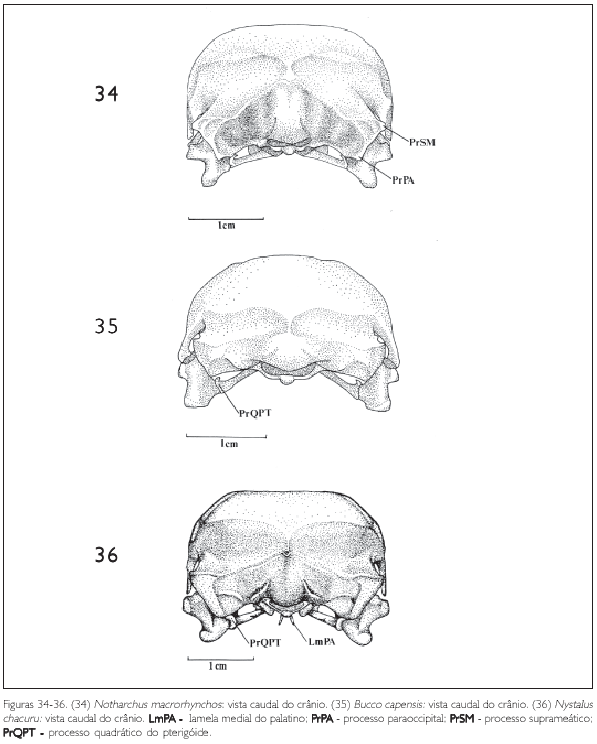
Monasa morphoeus, M. nigrifrons e M. atra (Figuras 10-12) apresentam um tipo de fossa temporal bastante semelhante sendo evidente, bem desenvolvida e mais longa do que larga. Em Bucco capensis (Figura 35) a fossa temporal é bastante profunda, mais longa e mais estreita do que nas espécies acima citadas, encontrando-se caudalmente com a sua simétrica, na região supra-occipital. Esse padrão é semelhante ao encontrado em Notharchus macrorhynchos (Figura 34) e Nystalus chacuru (Figura 36). Em Nonnula rubecula (Figuras 14 e 32) e Malacoptila rufa (Figuras 13 e 31) a fossa temporal é rasa, estreita e curta em relação àquela das outras espécies. Já em Chelidoptera tenebrosa (Figuras 15 e 33) essa estrutura é pouco desenvolvida e seus limites inconspícuos.
A região esquamosal (S: Figuras 10 e 15) localiza-se na face lateral da caixa craniana, completando-a juntamente com os ossos frontal e parietal, e forma a margem caudal da órbita. É delimitada dorsolateralmente pela crista temporal dorsal (CrTD: Figuras 10 e 15), laterocaudalmente pela crista occipital (CrO: Figura 30) e dorsolateralmente pela crista temporal ventral (CrTV: Figura 15). Lateroventralmente observase o processo zigomático (PrZ: Figuras 4, 10 e 11), que, nos Bucconidae, é longo e fino, bastante desenvolvido na maioria das espécies e voltado ventrorrostralmente. Em Malacoptila rufa, Chelidoptera tenebrosa e Bucco capensis esta estrutura é delgada, porém, mais curta (Figuras 13, 15 e 17).
Também na região esquamosal, laterocaudalmente pode-se observar o processo suprameático (PrSM: Figuras 10, 12 e 14), situado caudalmente ao processo zigomático, formando parte da borda dorsal externa do meato acústico. É uma estrutura evidente em todas as espécies observadas, porém mais conspícua em Nonnula rubecula (Figura 14) Notharchus macrorhynchos, Bucco capensis e Nystalus chacuru (Figuras 16-18 e 34-36).
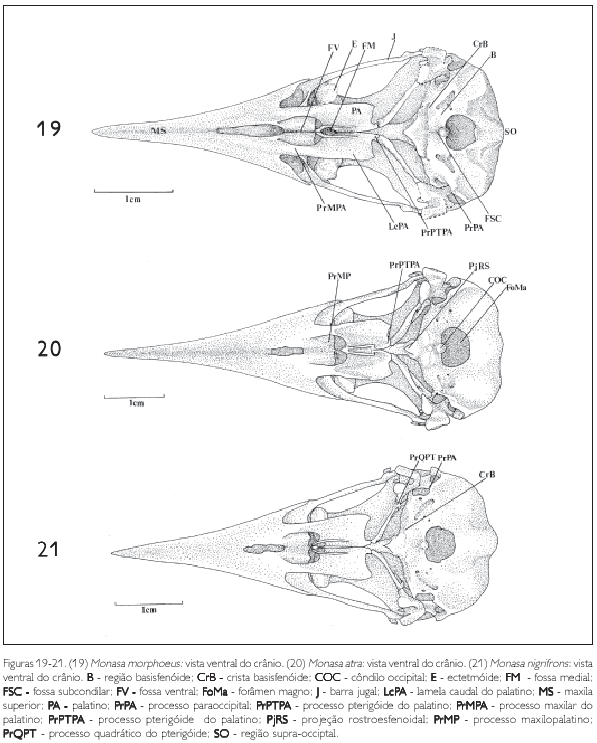
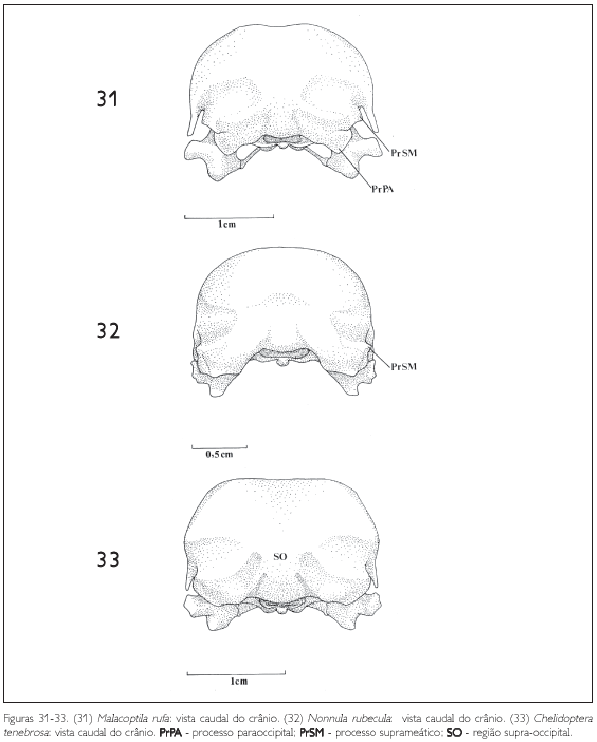
A região occipital situa-se caudalmente na caixa craniana. Ela inclui a região dos ossos exoccipital (EX: Figura 24), supra-occipital (SO: Figuras 11, 19 e 33) e basioccipital (B: Figura 19), sendo delimitada dorsolateralmente pela crista occipital (CrO: Figura 30), ventrolateralmente pela ala timpânica (AT: Figuras 10) por meio da crista timpânica e ventromedialmente pela região basisfenóide. Ventralmente, no limite da região exoccipital e da região basioccipital, destaca-se o processo paraoccipital (PrPA: Figuras 19, 21, 27, 28, 31 e 34). Este processo forma a parede caudal do meato acústico, podendo ser observado em todas as espécies.
A região supra-occipital (SO: Figuras 11, 19 e 33) mostra-se projetada caudalmente em Bucco capensis e Nystalus chacuru (Figuras 8 e 9). Dorsalmente ao forâmen magno (FoMa: Figuras 20 e 28) pode-se observar a proeminência cerebelar (PC: Figuras 1, 3, 7, 13 e 14).
A região basioccipital (B: Figuras 19) ventrorrostralmente limita-se através da crista basioccipital (CrB: Figuras 19 e 21), bastante evidente em todas as espécies aqui estudadas, porém, menos conspícua em Nonnula rubecula (Figura 23). Nesta região encontra-se o côndilo occipital (COC: Figuras 20 e 28). A principal parte do côndilo occipital é formada pelos ossos basioccipitais; lateralmente é formado pelos ossos exoccipitais, todos fusionados no adulto. Lateroventralmente ao côndilo occipital localiza-se a fossa subcondilar (FSC: Figura 19), também evidente em todas as espécies de Bucconidae aqui observadas.
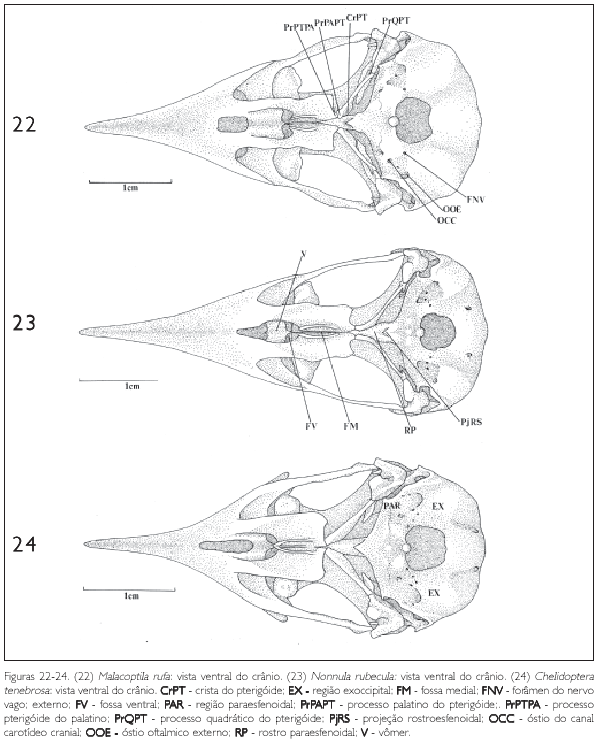
Além do forâmen magno (FoMa: Figuras 20 e 28), por onde passa a medula espinal, na região basioccipital observam-se três pequenas aberturas: o óstio do canal carotídeo cranial (OCC: Figura 22), o óstio oftálmico externo (OOE: Figura 22) e o forâmen do nervo vago (FNV: Figura 22)
No limite entre a região basioccipital e a região basisfenóide encontra-se ventromedialmente o processo basioccipital, conspícuo na maioria das espécies, mas pouco evidente em Nonnula rubecula e Chelidoptera tenebrosa (Figuras 23 e 24).
A região basisfenóide (B: Figura 19) encontra rostralmente a região paraesfenóide (PAR: Figura 24), formando junto com a região basioccipital a maior parte do assoalho da caixa craniana. Medialmente, na região paraesfenóide, pode-se notar um processo bastante prolongado, o rostro paraesfenoidal (RP: Figura 23). Esta estrutura lateralmente articula-se com os ossos pterigóides e com os ossos palatinos (PA: Figura 19), fusionando-se dorsalmente à porção ventral do septo interorbital. Este mesmo padrão é observado nos Bucconidae analisados. Caudalmente à região paraesfenóide encontra-se uma pequena projeção rostroesfenoidal (PjRS: Figuras 20 e 23), que possui na sua base dois pequenos forâmens, representantes dos tubos direito e esquerdo da tuba auditiva comum.
A região lateroesfenóide estende-se desde o septo interorbital (SIO: Figura 10) até o processo pós-orbital (PrPO: Figuras 1, 3, 4, e 10) e a fossa temporal (FT: Figura 16 e 28). Ela funde-se lateralmente com a região esquamosal (S: Figuras 10 e 15).
O septo interorbital limita-se rostrolateralmente com a região do ectetmóide e rostrodorsalmente com a face ventral do osso frontal, por meio do sulco do nervo olfatório (SNF: Figura 16). Este septo não se encontra fusionado ao ectetmóide, mas se funde ao frontal na sua porção ventral, caudalmente alcançando a região lateroesfenóide. Na sua porção ventromedial o septo interorbital articula-se com os ossos palatino e pterigóide. O sulco do nervo olfatório é uma fossa alongada entre a face ventral do frontal e o septo interorbital. Ele é delimitado dorsocaudalmente pelo forâmen do nervo olfatório (FoNO: Figuras 10 e 16); e rostrodorsalmente é delimitado pelo forâmem órbito-nasal medial (FoOM: Figuras 10 e 16), observados em todos os buconídeos.
Os ossos palatinos nos Bucconidae formam a maior porção do palato, ligam-se rostralmente aos maxilares ou premaxilares e estendem-se caudalmente, articulando-se com os ossos pterigóides. O palato dos Bucconidae analisados mostra um padrão característico dos palatos definidos como desmognato, segundo a classificação de Huxley (1867). Em Bucco capensis, Notharchus macrorhynchos e Nystalus chacuru a porção rostral do palatino projeta-se como uma lâmina, encontrando a região formada pela fusão dos premaxilares recobrindo os processos maxilopalatinos (PrMP: Figura 20). Nas outras espécies o palatino emite um prolongamento mais afilado, o processo maxilar do palatino (PrMPA: Figura 19), que alcança mais rostralmente os premaxilares, deixando uma fenda entre eles, onde os maxilopalatinos podem ser evidenciados.
Uma grande parte do palatino é constituída por duas grandes lamelas. A maior delas, a lamela caudolateral (LcPA: Figuras 19 e 26), forma a maior parte do palatino. A porção medial da lamela caudolateral dobra-se verticalmente formando a lamela medial (LmPA: Figura 36), que termina na crista palatina ventral (CrPAV: Figura 26). Na região ventromedial do palatino, entre as cristas palatinas ventrais existe uma profunda fenda, a fossa medial (FM: Figuras 19 e 23). Rostralmente às lamelas caudolaterais aparece outra fenda menos profunda, a fossa ventral (FV: Figuras 19 e 23), bem evidente em todas as espécies de Bucconidae. A extremidade caudal do palatino forma um pequeno processo que se encontra no pterigóide, o processo pterigóide do palatino (PrPTPA: Figuras 19, 20, 22 e 25) e articula-se, na sua porção caudomedial, com o rostro paraesfenoidal (RP: Figuras 23). Este processo do palatino é evidente em todas as espécies analisadas.
O processo maxilopalatino (PrMP: Figura 20), situado rostralmente à fossa ventral, é menos evidente em Bucco capensis, Notharchus macrorhynchos e Nystalus chacuru (Figuras 25-27).
O pterigóide articula-se caudolateralmente com a face medial do quadrado e rostromedialmente com o osso palatino (PA: Figura 19). Na sua extremidade dorsocaudal, onde encontra o osso quadrado, existe um processo dorsal bem desenvolvido, o processo quadrático (PrQPT: Figuras 21, 22 e 25). Na porção rostral do pterigóide observa-se um processo, denominado processo palatino do pterigóide (PrPAPT: Figuras 25 e 26). Nas espécies observadas este processo é ligeiramente achatado. Em Monasa morphoeus, M. atra, M. nigrifrons, Malacoptila rufa e Nonnula rubecula esta estrutura, na sua área de contato com a face dorsal do palatino, forma uma superfície larga, lisa e triangular, ligeiramente côncava. Já em Notharchus macrorhynchos e Nystalus chacuru esta superfície não é triangular, pois se funde ao palatino, não mostrando separação evidente entre um e outro osso. A parte rostral do pterigóide prolonga-se dorsalmente como uma lâmina, que atinge a região dorsal do palatino, dobrando-se verticalmente, encontrando a porção ventral do septo interorbital (SIO: Figura 10).
Ao longo do corpo do pterigóide, nos Bucconidae, ocorre uma crista afilada dorsalmente que se estende do processo palatino do pterigóide até próximo ao processo quadrático do pterigóide (PrQPT: Figuras 22 e 25), alcançando, em alguns casos (Monasa morphoeus, M. nigrifrons M. atra, Nystalus chacuru e Chelidoptera tenebrosa), 2/3 do comprimento total.
Os vômeres (V: Figura 23) nos Bucconidae encontram-se bastante reduzidos e fusionados, visíveis, quando possível, na região da fossa medial.
A barra jugal (J: Figuras 1 e 19) é formada pela fusão do processo jugal do osso maxilar com os ossos jugal e quadrado jugal, estabelecendo uma ligação entre a maxila superior e o osso quadrado. É geralmente delgada e longa, com suas extremidades rostrais ligeiramente achatadas dorsoventralmente, sendo sua porção caudal formada pelo osso quadrado jugal. Nas espécies estudadas é mais delgada em Malacoptila rufa, Nonnula rubecula e Chelidoptera tenebrosa (Figuras 13-15). Em Nonnula rubecula a barra jugal, vista lateralmente, apresenta-se ligeiramente convexa na sua porção rostral e ligeiramente côncava na sua porção caudal. Em Chelidoptera tenebrosa a barra jugal, vista dorsalmente, apresenta uma região triangular na área de contato com o processo jugal do maxilar e caudalmente a esta porção é ligeiramente achatada dorsoventralmente, próximo à área de articulação com o quadrado.
O osso quadrado (Figuras 37 e 38) situa-se ventrocaudalmente em relação à órbita. Possui uma parte central bem desenvolvida, c orpus quadrati, que interliga três extremidades. Caudodorsalmente tem-se o processo ótico (PrOQ: Figura 37), mediorrostralmente observa-se o processo orbital (PrORQ: Figuras 37 e 38) e ventrolateralmente encontra-se o processo mandibular (PrMQ: Figura 38).
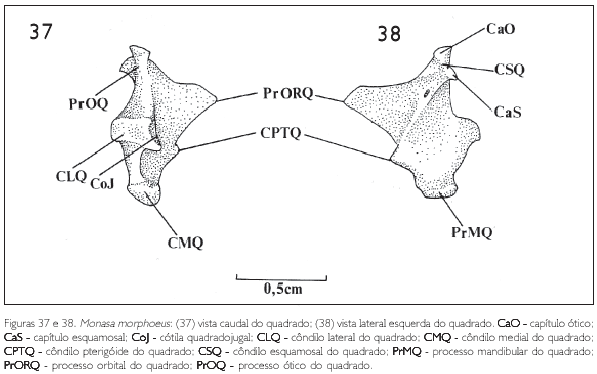
O processo ótico do quadrado (PrOQ: Figura 37) possui dois pontos distintos de articulação com a caixa craniana: o capítulo esquamosal (CaS: Figura 38), voltado dorsalmente; e o capítulo ótico, mais caudal (CaO: Figura 38). Na extremidade do capítulo esquamosal, na região de articulação, encontra-se o côndilo esquamosal do quadrado (CSQ: Figura 38) voltado dorsolateralmente e articulado com a porção ventral do processo zigomático.
O processo mandibular do quadrado (PrMQ: Figura 38) possui dois côndilos: o côndilo lateral (CLQ: Figura 37), voltado lateralmente, e o medial (CMQ: Figura 37), mais evidente e dirigido medioventralmente (Figuras 37 e 38). O côndilo lateral (CLQ: Figura 37) possui uma área de articulação com a barra jugal, denominada cótila quadradojugal (CoJ: Figura 37).
Próximo ao côndilo medial, entre ele e a extremidade do processo orbital, nota-se uma estrutura delgada e afilada, o côndilo pterigóide (CPTQ), área de articulação do osso quadrado com o osso pterigóide (Figuras 37 e 38).
O processo orbital do quadrado é triangular e está voltado rostromedialmente em direção à órbita. Possui uma extremidade afilada e apresenta o mesmo padrão nos Bucconidae. Em Nonnula rubecula esta estrutura é mais curta, alargada e voltada mediodorsalmente.
A maxila superior (MS: Figura 1, 10 e 19) é um conjunto de ossos com a forma triangular. Nas espécies de Bucconidae analisadas seu tamanho é cerca de 50% do comprimento total do crânio e encontra-se, na sua porção caudal, com osso frontal formando uma região de sutura (SFN: Figura 1). Em Nystalus chacuru (Figura 9) esta região é achatada com pouca evidência de uma área de articulação, diferente do que se observa nas outras espécies. Rostralmente a esta região, naquela do osso nasal (N: Figuras 8 e 11), pode-se verificar uma abertura, a narina (NA: Figuras 1 e 10), com cerca de 30% do comprimento do crânio em todas as espécies aqui observadas. Nos Bucconidae não há fusão do osso nasal com o lacrimal em quase todas as espécies, exceto em Bucco capensis, Notharchus macrorhynchos e Nystalus chacuru (Figuras 7-9) como já discutido.
Quanto à narina, de acordo com a classificação de Garrod (1873), os Bucconidae possuem narina do tipo holorrina, onde os ossos envolvidos apresentam-se fusionados (Figuras 1-3, 4-6 e 7-9). Próximo à borda dorsal das narinas medialmente forma-se uma coluna longitudinal, a pila nasal (PN: Figura 1).
Mandíbula
A mandíbula, como em todas as aves, apresenta os ossos que a compõem fusionados no adulto, formando uma unidade óssea. Da mesma maneira, como no crânio, denomina-se região ao local correspondente a cada um destes ossos.
A mandíbula pode ser dividida em três partes distintas: a sinfisiária, mais rostral, onde se localiza a porção sinfisial (PSI: Figura 43); a intermediária (PI: Figura 43), que abriga a fenestra mandibular (FeM: Figuras 39 e 40, 45, 46 e 48), e a caudal (PC: Figura 43), onde a mandíbula articula-se com o quadrado.
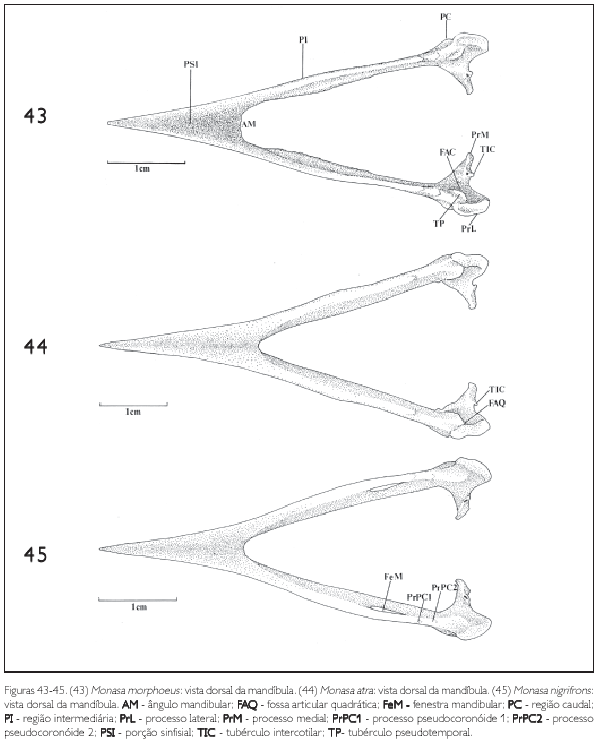
A região sinfisiária corresponde à porção rostral dos dois ossos dentários que se fusionam medialmente, formando o ângulo mandibular (AM: Figura 43). O ângulo mandibular corresponde à região caudal da sínfise mandibular, que nos Bucconidae apresenta-se bastante semelhante, sendo maior e arredondado em Bucco capensis (Figura 50) e menor em Nonnula rubecula (Figura 47). Em relação ao comprimento total da mandíbula, a sínfise mandibular (PSI) da maioria das espécies estudadas compreende de 37 a 40%. É maior em Monasa atra, Nonnula rubecula, Bucco capensis e Nystalus chacuru (Figuras 44, 47, 50 e 51). Em Chelidoptera tenebrosa a sínfise mandibular corresponde a apenas 20% (Figura 48).
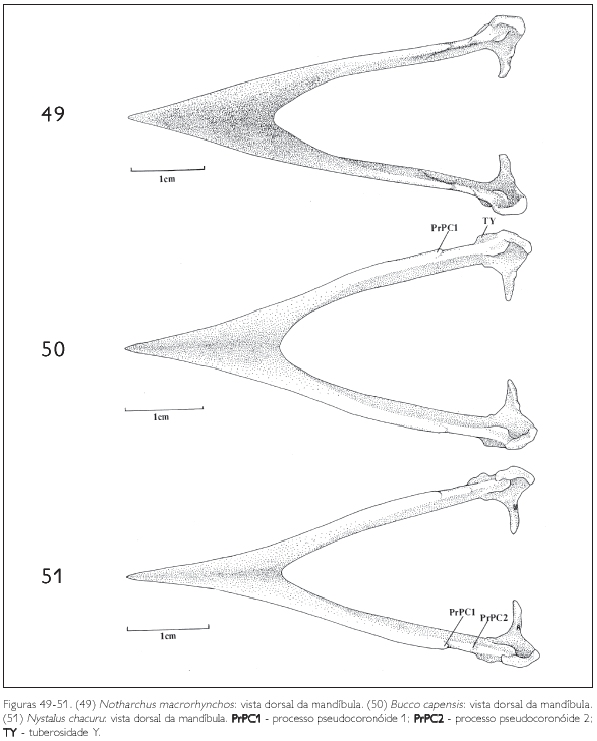
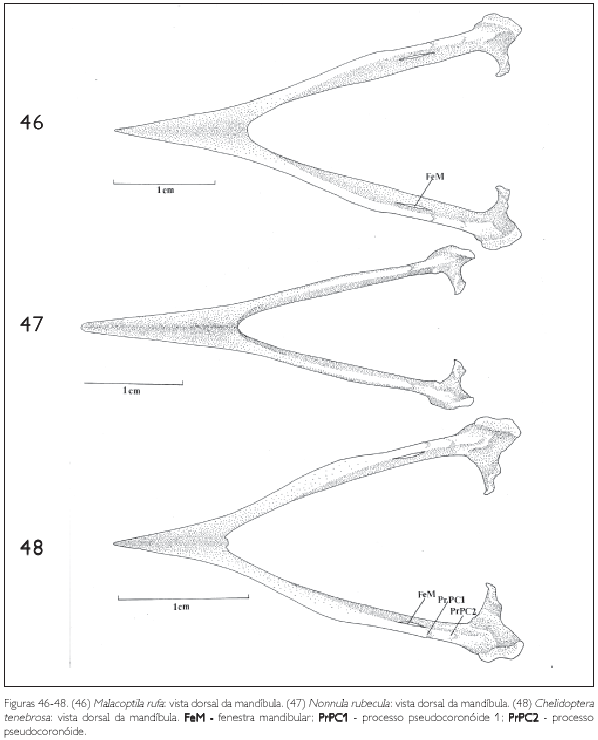
A região intermediária é achatada lateralmente e corresponde a cerca de 50% do comprimento total da mandíbula, apresentando-se um pouco mais longa em Bucco capensis (Figura 50) e um pouco mais curta em Monasa atra (Figura 39). Todas as espécies de Bucconidae analisadas possuem apenas uma fenestra mandibular (FeM: Figura 39). Em Bucco capensis nota-se uma fenestra curta e arredondada, enquanto nas demais espécies é alongada. Em Monasa morphoeus (Figura 39), M. atra, M. nigrifrons e Chelidoptera tenebrosa é inconspícua.
Na região dorsal da mandíbula pode-se observar dois processos: o pseudocoronóide 1 (PrPC1) e, laterocaudalmente a ele, o pseudocoronóide 2 (PrPC2: Figuras 39, 45, 48, 50 e 51).
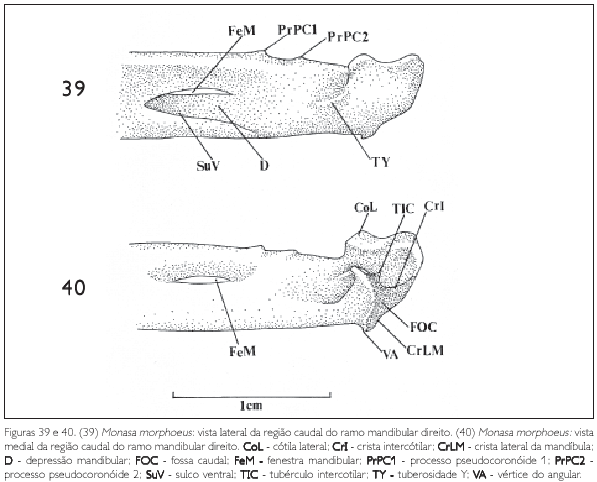
Ao longo da região intermediária, na sua face lateral, nota-se uma depressão (D: Figura 39), que possui um sulco ventral. Laterocaudalmente, onde a região intermediária encontra a região caudal, aparece uma tuberosidade (TY: Figuras 39 e 50) observada em todas as espécies estudadas, porém, mais evidente em Nonnula rubecula (Figura 47), Bucco capensis (Figura 50) e Nystalus chacuru (Figura 51) e inconspícua em Chelidoptera tenebrosa(Figura 48).
Na face medial da mandíbula, caudalmente à região intermediária, onde esta se encontra com a região caudal, pode-se observar uma fossa pronunciada, a fossa articular quadrática (FAQ: Figuras 42, 43-45, 46-48 e 49-51), local de articulação com o processo mandibular do quadrado. Dorsalmente a esta fossa encontra-se o tubérculo pseudotemporal (TP: Figura 43), conspícuo em todos os Bucconidae analisados.
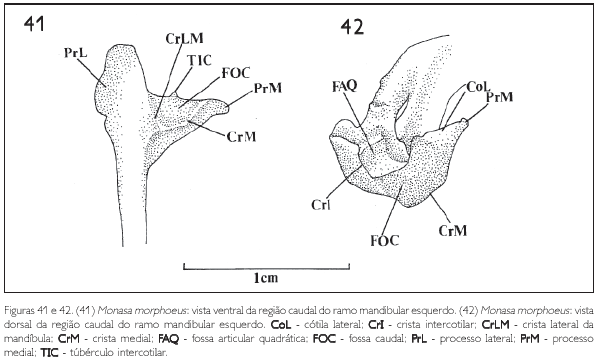
Na região caudal, medialmente, projeta-se o processo medial mandibular (PrM: Figuras 41, 42 e 43), que, observado em vista dorsal ou caudalmente, tem a forma triangular, é delgado, longo, mostra o mesmo padrão em todas as espécies e projeta-se dorsomedialmente. Na sua face caudal observa-se a fossa caudal (FOC: Figuras 40, 41 e 42). Próximo à extremidade do processo medial aparece um tubérculo denominado tubérculo intercotilar (TIC: Figuras 40, 41, 43 e 44), observado em todas as espécies, com mais evidência em Monasa morphoeus, M. atra, M. nigrifrons e Chelidoptera tenebrosa.
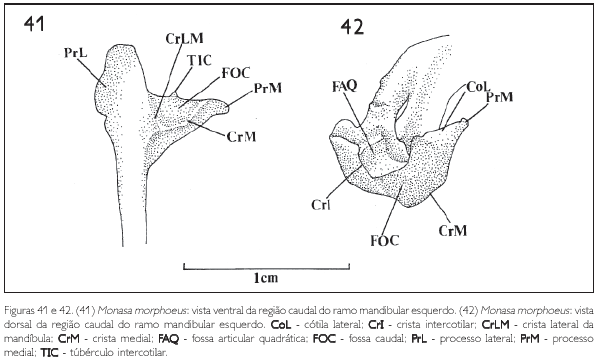
Na região articular da mandíbula dos Bucconidae, na área de articulação com o osso quadrado, observa-se a cótila lateral (CoL: Figuras 40 e 42) situada na face dorsal entre o processo retroarticular e o processo lateral (PrL: Figuras 41 e 43) e a cótila medial, no processo medial. Aparece, ainda, a crista intercotilar entre estas duas cótilas (CrI: Figura 42), Em todas as espécies observadas a cótila lateral é bem mais desenvolvida que a cótila medial (Figura 40).
Na face caudal da mandíbula, ventromedialmente à fossa caudal (FOC: Figuras 40, 41 e 42), forma-se uma crista bastante evidente denominada crista medial (CrM: Figuras 41 e 42), que encontra a crista lateral (CrLM: Figuras 40 e 41) na região do vértice do angular (VA: Figura 40).
DISCUSSÃO
Crânio
O teto da caixa craniana é formado principalmente pelos ossos frontais e parietais. Rostralmente na região frontal, nas espécies de Bucconidae estudadas, próximo à região de articulação com a região nasal, observou-se uma concavidade que Donatelli (1987, 1992) denominou, nos Galbulidae, concavidade mediana, assim como Höfling e Gasc (1984) observaram em Ramphastos tucanus e Marceliano (1996) em Opisthocomus hoazin, Mitu tuberosa, Coccyzus americanus, Tauraco erythrolophus, Piaya cayana, Crotophaga ani e Guira guira.
O osso lacrimal apresenta variações interessantes entre as espécies de Bucconidae. Quanto ao uso deste termo, existem divergências entre diversos autores, pois, em alguns trabalhos anatômicos é utilizada a denominação lacrimal, enquanto em muitos outros este osso é denominado pré-frontal. Shufeldt (1909), Bock (1964), Cracraft (1968), Burton (1984), Hõfling e Gasc, (1984), Donatelli (1987, 1991, 1992, 1996), Zusi (1 993), Marceliano (1996), entre outros, utilizaram a denominação lacrimal justificada pelo fato deste osso alojar o duto lacrimal. Jollie (1957), King e McLelland (1984), Bühler (1985) e Baumel et al. (1993) sugerem o termo pré-frontal. Jollie (1957) justifica o uso de pré-frontal por este osso ser equivalente àquele encontrado em répteis.
Na família Bucconidae foi encontrada uma variação quanto à forma e ao tamanho das três principais subdivisões do lacrimal (cabeça, processo descendente e pé) descritas por Cracraft (1968). Em Monasa morphoeus, M. nigrifrons, M. atra, Malacoptila rufa e Nonnula rubecula a cabeça do lacrimal mostra-se evidente e delimitada, o que não foi observado em Chelidoptera tenebrosa, onde é reduzida. Para os Bucconidae, Cracraft (1968) descreve uma cabeça do lacrimal de moderadamente a bem desenvolvida. Em Notharchus macrorhynchos, Bucco capensise Nystalus chacuru esta estrutura é realmente bem desenvolvida, mas a forma encontrada em Chelidoptera tenebrosa, no extremo oposto, não se apresenta como na descrição de Cracraft (1968). Novamente em Notharchus macrorhynchos, Bucco capensise Nystalus chacuru observa-se a fusão da cabeça do lacrimal com o nasal, também diferente do citado por aquele mesmo autor, que descreve para esta família uma área de articulação tanto com o nasal como com o frontal. Quanto ao pé do lacrimal, onde foi encontrado um padrão geral entre as espécies de Bucconidae, verifica-se uma grande variação quanto ao tamanho. Apesar de Cracraft (1968) ter se referido a esta estrutura como sendo delgada, tal qual apresentada na maioria das espécies, ela difere em Notharchus macrorhynchos, Bucco capensis e Nystalus chacuru, onde é bem evidente e robusta. Não há fusão do pé do lacrimal com a barra jugal em nenhuma das espécies observadas. O que se observa em Chelidoptera tenebrosa é a existência, na área de contato do pé do lacrimal com a barra jugal, de uma área de sutura, isto é, esta estrutura alcança a barra jugal, mas não há uma fusão total entre estes ossos. Em Notharchus macrorhynchos o pé do lacrimal funde-se à maxila superior na sua porção caudal e não com a barra jugal. Já em Nystalus chacuru o pé do lacrimal forma uma região de sutura com a barra jugal e funde-se à porção caudal da maxila superior.
Segundo Bühler (1985), em Falconiformes, Galliformes, Strigiformes, Piciformes e Passeriformes, não há fusão do lacrimal com a parte frontal da caixa craniana. Nas espécies estudadas da família Bucconidae foi observada uma variação quanto ao grau de fusão do lacrimal com os ossos adjacentes a ele. Enquanto em Monasa morphoeus, M. atra, M. nigrifrons Malacoptila rufa, Chelidoptera tenebrosa e Nonnula rubecula o lacrimal não se encontra fusionado com o osso frontal ou com o nasal, em Nystalus chacuru, Notharchus macrorhynchos e Bucco capensis a cabeça do lacrimal funde-se ao nasal, mas não ao frontal. Na região onde não há fusão dos ossos forma-se uma área de articulação. Donatelli (1987, 1992) verificou nos Galbulidae que o lacrimal não se funde ao frontal ou ao nasal, enquanto em Picidae (DONATELLI, 1991, 1996) ocorre a fusão do lacrimal ao frontal ou nasal. Höfling e Gasc (1984) e Höfling (1995) observaram que a região lacrimal em Ramphastidae é arredondada e funde-se à região ectetmóide, delimitando a órbita rostralmente.
Cracraft (1968) verificou que o lacrimal geralmente articula-se com o osso nasal e o osso frontal em vários grupos, mas que pode articular-se somente com o nasal, como em Opisthocomidae, Threskiornithidae e Meleagridae, ou somente com o frontal, como em Psittacidae, Sullidae e Pelecanidae. Tipicamente o lacrimal articula-se com a borda lateral da sutura frontonasal, mas em algumas aves articula-se com a face ventral do osso frontal (Podicipedidae e Phalacrocoracidae).
Höfling (1995), em um estudo de várias famílias da ordem Piciformes, verificou que em Galbulidae e Bucconidae uma fina barra óssea, com origem dorsomedial na região lacrimal, dirige-se ventrolateralmente, fundindo-se à barra jugal. Aqui esta estrutura, com base no trabalho de Cracraft (1968), foi denominada processo descendente do lacrimal e não foi observada a fusão desta estrutura com a barra jugal em nenhuma das espécies de Bucconidae estudadas, ocorrendo nesta região, dependendo da espécie, uma sutura.
Quanto ao osso ectetmóide, nas espécies de Bucconidae observadas, verificou-se que este osso tem uma forma bulbosa e não se funde ao lacrimal nem à porção ventral do osso frontal, diferindo do que foi reportado por Cracraft (1968). O que se observa é uma região de sutura entre a porção dorsal do ectetmóide e o osso frontal, delimitada por um sulco. Foi também observado um processo do ectetmóide, o que seria uma projeção ventral deste osso em direção ao palatino, onde se expande, distintamente do observado pelo mesmo autor para a família Bucconidae. Donatelli observou esta estrutura nos Galbulidae (1987, 1992), assim como em Picidae (1991, 1996), da mesma forma que Hõfling (1995) verificou nos Ramphastidae e Capitonidae, enquanto Marceliano (1996) descreveu-a em Opisthocomus hoazin, Coccyzus americanus, Piaya cayana, Crotophaga ani e Guira guira.
Ambos os ossos, lacrimal e ectetmóide, estão presentes na maioria das famílias de aves, mas também podem estar ausentes, um ou outro, em algumas famílias. Cracraft (1968) não verificou nenhuma família na qual os dois ossos estivessem ausentes, embora em algumas um deles poderia estar ausente e o outro pobremente desenvolvido. Devido à constante fusão do lacrimal com o frontal e nasal e, algumas vezes, com o ectetmóide, geralmente é difícil determinar, sem estudos embriológicos, se o lacrimal no adulto foi perdido ou está fusionado. Segundo Cracraft (1968), as implicações evolutivas seriam óbvias, pois o lacrimal fusionado poderia se tornar livre outra vez, sob influência de forças seletivas, sendo improvável que o lacrimal surgisse outra vez na mesma linhagem filogenética, onde tivesse sido perdido.
O processo pós-orbital apresenta-se semelhante nas várias espécies de Bucconidae aqui estudadas, Segundo Jollie (1957) e Zusi (1993), é formado pelos ossos frontal, esquamosal e possivelmente pelo lateroesfenóide, Este processo é local de origem do ligamento pós-orbital das aves (HÖFLING, 1995).
Nas espécies da família Bucconidae, de maneira geral, o processo pós-orbital é largo na base, longo e afilado na extremidade ventral, Donatelli (1987, 1992) descreveu para os Galbulidae uma estrutura longa, fina e bem desenvolvida em quase todas espécies observadas, Este mesmo grau de desenvolvimento pode ser verificado em Leptosomatidae e Coraciidae, segundo Burton (1984), Donatelli (1991, 1996) observou nos Picidae um processo pós-orbital curto na maioria das espécies observadas, Höfling (1995) verificou nos Ramphastidae um processo bem desenvolvido e dirigido ventralmente e em Indicatoridae, também bem desenvolvido, mas não como nos Bucconidae, Em Capitonidae, ao contrário do que foi mencionado por Burton (1984), Höfling (1995) observou a presença desta estrutura em todas as espécies estudadas, com alguma modificação no seu desenvolvimento e quanto à direção para onde sua extremidade volta-se; e em Indicatoridae ocorre um processo bem evidente, mas também menos desenvolvido que em Bucconidae, Em Cerylinae (MÉNDEZ, 1998), o processo pós-orbital é pouco desenvolvido, Silveira (1999) verificou em Eudromia elegans (Tinamidae) que o frontal participa da formação do processo pós-orbital.
A fossa temporal dos Bucconidae apresenta quatro padrões entre as espécies estudadas, Monasa morphoeus, M. nigrifrons e M. atra possuem um tipo de fossa temporal evidente, bem desenvolvida e mais longa do que larga, Em Bucco capensis, Notharchus macrorhynchos e Nystalus chacuru esta estrutura apresenta-se bastante profunda, mais longa e mais estreita, encontrando-se mediocaudalmente com a sua simétrica, na região supra-occipital. Já em Nonnula rubecula e Malacoptila rufa a fossa temporal é rasa, estreita e curta em relação à das outras espécies, enquanto em Chelidoptera tenebrosa essa estrutura é pouco evidente e seus limites inconspícuos. Essa característica é importante por fornecer parâmetros sobre o desenvolvimento do músculo adductor mandibulae externus superficialis, pois quanto mais profunda essa fossa, mais desenvolvido apresenta-se este músculo (DONATELLI, 1987, 1992). Zusi e Storer (1969) observaram uma fossa rasa no gênero Podilymbus (Podicepediformes). Gennip (1986) encontrou também, em Columba livia, uma fossa temporal rasa e pouco evidente. Donatelli (1991, 1996) descreveu uma fossa temporal mais longa verticalmente do que horizontalmente para maioria dos Picidae estudados, exceto para Thripias namaquus, onde a fossa é mais longa horizontalmente. Höfling e Gasc (1984) mostraram que em Ramphastos tucanus existe uma estrutura semelhante à encontrada nas espécies de Bucconidae estudadas. Höfling (1995) mostrou esta estrutura em Lybius dentatus (Capitonidae) semelhante àquela encontrada em Notharchus macrorhyncos e Nystalus chacuru. Em Cerylinae (MÉNDEZ, 1998) a fossa temporal apresenta-se dividida em duas porções distintas: a fossa temporal rostral e a fossa temporal caudal. Baumel et al. (1993) citam uma fossa temporal fortemente escavada no crânio de larídeos e ardeídeos. Em Opisthocomus hoazin, Marceliano (1996) observou que esta estrutura apresenta-se mais larga do que longa.
A região esquamosal é delimitada dorsolateralmente pela crista temporal dorsal, laterocaudalmente pela crista occipital e dorsolateralmente pela crista temporal ventral. Baumel et al. (1993) utilizam o termo crista nuchalis transversa e Hofer (1945) crista temporal, para o que aqui foi denominado de crista occipital, adotando a terminologia dos trabalhos de Höfling e Gasc (1984), Donatelli (1987, 1991, 1992, 1996) e Marceliano (1996). Ventralmente à fossa temporal encontra-se o processo zigomático. Donatelli (1987, 1992) verificou que na maioria dos Galbulidae este processo é pouco desenvolvido, enquanto nos Bucconidae aqui estudados observou-se um processo longo e fino, bastante desenvolvido na maioria das espécies. Em Malacoptila rufa, Bucco capensis e Chelidoptera tenebrosa esta estrutura apresenta-se delgada, porém, mais curta. Já em Picidae, Donatelli (1991, 1996) verificou que esta estrutura estende-se cerca de 1/3 da distância entre o crânio e a barra jugal, exceto em Celeus flavescens, onde se estende cerca de 1/2 desta distância. Em Cerylinae (MÉNDEZ, 1998) o processo zigomático apresenta uma face caudal plana. Esta região é o local de origem das aponevroses do músculo adductor mandibulae externus ventralise do músculo adductor mandibulae externus rostralis lateralis. Baumel et al. (1993) reportam ser esta estrutura bem desenvolvida em ratitas, Gaviiformes, Galliformes, Piciformes e Passeriformes. Segundo estes autores, a extremidade deste processo pode estar fusionada ao processo pós-orbital em algumas aves, como nos Galliformes. Esta fusão foi observada por Marceliano (1996) em Mitu tuberosa e Crax alector (Cracidae).
Na região occipital, no limite entre a região exoccipital com a região basioccipital, aparece o processo paraoccipital, facilmente observado em todos os Bucconidae estudados, sendo menos evidente em Nonnula rubecula. Este processo foi também denominado exoccipital por Richards e Bock (1973) e opistótico por Zusi (1962). Forma a parede caudal do meato acústico, sendo o local de origem do ligamento occipitomandibular e parte do músculo depressor mandibulae. O processo paraoccipital é um osso composto, formado pela fusão de três elementos: o osso opistótico medialmente, o osso metótico lateralmente e o exoccipital, que forma uma lâmina de extensão variável; é especialmente desenvolvido em Gavia, Pelecanus, Anser e Caprimulgus (BAUMEL et al., 1993).
Na região supra-occipital, dorsalmente ao forâmen magno, está presente a proeminência cerebelar, que foi observada em todos os Bucconidae. Esta região convexa do osso supra-occipital, juntamente com o osso parietal, na porção caudal da caixa craniana, recobre o dorso do cerebelo, refletindo o seu contorno externamente. Donatelli (1987, 1992) considerou esta estrutura característica de todas as espécies de Galbulidae.
Na região basioccipital encontra-se o côndilo occipital, único nas Aves, como também nos répteis. A principal parte desta estrutura é formada pelo osso basioccipital e lateralmente pelos ossos exoccipitais (BAUMEL et al., 1993). Lateroventralmente a ele localiza-se a fossa subcondilar, evidente em todas as espécies de Bucconidae estudadas. Esta fossa encontra-se presente nos Galbulidae (DONATELLI, 1987, 1992) e em Picidae, com exceção de Campephillus rubricollis (DONATELLI, 1991, 1996). Esta mesma estrutura foi observada em Opisthocomus hoazin, Ortalis momot, Tauraco erythrolophus, Piaya cayana e Coccyzus americanus por Marceliano (1996).
No limite entre a região basioccipital e a região basisfenóide encontra-se medialmente, nos Bucconidae, a crista basioccipital, que Donatelli (1991, 1996) denominou processo basioccipital, talvez pela sua menor extensão, e verificou que algumas espécies de Picidae não possuem esse processo (Picumnus cirratus). Esta estrutura, considerada a mesma, é evidente na maioria das espécies analisadas, sendo bastante pronunciada em Nystalus chacuru, mas pouco evidente em Nonnula rubecula. Foi também observada nos Galbulidae (DONATELLI, 1987, 1992).
Quanto ao rostro paraesfenoidal, termo aqui utilizado, são usados dois termos para denominá-lo: rostro paraesfenoidal (BAUMEL et al., 1993; HÒFLING, 1995; MARCELIANO, 1996; MÉNDEZ, 1998; SILVEIRA, 1999) ou rostro esfenoidal (DONATELLI, 1987, 1991, 1992, 1996). Nas espécies de Bucconidae observadas esta estrutura aparece bem desenvolvida e com sua extremidade rostral alongada, diferente do encontrado em Melanerpes cruentatus (Picidae) por Donatelli (1991, 1996), onde o rostro paraesfenoidal possui uma base alargada, mas sua extremidade é curta.
A região do palato é formada pelos ossos palatinos e pterigóides e, às vezes, pelos vômeres, formando uma articulação com o rostro paraesfenoidal (ZUSI, 1993).
O osso pterigóide é alongado e articula-se com o quadrado caudalmente e com o palatino rostralmente (KING; MCLELLAND, 1984). Os dois ossos pterigóides desempenham um importante papel na movimentação da maxila superior, pois transmitem o movimento dos ossos quadrados aos ossos palatinos e vice-versa (GENNIP, 1986). Em todas as espécies observadas o osso pterigóide apresentou o processo palatino do pterigóide, que se mostra achatado e com sua porção rostral triangular na área de encontro com o palatino. Dorsalmente prolonga-se como uma lâmina que se articula com a região dorsal do palatino. Uma estrutura semelhante foi observada em Opisthocomus hoazin por Marceliano (1996).
O palato nos Bucconidae analisados mostra um padrão característico dos palatos definidos como desmognatos, segundo a classificação de Huxley (1867). Em Bucco capensis, Notharchus macrorhynchos e Nystalus chacurua porção rostral do palatino projeta-se como uma lâmina, encontrando a região formada pela fusão dos premaxilares, recobrindo os maxilopalatinos. Uma condição semelhante a esta foi observada nos Galbulidae (DONATELLI, 1987, 1992) e Ramphastidae (HOFLING, 1995). Nas outras espécies o palatino emite um prolongamento mais afilado, o processo maxilar do palatino que alcança mais rostralmente os maxilares deixando uma fenda entre eles, onde se pode observar os maxilopalatinos, semelhante ao encontrado por Donatelli (1991, 1996) em Picidae. Na família Capitonidae, o palato pode ser considerado desmognato por alguns autores ou egitognato com tendência a desmognato por outros, enquanto os Indicatoridae são considerados egitognatos (HÖFLING, 1995).
Os ossos palatinos formam a maior porção do palato das aves. Ligam-se rostralmente aos maxilares, ou premaxilares, e estendem-se caudalmente, articulando-se com os ossos pterigóides (ZUSI, 1993). Na crista palatina ventral prendem-se feixes do músculo pterigoideus ventralis.
A fossa medial do palatino é bem evidente em todas as espécies de Bucconidae estudadas. Em Galbulidae (DONATELLI, 1987, 1992) a fossa medial é pouco evidente, enquanto em Picidae (DONATELLI, 1991, 1996), Ramphastidae (HÖFLING; GASC, 1984; HÖFLING, 1995) e Capitonidae (HÖFLING, 1995) pode ser facilmente observada.
Existem muitos trabalhos que discutem a região do palato e vários autores usaram as diferentes condições para afastar ou aproximar os grupos de aves (HUXLEY, 1867; PARKER, 1875; TORDOFF, 1954). Atualmente são considerados quatro tipos de estruturas palatais em aves. Os Struthioniformes, Rheiformes, Casuariformes e Apteriformes apresentam a condição paleognata, considerada mais primitiva. Os Passeriformes e os Apodiformes são considerados egitognatos, uma forma modificada da condição neognata. Os Anseriformes, Pelecaniformes e Psittaciformes são desmognatos, sendo esta condição caracterizada por uma fusão mediana dos processos maxilopalatinos. As demais ordens de aves são neognatas (ou esquizognatas) (WEBB et al., 1979; ZISW1LLER, 1980). Burton (1984), nos Piciformes, verificou que os Galbuloidea (Galbulidae e Bucconidae) e os Ramphastidae apresentam a condição desmognata. Em Capitonidae (BURTON, 1984) encontrou vários estágios intermediários entre esta condição e a esquizognata ou egitognata, o que foi discutido por vários autores (HÖFLING, 1995). O palato dos Bucconidae, como já citado, seguindo a classificação de Huxley (1875), é considerado desmognato e, conforme Burton (1984), 'fortemente' desmognatos. Este tipo de palato caracteriza-se pelos ossos pterigóides e palatinos encontrarem-se separados pelo rostro paraesfenoidal e os vômeres apresentarem-se fusionados e afastados dos ossos pterigóides.
O osso quadrado tem um importante papel no aparelho mandibular das aves, pois conecta alguns de seus mais importantes elementos, isto é, a caixa craniana, a mandíbula, a barra jugal e o pterigóide, além de servir como local de origem e inserção de vários músculos (GENNIP, 1986). O processo mandibular do quadrado possui três côndilos: o côndilo lateral voltado laterorrostralmente e articulado com a barra jugal, o côndilo caudal voltado caudalmente e o côndilo medial mais evidente e dirigido medioventralmente. Bock (1960), em um estudo sobre a articulação secundária na mandíbula de Aves, verificou que em Bucconidae o côndilo medial é mais desenvolvido, mais arredondado e apresenta uma maior área de articulação com a mandíbula, coincidindo com o que também foi verificado nos Bucconidae aqui estudados.
O côndilo lateral do quadrado possui uma área de depressão que se apoia na barra jugal, chamada por Gennip (1986) de cótila quadradojugal. Em Ramphastos tucanus (HÖFLING; GASC, 1984) foi observado que esta estrutura está fortemente suturada à barra jugal.
Uma outra estrutura do osso quadrado, distinta por alguns autores, como já citado por Bock (1960), que Donatelli (1987, 1992) denomina côndilo caudal e Höfling e Gasc (1984) côndilo posterior faz parte do processo mandibular do quadrado e está voltado caudalmente. Aqui, nas espécies de Bucconidae, não se observa uma distinção evidente entre o côndilo lateral e o côndilo caudal, considerados, portanto, um único corpo. Na verdade, o côndilo caudal parece ser uma extensão do côndilo lateral.
A maxila superior, na maioria das aves, é um conjunto de ossos rígido e com forma triangular que pode ser elevado e abaixado, na articulação craniofacial. É formada pela fusão dos ossos premaxilar, maxilar e nasal (KING; MCLELLAND, 1984; BÜHLER, 1985; ZUSI, 1993).
O comprimento da maxila superior nos Bucconidae estudados é cerca de 50% do comprimento total do conjunto maxila superior/crânio. Nas outras famílias de Piciformes o que se encontrou foi: em Galbulidae o seu tamanho é cerca de 66%, com exceção de Jacamerops aurea (DONATELLI, 1987, 1992); na maioria das espécies de Picidae estudadas é cerca de 50%, com exceção de Campephilus rubricolis, Geocolaptes olivaceus, Mesopicus griseocephalus e Thripias namaquus, onde a maxila superior atinge cerca de 60% (DONATELLI, 1991,1996), enquanto nos Ramphastidae esta medida varia de 83% em Ramphastos toco e R. tucanus e, no extremo oposto, 62% em Selenidera maculirostris (HÖFLING, 1995). Marceliano (1996) encontrou em Opisthocomus hoazin uma maxila superior, com 34% do comprimento total.
As narinas ósseas podem ser pequenas ou até muito grandes em relação ao rostro maxilar ou maxila superior (ZUSI, 1993). Garrod (1873) descreveu dois tipos de abertura nasais: holorrina e esquizorrina. A narina holorrina é aquela que possui todos os ossos envolvidos totalmente fusionados, possuindo a borda caudal arredondada e situada próxima à articulação craniofacial e ao limite caudal do processo nasal do premaxilar. Na narina esquizorrina as bordas formam um espaço angular que termina, em geral, caudalmente à extremidade do processo nasal do premaxilar; o processo maxilar do nasal é livre e quase destacado do processo maxilar. A abertura nasal, neste caso, tem forma de uma fenda. Os Bucconidae possuem narina do tipo holorrina. Em Ramphastidae foi observada também, por Höfling (1995), uma narina holorrina. Hofer (1954), Bock (1964) e Zusi (1984) relacionaram a narina holorrina ao procinetismo das aves.
Mandíbula
A mandíbula é formada por seis pares de ossos fusionados: o dentário, o esplenial, o angular, o suprangular, o pré-articular e o articular (JOLLIE, 1957; KING; MCLELLAND, 1984; BÜHLER, 1985; GENNIP, 1986; ZUSI, 1993). Proctor e Lynch (1993) consideram cinco os ossos que compõem a mandíbula, excluindo o osso articular, e Baumel et al. (1993) consideram sete, incluindo o osso coronóide.
Cada ramo da mandíbula é formado pelo osso suprangular dorsalmente, pelo angular ventralmente, o esplenial e o prearticular na superfície medial. O articular situa-se na porção caudal e articula-se com o quadrado. Com poucas exceções, nas aves, a porção rostral dos dois dentários funde-se medialmente, na região sinfisial (KING; MCLELLAND, 1984; BÜHLER, 1985; PETTINGILL, 1985; ZUSI, 1993).
Na região intermediária da mandíbula dos Bucconidae foi observada apenas uma fenestra mandibular rostral, da mesma forma que Gennip (1986) observou em Columba livia. Donatelli (1987, 1992) não observou uma fenestra nos Galbulidae, assim como nos Picidae (1991, 1996). Em algumas aves pode-se verificar duas aberturas no ramo mandibular: a fenestra mandibular rostral e, mais caudalmente, a fenestra mandibular caudal. Duas fenestras ocorrem em alguns Charadriiformes, Gruiformes, Psittaciformes e Strigiformes. Em algumas aves a fenestra pode, também, estar ausente (BAUMEL et al., 1993). Muitas aves apresentam flexibilidade lateromedial nos ramos mandibulares, o que geralmente está associada à presença de uma fenestra mandibular nesta região e ao estreptognatismo, que é o movimento lateral dos ramos mandibulares durante a abertura da cavidade bucal (ZUSI, 1993).
Na região dorsal da mandíbula foi observado o processo pseudocoronóide 1 que, local de inserção do tendão comum aos músculos adductor mandibulae externus rostralis temporalis e adductor mandibulae externus rostralis medialis. Laterocaudalmente a esse processo foi observado 0 processo pseudocoronóide 2. Esta mesma nomenclatura foi utilizada por Donatelli (1987, 1991, 1992, 1996). Höfling e Gasc (1984) e Höfling (1988), em estudos sobre os Ramphastidae, e Höfling (1995), em um trabalho sobre a anatomia de alguns Piciformes, utilizaram os termos processo coronóide e processo A da mandíbula. Marceliano, (1996) em Opisthocomus hoazin, denominou processo coronóide e processo p1 ao que neste trabalho foi denominado processo pseudocoronóide 1 e processo pseudocoronóide 2, respectivamente.
Em relação ao comprimento total da mandíbula, a sínfise mandibular da maioria das espécies de Bucconidae estudadas compreende de 37% a 40%. É maior em Monasa atra, Nonnula rubecula, Bucco capensis e Nystalus chacuru, enquanto Chelidoptera tenebrosa, em outro extremo, mostrou uma sínfise mandibular correspondente a apenas 20%. Em Galbulidae, Donatelli (1987, 1992) verificou que, em quase todas as espécies estudadas, a sínfise mandibular corresponde a 66% do comprimento total da mandíbula, com exceção de Jacamerops aurea, onde esta região equivale a 50%. Na família Picidae a maioria das espécies possui uma sínfise mandibular correspondente a 33% do comprimento total da mandíbula, embora Dendropicus fuscescens, Mesopicus griseocephalus e Picumnus cirratus apresentem valores de 40% e Campephilus rubricolis, Melanerpes cruentatuse Thripias namaquus 50% (DONATELLI, 1991, 1996). Nas espécies de Ramphastidae estudadas por Höfling (1995) estes valores variaram de 70% (Ramphastos toco e R. tucanus) a 41% (Selenidera maculirostris). Marceliano (1996) encontrou valores diversos entre as famílias estudadas: nos Cucculidae a sínfise corresponde a cerca de 25%, em Cracidae de 12 a 20% e em Opisthocomus hoazin 16% do comprimento total da mandíbula.
Na região de contato entre a crista lateral e a crista medial da mandíbula inserem-se as aponevroses do músculo depressor mandibulae. Na face medial encontra-se o processo medial da mandíbula, que Höfling e Gasc (1984) denominaram processo medial do angular. O processo medial da mandíbula é formado principalmente pelo osso articular segundo Baumel et al. (1993) e foi denominado por Burton (1984) processo interno da mandíbula. Quando este processo é pouco desenvolvido sugere movimentos limitados da mandíbula (RICHARDS; BOCK, 1973). Em todos os Bucconidae observados este processo apresentou-se bem desenvolvido.
CONCLUSÕES
A partir da descrição e da análise dos caracteres osteológicos do crânio das nove espécies de sete gêneros da família Bucconidae pode-se visualizar algumas estruturas comuns ao grupo, enquanto outras apresentaram variações notáveis.
Em todas as espécies, o processo pós-orbital é bastante desenvolvido, com uma base larga e quase alcançando a barra jugal. Da mesma forma encontra-se um processo zigomático longo e bem evidente. A maxila superior e os ossos envolvidos na sua formação também apresentam um padrão semelhante, como o seu tamanho em relação ao da caixa craniana e a forma da narina. O osso lacrimal mostra variações quanto à estrutura de suas partes e quanto ao grau de fusão com os ossos nasal e frontal. Enquanto as espécies dos gêneros Monasa, Malacoptila, Nonnula e Chelidoptera não possuem este osso fusionado aos ossos adjacentes, as espécies do gênero Bucco, Notharchus e Nystalus possuem o osso lacrimal fusionado ao nasal e com uma projeção lateral bastante evidente.
A fossa temporal mostra grandes variações, sendo profunda e alongada na sua porção caudal em Bucco, Notharchuse Nystalus, um pouco menos desenvolvida nas espécies do gênero Monasa e pouco evidente e rasa em Nonnula, Malacoptila e Chelidoptera.
O palato das espécies de Bucconidae, segundo a classificação seguida pela maioria dos autores, é considerado desmognato, porém, algumas estruturas que o compõem mostram dois padrões distintos entre os gêneros, onde Bucco, Notharchus e Nystalus distinguem-se dos outros gêneros estudados.
Pode-se, então, a partir da análise do conjunto de estruturas ósseas do crânio destas aves, distinguir dois grupos quanto ao padrão morfológico de seus ossos: de um lado as espécies pertencentes aos gêneros Monasa, Malacoptila, Nonnula e Chelidoptera e de outro aquelas pertencentes aos gêneros Bucco, Notharchus e Nystalus.
Estes resultados poderão fornecer elementos para uma futura análise filogenética da ordem Piciformes, juntamente com os trabalhos realizados por outros autores com as famílias Galbulidae, Picidae, Ramphastidae, Capitonidae e Indicatoridae.
AGRADECIMENTOS
À Dra. Maria Luiza Videira Marceliano (Museu Paraense Emílio Goeldi) e ao Dr. Herculano M. F. Alvarenga (Museu de História Natural de Taubaté, SP), pelo empréstimo do material; a France M. Pedreira, pelas ilustrações; à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pela bolsa de mestrado de L. M. C. E. B. L; e ao Conselho Nacional de Pesquisas (CNPq), pela bolsa de Produtividade em Pesquisa de E. H.
REFERÊNCIAS
AUSTIN, O. L. Birds of the world. London: Spring Book, 1988. 316 p.
BAUMEL, J. J.; KING, A. S.; BREAZILE, J. E.; EVANS, H. E.; BERGE, J. C. van den. (Eds). Handbook of avian anatomy: nomina anatomica avium. 2. ed. Cambridge: Nuttall Ornithological Club, 1993. 779 p. (Publication, n. 23).
BEDDARD, F. E. The structure and classification of birds. London: Longmans, 1898. 548p.
BEECHER, W. J. Feeding adaptation and systematics in the avian order Piciformes. J. Wash. Acad. Sci, Washington, n. 43, p. 293-299, 1953.
BOCK, W. J. Secondary articulation of avian mandible. Auk, Washington, v. 77, n. 1, p. 19-55, 1960.
BOCK, W. J. Kinetics of the avian skull. J. Morphol., New York, v. 114, n. 1, p. 1-52, 1964.
BÜHLER, P. Funcional anatomy of the avian jaw apparatus. In: KING, A S.; McLELLAND, J. (Eds). Form and function in birds. London: Academic Press, 1985. v. 2, p. 439-465.
BURTON, P. J. K. Anatomy and evolution of the feeding apparatus in avian orders Coraciiformes and Piciformes. Bull. Brit. Mus. Nat. Hist. Zool., London, n. 47, n. 6, p. 331-443, 1984.
CAMPBELL, B. The dictionary of birds. New York: Exeter Books, 1983. 352 p.
CAMPBELL, B.; LACK, E. (Eds). A Dictionary of birds. Vermillion: Buteo Books, 1985. 670p.
CRACRAFT, J. The lacrimal-ecthetmoid bone complex in birds: a single character analysis. Am. Midl. Nat., New York, v. 80, n. 2, p. 316-359, 1968.
CRACRAFT, J. Toward a phylogenetic classification of the recent birds of the world (Class Aves). Auk, Washington, v. 98, n. 4, p. 681714, 1981.
DONATELLI, R. L. Osteologia e miologia cranianas de Galbulidae (Aves, Piciformes), com enfoque filogenético. Dissertação (Mestrado). Universidade de São Paulo, 1987.
DONATELLI, R. L. Anatomia craniana e aspectos evolutivos de Picidae (Aves, Piciformes) neotropicais e afrotropicais.Tese (Doutorado). Universidade de São Paulo, 1991.
DONATELLI, R. J. Cranial osteology and myology of the jaw apparatus in the Galbulidae (Aves, Piciformes). Arq. Zool., São Paulo, v. 32, n. 1, p. 1-32, 1992.
DONATELLI, R. J. The jaw apparatus of the neotropical and afrotropical woodpeckers (Aves: Piciformes). Arq. Zool., São Paulo, v. 33, n. 1, p. 1-70, 1996.
FJELDSA, J.; KRABBE, N. Birds of the high Andes. Verbog (Denmark): Norhaven, 1990. 876p.
GARROD, A. H. On the value in classification of a peculiarity in the anterior margin of the nasal bone of certain birds. Proc. Zool.Soc. Lond., London, v. 10, n. 3, p. 33-38, 1873.
GENNIP, E. M. S. J. The osteology, arthrology and myology of the jaw apparatus of the pigeon (Columba livia L.). Neth. J. Zool., Leiden, v. 36, n. 1, p. 1-46, 1986.
GILL, F. B. Ornithology. 2. ed. New York: W. H. Freeman, 1995. 763p.
HARRISON, C. J. O. (Ed). Bird families of the world. New York: Harvey N. Abrams, 1978. 264 p.
HARRISON, J. G. A comparative study of the method of skull pneumatisation in certain birds. Bull. Brit. Orn. Cl., London, v. 80, n. 8, p. 167-172, 1960.
HILTY, S. L.; BROWN, W. L. A guide to the birds of Colombia. Princeton: Princeton Univ. Press, 1986. 836p.
HOFER, H. Neuere Untersuchungen zur Kopfmorphologie der Vögel. In: INTERNATIONAL ORNITHOLOGICAL CONGRESS, 11, Basel. Proceedings. Basel, 1954. p. 104-137.
HÖFLING, E. Osteologia e miologia cranianas nos Ramphastidae (Aves, Piciformes). An. Acad. Bras. Ci., Rio de Janeiro, v. 60, n. 2, p. 257, 1988.
HÖFLING, E. Anatomia do crânio e da cintura escapular dos Ramphastidae (Aves: Piciformes) e de alguns grupos próximos, com implicações sistemáticas. Tese (Livre-Docência). Universidade de São Paulo, 1995.
HÖFLING, E.; GASC, J. P Biomécanique du crâne et du bec chez Ramphastos (Ramphastidae, Aves). I Description des elements anatomiques. Gegenbaurs Morphol. Jahrb., Leipzig, v. 130, n. 1, p. 125-147, 1984.
HOWARD, R.; MOORE, A. A Complete checklist of the birds of the world. 2. ed. London: Academic Press, 1994. 630 p.
HUXLEY, T. H. On the classification of birds, and on the taxonomic values of the modification of certain of the cranial bones observable in that class. Proc. Zool. Soc. Lond., London, v. 27, p. 415-472, 1867.
JOLLIE, M. The skeleton of the chicken and remarks on the anatomy of this region in other birds. J. Morphol., New York, v. 100, n. 4, p. 389-436, 1957.
KING, A S.; McLELLAND, J. Birds - their structure and function. London: Baillière Tindall, 1984. 334p
LANYON, S. M.; ZINK, R. M. Genetic variation in Piciformes birds: monophyly and generic and familial relationship. Auk, Washington, v. 104, n. 4, p. 724-732, 1987.
MARCELIANO, M. L. V. Estudo osteológico e miológico do crânio de Opisthocomus hoazin (Müller, 1776) (Aves: Opisthocomidae) comparado com algumas espécies de Cracidae, Musophagidae e Cuculidae. Tese (Doutorado). Universidade de São Paulo, 1996.
MÉNDEZ, A. C. Osteologia craniana de Alcedinidae tropicais (Aves: Coraciformes). Dissertação (Mestrado). Universidade de São Paulo, 1998.
MORONY Jr., J. J.; BOCK, W. J.; FARRAND Jr., J. Reference list of the birds of the world. New York: American Museum of Natural History, 1975. 207p.
MONROE Jr., B. L.; SIBLEY, C. G. A world checklist of birds. New Haven: Yale University Press, 1993. 393 p.
OLSON, S. L. A critique of Cracraft's classification of birds. Auk, Washington, v. 99, n. 4, p. 723-739, 1982.
OLSON, S. L. Evidence for polyphyletic origin of the Piciformes (Aves). Auk, Washington, v. 11, n. 1, p. 126-133, 1983.
PARKER, W. K. On the morphology of the skull in the woodpecker (Picidae) and wrynecks (Jyngidae). Trans. Linn. Soc. Lond., London, v. 1, n. 1-22, 1875.
PETTINGILL, O. S. Ornithology in laboratory and field. Orlando: Academic Press, 1985. 403 p.
PINTO, O. M. O. Novo catálogo das aves do Brasil. São Paulo: [s. n.], 1978. v. 1.
PROCTOR, N. S.; LYNCH, P. J. Manual of Ornithology: avian structure & function. New Haven: Yale University Press, 1993. 340 p.
RICHARD, L. P.; BOCK, W. J. Functional anatomy and adaptative evolution of the feeding apparatus in the Hawaian honeycreeper genus Loxops (Drepanididae). Ornithol. Monogr. Washington, n. 15, p. 1-173, 1973.
RAIKOW R. J.; CRACRAFT, J. Monophyly of the Piciformes: a reply to Olson. Auk, Washington, v. 100, p. 134-138, 1983.
SCHAUENSEE, R. M. Meyer de A guide to the birds of South America. [s. l.]: Intercollegiate Press, 1982. 498 p.
SCHUBART, D.; AGUIRRE, A. C.; SICK, H. Contribuição para o conhecimento da alimentação das aves brasileiras. Arq. Zool., São Paulo, n. 12, p. 95-249, 1965.
SHUFELDT, R. W. Osteology of birds. N. Y State Mus. Bull., New York, n. 130, p. 1-381, 1909.
SIBLEY, C. G.; AHLQUIST, J. Phylogeny and classification of birds. New Haven: Yale University Press, 1990. 976 p.
SICK, H. Ornitologia brasileira: uma introdução. Brasília: Ed. Universidade de Brasília, 1985. 2 v.
SICK, H. Birds in Brazil: a natural history. Princeton: Princeton University Press, 1993. 703p.
SICK, H. Ornitologia Brasileira. Rio de Janeiro: Nova Fronteira, 1997. 862 p.
SILVA, J. M. C. Sistemática e biogeografia da superespécie Nystalus maculatus (Piciformes: Bucconidae). Ararajuba, Rio de Janeiro, v. 2, p. 75-79, 1991.
SILVEIRA, L. F. Osteologia Craniana dos Tinamidae (Aves: Tinamiformes). Dissertação (Mestrado). Universidade de São Paulo, 1999.
SIMPSON, S. F.; CRACRAFT, J. The phylogenetic relationships of the Piciformes. (Class Aves). Auk, Washington, v. 98, n. 3, p. 481494, 1981.
SKUTCH, A. F. Studies of tropical American birds. Cambridge, Nuttall Ornithological Club, 1972. 228 p. (Publication, n. 10).
STARCK, J. M. Evolution of avian ontogenis. In: POWER, D. M. (Ed). Current Ornithology. New York: Plenum Press, 1993. p. 275366. v. 10.
STILES, F. G.; SKUTCH, A. F Birds of Costa Rica. New York: Cornell University Press, 1989. 511 p.
STOTZ, D. F.; FITZPATRICK, J. M.; PARKER III, T. A., MOSKOVITS, D. K. Neotropical birds-ecology and conservation. Chicago, University of Chicago Press, [19?]. 478 p.
SWIERCZEWSKY, E. V.; RAIKOW, R. J. Hind limb morphology phylogeny and classification of the Piciformes. Auk, Washington, v. 98, n. 3, p. 466-480, 1981.
TORDOFF, H. B. On the morphology of the avian family Fringillidae based on the structure of the skull. Misc. Publ. Mus. Zool. Univ. Mich., Michigan, n. 81, p. 1-41, 1954.
TYNE, J. van; BERGER, A. J. Fundamentals of ornitology. 2. ed. New York: J. Wiley, 1976. 624 p.
VERHEYEN, R. Contribution à la systématique des Piciformes basée sur l'anatomie comparée. Bull. Inst. R. Sci. Nat. Belg. Bruxelles, n. 31, n.52, p. 1-43, 1955.
WEBB, J. E.; WALLWORK, J. A.; ELGOOD, J. H. Guide to living birds. London: Macmillan Press, 1979. 291 p.
ZISWILLER, V. Vertebrados. Amniotas. Barcelona: Ed. Omega, 1980. v. 2. 413 p.
ZUSI, R. L. Structural adaptation of the head and neck in the black-skimmer Rhynchops nigra. Cambridge: Nuttall Ornithological Club, 1962. 101 p. (Publication, n. 3)
ZUSI, R. L. Patterns of diversity in avian skull. In: HANKEN, J.; HALL, B. L. (Eds). The Skull. Chicago: Chicago University Press, 1993. p. 391-437. v. 2.
ZUSI, R. L.; STORER, R. W Osteology and myology of the head and neck of the pied-bill grebes (Podilymbus). Misc. Publi. Mus. Zool. Univ. Mich. Michigan, n. 139, p. 1-49, 1969.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail:boletim@museu-goeldi.br
Recebido: 02/03/2000
Aprovado: 17/05/2002
Apêndice. Material Examinado
• Monasa atra (Boeddart, 1783) MZ: DFS 87-231, sexo indeterminado, Roraima, Colônia do Apiaí - 04/10/87
• Monasa morphoeus (Hahn & Küster, 1823)
MG: 1588, sexo indeterminado, 09/38
MZ: DFS 88-279, sexo indeterminado, Pedra Branca, Rio Arari, RO - 19/02/88
• Monasa nigrifrons (Spix, 1824)
MHNT: 140, fêmea, Rio Suiamissu, MT - 05/09/83
MZ: DFS 88-139, sexo indeterminado, Anari, RO - 12/02/88
• Nystalus chacuru (Vieillot, 1816)
MHNT: 1312, fêmea, São Luiz do Paraitinga, SP - 13/12/92
AZ: 56, sexo indeterminado, Baia do Campo Grande, Jacareí, SP - 07/12/87
• Notharchus macrorhynchos (Gmelin, 1788)
MHNT: 141, macho, Ubatuba, SP - 13/05/88
MHNT: 508, fêmea, Ubatuba, SP - 13/05/88
• Malacoptila rufa (Spix, 1824)
MHNT: 1225, sexo indeterminado, Santarém, PA- 28/04/75
MZ: DFS 88-209, sexo indeterminado, Pedra Branca, Rio Anari, RO
• Nonnula rubecula (Spix, 1824)
MZ: DFS 87-232, sexo indeterminado, Colônia do Apiaí, RR - 04/10/87
• Bucco capensis Linnaeus, 1726
MZ: DFS 87-231, sexo indeterminado, Colônia do Apiaí, RO - 05/10/87
• Chelidoptera tenebrosa (Pallas, 1782)
MHNT: 347, fêmea, Rio Crixás, GO - 31/03/80
MHNT: 1218, fêmea, Tapurah, MT - 04/08/92













