Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.2 n.1 Belém abr. 2007
Osteología craniana de Cerylinae (Coraciiformes: Alcedinidae)
Cranial osteology of Cerylinae (Coraciiformes: Alcedinidae)
Andrés Calonge-MéndezI; Elizabeth HöflingII
IUniversidade de São Paulo. Instituto de Biociências. Departamento de Zoologia. São Paulo, Brasil e-mail acmzoo@usp.br
IIUniversidade de São Paulo. Instituto de Biociências. Departamento de Zoologia. São Paulo, Brasil e-mail ehofling@usp.br
RESUMO
A anatomia craniana de oito espécies de martins-pescadores da subfamília Cerylinae (Megaceryle torquata, M. lugubris, M. alcyon, Ceryle rudis, Chloroceryle amazona, C. americana, C. inda e C. aenea) foi comparada com a de outros Alcedinidae e com representantes da maioria das famílias de Coraciiformes (Coraciidae, Leptosomidae, Bucerotidae, Upupidae, Todidae, Momotidae e Meropidae), a fim de verificar o padrão da região temporal e da barra jugal. Esses dados foram comparados também com os disponíveis na literatura referentes aos Ramphastidae, Picidae, Galbulidae, Capitonidae e Cuculidae. A região temporal com duas fossas bem delimitadas, a barra jugal expandida rostrolateralmente e o processo ótico do quadrado com três saliências articulares, entre outros, são caracteres comuns para Cerylinae. Quatro características permitiram separar os gêneros de Cerylinae: expansão dorsal do processo orbital do lacrimal (ausente em Chloroceryle [danificado em Ceryle rudis], presente em Megaceryle); côndilo caudal do quadrado (forma cotilar em Chloroceryle e Ceryle rudis, forma condilar em Megaceryle); cótila lateral e caudal da mandíbula (indistintas em Chloroceryle e Ceryle rudis, distintas em Megaceryle); e parede dorsal da fossa caudal da mandíbula (ausente em Chloroceryle e Ceryle rudis, ausente Megaceryle).
Palavras-chaves: Coraciiformes. Alcedinidae. Crânio. Osteologia. Sistemática.
ABSTRACT
Skull osteology of eight species of Cerylinae Kingfishers (Megaceryle torquata, M. lugubris, M. Alcyon, Ceryle rudis, Chloroceryle amazona, C. americana, C. inda and C. aenea) were compared with other Alcedinidae and representatives of most families of Coraciiformes (Coraciidae, Leptosomidae, Bucerotidae, Upupidae, Todidae, Momotidae and Meropidae) with the purpose of verifying the pattern of the temporal region and the jugal arch. These data were also compared with the information on the bibliography about the Ramphastidae, Picidae, Galbulidae, Capitonidae and Cuculidae. The temporal region with two well delimited fossas, the jugal arch expanded rostrolaterally and quadrate with three saliences on the otical process, are common characters on the Cerylinae kingfishers. Four characters were diagnostic to separate the genera of Cerylinae studied: the dorsal expansion of the orbital process of the lacrimal (absent in Chloroceryle [unavailable in Ceryle rudis], present in Megaceryle); caudal condyle of quadrate (cotylar-shaped in Chloroceryle and Ceryle rudis, condylar-shape in Megaceryle); lateral and caudal cotyles of mandible (non distinct in Chloroceryle and Ceryle rudis, distinct in Megaceryle) and dorsal wall of the caudal fossa of jaw (absent in Chloroceryle and Ceryle rudis, present in Megaceryle).
Keywords: Coraciiformes, Alcedinidae, Skull, Osteology, Systematic.
INTRODUÇÃO
Os martins-pescadores (Alcedinidae) são um grupo cosmopolita que habita, principalmente, regiões tropicais e subtropicais do Velho Mundo. Existem aproximadamente 90 espécies, sendo a região Neotropical representada por apenas seis (HOWARD; MOORE, 1994).
São aves que, geralmente, apresentam corpo robusto, cabeça relativamente grande, pescoço curto, língua curta, bico longo, robusto e pontiagudo. Possuem narinas do tipo holorrino (GARROD, 1873), palato desmognato, sendo o vômer e o processo basipterigóide ausentes. Os pés são bastante pequenos, impróprios para nadar (SICK, 1997), com sindactilia avançada e os três artelhos anteriores unindo-se basalmente e o III e o IV até a porção mediana.
Atualmente, reconhecem-se três grupos de martins-pescadores: Alcedininae, Daceloninae e Cerylinae (MILLER, 1912; MAURER; RAIKOW, 1981) ou Alcedinidae, Dacelonidae e Cerylidae (SIBLEY; AHLQUIST 1990; FRY et al., 1992).
O relacionamento filogenético entre os Alcedinidae é incerto. Miller (1912) acredita que os Alcedininae são mais relacionados aos Daceloninae do que aos Cerylinae. Maurer e Raikow (1981) citam os Daceloninae como basais em relação aos Alcedininae e Cerylinae. No entanto, Sibley e Ahlquist (1990) acreditam serem os Alcedinidae basais em relação a Cerylidae e Dacelonidae, verificando-se, desta maneira, as três hipóteses possíveis de relacionamento filogenético para três táxons. A questão do relacionamento filogenético entre as subfamílias de Alcedinidae é, ainda, um assunto controvertido e de fundamental importância ao se tentar elucidar a história evolutiva do grupo, principalmente sob os pontos de vista biogeográfico e da evolução do hábito alimentar.
Os Cerylinae distribuem-se em três gêneros (Megaceryle, Ceryle e Chloroceryle), comportando nove espécies (Ceryle rudis, Megaceryle maxima, M. lugubrís, M. alcyon, M. torquata, Chloroceryle amazona, C. americana, C. inda e C. aenea) e várias subespécies (HOWARD; MOORE, 1994). Vários autores reconhecem apenas Ceryle e Chloroceryle (SCHAUNSEE, 1982).
Segundo Miller (1912), os Cerylinae "constituem um grupo bem definido separado das outras duas subfamílias por um excelente número de caracteres". Estas assertivas são corroboradas por Stresemann e Stresemann (1961), através do padrão de muda das rêmiges primárias, por Maurer e Raikow (1981), através da musculatura dos membros posteriores, e por Sibley e Ahlquist (1990), através de hibridação de DNA. Estes últimos apresentam um cladograma para as espécies de Cerylinae, onde Chloroceryle é o grupo basal e Ceryle rudis grupo-irmão dos Megaceryle.
Fry et al. (1992) acreditam que o relacionamento entre as espécies de Chloroceryle seja de fácil interpretação. Segundo estes autores, as quatro espécies de Chloroceryle são produto de especiação dicotômica: Chloroceryle amazona e Chloroceryle americana seriam espécies-irmãs, assim como Chloroceryle inda e Chloroceryle aenea. Estas hipóteses são corroboradas pelos hábitos de C. inda e C. aenea, espécies de interior de mata, ao contrário de C. amazona e C. americana, que se associam a ambientes aquáticos. Outra característica que apóia o relacionamento das espécies de Chloroceryle é a coloração das fêmeas de C. inda e C. aenea, que apresentam uma faixa esverdeada no peito.
Este trabalho objetiva descrever e comparar a osteologia craniana dos martins-pescadores neotropicais, caracterizar os gêneros de Cerylinae com base na osteologia craniana, discutir e comparar o padrão da região temporal, do arco jugal e do quadrado.
MATERIAL E MÉTODOS
Foram analisados os crânios de 43 espécimes de aves, representando 41 espécies de sete famílias de Coraciiformes, além de um representante das famílias Trogonidae e Cuculidae (Apêndice 1). Destes 41 crânios, analisaram-se 33 de Alcedinidae (martins-pescadores), amostrando-se as três subfamilias propostas por Miller (1912): Daceloninae (n=7), Alcedininae (n=2) e Cerylinae (n=24).
Um exemplar de Chloroceryle americana (AZ 511), fixado em formol 4% e conservado em álcool 70% v. v., foi dissecado para se estabelecer adequadamente os limites da região temporal.
A descrição anatômica baseou-se em Chloroceryle amazona que, posteriormente, foi comparada com os outros martins-pescadores, produzindo uma descrição única. As outras espécies de Coraciiformes, como também Trogon melanurus (Trogonidae) e Coccyzus americanus (Cuculidae), foram analisadas, principalmente, com o intuito de comparar o padrão da região temporal e da barra jugal, sendo tal análise incluída na discussão.
O material ornitológico faz parte das coleções do Museu Paraense Emilio Goeldi, Belém, PA, Brasil (MPEG); do Departamento de Zoologia, Instituto de Biociências, Universidade de São Paulo, São Paulo, SP Brasil (AZ); do United States National Museum, Smithsonian Institution, Washington, USA (USNM); do Louisiana State University Museum of Zoology, Louisiana, USA (LSUMNS); e do Museu de História Natural de Taubaté, SP Brasil (MHNT).
O material osteológico pertencente ao Departamento de Zoologia do Instituto de Biociências da Universidade de São Paulo foi preparado com o auxílio de larvas de Dermestes sp. (Coleoptera), segundo Alvarenga (1992). O material oriundo do Museu Paraense Emílio Goeldi, do United States National Museum, Smithsonian Institution, do Louisiana State University Museum of Zoology e do Museu de História Natural de Taubaté encontrava-se preparado.
Os crânios foram observados e descritos utilizando-se esteroscópio Wild M3 (9,6x - 60x), fotografados e, posteriormente, desenhados.
O quadrado foi desarticulado da caixa craniana, com o intuito de observar detalhes da articulação entre o quadrado e a caixa craniana. A desarticulação foi precedida de um banho em água por, aproximadamente, 20 minutos.
Devido ao anquilosamento observado nos componentes ósseos do crânio das aves, optou-se por referir-se a eles como simplesmente regiões.
A nomenclatura utilizada na descrição dos componentes ósseos segue a Nomina Anatomica Avium (BAUMEL et al., 1993), com exceção da região temporal, que segue Zusi e Livezey (2000).
A nomenclatura das familias segue Maurer e Raikow (1981) e a das espécies Howard e Moore (1994).
RESULTADOS
Ossa cranii: os frontale, os lacrimale, os ectethmoidale, os mesethmoidale
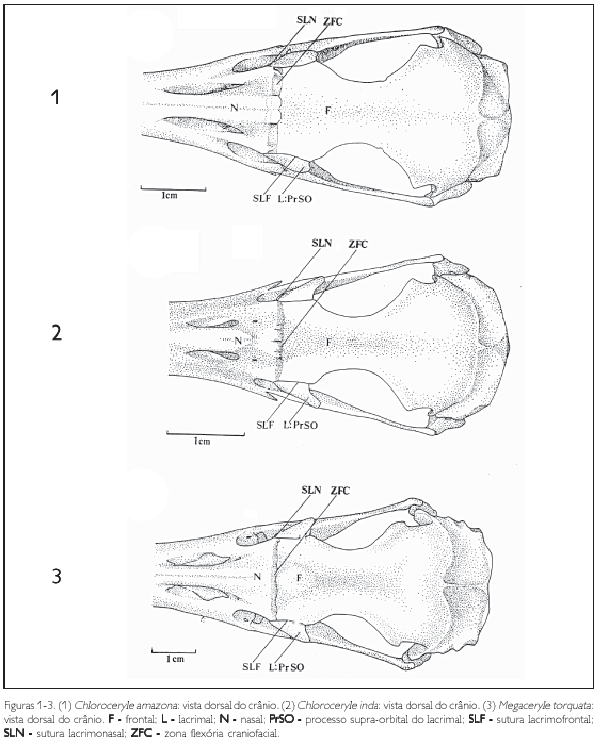
A região do osso frontal (os frontale) (F) articula-se rostralmente com a região do osso nasal (os nasale) (N) através da zona flexória craniofacial (zona flexoria craniofacialis) (ZFC). Esta estrutura apresenta-se como um sulco perpendicular ao eixo rostrocaudal do crânio, bastante evidente e característico em todas as espécies analisadas (Figuras 1-3).
Os lacrimais (os lacrimale) (L) são um par de ossos orientados quase perpendicularmente ao eixo rostrocaudal do crânio. Localizam-se entre a fenestra anterorbital (fenestra antorbitalis) (FeA) e a órbita, delimitando-as caudal e rostralmente, respectivamente (Figuras 4 e 5).
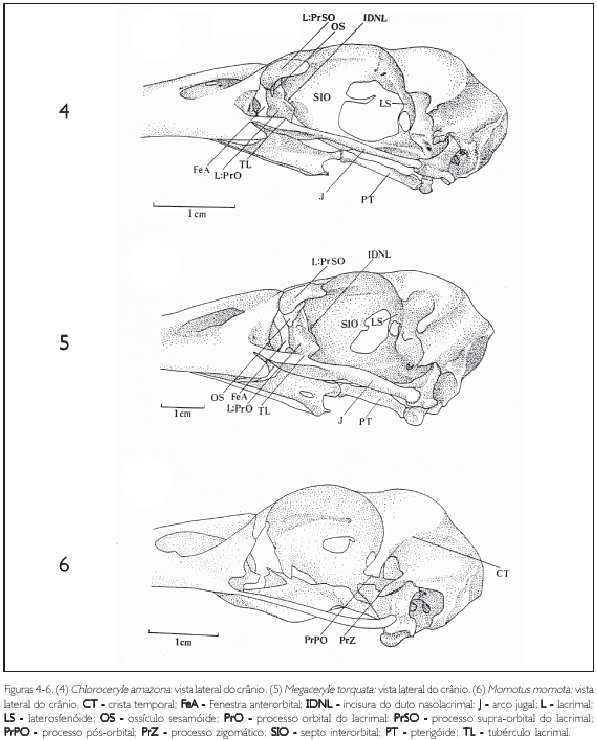
O lacrimal, na sua face lateral, apresenta uma conspicua depressão mediana por onde passa o duto nasolacrimal (ductus nasolacrimalis), sendo denominada incisura do duto nasolacrimal (incisura ductus nasolacrimalis) (IDNL) (Figuras 4 e 5). Esta estrutura delimita os processos supraorbital e orbital do lacrimal. O processo supraorbital (PrSO) localiza-se dorsalmente à incisura do duto nasolacrimal, em contato com os ossos nasal e frontal. O processo orbital (PrO) localiza-se ventralmente à incisura e direciona-se ao arco jugal (Figuras 4, 5, 13 e 14).
O processo supra-orbital do lacrimal, na sua face articular frontonasal, articula-se rostralmente com o nasal através da sutura lacrimonasal (sutura lacrimonasalis) (SLN) e caudalmente com o frontal através da sutura lacrimofrontal (sutura lacrimofrontalis) (SLF: Figuras 1-3).
A face dorsal do processo supra-orbital - face articular frontonasal - possui formato ligeiramente retangular orienta-se obliquamente ao eixo rostrocaudal do crânio, com a porção caudal voltada para a órbita e a porção rostral curvada ventralmente, voltada para a fenestra anterorbital (FeA: Figuras 4 e 5).
Na face rostrodorsolateral da face articular frontonasal, logo acima da incisura do duto nasolacrimal, observa-se um pequeno osso triangular - ossículo sesamóide (OS: Figuras 4, 5, 19 e 20). Este ossículo recobre a incisura do duto nasolacrimal, porém, não se observa oclusão entre eles. Originase rostralmente na margem externa da face ventral da face articular frontonasal em Chloroceryle amazona, C. inda e C. americana, e medialmente em Megaceryle torquata. Isto faz com que os ossículos difiram na forma e na sutura entre o ossículo e o corpo do lacrimal. Esta sutura apresenta-se reta em Chloroceryle amazona e C. americana, sendo curva em Megaceryle torquata, devido ao fato de acompanhar a borda arredondada com a qual se articula (Figuras 4 e 5).
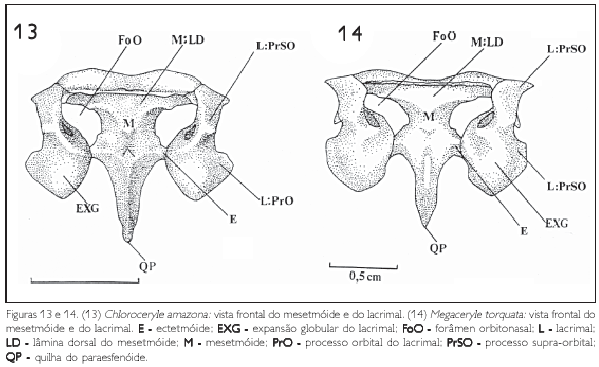
A parede medial do processo supra-orbital forma a parede lateral do forâmen orbitonasal (foramen orbitonasalis) (FoO: Figuras 13, 14, 19 e 20), que é amplo e conspícuo.
O processo orbital do lacrimal (PrO: Figuras 4, 5, 13 e 14) localiza-se abaixo da incisura do duto nasolacrimal; sua face rostral delimita a parede caudal da fenestra anterorbital (fenestra antorbitalis) (FeA: Figuras 4 e 5) e sua face caudal forma a porção rostroventral da órbita. A porção rostral do processo orbital do lacrimal apresenta-se pneumatizada e com uma expansão globular (expansão processo orbital do lacrimal) (EXG: Figuras 13 e 14). Na parede medial deste processo observa-se um conspícuo entalhe (En), onde o ectetmóide encaixa-se. Isto é observado em Chloroceryle (danificado em Ceryle rudis)e não em Megaceryle torquata, M. Acyon e M. lugubris. Ventralmente o processo orbital dispõe-se direcionado ao arco jugal, onde se apóia, porém, não se observa fusão entre eles (Figuras 4 e 5).
Os ectetmóides (os ectethemoidale) (E: Figuras 13, 14, 19 e 20) originam-se lateralmente a partir da região mediana do mesetimóide (M: Figuras 13 e 14), como um delgado osso triangular em forma espicular, perpendicular ao eixo rostrocaudal do septo interorbital (septum interorbitalis) (SIO: Figuras 4-6), formando praticamente um ângulo de 90o entre os dois (Figuras 13, 14, 19 e 20). O ectetmóide possui uma base larga que se afina até alcançar o processo orbital do lacrimal, a partir do qual se torna distalmente pontiagudo (Figuras 19 e 20). Em Megaceryle torquata (Figura 20), M. Alcyon e M. lugubris pouco se observa a porção distal do ectetmóide, devido a uma conspícua expansão lateral do processo orbital do lacrimal (Exl), que recobre dorsalmente o ectetmóide. Isto não é observado nas espécies do gênero Chloroceryle (Figuras 19 e 20).
Os mesetimóides (os mesethmoidale) (M) apresentam formato triangular, com o vértice disposto ventralmente (Figuras 13 e 14); formam a parte óssea rostral do septo interorbital e, dorsalmente, mantém-se em contato com a superfície ventral do frontal, através da lâmina dorsal (lamina dorsalis) (LD: Figuras 13 e 14). Esta lâmina dispõe-se tranversalmente ao plano sagital e distalmente direciona-se ao processo supra-orbital do lacrimal. O mesetimóide projeta-se ventrocaudalmente e é limitado caudalmente pela quilha do paraesfenóide (QP: Figuras 7, 8, 13 e 14).
O septo interorbital (SIO) é uma delgada placa óssea sagital que tem origem na porção caudal do mesetimóide e estende-se pela porção ventral do frontal, não atingindo a parede caudal das órbitas (Figuras 4 e 5).
Entre a extremidade rostral do mesetimóide e a borda caudal do septo nasal ocorre um espaço denominado hiato craniofacial (hiatus craniofacialis septi).
A fenestra anterorbital (fenestra antorbitalis) (FeA) é um espaço limitado rostralmente pelos processos nasal do maxilar e maxilar do nasal (BAUMEL et al., 1993), ventralmente pelo processo jugal do maxilar dorsalmente pelo nasal e pelo processo supra-orbital do lacrimal e, caudalmente, pela parede rostral do processo orbital do lacrimal (Figuras 4 e 5).
Os parasphenoidale, os basisphenoidale, os laterosphenoidale, os squamosum
Os basisfenóides não são distinguíveis devido à sua total fusão rostral com a lâmina do paraesfenóide (lamina parasphenoidalis) (LP: Figuras 9 e 10) e caudal com os basioccipitais (os basioccipitale).
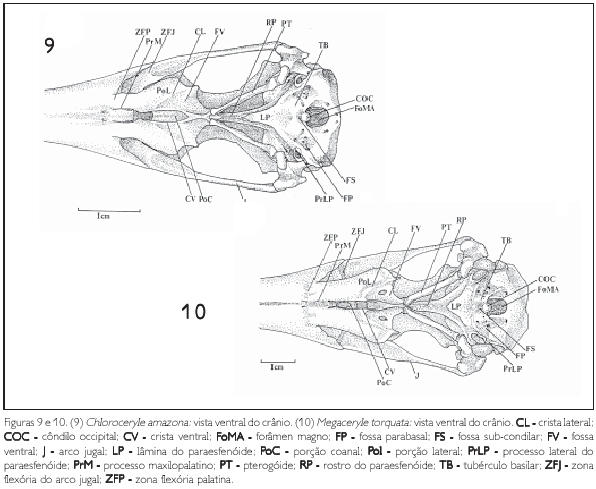
No osso paraesfenóide, duas regiões são prontamente discerníveis nas espécies analisadas: lâmina do paraesfenóide (LP) e rostro paraesfenóide (rostrum parasphenoidale) (RP: Figuras 9 e 10).
A lâmina do paraesfenóide é limitada caudalmente pelos tubérculos basilares (tuberculum basilare) (TB) e fossa subcondilar (fossa subcondilaris) (FS) dos ossos basioccipitais (Figuras 9 e 10). Tal lâmina apresenta formato triangular, com o vértice disposto rostralmente e localiza-se ventralmente ao rostro paraesfenóide.
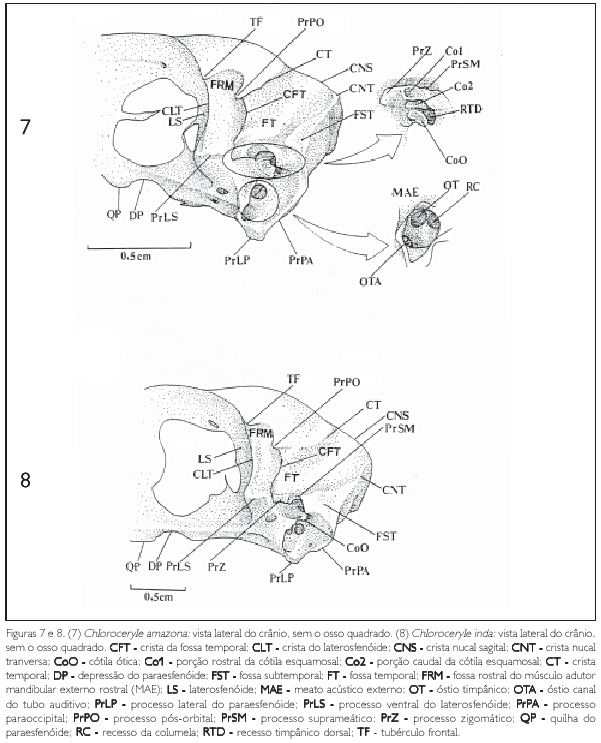
A base da lâmina do paraesfenóide estende-se lateralmente, formando o processo lateral do paraesfenóide (processus lateralis parasphenoidalis) (PrLP). Este processo é conspícuo e assume forma triangular com o vértice disposto em direção ventral (Figuras 7-10). O processo lateral do paraesfenóide direciona-se caudodorsalmente encontrando o processo paroccipital (PrPA: Figuras 7 e 8), onde forma a parede caudal do meato acústico externo (meatus acusticus externus) (MAE: Figura 7). O meato é limitado dorsalmente pela fossa subtemporal (fossa subtemporalis) (FST) e pelo processo suprameático (processum suprameaticus) (PrSM) do esquamosal (Figuras 7 e 8).
O processo lateral do paraesfenóide segue caudodorsalmente em direção à cótila ótica do esquamosal (cotyla quadratica otici) (CoO: Figura 7), formando a parede rostral do meato acústico externo, o qual se limita dorsalmente pela cótila supracitada (Figura 7). Tal parede apresenta-se expandida lateralmente, formando um meato bastante profundo (Figura 7). Ventrocaudalmente este processo limita-se pelo processo paroccipital do exoccipital (PrPA: Figuras 7 e 8).
No interior do meato acústico externo observam-se três pequenos orifícios, sendo dois situados dorsalmente e um ventralmente. Entre os primeiros, o óstio timpânico (ostium tympanicum)tem posição rostral (OT) e o óstio canal do tubo auditivo (ostium canalis tubae auditivae)tem posição caudal (OTA). O orifício situado ventralmente é o recesso da columela (recessus columellae) (RC: Figura 7).
Disposto a partir do óstio timpânico e lateralmente no rostro paraesfenóide, dispõe-se o tubo auditivo. Seus ramos direito e esquerdo confluem rostralmente em direção à quilha do paraesfenóide.
O rostro paraesfenóide (RP) apresenta um formato triangular com o vértice disposto rostralmente (Figuras 9 e 10) e limita-se caudalmente pela lâmina do paraesfenóide (LP) e pela parede rostral do meato acústico externo (Figuras 9 e 10). Dorsalmente limita-se pelo laterosfenóide (LS: Figuras 4 e 8) e ventralmente pela lâmina do paraesfenóide. Tal rostro apresenta uma expansão dorsal mediana de esboço triangular, localizada logo abaixo do fontículo interorbital (fonticulis interorbitalis)e uma placa óssea ventral, entre este e a lâmina do paraesfenóide (Figuras 7 e 8). Rostralmente à placa óssea ventral observa-se uma acentuada depressão rostral do rostro paraesfenóide (DP), seguida da acentuada quilha do paraesfenóide (QP), que repousa sobre a articulação entre o pterigóide e o palatino (articulatio pterygopalatina),limitando rostralmente o rostro paraesfenóide (Figuras 7 e 8).
Os laterosfenóides (os laterosphenoidale) (LS) limitam-se medialmente com o septo interorbital (SIO), dorsalmente com o frontal e ventralmente com o rostro paraesfenóide. Ventrolateralmente observa-se a área muscular áspera, de formato globular, onde medialmente forma-se um pequeno processo (PrLS: processo do laterosfenóide).
A região temporal (regio temporalis) corresponde às fossas e impressões decorrentes da origem do complexo muscular adutor mandibular externo (ZUSI; LIVEZEY, 2000). A porção mais conspícua desta região é a fossa temporal (fossa temporalis), que, por definição, se situa caudalmente ao processo pós-orbital (processum postorbitalis) e dorsal ao meato acústico externo (BAUMEL et al., 1993), sendo seu principal componente o osso esquamosal.
Os Cerylinae apresentam duas fossas na região temporal: a fossa rostral do músculo adutor mandibular externo rostral (feixe pós-orbital Burton 1984), denominada a partir daqui como fossa rostral do MAE (FRM) e fossa temporal (FT).
Nos Cerylinae e Alcedininae o processo pós-orbital é muito reduzido, confluente com a crista temporal e com orientação rostroventral (Figuras 7 e 8). No entanto, em Daceloninae observa-se um processo pós-orbital relativamente longo, o que faz com que apresentem regiões temporais de aspectos distintos.
A fossa rostral do MAE (FRM) tem orientação dorsoventral; limita-se rostralmente por um tubérculo frontal (TF) e caudalmente com o processo pós-orbital (PrPO). As fibras carnosas do feixe rostral do músculo adutor mandibular externo (MAE) têm origem na fossa rostral do MAE; correm em direção à aponevrose de inserção, alojadas sobre uma depressão bem demarcada no laterosfenóide. O feixe rostral do MAE recobre o músculo Pseudotemporalis superfcialis, que, por sua vez, se origina na área muscular áspera. A fossa rostral do MAE e sua adjacente depressão separam-se da porção caudal da órbita através de uma tênue crista perpendicular ao eixo rostrocaudal do crânio - a crista do laterosfenóide (CLT) - e da fossa temporal (FT) por uma outra crista perpendicular - a crista da fossa temporal (CFT: Figuras 7 e 8).
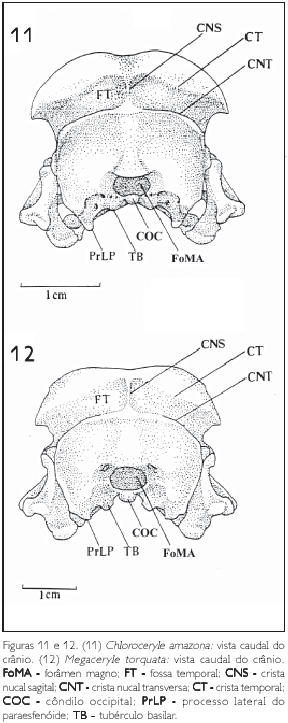
A fossa temporal (FT) é profunda e encontra-se entre a crista temporal (CT) e a crista nucal tranversa (CNT). Esta fossa circunda a caixa craniana no sentido ventrocaudodorsal. A porção distal da fossa temporal é limitada dorsalmente pelo processo pós-orbital e ventralmente pelo processo zigomático (PrZ). A sua porção proximal é limitada pela crista nucal sagital (CNS), que divide suas duas porções simétricas (Figuras 7, 8, 11 e 12).
A fossa subtemporal (fossa subtemporalis) (FST), que também pertence à região temporal, é uma cavidade rasa de aspecto triangular, localizada na porção lateral da crista nucal transversa (CNT); limita-se dorsorostralmente com a fossa temporal, ventrorostralmente com o processo suprameático (PrSM) e caudalmente pela região supra-occipital (SO) e pelo processo paroccipital da região exoccipital (PrPA: Figuras 7 e 8).
O esquamosal sempre está associado à fossa temporal e à região que recebe o processo ótico do quadrado (Figuras 7 e 8). Porém, no adulto é impossível determinar sua abrangência e estabelecer seus limites, principalmente pelo grande desenvolvimento da fossa temporal, que recebe contribuições de ossos adjacentes.
A cótila esquamosal (CoS), o processo zigomático (PrZ) e o processo suprameático (PrSM) são as principais e mais conspícuas estruturas do esquamosal (Figuras 7 e 8). A cótila ótica (CoO) também está associada à região esquamosal, mas é originária embriologicamente do ósso ótico (ossa otica),principalmente do proótico (os prooticum) (BAUMEL et al., 1993).
O processo zigomático (PrZ) limita ventrorostralmente a fossa temporal e apresenta-se como uma pequena parede achatada com orientação oblíqua ao eixo rostrocaudal do crânio (Figuras 7 e 8).
O processo suprameático (PrSM) forma a parte caudal da cótila esquamosal e contribui para o limite dorsal do meato acústico externo (BAUMEL et al., 1993) (Figuras 7 e 8).
O quadrado articula-se com o crânio através de duas cótilas: cótila esquamosal (CoS) e ótica (CoO). Cabe ressaltar que a cótila esquamosal apresenta-se bem desenvolvida e dividida em duas porções, observando-se, portanto, três cavidades cotilares para receber o processo ótico do quadrado. A primeira cavidade cotilar (Co1: porção rostral da cótila esquamosal) recebe a porção rostral do capítulo esquamosal (CaS1). Esta primeira cavidade cotilar apresenta-se orientada caudalmente e limita-se dorsalmente com a fossa temporal (FT), rostralmente com o processo zigomático (PrZ), caudalmente com o processo suprameático (PrSM) e ventralmente com a porção caudal da cótila esquamosal (CoS2: Figuras 7 e 8).
A porção caudal da cótila esquamosal (CoS2) é a mais desenvolvida entre as três cavidades cotilares e apresenta formato de meia-lua. Orienta-se ventralmente e limita-se rostralmente com o processo zigomático e a porção rostral da mesma cótila; seu limite caudal é estabelecido com o processo suprameático (PrSM), ventralmente com a cótila ótica (CoO) e ventrocaudalmente com o recesso timpânico dorsal (recessum tympanicus dorsalis) (RTD: Figuras 7 e 8).
A cótila ótica (CoO) é a mais ventral entre as três e apresenta orientação lateral. Limita-se dorsalmente com a porção caudal da cótila esquamosal, ventralmente com a porção dorsal do meato acústico externo e caudalmente com o recesso timpânico dorsal (RTD: Figuras 7 e 8).
Os basioccipitale, os exoccipitale, os supraoccipitale
O conjunto destas três regiões forma a parede caudal que delimita a caixa cranaina, transversalmente ao plano sagital. Ela é limitada dorsalmente pela crista nucal tranversal e ventralmente pelos tubérculos basilares (TB) e pela fossa parabasal (FP: Figuras 9, 10, 11 e 12).
No adulto não é possível estabelecer os limites destas três regiões devido ao seu fusionamento, porém, a procedência de suas estruturas mais conspícuas, tais como o côndilo occipital (condylus occipitalis) (COC), o tubérculo basilar (TB), a fossa parabasal (FP), o processo paroccipital (PrPO) e a crista nucal transversa (CNT), é apresentada por Baumel et al. (1993) e adotada no presente trabalho.
A crista nucal tranversal limita dorsalmente as três regiões (basioccipital, exoccipital e supra-occipital), além de formar o limite caudal da fossa temporal e interromper-se lateralmente por meio da fossa subtemporal (FST: Figuras 7 e 8).
Caudalmente, estas três regiões limitam-se pelos pouco conspícuos tubérculos basilares (TB), fossa subcondilar (FS) e fossas parabasais (FP: Figuras 9 e 10). Dorsalmente às estruturas supracitadas, observa-se o côndilo occipital (COC), que, por sua vez, limita ventralmente o forâmen magno (foramen magnum) (FoMa: Figuras 9). Laterorostralmente ao forâmen magno observam-se acentuadas fossas parabasais (FP), que, possivelmente, contribuem, por meio da crista fossa parabasal, para o bem desenvolvido processo lateral do paraesfenóide (Figuras 9, 10, 11 e 12).
O processo paroccipital (PrPA) do exoocipital é bem desenvolvido e também recebe contribuições do osso ótico (BAUMEL et al., 1993). Tal processo forma a parede caudal do meato acústico externo e limita caudalmente a fossa subtemporal (Figuras 4, 5, 7 e 8).
Os palatinum, os pterygoideum, os jugale
Os palatinos (os palatinum) (PA: Figura 23) fundem-se rostromedialmente aos maxilares (os maxillare)através dos processos maxilares dos palatinos (processum maxillaris) (PrMP), com os quais formam a zona flexória palatina (zona flexoria palatina) (ZFP: Figuras 9 e 10). Rostralmente a esta zona, os componentes que formam a maxila superior coalescem, fechando-a ventralmente. Esta conformação, acrescida da fusão mediana dos processos maxilopalatinos (PrM), caracteriza os Alcedinidae como desmognatos (HUXLEY, 1867); não se observa o vômer (Figuras 9 e 10).
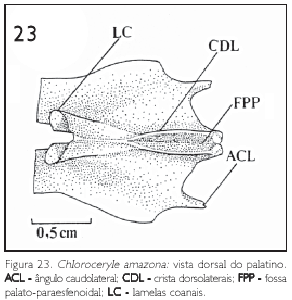
Os palatinos caudalmente encontram-se com os pterigóides (os pterigoideum) (PT) e o rostro paraesfenóide através das face articular do pterigóide (facies articularispterygoidea)da porção coanal (pars choanalis) (PoC) e face articular do paraesfenóide (facies articularis parasphenoidalis)da porção lateral (pars lateralis) (BAUMEL et al, 1993) (Figura 9, 10 e 23).
Duas partes principais são identificáveis nos palatinos: a porção coanal (pars choanalis) (PoC), associada à fossa coanal (fossa choanalis) (FC); e a porção lateral (pars lateralis) (PoL), geralmente lateral à precedente e relacionada com a musculatura do pterigóide (BAUMEL et al., 1993) (Figuras 9, 10 e 23).
As lamelas coanais (lamellas choanalis) (LC) projetam-se dorsalmente (Figura 23), apresentam leve orientação lateral e em forma de asas, formando as paredes dorsolaterais da fossa coanal (Figura 23).
Dorsocaudalmente encontram-se as cristas dorsolaterais (CDL), que não são fusionadas e por isto formam uma fossa dorsocaudal (FPP: fossa palatoparaesfenoidal) por onde a quilha do rostro paraesfenóide desliza no momento da abertura das maxilas (Figura 23).
A fossa coanal orienta-se ventrocaudalmente e é circundada pelas cristas ventrais (CV), que se fusionam caudalmente, formando o processo do pterigóide (processum pterygoideus),que conecta o palatino com o pterigóide (PT: Figuras 9 e 10).
Ventralmente observa-se a fossa ventral (fossa ventralis) (FV), limitada pelas crista ventrais (CV) e crista laterais (CL), sendo que estas últimas, nas espécies de Chloroceryle, ao contrário do observado em Megaceryle torquata, são pouco conspícuas, percebendo-se apenas uma tênue linha (Figuras 9 e 10). Esta fossa está relacionada à musculatura do pterigóide (BAUMEL et al., 1993).
Os ângulos caudolaterais (angulus caudolateralis) (ACL), representados pela intersecção entre as margens caudais e laterais das porções laterais, são conspícuos e possuem uma projeção óssea, com orientação caudal em forma de espinho (Figuras 9, 10 e 23).
O processo maxilopalatino (processum maxillopalatinus) (PrM) do maxilar apresenta-se como a principal estrutura para a definição do tipo de palato desmognato (Figuras 9, 10 e 15). Os dois processos unem-se rostroventralmente na linha mediocaudal do rostro maxilar e formam a porção rostral da fossa coanal do palatino, a qual separa caudalmente ambos os processos (Figura 15); caudalmente cada processo possui duas porções separadas e expandidas em forma de asa. Dorsalmente ao processo observa-se o divertículo do sino infra-orbital (DSI), que se apresenta como uma evaginação da cavidade nasal (Figuras 15 e 16). Tal divertículo tem formato ligeiramente triangular, com o vértice ventral (Figura 15).
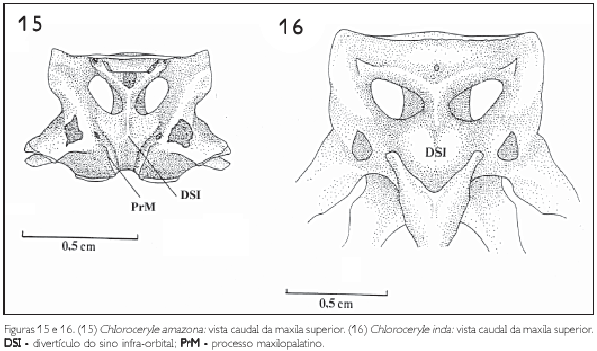
Os pterigóides (PT) são barras delgadas, que se articulam rostralmente com os palatinos através da face articular palatina (facies articularis palatina)e caudalmente com os ossos quadrados através da face articular do quadrado (facies articularis quadratica).
O arco jugal (formado pelo processo jugal do maxilar, jugal e quadradojugal) (J) é uma barra que liga o quadrado ao maxilar. Caudalmente articula-se com o quadrado, através do conspícuo côndilo do quadrado (condylus quadraticus) (Figuras 4-6, 9 e 10). Rostralmente este arco encontra-se com o processo jugal do maxilar (processus jugalis de os maxillare),onde se observa a zona flexória do jugal (zona flexoria arcus jugalis) (ZFJ: Figuras 9 e 10).
O arco jugal, nos Cerylinae e Alcedininae, a partir de sua porção mediana, apresenta uma expansão rostrolateral, formando uma placa achatada dorsoventralmente, cerca de três vezes mais larga do que a porção caudal do jugal (J: Figuras 9 e 10).
A porção rostral do jugal apresenta-se ventralmente côncava e, dorsalmente na margem externa, observa-se o conspícuo tubérculo do lacrimal (tuberculum lacrimale) (TL: Figuras 4 e 5). Exatamente na margem oposta ao tubérculo do lacrimal existe uma pequena incisura. Rostralmente ao tubérculo lacrimal nota-se uma pequena fossa, extremamente acentuada em Megaceryle torquata.
Os quadratum
Três principais processos são distinguíveis no corpo deste osso (corpus ossis quadrati):processo ótico (processum oticum) (PrOQ), processo orbital (processum orbitalis) (PrORQ) e processo mandibular (processum mandibularis) (PrMQ: Figuras 24-27).
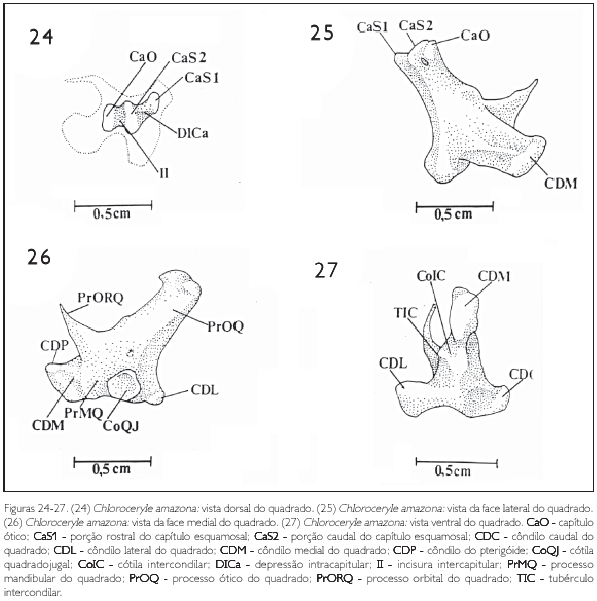
O quadrado articula-se com o crânio através do processo ótico, por meio dos capítulos esquamosal (capitulum squamosum) (CaS) e ótico (capitulum oticum) (CaO: Figuras 24-26). Estes articulam-se respectivamente às cótilas esquamosal (cotylaquadratica squamosi)e ótica (CoO) (cotyla quadratica otici) (CoS: Figuras 7 e 8).
O capítulo esquamosal é o maior entre os dois capítulos e possui uma expansão rostral que se prolonga através da borda do processo ótico do quadrado até sua extremidade rostral. Desta maneira, forma-se uma nova saliência, que se articula com a porção rostral da cótila esquamosal (Figuras 24-26).
A porção rostral do capítulo esquamosal (CaS1) localiza-se na extremidade rostral do processo ótico do quadrado, sendo menos arredondada que a porção caudal. Ela se posiciona rostralmente em relação à porção caudal do capítulo esquamosal (CaS2) e do capítulo ótico (CaO: Figuras 24 e 26), separando-se da porção caudal do capítulo esquamosal por meio de uma conspícua depressão (DICa: depressão intracapitular). Porém, tal depressão não é completa devido ao capítulo esquamosal prolongar-se rostralmente através da face medial do processo ótico do quadrado, resultando na segunda saliência articular do capítulo esquamosal (CaS1: Figuras 24 e 26). Cabe ressaltar que esta conformação poderia ser considerada como duas estruturas distintas e, assim, lhes seriam atribuídos nomes distintos. No entanto, optou-se por descrever uma estrutura única com duas porções.
A porção caudal do capítulo esquamosal (CaS2) é a maior entre as três saliências articulares e localiza-se entre a porção rostral do capítulo esquamosal (CaS1) e capítulo ótico (CaO: Figuras 24 e 26).
O capítulo ótico é menor que o esquamosal, situando-se caudalmente em relação às duas porções deste último capítulo. Separa-se do capítulo adjacente pela incisura intercapitular (incisura intercapitularis) (II: Figuras 24 e 26).
O processo orbital (processum orbitalis) (PrORQ) projeta-se rostralmente na forma de um fino espinho e situa-se na porção rostral do quadrado, entre os côndilos medial (condylus medialis) (CDM) e lateral (condylus lateralis) (CDL: Figuras 25 e 27).
O processo mandibular (processum mandibularis) (PrMQ) é o mais dorsal entre os três e articula-se com a mandíbula através de três côndilos de formatos irregulares: côndilo medial (condylus medialis) (CDM), côndilo lateral (condylus lateralis) (CDL) e côndilo caudal (condylus caudalis) (CDC). O côndilo medial é o mais ventral e os outros dois encontram-se no mesmo plano (Figuras 25 e 27).
O côndilo medial (CDM: Figuras 25-27) é o mais desenvolvido entre os três e apresenta-se ligeiramente arredondado. Além de articular-se com a cótila medial (CoM) da mandíbula, articula-se rostralmente com o pterigóide, através do côndilo do pterigóide (condylus pterygoideus),que se apresenta dorsal em relação ao côndilo medial (Figura 25).
Entre os côndilos medial e lateral nota-se um conspícuo tubérculo intercondilar (TIC: Figura 27); a presença deste processo na parede que separa os côndilos faz com que se formem duas cavidades cotilares. A formação cotilar ventral (CoIC: cótila intercondilar) articula-se com o tubérculo intercotilar da mandíbula (Figura 27).
O côndilo lateral localiza-se na face lateral do processo mandibular do quadrado, onde se observa uma conspícua e profunda cótila quadradojugal (cotyla quadratojugalis) (CoQJ), que recebe a barra jugal (Figura 25). Este côndilo articula-se com a mandíbula através da cótila lateral (CoL) da fossa articular quadrática (fossa articularis quadratica) da mandíbula.
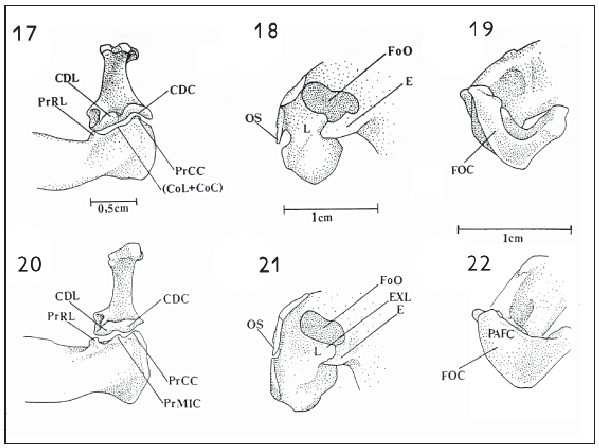
O côndilo caudal (condylus caudalis) (CDC) encontra-se adjacente à porção caudal do côndilo lateral e é o menos desenvolvido entre os três (Figuras 17, 18 e 27), situando-se no mesmo plano do côndilo lateral (Figuras 17, 18 e 27). Em Ceryle rudis e nas espécies de Chloroceryle o côndilo possui natureza cotilar, com a face ventral formando uma superfície ventral côncava, ou seja, cotilar, que se articula com a mandíbula através do processo caudal cotilar da mandíbula de natureza condilar (Figura 17).
Em Megaceryle torquata, M. alcyon e M. lugubris não se observa esta condição. O côndilo caudal realmente possui natureza condilar, articulando-se com a cótila caudal da mandíbula (Figura 18).
Ossa mandibulae
A mandíbula apresenta formato pontiagudo e três partes principais são prontamente discerníveis: porção sinfisial (pars symphysialis) (PSI), porção intermediária (parsintermedia) (PI) e porção caudal (pars caudalis) (PC: Figura 31).
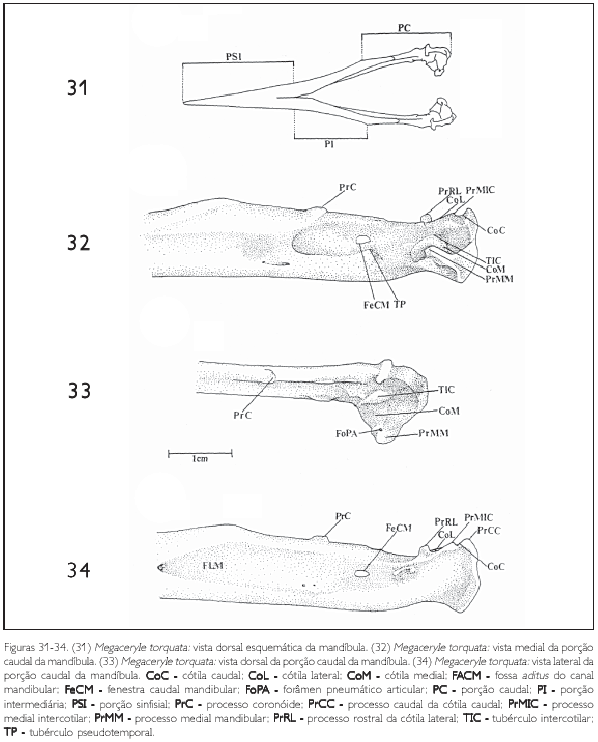
A porção sinfisial (PSI) é a porção mais rostral, com ambos os ramos mandibulares unidos. A partir de sua separação, até o ângulo mandibular (angulus mandibulae) (AM), situa-se a porção intermediária (PI), seguida da porção caudal (PC) (Figura 31).
A porção sinfisial é achatada dorsoventralmente e a sua metade caudal torna-se gradativamente achatada lateralmente. A partir do ângulo mandibular, em direção caudal, é achatada lateralmente em sua totalidade. A extremidade caudal, que se articula com o quadrado, por meio da fossa articular do quadrado, apresenta formato irregular.
A porção caudal limita-se rostralmente pelo ângulo mandibular e caudalmente pela fossa caudal (fossa caudalis) (FOC: Figura 21 e 22). Esta porção exibe maior complexidade estrutural por servir como elo de ligação entre a mandíbula e a caixa craniana, através do quadrado, e sustentar musculatura, aponevroses e tendões relacionados com a movimentação da mandíbula (Figuras 28-30, 31-34).
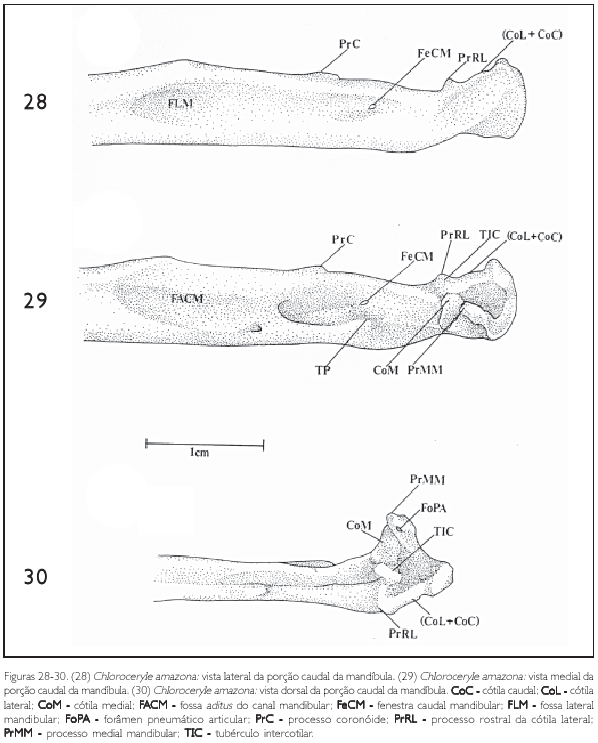
Esta região pode ser dividida em porção rostral e caudal. A primeira estende-se do ângulo mandibular até a porção rostral da fossa articular do quadrado, enquanto a porção caudal é a própria fossa articular do quadrado (Figuras 29, 30, 31 e 33).
A porção rostral apresenta fossas em ambas as faces (lateral e medial): fossa aditus do canal mandibular (fossa aditus canalis mandibulae) (FACM) e fossa lateral mandibular (fossa lateralis mandibulae) (FLM: Figuras 28, 29, 32 e 34).
Na face medial nota-se a fossa aditus do canal mandibular, que é longa e se estende desde o ângulo caudomedial até a porção rostral da fossa articular do quadrado. Observam-se duas fenestras: fenestra rostral mandibular (fenestra rostralis mandibulae) (não representada) e fenestra caudal mandibular (fenestra caudalis mandibulae) (FeCM: Figuras 28, 29, 32 e 34).
A fenestra caudal mandibular (FeCM) situa-se entre o processo coronóide (processum coronoideus) (PrC) e o tubérculo pseudotemporal (tuberculum pseudotemporale) (TP: Figuras 28, 29, 32 e 34).
Na face dorsal da extremidade rostral da porção caudal observa-se o conspícuo processo coronóide (PrC), que se situa entre o ângulo caudomedial e a porção caudal da fossa articular do quadrado (Figuras 28, 29, 32-34).
Na porção medioventral da fossa aditus do canal mandibular, e exatamente abaixo da fenestra caudal mandibular, observa-se o conspícuo tubérculo pseudotemporal (TP: Figuras 29, 32 e 33).
A fossa articular do quadrado recebe os côndilos do quadrado através das cótilas da fossa articular do quadrado (cotylae fossae articularis).
As cótilas medial, lateral e caudal (cotyla medialis, cotyla lateralis e cotyla caudalis) (CoM, CoL, e CoC) recebem, respectivamente, os côndilos medial, lateral e caudal do quadrado.
As cótilas lateral (CoL) e caudal (CoC) encontram-se na face lateral da fossa articular do quadrado (Figuras 28-30, 32-34). Orientam-se rostrocaudalmente e são adjacentes, ocupando o mesmo plano, ao contrário da cótila medial, em forma de meia-lua, que não se posiciona no mesmo plano que as outras, situando-se dorsalmente a ambas (Figuras 28-30, 32-34).
A cótila lateral limita-se rostralmente por um pequeno processo (processo rostral da cótila lateral) (PrRL: Figuras 17, 18, 28-30, 32 e 34). Em Megaceryle torquata, M. alcyon e M. lugubris esta cótila limita-se caudalmente por um pequeno processo (PrMIC: processo medial intercotilar), que também marca o início da cótila caudal (Figuras 18, 32 e 34), que, por sua vez, se limita caudalmente por outro pequeno processo (processo caudal da cótila caudal) (PrCC: Figuras 17, 18 e 34).
O processo medial intercotilar é ausente em Ceryle rudis e nas espécies de Chloroceryle. Esta condição faz com que, em Ceryle rudis e em Chloroceryle, ambas as cótilas (lateral e caudal) confundam seus limites, aparentando existir apenas uma grande e única cótila (Figuras 17, 28-30). No entanto, Megaceryle torquata, M. alcyon e M. lugubris possuem as duas cótilas bem definidas (Figuras 18, 32-34).
Em Ceryle rudis e nas espécies de Chloroceryle, o processo caudal da cótila caudal (PrCC) assume papel importante na articulação quadrado mandibular devido à ausência do processo medial intercotilar. Tal ausência faz com que a articulação entre as cótilas mandibulares (exetuando a medial) e os côndilos do quadrado (exetuando o medial) apresentem-se totalmente distintas nos gêneros em questão (Figuras 17 e 18).
Em Megaceryle torquata, M. alcyon e M. lugubris nota-se a articulação entre as duas cótilas mandibulares e os dois côndilos do quadrado (excetuando a cótila e o côndilo medial) (Figura 18). No entanto, as espécies de Chloroceryle apresentam uma condição contrária, no que se refere à cótila e ao côndilo caudal. Esta articulação ocorre na forma de uma saliência condilar na mandíbula e uma cavidade cotilar do quadrado (Figura 17), o que se deve à ausência do processo medial intercotilar, formando, aparentemente, uma única grande cótila (cótila lateral mais a caudal) e, principalmente, pela condição do côndilo caudal do quadrado, que forma uma aba côncava (portanto, de natureza cotilar), que recobre e articula-se com o processo caudal da cótila caudal (portanto, de natureza condilar) (Figuras 17 e 18).
A porção caudal da fossa articular do quadrado tem formato de V e nela observa-se a fossa caudal (fossa caudalis) (FOC: Figuras 21 e 22), que está relacionada ao músculo depressor mandibular. Nas espécies de Chloroceryle e Ceryle rudis esta fossa é rasa e estreita. No entanto, Megaceryle torquata, M. alcyon e M. lugubris possuem a fossa mais ampla, devido à formação de uma parede dorsal (PaFC: parede dorsal da fossa caudal), que praticamente fecha a porção caudal do ramo mandibular, descaracterizando o formato de V supracitado, para assumir uma conformação triangular com o vértice situado ventralmente (Figura 22).
O processo medial mandibular (processum medialis mandibulae) (PrMM) é conspícuo e mostra-se orientado dorsalmente (Figuras 29, 30, 32 e 33). Na sua face medial encontra-se o forâmen pneumático articular (foramen pneumaticum articularis) (FoPA: Figuras 30 e 33).
A cótila medial (CoM) é a mais desenvolvida entre as três cótilas, tem forma de meia-lua e orienta-se perpendicularmente ao eixo rostrocaudal do crânio (Figuras 29, 30, 32 e 33). Esta cótila, na sua face medial, limita-se com o processo medial mandibular (PrMM) e na sua face lateral apresenta o tubérculo intercotilar (TIC: Figuras 29, 30, 32 e 33), que se articula com a cótila intercondilar (CoIC: Figura 27) do quadrado.
DISCUSSÃO
Dois ossos foram suprimidos da descrição e das correspondentes figuras: o esquamosal e o parietal. O esquamosal não foi citado nominalmente porque suas principais estruturas estão descritas e representadas (processo zigomático, processo suprameático e cótila do esquamosal).
O parietal, no entanto, não possui um conjunto de estruturas características, sendo a crista nucal transversa a única estrutura listada para este osso (BAUMEL et al, 1993). Porém, devido ao grande desenvolvimento da fossa temporal e a localização da crista nucal transversa, é plausível supor que o parietal também contribua para a supracitada fossa.
Barnikol (1952, ap, Burton 1984) descreve o crânio do tipo streckschädel, com o forâmen magno situado ventralmente no crânio, os pterigóides longos e repousando no mesmo plano dos palatinos e rostro paraesfenoidal. Este autor acredita que tal conformação de crânio seria uma forma arcaica, relacionada à piscivoria. Nos martins-pescadores analisados esta condição encontra-se bastante evidente e Burton (1984) afirma que nos martins-pescadores piscívoros (Cerylinae e Alcedininae) esta condição é mais marcada do que nos martins-pescadores florestais (Daceloninae),
As narinas são tipicamente do tipo holorrino (GARROD, 1873), que, juntamente com uma zona flexória craniofacial bem desenvolvida e a presença do hiato craniofacial (hiatus craniofacialis septi),proporcionam um eficiente movimento de procinese. A condição holorrina, geralmente, está associada ao procinetismo das aves (BOCK, 1964; ZUSI, 1984). O hiato craniofacial é importante para o cinetismo craniano e está presente em todas as aves modernas procinéticas, como também em muitas neognatas rincocinéticas (BÜHLER, 1985).
Huxley (1867), ao classificar os tipos de palato, define os desmognatos como apresentando fusão medial dos processos maxilopalatinos, totalmente em concordância com este trabalho. A condição de palato desmognato parece ter surgido independentemente em diferentes grupos de aves, já que vários grupos não estreitamente relacionados (Ardeidae, Anatidae, Alcedinidae) possuem a mesma condição de palato. O processo maxilopalatino, segundo Baumel et al. (1993), apresenta considerável variação em decorrência da sua associação com o divertículo maxilar do sino infra-orbital.
O mesetimóide não está associado ao septo nasal, formando o hiato craniofacial. Nas aves paleognatas, ao contrário do observado aqui, o septo nasal continua-se com o mesetimóide (BAUMEL et al., 1993).
Cracraft (1968) analisou o complexo lacrimal-ectetmóide em diversas famílias de aves e dividiu o lacrimal em três partes: cabeça do lacrimal, processo descendente do lacrimal e pé do lacrimal. Segundo Cracraft, Alcedinidae, Todidae, Coraciidae, Brachypteraciidae e Bucerotidae compartilham o mesmo padrão do complexo lacrimal-ectetmóide, com o lacrimal bem desenvolvido em contato com a zona flexória craniofacial e o ectetmóide delgado com forma de 'espora'. Também descreve, sem maiores detalhes, um lacrimal com um entalhe medial para receber o ectetmóide e a ocorrência ocasional de ossos sesamóides na sua parede lateral.
Nos Alcedinidae, como na maioria das aves, o lacrimal articula-se com os ossos frontal e nasal através de suturas que permitem movimentação do complexo lacrimal-ectetmóide em relação à maxila superior, o que auxilia na procinese (ZUSI, 1962; CRACRAFT, 1968; BÜHLER, 1985). O lacrimal pode articular-se somente com o frontal (Psittacidae), apenas com o nasal (Treskiornithidae) (Cracraft 1968) ou, ainda, fusionar-se ao ectetmóide (Ramphastidae), delimitando rostralmente a órbita (HÖFLING; GASC, 1984; HÖFLING, 1995).
Nos Galbulidae, Donatelli (1992) verificou que o lacrimal articula-se ao frontal e ao nasal, enquanto nos Picidae (DONATELLI, 1996) encontra-se fusionado ao frontal e à maxila superior.
Em Cracidae, exceto em Mitu tuberosa, o nasal e o frontal encontram-se fundidos, "formando uma única sutura nasofrontolacrimal" (MARCELIANO, 1996). Ophistocomus hoazin, Tauraco hartlaubi, Tauraco erythrolophus e Tauraco leucotis apresentam as suturas nasolacrimal e frontolacrimal, como também os cuculídeos Coccyzus americanus, Coccyzus melacoryphus, Piaya cayana, Crotophaga ani e Guira guira.
As únicas variações observadas na forma dos processos supra-orbital e orbital dos martins-pescadores foi a presença de uma apófise na porção caudal da face articular frontonasal em Dacelo novaguineae e a presença da expansão dorsal do processo orbital recobrindo o ectetmóide nos Megaceryle. Uma apófise no lacrimal é reportada por Höfling (1995) para a maioria dos Ramphastidae e Capitonidae da região Neotropical. Na porção rostral do processo orbital do lacrimal, a expansão globular confere um aspecto bulboso, tal qual como reportado por Gennip (1986) para Strigidae e Tytonidae.
Miller (1912) aponta diferenças quanto ao local de contato do ectetmóide e o processo orbital do lacrimal. Segundo este autor, em Cerylinae, isto ocorre próximo ao limite dorsal do processo orbital do lacrimal; em Alcedininae, na porção mediana; e em Daceloninae, o contato ocorre ventral à porção mediana. Este autor também aponta diferenças entre Megaceryle e Chloroceryle, com o ectetmóide formando a porção ventral de uma grande vacuidade em Megaceryle e uma pequena vacuidade em Chloroceryle. O ectetmóide nos martins-pescadores apresenta formato de espinho e é totalmente independente do lacrimal, não apresentando problemas quanto à sua individualização, como observado em outros grupos de aves (Ramphastidae). Cabe ressaltar que em Picidae o ectetmóide ancora-se na barra jugal e em Galbulidae e Bucconidae observa-se uma delgada barra óssea com origem dorsomedial no lacrimal, que se funde à barra jugal (DONATELLI, 1992, 1996; HÖFLING, 1995; LADEIRA, 1997).
O ossículo sesamóide do lacrimal é bastante frágil, podendo ser facilmente perdido durante a preparação. Este ossículo não foi observado em alguns Alcedinidae, porém, isto deve ser, provavelmente, decorrente de sua fragilidade. Cracraft (1968), sem maiores detalhes, reporta ossos sesamóides na parede lateral do lacrimal em Alcedinidae.
No processo maxilar do palatino observa-se uma conspícua zona de flexão denominada zona flexória palatina, que é bem marcada nos martins-pescadores e, junto com a zona flexória do arco jugal e zona flexória craniofacial, devem exercer papel importante na procinese relacionada à dieta piscívora.
O arco jugal, na sua porção rostral, possui uma grande expansão rostrolateral, que faz com que a barra duplique-se em largura. Esta expansão é observada em todos os Cerylinae e Alcedininae, mas não nos Daceloninae; segundo Miller (1912), esta estrutura está relacionada à piscivoria e provavelmente estaria presente em Ceryle rudis, o que foi confirmado no presente trabalho.
A zona flexória do arco jugal é bem marcada e conseqüentemente também apresenta-se expandida lateralmente, o que aumenta consideravelmente a área de flexão do arco jugal. Levando em consideração que o bico dos martins-pescadores está sujeito a uma grande pressão, quando ele mergulha na água, a partir de um poleiro alto, parece plausível supor que esta condição seja uma adaptação para este tipo de piscivoria. Esta hipótese tem a favor o fato dos Daceloninae, de hábitos florestais, não apresentarem nenhuma expansão no jugal, enquanto os piscívoros Cerylinae e Alcedininae possuem tal expansão.
A região temporal nas aves está relacionada com o conjunto de impressões (impressio)e fossas decorrentes da origem do músculo adutor mandibular externo e seus distintos feixes (ZUSI; LIVEZEY 2000). Nos martins-pescadores analisados, com exceção dos Daceloninae, a região temporal apresenta duas fossas bem delimitadas: fossa rostral do MAE e a fossa temporal. No entanto, só a fossa temporal é observada em todas as famílias examinadas de Coraciiformes, como exemplificado por Momotus momota (Figura 6). Este padrão de região temporal é bastante comum em aves (Ramphastidae, Bucconidae, Galbulidae), com o processo pós-orbital longo e confluente ventralmente com a crista temporal, formando o limite rostral da fossa temporal. Interpreta-se que este padrão de região temporal (Cerylinae e Alcedininae) deve-se à presença de um feixe adicional do músculo adutor mandibular externo (feixe pós-orbital) (BURTON, 1984), que devido ao seu grande desenvolvimento forma uma fossa como local de origem.
A fossa rostral do MAE aloja um feixe do músculo adutor mandibular externo rostral. Este padrão de região temporal poderia ser questionado quanto à inclusão ou não da fossa rostral do MAE na região temporal, mas a origem deste feixe muscular justifica a sua inclusão. Mais ainda, observou-se por meio de dissecção de material fixado que o feixe que se origina na fossa rostral do MAE percorre a região do laterosfenóide e insere-se por meio de aponevrose àquela do feixe principal. Por sua vez, esta aponevrose (aponevrose 1) (BURTON, 1984) insere-se por um tendão achatado no processo coronóide da mandíbula.
Os Daceloninae, em vista lateral, apresentam uma região temporal com uma única fossa (fossa temporal), cujo processo pós-orbital é relativamente longo e confluente ventralmente com a crista temporal. No entanto, na parede caudal da órbita nota-se uma conspícua fossa associada à área muscular áspera, com o processo ventral do laterosfenóide extremamente pronunciado em forma de espinho. Esta fossa pode ser homóloga à fossa rostral do MAE.
Os martins-pescadores possuem um processo pós-orbital extremamente curto, ao contrário do observado em Galbulidae, Bucconidae, Coraciidae e Leptosomidae, entre outros. O processo pós-orbital é o local de origem do ligamento pós-orbital e, segundo Zusi (1967), este ligamento surgiu no início da evolução das aves modernas, relacionado à coordenação do movimento da mandíbula. Este ligamento está ausente nos Alcedininae e presente nos Daceloninae e Cerylinae (BURTON, 1984).
Um padrão muito semelhante de fossa temporal é encontrado em Merops apiaster. Nesta espécie a região temporal apresenta uma única fossa (fossa temporal), extremamente semelhante à fossa temporal dos martins-pescadores, por ser bastante profunda e circundar o crânio no mesmo sentido daquela dos Alcedinidae. Esta conformação de fossa temporal concorda com a hipótese de Maurer e Raikow (1984), de que a família Meropidae seria grupo-irmão de Alcedinidae.
Shufeldt (1884) não cita a região temporal com duas fossas. No entanto, cita a fossa rostral do MAE, como "parede do alisfenóide" e uma bem desenvolvida fossa temporal, dividida medianamente por uma conspícua linha (crista nucal sagital).
Verheyen (1955) cita fossas temporais longas e profundas para os Alcedinidae e também um processo pós-orbital "bicéfalo", consistindo em dois "lobos vestigiais" separados por um "encurvamento" da borda da órbita.
Jollie (1957) cita sete centros de ossificação para o osso paraesfenóide, constituindo uma estrutura merecedora de estudos ontogenéticos, para verificar se este número varia em diferentes grupos de aves.
Ao analisar um exemplar previamente imerso em água, verifica-se que a quilha do paraesfenóide desliza sobre a fossa palatoparaesfenoidal do palatino. A quilha do paraesfenóide é discutida quanto ao seu aspecto funcional por Burton (1978), que acredita ter surgido independentemente em várias linhagens de Alcedinidae, principalmente nos piscívoros mais especializados.
O processo lateral do paraesfenóide, bastante pronunciado nos Alcedinidae, articula-se com o processo medial da mandíbula, provavelmente com a finalidade de prevenir a desarticulação entre a caixa craniana e a mandíbula (BOCK, 1960). Este termo é sinônimo de processo lateral basitemporal, proposto por Bock (1960), funcionando como uma segunda articulação entre o crânio e a mandíbula, ao formar uma articulação entre esta última e o paraesfenóide (articulatio mandibulosphenoidalis). É relevante citar que pela extensão do processo lateral do paraesfenóide, é possível que este receba contribuições de ossos adjacentes, tais como o processo paroccipital e a crista da fossa parabasal do exoccipital, e não somente da lâmina do paraesfenóide, sendo importante a análise de indivíduos jovens suturados para corrobar tais assertivas. Höfling e Gasc (1984) não observaram esta estrutura nos Ramphastidae.
Walker (1888) analisa a forma do quadrado em várias famílias de aves e, basicamente, aponta para Alcedinidae as mesmas divisões observadas neste trabalho. O quadrado mostra-se pouco significativo em termos de padrão filogenético, devido ao fato de grupos não estreitamente aparentados apresentarem o mesmo padrão de quadrado, como Ramphastos e Upupa ou Alcedo e Psittacinae.
O capítulo esquamosal é o mais desenvolvido e pode ser divido em duas porções: rostral e caudal. Esta divisão parece ser válida, não somente pela grande extensão do capítulo, mas também pela efetiva formação de uma segunda saliência articular na porção rostral do capítulo esquamosal. Optou-se por não nomear um novo capítulo (porção rostral do capítulo esquamosal) devido à porção rostral do processo ótico do quadrado sofrer um estrangulamento no seu bordo lateral, porém, sem se interromper e continuar-se através da face medial do capítulo esquamosal, formando na sua porção rostral uma nova saliência articular. Cabe ressaltar que, ao analisar as cótilas, verifica-se a diferenciação de uma cavidade articular adicional (porção rostral da cótila esquamosal) para receber a porção rostral do capítulo esquamosal. Esta situação pode incentivar a reconhecer três capítulos e cótilas distintas. No entanto, antes de um estudo ontogenético, prefere-se individualizar somente duas estruturas distintas.
Uma hipótese para a formação do capítulo esquamosal dividido em duas porções consiste em supor que este capítulo sofreu uma expansão rostral através da face medial do processo ótico do quadrado, formando rostralmente a terceira saliência articular. Walker (1888) cita para os martins-pescadores um capítulo externo (=esquamosal) escavado externamente, sem mencionar qualquer saliência articular adicional. Esta descrição sugere que a condição do capítulo esquamosal é derivada de um capítulo (grande) que sofreu uma escavação no seu bordo lateral, formando a terceira saliência articular rostral, e não decorrente de uma expansão rostral por parte do mesmo.
Walker (1888) divide a face de articulação do quadrado com a mandíbula em duas partes principais: superfície articular anterior e superfície articular posterior, esta última ainda dividida em anterior e posterior. Dorsalmente à porção caudal do côndilo medial, na parede que separa este côndilo do lateral, observa-se uma pequena proeminência denominada tubérculo intercondilar. Esta estrutura foi descrita para os Alcedinidae como "tróclea acessória". A presença deste tubérculo forma uma cavidade entre os côndilos medial e lateral, que se articula com o tubérculo intercotilar da mandíbula.
Os côndilos lateral e caudal são adjacentes e encontram-se no mesmo plano. Chloroceryle, Alcedo atthis e Ceyx erithacus apresentam o côndilo lateral em forma de aba, formando uma superfície cotilar ventral que se articula com o processo caudal da cótila caudal. No entanto, Megaceryle torquata, M. alcyon, M. lugubris e os Daceloninae possuem a condição padrão para aves, com os dois côndilos realmente de natureza condilar (Figura 18).
A parte sinfisial da mandíbula corresponde a aproximadamente 50% do comprimento total da mandíbula. Em Ramphastidae esta parte é extremamente menor do que os ramos separados (HÖFLING, 1995) e em Galbulidae apresenta-se maior (DONATELLI, 1992).
A região de articulação com o quadrado é a mais heterogênea morfologicamente. A cótila medial é a mais desenvolvida entre as três cótilas mandibulares e apresenta lateralmente o tubérculo intercotilar, que se articula com a cavidade intercondilar do quadrado. Esta mesma estrutura é descrita por Höfling (1995) para Capitonidae, com o tubérculo articulando-se com a face lateral do côndilo medial do quadrado.
Em algumas aves as cótilas lateral e caudal emergem em uma única superfície articular (Larus, Chloroceryle, Alcedo) e em outras aparecem duas superfícies articulares distintas (Ardea, Morus, Sula, Megaceryle, Dacelo) (BAUMEL et al., 1993).
Os martins-pescadores possuem ambas condições. No entanto, independentemente da condição encontrada, a cótila lateral limita-se rostralmente pelo processo rostral da cótila lateral e a cótila caudal limita-se pelo processo caudal da cótila caudal. Chloroceryle, Alcedo atthis e Ceyx erithacus possuem uma única cótila que recebe o côndilo lateral do quadrado, enquanto o côndilo caudal apresenta formato de aba e cobre o processo caudal da cótila caudal. Cabe ressaltar que nesta última articulação forma-se uma condição contrária ao esperado, já que há ligação entre uma superfície cotilar do quadrado e uma superfície condilar na mandíbula, sendo o padrão geral exatamente contrário.
Megaceryle torquata, M. alcyon, M. lugubris e os Daceloninae possuem as duas cótilas (lateral e caudal) distintas, devido à presença do processo medial intercotilar, que as separa medianamente. A articulação entre a mandíbula e o quadrado segue o padrão normal, com superfícies condilares por parte do quadrado e superfícies cotilares por parte da mandíbula.
O processo medial mandibular é bastante desenvolvido em todas as espécies e articula-se com o processo medial do paraesfenóide. Esta articulação (mandibuloesfenoidal) foi descrita originalmente por Bock (1960) e estaria relacionada à prevenção da desarticulação do crânio com a mandíbula.
A fossa caudal esta relacionada à inserção do músculo depressor mandibular (BAUMEL et al., 1993) e mostra significativa variação nas espécies analisadas. Ela é estreita em Chloroceryle, Ceryle rudis, Alcedo atthis e Ceyx erithacus, enquanto em Megaceryle torquata, M. alcyon, M. lugubris e nos Daceloninae ocorre uma ampla parede dorsal associada a esta fossa, tal qual como observado nos Galbulidae por Donatelli (1992).
CONCLUSÕES
Os resultados contidos no presente trabalho fornecem informações da osteologia craniana dos martins-pescadores neotropicais e pretendem somar-se a outros trabalhos na mesma linha de pesquisa (HÖFLING; GASC, 1984; HÖFLDNG, 1995; DONATELLI, 1992, 1996, 1997; MARCELIANO, 1996; LADEIRA, 1997), que tratam de grupos possivelmente aparentados (Piciformes e Passeriformes). Dois principais aspectos podem surgir futuramente com a somatória e sistematização destes trabalhos: análises funcionais comparativas e subsídios morfológicos para uma análise filogenética dos grupos em questão.
As estruturas ósseas analisadas apresentam-se bastante homogêneas nos seus limites intragenéricos. No entanto, a osteologia craniana revelou-se bastante eficiente para separar os gêneros de Cerylinae. Todos os caracteres que separam os dois gêneros não apresentam variação significativa para poder estabelecer algum tipo de relação entre as espécies de Chloroceryle. Estas estruturas, nas espécies de Chloroceryle, variaram no tamanho, decorrente da grande disparidaridade de tamanho entre seus membros, porém não se detecta variação efetiva na forma.
Quatro caracteres consistentes separam os gêneros em questão: expansão dorsal do lacrimal sobre o ectetmóide, ausente em Chloroceryle (danificado em Ceryle rudis)e presente em Megaceryle torquata; côndilo caudal do quadrado, cotilar em Chloroceryle e Ceryle rudis e condilar em Megaceryle torquata; cótilas lateral e caudal da mandíbula, indistintas em Chloroceryle e Ceryle rudis e distintas em Megaceryle torquata; fossa caudal da mandíbula, parede dorsal ausente em Chloroceryle e Ceryle rudis e presente em Megaceryle torquata.
Com base nestes caracteres é possível afirmar que os gêneros Chloroceryle e Ceryle são mais semelhantes entre si do que com Megaceryle. Entretanto, estes dados são inconclusivos para tentar estabelecer as relações filogenéticas entre os gêneros, assim como para validar ou invalidar o gênero Ceryle. Para tais finalidades, há a necessidade de analisar um número mais representativo de Alcedinidae, tal qual de outros Coraciiformes e, também, se possível, fazer uma análise ontogenética para elucidar possíveis homoplasias.
AGRADECIMENTOS
Ao Dr. Herculano M. F. Alvarenga (MHNT), que gentilmente forneceu material e sempre esteve atento a sanar dúvidas referentes à ornitologia. A Sérgio Posso, pelas valiosas sugestões. A France M. Pereira, pelas ilustrações deste trabalho. A Alexandre Aleixo, que se empenhou para a obtenção de material. Ao Dr. J. V. Remsen (LSUMNS), ao Dr. S. Olson (USMN) e à Dra. Maria Luiza Videira Marceliano (MPEG), pelo empréstimo do material. À Coordenação de Aperfeicoamento de Pessoal de Nível Superior (CAPES), pela bolsa de mestrado de A. C. M., e ao Conselho Nacional de Pesquisas (CNPq), pela bolsa de Produtividade em Pesquisa de E. H.
REFERÊCIAS
ALVARENGA, H. Coleções osteológicas: perspectivas para a ornitologia no Brasil. Bol. Mus. Para. Emilio Goeldi. Belém, v.8, n.1, p. 247-257, 1992.
BAUMEL, J. J.; KING, A. S.; BREAZILE, J. E.; EVANS, H. E.; BERGE, J. C. van den. (Eds.) Handbook of avian anatomy: nomina anatomica avium. 2. ed. Cambridge: Nuttall Ornithological Club, 1993. 779 p.
BOCK, W. J. Secondary articulation of avian mandible. Auk, Washington, v.77, n.1, p.19-55, 1960.
BOCK, W. J. Kinetics of the avian skull. J. Morphol., Philadelphia, v.114, n.1, p.1-52, 1964.
BÜHLER, P. 1985. Functional anatomy of the avian jaw apparatus. In: KING, A. S.; Mclelland, J. (eds). Form and function in birds. London: Academic Press., 1985. v.2. p. 439-465.
BURTON, P. J. K. The basisphenoid notch of kingfishers. Bull. Brit. Orn. Cl., London, v.98, n.2, p. 68-74, 1978.
BURTON, P. J. K. Anatomy and evolution of the feeding apparatus in avian orders Coraciiformes and Piciformes. Bull. Brit. Mus. Nat. Hist. Zool. London, n.47, p.331-443, 1984.
CRACRAFT, J. The lacrimal-ecthetmoid bone complex in birds: a single character analysis. Am. Midl. Nat. New York, v.80, n.2, p.31 6-59, 1968.
DONATELLI, R. L. Cranial osteology and myology of the jaw apparatus in the Galbulidae (Aves, Piciformes). Arq. Zool., São Paulo, v.33, n.1, p.1-32, 1992.
DONATELLI, R. L. The jaw apparatus of the Neotopical and Afrotropical woodpeckers (Aves, Piciformes). Arq. Zool., São Paulo, v.33, n.1, p.1-70, 1996.
DONATELLI, R. L. Osteologia e miologia cranianas de Dendrocolaptidae (Passeriformes, Tyranni) 1. Gêneros Glyphorhyncus, Dendrocincla, Xiphorhynchus e Dendrocolaptes. Ararajuba, Rio de Janeiro, v.5, n.1, p. 19-37, 1997.
FRY, C, H.; FRY, K.; HARRIS, A. Kingfishers, bee-eaters& rollers. New Jersey: Princeton Univ. Press, 1992. 324p.
GARROD, A. H. On the value in classification of a peculiarity in the anterior margin of the nasal bones of certain birds. Proc. Zool. Soc. London, London, v.30, n. 3, p.33-38, 1 873.
GENNIP, E. M. S. J. van. The osteology, arthrology and myology of the jaw apparatus of the Pigeon (Columba livia L). Neth. J. Zool., Wageningen, v.36, n.1, p.1-46, 1986.
HÖFLING, E.; GASC, J. P Biomécanique du crâne et du bec chez Ramphastos (Aves, Ramphastidae). 1 Description des éléments anatomiques. Gegenbaurs Morphol. Jahrb., Leipzig, v.130, n..1, p.125-147, 1984.
HÖFLING, E. Anatomia do crânio e da cintura escapular dos Ramphastidae (Aves: Piciformes) e de alguns grupos próximos, com implicações sistemáticas. Tese (Livre-Docência). Universidade de São Paulo, 1995.
HOWARD, R.; MOORE, A. A complete checklist of the birds of the world. 2. ed. London: Academic Press, 1994. 630 p.
HUXLEY, T. H. On the classification of birds, and on the taxonomy values of the modification of certain of the cranial bones observable in that class. Proc. Zool. Soc. Lond., London, n.27, p.415- 472, 1867.
JOLLIE, M. The head skeleton of the chicken and remarks on the anatomy of this region in other birds. J. Morphol., Philadelphia, v.100, n.4, p.389-436, 1957.
LADEIRA, L. M. C. E. B. Osteologia craniana de Bucconidae (Aves: Piciformes). Dissertação (Mestrado). Universidade de São Paulo,.1997.
MARCELIANO, M. L. V. Estudo osteológico e miológico de Ophistocomus hoazin (Müller, 1776) (Aves: Ophistocomidae) comparado com algumas espécies de Cracidae, Musophagidae e Cuculidae. Bol. Mus. Para. Emílio Goeldi. série Zool., Belém, v.12, n.2, p.95-246, 1996.
MAURER, R. D.; RAIKOW R. J. Appendicular myology, phylogeny, and classification of the avian order Coraciiformes (including Trogoniformes). Ann. Carnegie Mus. Pittsburg, v.50, n.18, p.417-34, 1981.
MILLER, W. DeW. A revision of the classification of the kingfishers. Bull. Amer. Mus. Nat. Hist., New York, v.22, n.31 p.239-311, 1912.
POSSO, S. R. Osteologia craniana dos Cuculiformes do Novo Mundo (Aves) com implicações sistemáticas. Dissertação (Mestrado). Universidade Estadual Júlio de Mesquita Filho,1999
SCHAUNSEE, R. M. Meyer de. A guide to the birds of South America. [S. l.]: Intercollegiate Press, 1982. 498 p.
SHUFELDT, R. W. Osteology of Ceryle alcyon. J. Anat. Physiol., London, n.18, p. 279-94, 1884.
SIBLEY, C. G.; AHLQUIST, J. E. Phylogeny and classification of birds. New Haven: Yale Univ. Press, 1990. 1111 p.
SICK, H. Ornitologia brasileira. Rio de Janeiro: Nova Fronteira, 1997. 862 p.
STRESEMANN, V.; STRESEMANN, E. Die handschwingen-mauser der eisvögel (Alcedinidae). J. Ornithol., Leipzig, v.102 , n.4, p.439- 55, 1961.
VERHEYEN, R. Analyse du potentiel morphologique et considérations sur la systématique des Coraciiformes (Wetmore, 1934). Bull. Inst. R. Sci. Natur. Belg., Bruxelles, v. 31, n. 92, p. 1-16, 119, 1-16, 1955.
WALKER, M. On the form of the quadrate bone in birds. Zool. Univ. Coll. Dundee. p.1-8, 1 888.
ZUSI, R. L. Structural adaptation of the head and neck in the black-skimmer Rhyncops nigra. Cambridge: Nuttall Ornithological Club, 1962. 101p. (Publication n. 3).
ZUSI, R. L. The role of the depressor mandibulae muscle in kinesis of the avian skull. Proc. U. S. Nat. Mus., Washington, v.123, n.3607, p.1-28, 1967.
ZUSI, R. L. A functional and evolutionary analysis of rhynchokinesis in birds. Smithson. Contrib. Zool., Washington, n.395, p.1- 40, 1984.
ZUSI, R. L.; LIVEZEY, B. C. Homology and phylogenetic implications of some enigmatic cranial features in Galliform ans Anseriform birds. Ann. Carnegie Mus., Pittsburg, v.69, n.3, p.157-193, 2000.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail:boletim@museu-goeldi.br
Recebido: 25/02/2000
Aprovado: 17/01/2002
Apêndice. Material examinado
Coraciidae (n=1): Eurystomus orientalis (MHNT: 133); Bucerotidae (n = 2): Aceros undulatus (MHNT: 138), Tockus erythrorhyncus (MHNT: 137); Upupidae (n = 1): Upupa epops (MHNT: 135); Todidae (n = 1): Todus subulatus (MHNT: 129); Momotidae (n = 2): Baryphthengus ruficapillus(MHNT: 1429), Momotus momota (AZ: 65); Meropidae (n=1): Merops apiaster (MHNT: 131); Alcedinidae (n = 33); Daceloninae (n = 7): Halcyon cyanoventris (LSUMNS: 1 31 369), Halcyon sancta (LSUMNS: 105061), Halcyon funebris (USNM: 557210), Halcyon cinnamomina (LSUMNS: 87038), Dacelo novaeguineae (n = 2) (LSUMNS: 154937; MHNT: 126), Tanysipteragalatea (USNM: 557213); Alcedininae (n = 2):Alcedo atthis (MHNT: 128), Ceyx erithacus (USNM: 559832); Cerylinae (n=25): Megaceryle torquata (n = 4) (MHNT: 127, 378, 1500; MPEG: 1047), Megaceryle alcyon (LSUMNS: 139939), Megaceryle lugubris guttulata (USNM: 318238), Ceryle rudis leucomelanura (USNM: 343520), Chloroceryle amazona (n=4) (MHNT: 306, s.no, 701; AZ: 66), Chloroceryle americana (n=6) (MHNT: 611, 628, 767; AZ: 62, 63, 511); Chloroceryle inda (n=4) (MHNT: 1371; AZ: 61, 64; MPEG 881),Chloroceryle aenea (n=4) (MHNT: 609, 1416; MPEG: 2773, 3742); Trogonidae (n=1) Trogon melanurus (MHNT:410); Cuculidae (n=1)Coccyzus americanus (AZ: 55).













