Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.4 n.1 Belém abr. 2009
Análise estrutural de dois bosques de mangue do rio Cajutuba, município de Marapanim, Pará, Brasil
Structural analysis of two mangrove stands, Cajutuba river, municipality of Marapanim, Pará, Brazil
João Braullio de Luna SalesI; Ulf MehligII; Josinaldo Reis NascimentoIII; Luis Fernando Rodrigues FilhoIV; Moirah Paula Machado de MenezesV
IUniversidade Federal do Pará. Instituto de Estudos Costeiros. Bragança, Pará, Brasil (jbraullio@yahoo.com.br)
IIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Bragança, Pará, Brasil (ulf.mehlig@gmx.net)
IIIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Bragança, Pará, Brasil (josinaldoreis@yahoo.com.br)
IVUniversidade Federal do Pará. Instituto de Estudos Costeiros. Bragança, Pará, Brasil (lfsrf@yahoo.com.br)
VUniversidade Federal do Pará. Instituto de Estudos Costeiros. Bragança, Pará, Brasil (moirah@ufpa.br)
RESUMO
O presente estudo descreve a estrutura dos bosques de mangue do rio Cajutuba, no município de Marapanim, estado do Pará, Brasil. Para o estudo estrutural do bosque, foi utilizado o método do quadrante centrado (PCQM), para o qual foram demarcadas duas transecções em dois diferentes sítios (C1 e C2). A salinidade da água intersticial foi medida apenas pontualmente em uma única coleta. Foram observadas três espécies típicas de mangue (Rhizophora mangle L., Avicennia germinans (L.) L. e Laguncularia racemosa C. F. Gaertn.). Em C1, foram encontradas as três espécies, enquanto C2 apresentou apenas indivíduos de R. mangle e A. germinans. C2 pode ser considerado um bosque monoespecífico de R. mangle, pois, em meio às árvores de R. mangle, apenas um indivíduo de A. germinans foi encontrado. Em C1, as árvores apresentaram altura entre 4 e 21 m e diâmetro entre 8,6 e 108,3 cm. Em C2, a altura das árvores variou entre 10 e 22 m e o diâmetro entre 10,5 e 97,1 cm. Como consequência do elevado diâmetro, C2 apresentou os maiores valores de área basal. Em C1, são encontrados muitos indivíduos em classes intermediárias de diâmetro, porém com presença de indivíduos de pequeno porte. Já em C2, 76% dos indivíduos têm diâmetro entre 25 e 30 cm, sendo que indivíduos de pequeno porte são quase inexistentes, mostrando uma grande uniformidade na estrutura do bosque. Altura e diâmetro das árvores de mangue do bosque em C2 são significativamente maiores do que aquelas do bosque de mangue em C1. Como a salinidade foi medida apenas pontualmente, os resultados não permitem resultados conclusivos.
Palavras-chave: Estrutura florestal. Manguezais amazônicos. Marapanim.
ABSTRACT
The present study describes the structural characteristics of the mangrove forest of the Cajutuba river, municipality of Marapanim, Pará state, Brazil. The point centered quarter method (PCQM) was used to analyze two transects at two different study sites (C1, C2). Three mangrove species were found: Rhizophora mangle L., Avicennia germinans (L.) L. and Laguncularia racemosa C. F. Gaertn. At C1, all three species were registered. C2 is an almost monospecific R. mangle forest (one single tree of A. germinans). At C1, tree heights varied between 4 and 21 m, while diameter ranged between 8,6 and 108,3 cm. At C2, tree height varied between 10 and 22 m, stem diameter between 10,5 and 97,1 cm. C2 presented the highest basal area values. At C1, numerous individuals had intermediate diameters, but small trees also occurred. At C2, 76% of the trees had diameters between 25 and 30 cm, but small trees were almost absent. Diameter and height of mangrove trees at C2 are significantly larger than those at C1. Salinity results are not enough to take conclusive results.
Keywords: Forest structure. Amazonian mangroves. Marapanim.
INTRODUÇÃO
O manguezal é um ecossistema costeiro de transição entre o ambiente terrestre e o marinho, que encontra nas regiões tropicais as melhores condições para seu desenvolvimento (Lugo & Snedaker, 1974; Saenger & Snedaker, 1993; Tomlinson, 1986). Este ecossistema ocupa 8% de toda a linha de costa do mundo e um quarto da linha de costa da zona tropical, perfazendo um total de 181.077 km2 (Spalding et al., 1997).
As florestas de mangue apresentam baixa diversidade florística se comparadas às florestas tropicais terrestres. Isto porque o ambiente onde ocorrem oferece condições peculiares, como alta salinidade da água intersticial, baixa concentração de oxigênio do substrato lamoso e regime de inundações diárias, o que permite o desenvolvimento apenas de espécies com adaptações específicas ao meio (Tomlinson, 1986). Em uma escala mundial, o Brasil é o segundo país em extensão de áreas de manguezal (13.400 km2), ficando atrás apenas da Indonésia, que apresenta 42.550 km2 distribuídos por seus diversos arquipélagos (Spalding et al., 1997).
Na costa brasileira, os manguezais ocorrem desde o Amapá até Santa Catarina, margeando estuários, lagunas e enseadas costeiras (Lacerda, 1999). No Pará, os manguezais formam uma faixa quase contínua de 300 km de extensão, com uma área total de 2.176,78 km2 (Souza-Filho, 2005). No nordeste do estado, os manguezais constituem um traço comum da paisagem, cobrindo grandes superfícies nas margens das baías e estuários (Prost & Rabelo, 1996), formando, em conjunto com os manguezais do Maranhão, um cinturão contínuo de 7.591,09 km2 (Souza-Filho, 2005). Porém, apesar da grande área de manguezais do estado, pouco é conhecido desta vegetação. Uma exceção é a península de Ajuruteua, no município de Bragança, onde diversos estudos sobre a vegetação foram desenvolvidos (Mehlig, 2001; Menezes et al., 2003; Reise, 2003; Silva & Fernandes, 2004; Matni et al., 2006; Abreu et al., 2006; Seixas et al., 2006).
No estuário do rio Marapanim, no município de mesmo nome, foram desenvolvidos estudos de geomorfologia (conforme a Tese de Doutorado de J. F. Berredo, de 2006, intitulada "Geoquímica dos sedimentos de manguezais do nordeste do estado do Pará: o exemplo do estuário do rio Marapanim") e cartografia (Prost et al., 2001), porém, estudos de estrutura da vegetação são restritos apenas a Costa Neto et al. (2000). Dados desta natureza são importantes, pois a região sofre o aumento da exploração pesqueira e turística, que começa a fazer pressão sobre os recursos naturais da região.
Atualmente, o Instituto Brasileiro de Meio Ambiente e Recursos Naturais Renováveis (IBAMA) tem adotado uma política de implantação de Reservas Extrativistas Marinhas - RESEXM (Glaser & Oliveira, 2004) na costa do estado do Pará, que envolve diretamente áreas de manguezais. Dados estruturais e distribuição de espécies de bosques de manguezais podem fornecer informações relevantes na formulação de planos para o manejo sustentável destas RESEXM.
Este trabalho visa, portanto, contribuir para o conhecimento dos mangues da costa do estado do Pará, fornecendo dados sobre a estrutura dos bosques de mangue do município de Marapanim, nordeste do estado do Pará.
MATERIAL E MÉTODOS
ÁREA DE ESTUDO
O presente estudo foi desenvolvido nos manguezais do rio Cajutuba, município de Marapanim (0o 38' 01" S e 47o 39' 30" W), nordeste do estado do Pará, Brasil (Figura 1). Na área, foram demarcados dois sítios de estudo: 1) Furo do Sauá (um canal de maré), situado na margem leste do rio Cajutuba, neste estudo chamado de C1; 2) Margem oeste do rio Cajutuba, neste estudo chamado de C2 (Figura 1).
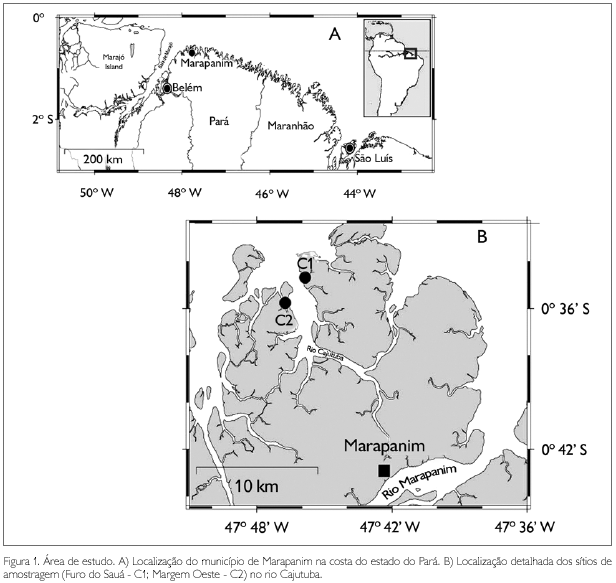
O nordeste do Pará abriga uma das maiores áreas de manguezais do mundo (Souza-Filho, 2005), desenvolvidos atrás de restingas, praias e dunas, nas margens das baías e nos estuários (Prost & Rabelo, 1996), cobrindo uma área de 2.176,78 km2 (Souza-Filho, 2005). Esta região é caracterizada por um relevo baixo (0 a 80 m), ampla planície costeira (com até 70 km de largura) e extensa plataforma continental adjacente (200 km de largura), sendo extremamente irregular, endentada e recortada por vários estuários (Souza-Filho, 2005). A costa está sujeita a um regime de macromarés semidiurnas, com variações entre 4 m na baía de Guajará, em Belém, e 7,5 m na baía de. São Marcos (DHN, 2004). O clima é quente e úmido, com estações seca (julho a dezembro) e chuvosa (janeiro a maio) bem definidas, com precipitação média anual variando de 2.500 a 3.000 mm anuais e temperatura média em torno de 26 oC (Moraes et al., 2005).
O acesso ao município de Marapanim a partir de Belém (capital do estado) é feito pela rodovia federal BR-316 até a cidade de Castanhal (cerca de 80 km de distância). A partir daí, através das rodovias estaduais PA-136 e PA-318 até a sede do município de Marapanim. Para chegar aos sítios de estudo, é necessária uma viagem de barco pelo rio Cajutuba, de aproximadamente 2 horas, a partir da sede do município de Marapanim.
METODOLOGIA
O trabalho de campo foi realizado no mês de junho de 2002, que corresponde ao final da estação chuvosa da região. Para o levantamento estrutural, foi utilizado o método do quadrante centrado, de acordo com recomendações de Schaeffer-Novelli & Cintrón (1986). Este método foi escolhido por ser mais dinâmico em relação ao método de parcelas e, portanto, mais indicado para o caso da área do presente estudo, que apresenta grande dificuldade de acesso (e movimentação durante as medidas de campo) e reduzido tempo de trabalho, dadas as marés semi-diurnas.
Em cada uma das áreas, foi delimitada uma transecção retilínea, perpendicular à linha de inundação da maré, com 400 m de comprimento, que, de acordo com Schaeffer-Novelli & Cintrón (1986), é o tamanho mínimo para uma transecção deste método. A cada 20 m de cada transecção, foi demarcado um ponto de amostragem. Em cada ponto de amostragem, foram medidas quatro árvores, correspondendo cada árvore a um quadrante. Foi medida a distância de cada árvore até o centro do ponto de amostragem (medida usada para o cálculo de densidade), identificadas as espécies e estimada a altura.
No campo, foi medida, ainda, a circunferência à altura do peito apenas de indivíduos com circunferência maior ou igual a 8 cm. No caso de árvores do gênero Rhizophora L., a circunferência foi medida após a emissão da última raiz escora (Schaeffer-Novelli & Cintrón, 1986). Posteriormente, estes valores de circunferência foram transformados em diâmetro e foi calculada a área basal. Foram também calculados frequência relativa, densidade absoluta e relativa, dominância relativa e valor de importância (Schaeffer-Novelli & Cintrón, 1986). Os dados de diâmetro e altura foram distribuídos em classes de intervalos de 5 cm (DAP) e 5 m (altura), calculados com o programa X-Act, Scilab, Alemanha. Para determinar se as áreas de estudo diferiam estruturalmente entre si, os dados de altura e diâmetro foram comparados através de um test-t, usando R Development Core Team (2008).
A salinidade intersticial foi medida às profundidades de 10 cm e 50 cm. Os valores foram obtidos através de medidas da condutividade em meio aquoso (1:5 w/v). Como as medidas foram realizadas apenas uma vez, estes dados representam valores momentâneos da salinidade local na estação chuvosa.
RESULTADOS
SALINIDADE
A análise pontual da salinidade intersticial indicou, a 10 cm de profundidade, valores de 49,0 e 23,2 para C1 e C2, respectivamente; valores, a 50 cm de profundidade, de 36,0 e 20,7 para C1 e C2, respectivamente.
OCORRÊNCIA DE ESPÉCIES
No sítio C1, foram encontradas as espécies Rhizophora mangle L., Avicennia germinans (L.) L. e Laguncularia racemosa C. F. Gaertn. Em C2, foi encontrada a espécie R. mangle e apenas um indivíduo de A. germinans. Valores de dominância e valor de importância mostram que, em ambos os sítios estudados, R. mangle é a espécie mais importante (Tabela 1).
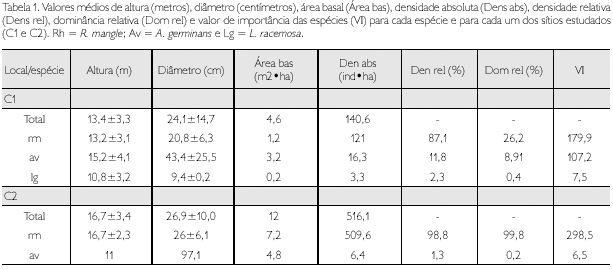
CARACTERÍSTICAS ESTRUTURAIS
Os valores de altura e diâmetro diferenciaram significativamente (altura t =-7,6807, df = 153,16; p < 0,001; diâmetro t =-7,6807, df = 153,16; p < 0,001) entre as áreas de estudo (Figura 2).
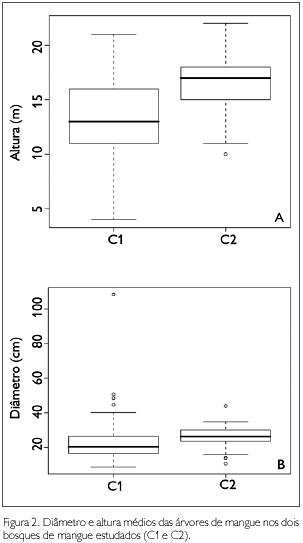
Em C1, a altura máxima foi 21 m e a altura mínima foi 4 m, cerca de 86% das árvores apresentaram altura 10 e 15 m entre as classes. Cerca de 84% dos indivíduos de R. mangle se distribuíram entre as classes 10 e 15 m de altura, estando, aproximadamente, 55% destes na classe 15 m (Figura 3). Já 30% dos indivíduos de A. germinans se encontraram na classe 10 m, 30% na classe 15 m e 40% na classe 20 m de altura (Figura 3). Os únicos dois indivíduos de L. racemosa apresentaram alturas de 8,5 m e 13 m (Tabela 1). Quanto ao diâmetro, o valor máximo foi de 108,3 cm e o mínimo de 8,6 cm. Na distribuição das classes de diâmetro, R. mangle apresentou indivíduos entre as classes 10 e 40 cm, estando cerca de 40% dos indivíduos na classe 20 cm (Figura 4). Para as árvores de A. germinans, 30% dos indivíduos se apresentaram na classe 40 cm (Figura 4). Os dois indivíduos de L. racemosa apresentaram diâmetros de 9,5 e 9,3 cm (Tabela 1).
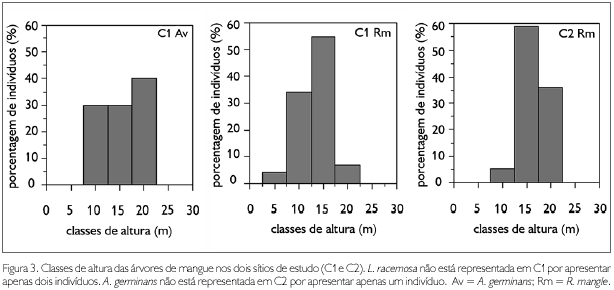
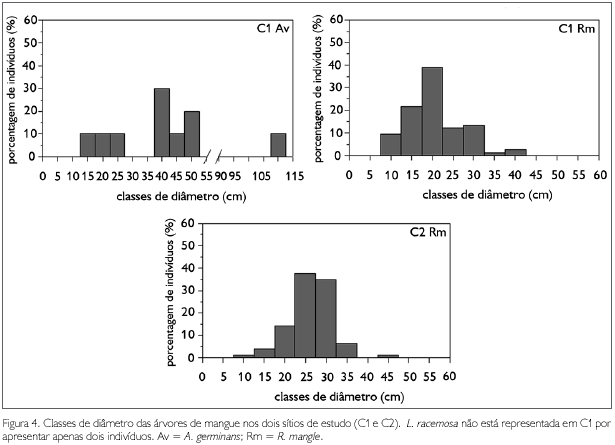
Em C2, o único indivíduo de A. germinans apresentou altura de 11 m e diâmetro de 97,1 cm (Tabela 1). Para R. mangle, a altura máxima foi de 22 m e a mínima de 10 m. A distribuição das classes de altura apresentou apenas três classes, com cerca de 59% dos indivíduos concentrados na classe 15 m (Figura 3). Quanto ao diâmetro, o máximo foi 97,1 cm e o mínimo 10,5 cm. A distribuição das classes de diâmetro mostrou as árvores de R. mangle entre as classes 10 cm e 45 cm; aproximadamente 76% dos indivíduos se concentraram nas classes 25 e 30 cm (Figura 4). Como consequência do elevado diâmetro médio das árvores, em C2, os valores de área basal foram mais elevados do que em C1 (Tabela 1).
DISCUSSÃO
As espécies encontradas neste estudo são as mesmas registradas para outros manguezais da costa nordeste do Pará: Curuçá (Ferreira et al., 1992; Almeida, 1996), praia do Crispim, em Marudá, e ilha de Algodoal, em Maracanã (Bastos & Lobato, 1996), península de Ajuruteua, em Bragança (Menezes et al., 2003; Matni et al., 2006; Seixas et al., 2006; Abreu et al., 2006), ilha de Canela (Amaral et al., 2001) e rio Marapanim, também no município de Marapanim (Costa-Neto et al., 2000). Prost et al. (2001) relatam a presença de Avicennia schaueriana (L.) Stapf & Leechm. ex Moldenke nos manguezais do rio Marapanim, porém, no presente estudo, esta espécie não foi encontrada.
Almeida (1996) enfatiza que em manguezais do estado do Pará, sob influência marinha, a flora arbórea é composta por R. mangle, A. germinans e L. racemosa. Contudo, L. racemosa não é abundante na área do presente estudo, pois foram encontrados apenas dois indivíduos desta espécie em C1 e nenhum indivíduo em C2. O sítio C2 é um bosque monoespecífico de R. mangle, pois apenas um indivíduo de A. germinans foi encontrado.
Em C1, observa-se ampla distribuição das classes de diâmetro, com indivíduos nas classes intermediárias e classes maiores, com a maioria dos indivíduos com diâmetro na faixa de 15-20 cm. Dentre os indivíduos pequenos, estão as árvores de L. racemosa. Por ser intolerante à sombra (Ball, 1980), em manguezais Amazônicos, L. racemosa é encontrada principalmente em áreas de clareiras (Matni et al., 2006; Berger et al., 2006; Menezes et al., 2008), dentro dos bosques ou nas margens dos canais. Já Soares (1999) mostrou que nos manguezais da Lagoa da Tijuca, Rio de Janeiro, a presença de L. racemosa indica alterações antrópicas. Portanto, a presença de poucos indivíduos desta espécie no sítio de estudo sugere ausência de clareiras no bosque e ausência de alterações antrópicas. A presença de poucos e grandes indivíduos de A. germinans sugere que árvores desta espécie são mais antigas do que aquelas de R. mangle e que estão, provavelmente, sendo substituídas no bosque. A substituição de A. germinans em C1 parece ser um processo natural, já que nenhum indício de alteração antrópica foi encontrado.
Já em C2, a distribuição das classes de diâmetro mostra tratar-se também de um bosque com a maioria dos indivíduos concentrada em apenas duas classes (25 cm, 30 cm). Os poucos indivíduos de classes menores evidenciam baixa regeneração, enquanto a não ocorrência de indivíduos de grande porte indica a ausência de árvores mais velhas, com exceção do único indivíduo de A. germinans presente na área. Trata-se, portanto, de um bosque com árvores de tamanho bastante uniforme.
Com base em Santos et al. (1997), de acordo com os valores de salinidade, os manguezais estudados poderiam ser classificados em salino (C1) e salobro (C2). Contudo, estes dados são apenas preliminares, somente dados mais consistentes poderiam confirmar tal resultado.
Os valores médios de altura e diâmetro registrados no presente estudo estão dentro dos valores compilados por Menezes et al. (2008) para os manguezais Amazônicos, cujos valores máximos registrados foram 42 cm de diâmetro em Curuçá, Pará, e 25 metros de altura em Vigia, Pará. Contudo, os valores de altura e diâmetro foram inferiores aos de Costa-Neto et al. (2000) para os bosques do estuário do rio Marapanim. A variação estrutural de florestas de manguezal e a dominância de cada tipo de um dado ambiente estão relacionadas tanto às características ambientais regionais quanto aos fatores de caráter local (Schaeffer-Novelli et al., 1990). Neste quesito, diferentes fatores estão relacionados, como: frequência de inundação (Menezes et al., 2003), aporte de nutrientes (Feller et al., 2003) e salinidade (Jimenez, 1991; Santos et al., 1997; Reise, 2003). Na região amazônica, salinidade tem sido o fator ambiental mais estudado. Através da análise de trocas gasosas de espécies de mangue (conforme a Dissertação de Mestrado de L. B. Brabo, de 2004, intitulada "Medidas gasosas de plantas de manguezal sob diferentes condições de salinidade e inundação em estufa e campo (Bragança - PA - Brasil)"), foi possível mostrar que o estresse salino chega a níveis críticos em ambientes hipersalinos e raramente inundados. Isto é constatado pelos bosques anões monoespecíficos de A. germinans, que ocorrem em áreas hipersalinas e raramente inundadas (Santos et al., 1997; Reise, 2003). Uma relação inversa entre altura de árvores de mangue e salinidade também tem sido descrita por Santos et al. (1997) e Lara & Cohen (2006). Almeida (1996) verificou que manguezais salobros apresentam bosques estruturalmente mais desenvolvidos quando comparados aos manguezais sob influência marinha. Por isso, futuros estudos são necessários para entender a influência dos parâmetros ambientais nos manguezais Amazônicos (Menezes et al., 2008) e, consequentemente, na estrutura dos bosques.
AGRADECIMENTOS
Os autores agradecem comentários e sugestões dos dois avaliadores anônimos. O presente estudo foi financiado pelos projetos Instituto do Milênio-Núcleo de Estudos Costeiros (MCT-CNPq) e MADAM (CNPq - Brasil e BMBf - Alemanha).
REFERÊNCIAS
ABREU, M. M., U. MEHLIG, R. E. S. A. NASCIMENTO & M. P. M. MENEZES, 2006. Caracterização estrutural e composição florística em um bosque de terra firme e um manguezal da península de Ajuruteua, Bragança (Pará-Brasil). Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 2(3): 27-34.
ALMEIDA, S. S., 1996. Estrutura e Florística em Áreas de Manguezais Paraenses: Evidências da Influência do Estuário Amazônico. Boletim do Museu Paraense Emílio Goeldi, série Ciências da Terra 8: 96-99.
AMARAL, D. D., J. U. M. SANTOS, M. N. C. BASTOS, S. V. COSTA-NETO & D. C. T. COSTA, 2001. A vegetação da Ilha Canela, município de Bragança, Pará, Brasil. Boletim do Museu Paraense Emílio Goeldi, série Botânica 2: 398-400.
BALL, M. C., 1980. Patterns of secondary succession in a mangrove forest of southern Florida. Oecologia 44: 226-235.
BASTOS, M. N. C. & L. C. B. LOBATO, 1996. Estudos fitossociológicos em áreas de bosque de mangue na praia do Crispim e Ilha de Algodoal. Boletim do Museu Paraense Emílio Goeldi, série Ciências da Terra 8: 157-167.
BERGER, U., M. ADAMS, V. GRIMM & H. HILDENBRANDT, 2006. Modelling secondary succession of neotropical mangroves: causes and consequences of growth reduction in pioneer species. Perspectives in Plant Ecology, Evolution and Systematics 7(4): 243-252.
COSTA NETO, S. V., C. SENNA & L. C. B. LOBATO, 2000. Estrutura e diversidade de bosques de manguezal da Baía de Marapanim, Pará, Brasil. Mangrove 2000 Conference, Recife. CD-ROM.
DHN - Departamento de Hidrografia e Navegação, 2004. Tábua de marés para 2004 - costa do Brasil e alguns portos estrangeiros: 1-96. Rio de Janeiro.
FELLER, I. C., D. F. WHIGHAM, K. MCKEE & C. E. LOVELOCK, 2003. Nitrogen limitation of growth and nutrient dynamics in a disturbed mangrove forest, Indian River Lagoon, Florida. Oecologia 134: 405-414.
FERREIRA, C. P., M. P. M. MENEZES, E. A. CARVALHO, N. S. MARQUES DA SILVA & L. F. ALMEIDA, 1992. Caracterização estrutural dos bosques de mangue dos municípios de Curuçá e Soure (PA). Anais do Simpósio sobre Estrutura Funcionamento e Manejo de Ecossistemas: 55. UFRJ, Rio de Janeiro.
GLASER, M. & R. S. OLIVEIRA, 2004. Prospects for the comanagement of mangrove ecosystems on the North Brazilian coast: whose rights, whose duties and whose priorities? Natural Resources Forum 28: 224-233.
JIMENEZ, J. A., 1991. Structure and dynamics of mangrove forests along a flooding gradient. Estuaries 14(1): 49-56.
LACERDA, L. D., 1999. Os manguezais do Brasil. In: M. VANUCCI. Os manguezais e nós: 1-233. EDUSP, São Paulo.
LARA, R. J. & M. C. L. COHEN, 2006. Sediment porewater salinity, inundation frequency and mangrove vegetation height in Bragança, North Brazil: an ecohydrology-based empirical model. Wetlands Ecology and Management 14: 349-358.
LUGO, A. & S. C. SNEDAKER, 1974. The ecology of mangroves. Annual Review of Ecology and Systematics 5: 39-69.
MATNI, A. S., M. P. M. MENEZES & U. MEHLIG, 2006. Caracterização estrutural dos bosques de mangue na Península Bragantina. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 3(2): 45-54.
MEHLIG, U., 2001. Aspects of tree primary production in an equatorial mangrove forest in Brazil: 1-155. Center for Tropical Marine Ecology (ZMT Contributions 14), Bremen.
MENEZES, M. P. M., U. BERGER & M. WORBES, 2003. Annual growth rings and long-term growth patterns of mangrove trees from the Bragança Peninsula. Wetlands Ecology and Management 11: 233-242.
MENEZES, M. P. M., U. BERGER & U. MEHLIG, 2008. Mangrove vegetation in Amazonia: a review of studies from the coast of Pará and Maranhão states, north Brazil. Acta Amazonica 38(3): 403-420.
MORAES, B. C, J. M. N. COSTA & A. C. L. COSTA, 2005. Variação espacial e temporal da precipitação no estado do Pará. Acta Amazonica 35: 207-214.
PROST, M. T. R. & B. V. RABELO, 1996. Variabilidade fito-espacial de manguezais litorâneos e dinâmica costeira: exemplos da Guiana Francesa, Amapá e Pará. Boletim do Museu Paraense Emílio Goeldi, série Ciências da Terra 8: 93-121.
PROST, M. T., A. C. MENDES, J. F. FAURE, J. F. BERREDO, M. E. SALES, L. G. FURTADO, M. G. SANTANA, C. A. SILVA, I. NASCIMENTO, I. GORAYEB, M. F. SECCO & L. LUZ, 2001. Manguezais e estuários da costa paraense: exemplo de estudo multidisciplinar integrado (Marapanim e São Caetano de Odivelas). In: M. T. PROST & A. MENDES (Eds.): Ecossistemas costeiros: impactos e gestão ambiental: 1-215. FUNTEC, Belém.
R DEVELOPMENT CORE TEAM, 2008. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. Disponível em: <http://www.R-project.org>. Acesso em: 31 março 2009.
REISE, A., 2003. Estimates of biomass and productivity in fringe mangroves on North-Brazil: 1-196. Center for Marine Tropical Ecology (ZMT) (ZMT Contribution 16), Bremen.
SAENGER, P. & S. C. SNEDAKER, 1993. Pantropical trends in mangrove above-ground biomass and annual litterfall. Oecologia 96: 293-299.
SANTOS, M. V., J. C. ZIEMAN & R. H. COHEN, 1997. Interpreting the upper mid-littoral zonation patterns of mangroves in Maranhão (Brazil) in response to microtopography and hydrology. In: B. KERVE, L. D. LACERDA & E. H. DIOP (Eds.): Mangrove ecosystem studies in Latin America and Africa: 1-149. UNESCO, Paris.
SCHAEFFER-NOVELLI, Y. & G. CINTRÓN, 1986. Guia para estudos de áreas de manguezal (Estrutura, Função e Flora): 1-150. Caribean Ecological Research, São Paulo.
SCHAEFFER-NOVELLI, Y., G. CINTRÓN, R. R. ADAIME & T. M. CAMARGO, 1990. Variability of the mangroves ecosystem along the Brasilian coast. Estuaries 13: 204-218.
SEIXAS, J. A. S., M. E. B. FERNANDES & E. SILVA, 2006. Análise estrutural da vegetação arbórea dos mangues no Furo Grande, Bragança, Pará. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 1(3): 35-43.
SILVA, E. S. & M. E. B. FERNANDES, 2004. Relação entre gradiente vegetacional e atributos do solo nos bosques de mangue do Furo Grande, Bragança, PA. Boletim do Laboratório de Hidrobiologia 17: 19-27.
SOARES, M. L. G., 1999. Estrutura vegetal e grau de perturbação dos manguezais da Lagoa da Tijuca, Rio de Janeiro, RJ, Brasil. Revista Brasileira de Botânica 14: 21-25.
SOUZA-FILHO, P. W., 2005. Costa de manguezais de macromaré da Amazônia: cenários morfológicos, mapeamento e quantificação de áreas usando dados de sensores remotos. Revista Brasileira de Geofísica 23(4): 427-435.
SPALDING, M., F. BLASCO & C. D. FIELD, 1997. World mangrove atlas: 1-178. The International Society for Mangrove Ecosystems, Okinawa.
TOMLINSON, P. B., 1986. The botany of mangroves: 1-418. Cambridge University Press, Cambridge.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz - CEP 66040-170
Belém - PA - Brasil
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail: boletim@museu-goeldi.br
Recebido: 17/04/2008
Aprovado: 23/04/2009













