Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.4 n.2 Belém ago. 2009
Variação temporal da composição, ocorrência e distribuição dos Copepoda (Crustacea) do estuário do Taperaçu, Pará, Brasil
Temporal variation in composition, occurrence and distribution of Copepoda (Crustacea) from Taperaçu estuary, Pará, Brazil
André MagalhãesI Regiane do Socorro Costa BessaII Luci Cajueiro Carneiro PereiraIII Rauquírio Marinho da CostaIV
IUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil (perezmagalhaes@hotmail.com)
IIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil(regianebessa@yahoo.com.br)
IIIUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Oceanografia Costeira e Estuarina. Bragança, Pará, Brasil (cajueiro@ufpa.br)
IVUniversidade Federal do Pará. Instituto de Estudos Costeiros. Laboratório de Plâncton e Cultivo de Microalgas. Bragança, Pará, Brasil (raucosta@ufpa.br)
RESUMO
O presente trabalho objetivou investigar as variações temporais na estrutura da comunidade dos copépodes do estuário do Taperaçu, Pará, Brasil. As medidas das variáveis físico-químicas e as amostragens de plancton foram conduzidas durante os meses de janeiro a junho de 2006, em três estações fixas localizadas ao longo deste estuário. Os arrastos de plancton foram realizados utilizando-se uma rede cônico-cilíndrica com 300 µm de abertura de malha. Considerando os parâmetros abióticos e bióticos, não foram observadas diferenças espaciais significativas (ANOVA, p > 0,05). Pseudodiaptomus marshi Wright S., 1936 (11,7 ± 14,3 a 20.909,7 ± 50.527,1 ind.m-3), Acartia lilljeborgii Giesbrecht, 1889 (0,1 ± 0,2 a 1.646,4 ± 1.237,3 ind.m-3),Acartia tonsa Dana, 1849 (8,0 ± 11,2 a 4.604,2 ± 4.521,7 ind.m-3) e Paracalanusquasimodo Bowman, 1971 (1,1 ± 2,7 a 405,1 ± 424,4 ind.m-3) foram os táxons numericamente mais representativos, sendo as suas densidades correlacionadas de forma significativa apenas com a salinidade. Através da análise de Cluster, foi constatada a formação de um único grupo (fevereiro, março, abril e maio), com os meses de janeiro e junho ficando isolados, o que ocorreu devido às mudanças mensais no balanço das densidades entre as quatro principais espécies de copépodes, demonstrando, dessa forma, um processo de sucessão entre estas espécies.
Palavras-chave: Copépodes planctónicos. Variação temporal. Estuário. Brasil.
ABSTRACT
The present study aimed to investigate temporal variations on the structure of the copepod community in the Taperaçu estuary, Pará, Brazil. The physical-chemical variables and plankton samplings were gathered from January to June 2006, at three fixed stations located along this estuary. Plankton tows were accomplished using a cylindrical-conical plankton 300 µm mesh net. No significant spatial differences were observed in the abiotic and biotic parameters (ANOVA, p > 0.05). Pseudodiaptomus marshi Wright S., 1936 (11.7 ± 14.3 a 20,909.7 ± 50,527.1 ind.m-3), Acartia lilljeborgii Giesbrecht, 1889 (0.1 ± 0.2 a 1,646.4 ± 1,237.3 ind.m-3), Acartia tonsa Dana, 1849 (8.0 ± 11.2 a 4,604.2 ± 4,521.7 ind.m-3) and Paracalanus quasimodo Bowman, 1971 (1.1 ± 2.7 a 405.1 ± 424.4 ind.m-3) were the most abundant taxa, presenting densities significantly correlated with the salinity. The Cluster analysis indicated the formation of a single group comprised by the months of February, March, April and May, with January and June showing no grouping formation. This occurred due to the monthly changes in the balance of the densities observed for the four main copepod species, showing a succession process among these species.
Keywords: Planktonic copepods. Temporal variation. Estuary. Brazil.
INTRODUÇÃO
Os estuários são ecossistemas costeiros de transição entre ambientes límnicos e marinhos que estão em constante dinamismo, sofrendo a ação do regime das marés (Schaeffer-Novelli, 1995). Os altos valores de biomassa encontrados nestes ambientes devem-se às elevadas taxas de produção primária e secundária das populações fitoplanctônicas, zooplanctônicas e zoobênticas. A dinâmica populacional destes grupos é influenciada por variações espaço-temporais dos parâmetros hidroquímicos e hidrodinámicos (Cloern et al., 1989; Kibirige & Perissinotto, 2003), sendo estes decorrentes das interações existentes entre as marés, vazão, geomorfologia e características topográficas dos estuários (Dyer, 1982).
Ambientes estuarinos podem ser considerados berçários da natureza por serem importantes áreas de desova de diversos vertebrados e invertebrados aquáticos, constituindo um dos ecossistemas mais produtivos do mundo e proporcionando habitat favorável para uma grande diversidade de organismos (Kaiser et al., 2005). Dentre estes, destacam-se os organismos do zooplâncton, os quais ocupam uma posição estratégica dentro da cadeia trófica aquática, atuando na reciclagem de nutrientes e na regulação das populações fitoplanctônicas, por meio do aumento da taxa de consumo sobre esses organismos. O zooplâncton atua também como elo na transferência de energia e matéria orgânica dos produtores primários para os principais consumidores do sistema, incluindo muitas espécies de peixes de interesse comercial (Lenz, 2005). Dentre os organismos que compõem o zooplâncton estuarino e marinho, os copépodes são o grupo dominante, compreendendo entre 80 e 90% da densidade total do zooplâncton (Ramaiah & Nair, 1997). As relações entre a distribuição espaço-temporal dos copépodes e as variáveis ambientais (salinidade, temperatura, competição, predação, qualidade alimentar etc.) vêm sendo amplamente investigadas em estuários (Achuthankutty et al., 1998; Ara, 2004; Brugnoli-Olivera & Morales-Ramírez, 2008; Hoffmeyer et al., 2009), constituindo a salinidade, de forma geral, um dos principais fatores controladores do desenvolvimento e da variação temporal destes organismos (Sarkar & Choudhury, 1998; Plourde et al., 2002; Lawrence et al., 2004; David et al., 2007).
Os primeiros trabalhos com enfoque nos copépodes do litoral norte brasileiro foram realizados por Dahl (1894) e Wright (1936a, b), que estudaram a composição específica dos copépodes coletados na foz do rio Amazonas. Investigação posterior desenvolvida na plataforma continental norte brasileira avaliou a abundância e distribuição espacial destes organismos (Calef & Grice, 1967). No que tange ao conhecimento sobre os copépodes do litoral paraense, somente a partir dos últimos anos os estudos vêm sendo intensificados (Magalhães et al., 2006; Martins, A. A. V et al., 2006; Leite et al., 2007; Costa et al., 2008; Costa et al., 2009; Magalhães et al., 2009). Apesar dos crescentes esforços e a despeito da grande importância deste grupo, pouco se conhece acerca da estrutura populacional dos copépodes em ecossistemas estuarinos desta região. Portanto, o presente trabalho teve como objetivo principal estudar as variações temporais na composição, ocorrência e distribuição da densidade e diversidade, bem como determinar a influência das variáveis físico-químicas (salinidade, temperatura, potencial hidrogeniônico e oxigênio dissolvido) e dos diferentes períodos de maré (enchente/vazante) sobre os copépodes coletados em três estações fixas situadas no estuário do Taperaçu, Pará, Brasil, durante os meses de janeiro a junho de 2006 (estação chuvosa).
MATERIAL E MÉTODOS
ÁREA DE ESTUDO
O estuário do Taperaçu (Figura 1), situado a cerca de 200 km a sudeste da desembocadura do rio Amazonas, no município de Bragança (nordeste do estado do Pará), é classificado como um estuário permanentemente aberto, caracterizado por elevados valores de turbidez e baixas profundidades (média de 4 m). Assim como outros estuários localizados ao norte do Brasil (Krumme et al., 2004; Giarrizzo & Saint-Paul, 2008), apresenta um regime de macromarés semidiurnas, com altura de maré em torno de 5 m, podendo alcançar valores de até 6 m durante as marés equinociais de sizígia (DHN, 2008), o que o diferencia dos estuários localizados nas demais regiões da costa brasileira.
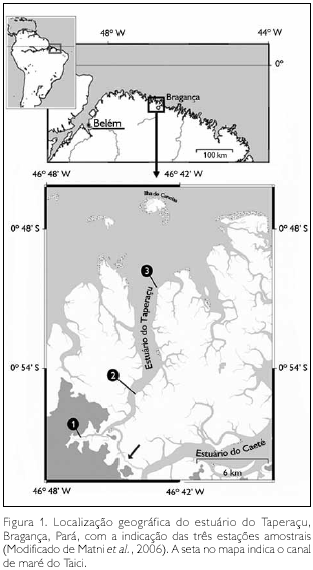
A área de estudo faz parte da Reserva Extrativista Marinha Caeté-Taperaçu, na qual os recursos naturais renováveis são tradicionalmente utilizados pelas populações extrativistas residentes em suas adjacências. O clima da região é equatorial quente e úmido, o qual apresenta uma sazonalidade acentuada, com uma estação chuvosa estendendo-se de janeiro a junho e uma estação seca (menos chuvosa) compreendendo os meses de julho a dezembro, e a umidade relativa do ar oscilando entre 80 e 91% (Martorano et al., 1993; Schories & Mehlig, 2000). Esta sazonalidade reflete o efeito do deslocamento da Zona de Convergência Intertropical sobre a região (Souza Filho & El-Robrini, 1997). A temperatura média e a precipitação pluviométrica anual são de 25,5 oC e 2.500 mm, respectivamente, com 75% da precipitação ocorrendo na estação chuvosa (INMET, 1992).
PROCEDIMENTOS DE CAMPO E ANÁLISES DE LABORATÓRIO
As coletas foram realizadas em três estações fixas, localizadas ao longo do estuário do Taperaçu (Figura 1), com a estação E1 (00o 56' 58,4" S e 46o 46' 26,9" W) situada na região mais interna e distante 7,5 km da E2 (00o 55' 06,8" S e 46o 44' 00" W), a qual está localizada na porção intermediária do estuário e dista 10 km da E3 (00o 50' 30,9" S e 46o 43' 02,4" W), situada na desembocadura dele. As amostragens de plâncton ocorreram de janeiro a junho de 2006 (estação chuvosa), nas marés de sizígia, nos períodos de enchente e vazante, através de arrastos horizontais realizados na camada sub-superficial da coluna de água, utilizando uma rede cônico-cilíndrica (300 µm de abertura de malha e 30 cm de diâmetro de boca) provida de um fluxômetro mecânico.
Mensalmente, foram realizados dois arrastos em cada estação de coleta, sendo um na maré vazante e o outro na enchente, tendo cada arrasto a duração de, aproximadamente, três minutos. Para tanto, foi utilizada uma pequena embarcação a motor deslocando-se a uma velocidade de 1,5 nós. Ao final das amostragens, os organismos coletados foram imediatamente acondicionados em recipientes plásticos com capacidade de um litro e fixados em formalina a 4%, neutralizada com tetraborato de sódio. Durante o período de estudo, coletou-se um total de 36 amostras.
Amostras de água da sub-superfície foram coletadas e analisadas in situ para a determinação das variáveis físico-químicas. As medidas de salinidade, oxigênio dissolvido, potencial hidrogeniônico (pH) e temperatura da água foram tomadas com o auxílio de um multianalisador eletrônico. Os dados referentes à precipitação pluviométrica foram cedidos pelo Instituto Nacional de Meteorologia (INMET) e são provenientes da estação meteorológica de Tracuateua, Pará, situada a 17 km da sede municipal de Bragança.
Em virtude do grande número de organismos nas amostras, o material coletado foi fracionado utilizando-se um subamostrador tipo ''Folsom Plankton Sample Splitter'' (McEwen et al., 1957), segundo a metodologia descrita por Boltovskoy (1981). Os copépodes presentes nas subamostras foram identificados com o auxílio de chaves taxonômicas (Trégouboff & Rose, 1957; Bjõrnberg, 1981; Bradford-Grieve et al., 1999) e contados. Após as contagens, o número de indivíduos registrado para cada espécie foi multiplicado pelo fator de subamostragem para a obtenção do número total de organismos da espécie presente na amostra.
Os dados quantitativos obtidos para os organismos das amostras foram utilizados para calcular a densidade, bem como os índices ecológicos (diversidade e equitabilidade). A diversidade específica dos copépodes foi determinada através do índice de Shannon-Wiener (Shannon, 1948), enquanto que a equitabilidade foi calculada pelo índice de Pielou (Pielou, 1977).
A frequência de ocorrência, porcentagem das amostras na qual cada táxon ocorreu em relação ao número total das amostras coletadas, foi também determinada. Em função dos resultados obtidos, os organismos foram classificados nas seguintes categorias: esporádicos (ES) - < 10%; pouco frequentes (PF) - 10% | — 40%; frequentes (FR) - 40% | — 70%; muito frequentes (MF) - ≥ 70%.
ANÁLISES ESTATíSTICAS
Para verificar o pressuposto da normalidade dos dados abióticos (salinidade, pH, oxigênio dissolvido, temperatura e período de maré) e bióticos (densidade, diversidade e equitabilidade), foi utilizado o teste de Lilliefors (Conover, 1971). Nos casos em que não foi possível observar este pressuposto, os dados foram transformados utilizando-se log (x+1) para a normalização das distribuições. Em seguida, a homogeneidade das variâncias foi avaliada por meio do teste de Cochran (C) (Underwood, 1997). Posteriormente, a análise de variância (ANOVA - um critério) foi aplicada para comparar os dados abióticos, a densidade, a diversidade e a equitabilidade das espécies dominantes de copépodes entre as estações e os meses de coleta, bem como entre os diferentes períodos de maré (enchente/vazante) (Zar, 1999).
A análise de correlação de Spearman foi empregada com a finalidade de verificar as possíveis correlações entre as variáveis abióticas e bióticas, sendo, para tanto, utilizado o programa STATISTICA, versão 6 (StatSoft, 2001).
Para investigar a similaridade entre os meses de coleta em relação à contribuição (%) de todas as espécies de copépodes, foi realizada a análise de agrupamento pelo método de Agrupamento Aglomerativo Hierárquico, baseando-se em uma matriz de similaridade, calculada utilizando o índice de Bray-Curtis, com a geração de um dendrograma. Adicionalmente, foi realizada a análise do percentual de similaridade (SIMPER) para identificar as espécies que mais contribuíram para a formação do grupo no dendrograma de associação dos meses de coleta. Estas análises foram realizadas utilizando-se o programa estatístico PRIMER (Plymouth Routines Multivariate Ecological Research), versão 6, de acordo com Clarke & Warwick (1994).
RESULTADOS
No presente estudo, não foram observadas diferenças espaciais significativas (ANOVA, p > 0,05) para os parâmetros abióticos, densidade das principais espécies de copépodes e para os índices ecológicos. Desta forma, os valores obtidos para as variáveis acima mencionadas foram agrupados e avaliados em escala mensal.
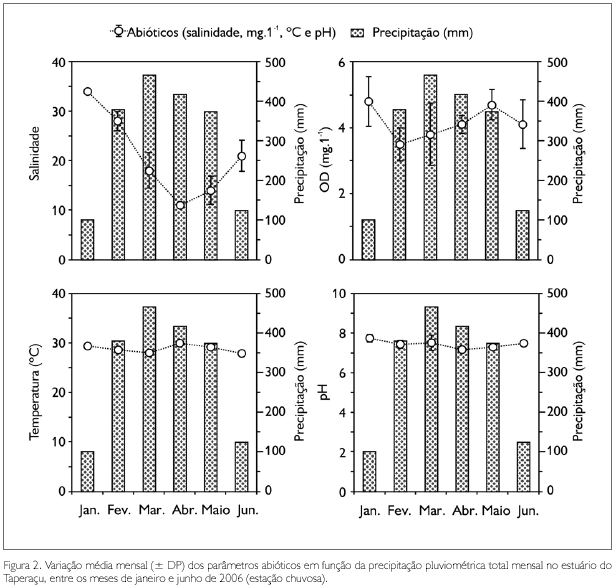
Com base nos índices pluviométricos obtidos, os meses de coleta foram caracterizados como pertencentes à estação chuvosa, apresentando valores totais mensais de precipitação variando entre 102,4 mm (janeiro) e 465,9 mm (março). As variações médias dos parâmetros abióticos em função da precipitação pluviométrica são apresentadas na Figura 2. A salinidade oscilou entre 11 ± 0,6 e 33,8 ± 0,4, com o menor e maior valor observados nos meses de abril e janeiro, respectivamente. Fato semelhante foi registrado para o pH (7,2 ± 0,1 e 7,7 ± 0,2), para o qual foi evidenciado um caráter levemente alcalino durante todo o período de estudo. A temperatura apresentou pequena variação mensal, tendo os valores oscilado entre 27,9 ± 0,6 oC (junho) e 29,9 ± 0,6 oC (abril). Com relação às concentrações de oxigênio dissolvido, os valores variaram entre 3,5 ± 0,5 mg.l-1 (fevereiro) e 4,8 ± 0,7 mg.l-1 (janeiro). As correlações de Spearman entre a precipitação e os parâmetros de salinidade (rs = -0,53; p < 0,05) e pH (rs = -0,45; p < 0,05) foram significativas e negativas. Contudo, tais correlações não foram significativas para temperatura (rs = -0,17; p > 0,05) e oxigênio dissolvido (rs = -0,32; p > 0,05).
Foram identificados 21 táxons, distribuídos em quatro ordens: Calanoida, Cyclopoida, Harpacticoida e Poecilostomatoida (Tabela 1). A ordem Calanoida apresentou o maior número de táxons, sendo representada por oito gêneros e quatorze espécies pertencentes a seis famílias: Paracalanidae, Eucalanidae, Centropagidae, Pseudodiaptomidae, Pontellidae e Acartiidae.

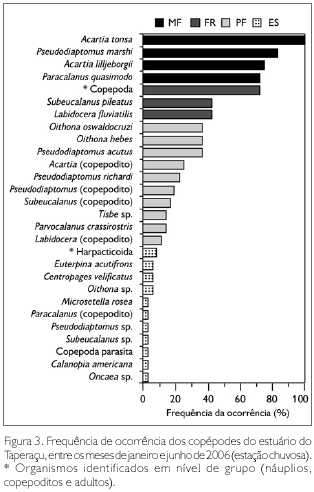
Dentre as espécies registradas, Acartia tonsa Dana, 1849 foi classificada como muito frequente, estando presente em 100% das amostras analisadas. Foram também muito frequentes Pseudodiaptomus marshi Wright S., 1936 (83%), Acartia lilljeborgii Giesbrecht, 1889 (75%) e Paracalanus quasimodo Bowman, 1971 (72%). Por outro lado, Harpacticoida, Euterpina acutifrons (Dana, 1847), Centropages velificatus (Oliveira, 1947), Oithona sp., Microsetella rosea (Dana, 1848), Paracalanus (copepodito), Pseudodiaptomus sp., Subeucalanus sp., Copepoda parasita, Calanopia americana Dahl F, 1894 e Oncaea sp. foram considerados esporádicos (Figura 3), com frequência de ocorrência abaixo de 10%.
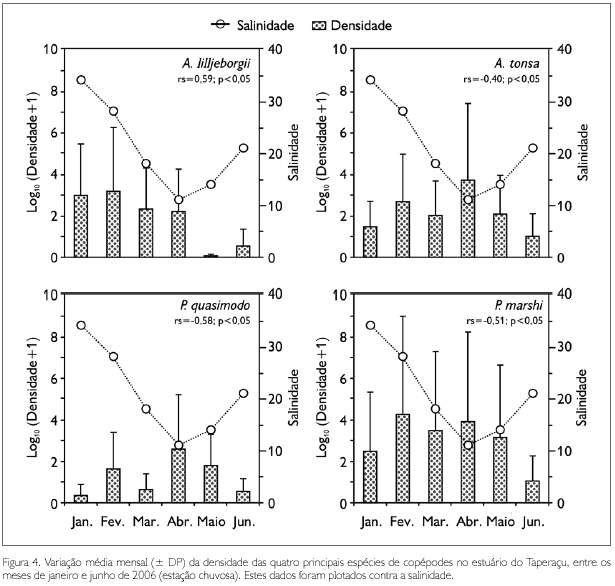
Os valores médios observados para as densidades dos copépodes (Figura 4 e Tabela 2) revelaram que P. marshi (11,7 ± 14,3 a 20.909,7 ± 50.527,1 ind.m-3) foi a espécie numericamente dominante, seguida por A. lilljeborgii (0,1 ± 0,2 a 1.646,4 ± 1.237,3 ind.m-3), A. tonsa (8 ± 11,2 a 4.604,2 ± 4.521,7 ind.m-3) e P. quasimodo (1,1 ± 2,7 a 405,1 ± 424,4 ind.m-3). Diferenças mensais significativas nas densidades de A. lilljeborgii (ANOVA, F = 69,7; p < 0,05), A. tonsa (ANOVA, F = 38,7; p< 0,05) e P. quasiomodo (ANOVA, F = 6,4; p < 0,05) foram registradas, o que não ocorreu para P. marshi (ANOVA, F = 1,5; p > 0,05).

Analisando as densidades das espécies dominantes em relação aos diferentes períodos de maré (enchente/vazante), foram verificadas, no mês de maio, diferenças significativas para P. quasimodo (ANOVA, F = 11,2; p < 0,05), com os maiores valores registrados na maré enchente. Os demais táxons não apresentaram diferenças mensais significativas em relação a este parâmetro.
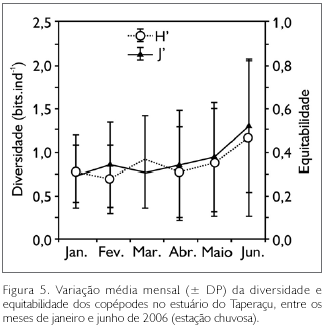
Quanto aos índices ecológicos (diversidade e equitabilidade), além de espacialmente uniforme, o estuário do Taperaçu foi considerado mensalmente homogêneo, apresentando baixa diversidade de espécies, com os valores médios (± DP) oscilando entre 0,7 ± 0,4 (fevereiro) e 1,2 ± 0,9 (junho) bits.ind-1. Fato similar foi observado para a equitabilidade, a qual variou de 0,3 ± 0,1 (janeiro) a 0,5 ± 0,3 (junho) (Figura 5). No que tange às variações dos índices ecológicos entre os períodos de maré, não foram observadas diferenças significativas. Os valores de diversidade (rs = 0,02; p > 0,05) e equitabilidade (rs = 0,03; p > 0,05) apresentaram correlações positivas, porém não significativas com a salinidade.
No tocante à contribuição dos táxons dominantes para a densidade total mensal dos copépodes, constatou-se que P. marshi alcançou 90,5% em fevereiro, com A. lilljeborgii apresentando 69,6% em janeiro, A. tonsa com 31,7% em abril e P. quasimodo com 9,3% em junho (Figura 6A). As análises de correlação de Spearman revelaram que a salinidade foi a única variável abiótica a se correlacionar de forma significativa com a densidade destas espécies, com P. marshi (rs = -0,51; p < 0,05), A. tonsa (rs = -0,40; p < 0,05) e P. quasimodo (rs = -0,58; p < 0,05) apresentando correlações negativas com a salinidade, sendo o oposto observado para A. lilljeborgii (rs = 0,50; p < 0,05) (Figura 4).
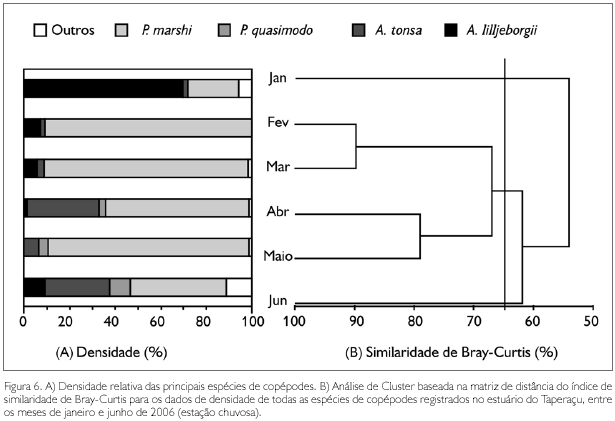
A análise de Cluster, realizada com base na densidade de todas as espécies de copépodes, evidenciou, no nível de 65% de similaridade, a formação de um único grupo, o qual foi constituído pelos meses de fevereiro, março, abril e maio, com os meses de janeiro e junho ficando isolados (Figura 6B). Através da análise SIMPER, foi possível constatar que as espécies que mais contribuíram para formação do grupo foram P marshi (65,78%), A. tonsa (19,29%), A. lilljeborgii (8,73%) e P. quasimodo (4,71%). No mês de janeiro, foi observada uma reduzida contribuição de P. marshi em contraposição ao registrado para A. lilljeborgii, atribuindo-se isto aos valores relativamente elevados de salinidade. O mês de junho foi caracterizado por uma distribuição mais equitativa entre as densidades das principais espécies de copépodes.
DISCUSSÃO
A precipitação pluviométrica é considerada por muitos autores como a variável climatológica mais importante em regiões tropicais (Moraes et al., 2005). Nestas regiões, as variações sazonais que ocorrem nos parâmetros hidrológicos estão principalmente relacionadas aos fatores climáticos, tais como a precipitação e a radiação solar (Tundisi, 1970). Para o estuário do Taperaçu, observou-se que a precipitação influenciou diretamente as condições físico-químicas da água, em especial a salinidade e o pH, com as menores (abril) e maiores (janeiro) médias mensais associadas, respectivamente, a elevados e moderados valores de precipitação. Para os ecossistemas estuarinos tropicais do Brasil (Thüllen & Berger, 2000; Mesquita et al., 2006; Magalhães et al., 2009) e do mundo (Capo et al., 2006; Lam-Hoai et al., 2006), as mudanças temporais de salinidade são especialmente influenciadas pela distribuição das chuvas no decorrer do ano.
A área de estudo foi considerada espacialmente homogênea quanto à variação dos parâmetros ambientais estudados. Isto esteve relacionado às características geomorfológicas do estuário, o qual não dispõe de drenagem continental significativa, capaz de proporcionar um influxo de água doce que possibilite, em associação com a água costeira, a formação de gradiente horizontal dos componentes hidrológicos. Desta forma, as características físico-químicas e biológicas observadas ao longo do estuário do Taperaçu foram, em grande parte, condicionadas pela entrada da água costeira no sistema, que é exclusivamente controlada pelo regime de macromarés semidiurnas, e não pelo influxo de um rio, como inicialmente sugerido por Costa et al. (2008), visto que, a partir de estudos mais recentes acerca da hidrodinâmica do Taperaçu (Nils Edvin Asp Neto, 2009, com. pess.), evidenciou-se que o referido estuário não possui bacia de drenagem.
A variabilidade temporal na estrutura da comunidade de copépodes tem sido relacionada à combinação dos fatores climatológicos regionais e parâmetros hidrográficos locais, além de outras associações multifatoriais, envolvendo variáveis biológicas e físico-químicas (Escribano & Hidalgo, 2000; Lo et al., 2004). No estuário do Taperaçu, as variações mensais ocorridas nas densidades das espécies dominantes de copépodes foram reguladas por mudanças na salinidade das águas costeiras, as quais foram ocasionadas por alterações nas taxas de precipitação. Na região costeira amazônica, ao contrário do que se observa no Taperaçu, o aumento da precipitação pluviométrica durante a estação chuvosa é responsável por aumentos graduais nas descargas dos rios, deslocando para longe da costa as águas mais salinas de origem marinha e, consequentemente, diminuindo os valores de salinidade em toda esta região.
A comunidade de copépodes do Taperaçu foi constituída por organismos de águas estuarinas, costeiras e oceânicas, com a predominância da ordem Calanoida, como observado em outros ecossistemas estuarinos e costeiros ao redor do globo (Mckinnon & Klumpp, 1998; Morgado et al., 2003; Vieira et al., 2003; Martins, A. L. P. et al., 2006). Dentre estes organismos, Pseudodiaptomus marshi, Acartia lilljeborgii, A. tonsa e Paracalanus quasimodo foram as espécies mais representativas, tanto em termos de densidade como de frequência de ocorrência.
Os copépodes da família Acartiidae são comumente registrados em áreas situadas próximas à linha da costa, nas quais podem ser observadas duas espécies do gênero Acartia coexistindo simultaneamente e, por vezes, com alternância nas densidades das espécies de acordo com a época do ano (Hubareva et al., 2008). Fato semelhante foi evidenciado para o presente trabalho, no qual, nos três primeiros meses de coleta, verificou-se a dominância numérica de A. lilljeborgii sobre A. tonsa, sendo o oposto observado nos meses subsequentes. A dominância de uma destas espécies sobre o seu congênere esteve associada às variações da salinidade, tendo A. tonsa apresentado as maiores contribuições durante os períodos em que foram registrados valores intermediários para este parâmetro, o que corrobora os resultados obtidos por Magalhães et al. (2009), os quais avaliaram as mudanças sazonais na estrutura da comunidade de copépodes no estuário do Curuçá, Norte do Brasil. Segundo Cervetto et al. (1999), A. tonsa atinge um desenvolvimento ótimo sob condições de salinidade que variam entre 15 a 22. Valores abaixo e acima desse intervalo podem, respectivamente, inibir a produção de ovos e/ou extrapolar os limites intra-específicos de tolerância à salinidade, afetando diretamente a sobrevivência da população.
Dominante em muitas áreas costeiras tropicais e subtropicais, P. quasimodo possui um comportamento marinho eurihalino, ocorrendo preferencialmente em águas mais salinas (Lopes et al., 1998), não sendo observado o mesmo comportamento para o estuário do Taperaçu, onde a menor e maior densidade para a espécie foram registradas concomitantemente ao maior e menor valor de salinidade. Sterza & Fernandes (2006), estudando a comunidade zooplanctônica do sistema estuarino da baía de Vitória, Espírito Santo, Brasil, constataram que P. quasimodo apresentou correlação positiva com a salinidade, indicando que a sua presença neste ecossistema dependeu do recrutamento de zonas costeiras adjacentes.
Na literatura, são muitos os estudos que descrevem a dominância de A. lilljeborgii, A. tonsa e P. quasimodo em estuários (Durbin & Durbin, 1981; Buskey et al., 1999; Hoffmeyer & Torres, 2001; Silva et al., 2003; Dias & Bonecker, 2008; Costa et al., 2009). Contudo, as contribuições destas espécies para a densidade total mensal dos copépodes foram pouco representativas quando comparadas às obtidas por P marshi. Esta última encontra-se relativamente bem distribuída ao redor do globo (Walter, 1986), sendo abundante em estuários e rios do norte e nordeste do Brasil (Björnberg, 1981).
No estuário do Taperaçu, os valores de densidade para P. marshi foram mais elevados do que os obtidos para estuário do Caeté (Krumme & Liang, 2004), litoral nordeste do estado do Pará. Estes dois ambientes estão conectados pelo canal de maré do Taici, por onde se observa um reduzido fluxo de água no sentido Caeté-Taperaçu durante as marés vazantes de sizígia, o que pode ocasionar o recrutamento de copépodes (por exemplo, P. marshi, A. tonsa) provenientes de zonas oligo-mesohalinas do Caeté. Tendo em vista as características geomorfológicas e hidrodinâmicas do Taperaçu, a importação de espécies típicas de áreas mais internas do Caeté poderia explicar a ocorrência das mesmas na região estudada, em especial no período em que prevaleceram as condições euhalinas (35 > salinidade superficial > 30). Embora seja apta a sobreviver e reproduzir em águas hipersalinas (Medeiros et al., 2006), o resultado obtido por meio da análise de correlação entre a salinidade e a densidade de P. marshi sugere a preferência desta espécie por águas estuarinas com baixos e moderados valores de salinidade. Portanto, a menor afinidade intra-específica às elevadas salinidades foi responsável pela reduzida contribuição de P. marshi no mês de janeiro em comparação aos demais meses de amostragem (fevereiro, março, abril, maio e junho).
A comunidade de copépodes foi caracterizada por baixas diversidades e equitabilidades de espécies. Padrões semelhantes foram observados para os copépodes coletados em outros estuários e baías (Uye, 1994), com poucas espécies dominantes (Hopcrofft et al., 1998). As oscilações mensais dos índices ecológicos estiveram associadas às mudanças nas densidades dos táxons dominantes, com o maior valor de diversidade observado em junho, mês em que se registrou uma distribuição mais equitativa entre as densidades das espécies dominantes. Situação antagônica foi evidenciada em fevereiro, onde P. marshi correspondeu à quase totalidade dos organismos coletados no mês. Segundo Omori & Ikeda (1984), a diversidade do zooplâncton diminui quando a comunidade é dominada por uma ou poucas espécies, quando indivíduos raros são substituídos por indivíduos de espécies mais comuns ou quando uma ou poucas espécies se reproduzem rapidamente.
A equitabilidade mostrou padrão similar à diversidade, com este último apresentando valores menores do que os reportados por Dias & Bonecker (2008), que estudaram a variabilidade interanual dos copépodes planctónicos em relação às condições hidrográficas da baía do Espírito Santo, Sudeste do Brasil, e constataram que as variações de salinidade e temperatura influenciaram a abundância das espécies dominantes (A. lilljeborgii, P. quasimodo, Oithona hebes Giesbrecht, 1891 etc.) e, por conseguinte, a diversidade da comunidade. As baixas diversidades e equitabilidades evidenciadas para o período de estudo (estação chuvosa) ocorreram possivelmente em virtude da redução do aporte de água marinha no Taperaçu, a qual foi ocasionada pelo aumento da precipitação, como discutido anteriormente. A entrada da água do mar no ambiente estuarino promove o recrutamento de organismos marinhos, aumentando a diversidade zooplanctónica nos estuários e, consequentemente, provocando mudanças na estrutura da comunidade destes organismos (Kibirige & Perissinotto, 2003; Froneman, 2004).
Por meio da análise de Cluster, foi verificada a formação de apenas um grupo (fevereiro, março, abril e maio), com os meses de janeiro e junho ficando isolados. Isto ocorreu devido às mudanças mensais no balanço das densidades entre as quatro principais espécies de copépodes, definidas, principalmente, pela maior ou menor tolerância destas às flutuações de salinidade, tornando evidente a ocorrência de um processo de sucessão entre elas. Estas flutuações são particularmente importantes porque podem exceder a faixa de tolerância das espécies e influenciar seus processos osmorregulatórios, afetando as suas distribuições no ambiente.
A sucessão temporal dos copépodes estuarinos é um processo principalmente controlado pela salinidade e temperatura, embora fatores como a competição e a predação desempenhem papel importante nesse processo (Wooldridge & Melville-Smith, 1979; Sullivan & McManus, 1986; Hoffmeyer, 1994). No estuário do Taperaçu, alguns dos copépodes dominantes são classificados como onívoros, apresentando uma variada gama de hábitos alimentares, como observado para A. tonsa e A. lilljeborgii (Uye et al., 1987; Paffenhõfer, 1991; Ara, 2001), o que, de certa forma, poderia diminuir a pressão da competição por alimento entre essas espécies, tornando-a um fator secundário no processo de sucessão ecológica. Todavia, não é possível dimensionar ainda a real contribuição destes fatores na estruturação das comunidades planctônicas deste estuário.
CONCLUSÃO
No presente estudo, não foram observadas diferenças espaciais significativas para os parâmetros abióticos e bióticos, o que esteve relacionado às características geomorfológicas do estuário do Taperaçu. Quanto à interação entre estes parâmetros, as análises de correlação de Spearman revelaram que a salinidade influenciou de forma significativa a estrutura da comunidade dos copépodes, sendo Pseudodiaptomus marshi, Acartia lilljeborgii, A. tonsa e Paracalanus quasimodo as espécies mais representativas, tanto em termos de densidade como de frequência de ocorrência. Os baixos valores observados para os índices ecológicos ocorreram possivelmente em virtude da redução do aporte de água marinha no Taperaçu, sendo este ocasionado pelo aumento da precipitação pluviométrica na região. A alternância mensal da dominância entre as principais espécies de copépodes, determinada por suas tolerâncias intra-específicas às variações de salinidade, demonstraram a ocorrência de um processo de sucessão envolvendo estas espécies durante o período de estudo. Não obstante, fatores como a predação e a competição podem estar atuando neste processo, muito embora, até o presente momento, não seja possível dimensionar a real importância desses fatores na estruturação das comunidades planctônicas do estuário do Taperaçu.
AGRADECIMENTOS
Este estudo foi financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), por meio dos Programas CT-Amazônia (# 553062/2005-0), Taxonomia (# 563967/05-6), CT-Hidro Casadinho (# 552126/05-5). Os autores L. C. C. Pereira e R. M. Costa agradecem ao CNPq pelas bolsas de Produtividade em Pesquisa concedidas aos mesmos (# 304392/2005-7, # 308953/2006-1, respectivamente). Suporte logístico e financeiro foi também provido pelo Laboratório de Plâncton e Cultivo de Microalgas, da Universidade Federal do Pará/Instituto de Estudos Costeiros.
REFERÊNCIAS
ACHUTHANKUTTY, C. T., N. RAMAIAH & G. PADMAVATI, 1998. Zooplankton variability and copepod assemblage in coastal and estuarine waters of Goa along the central west coast of India. In: A. C. PIERROT-BULTS & S. VAN DER SPOEL (Eds.): Pelagic Biogeography ICoPB II. Proceedings of the 2nd International Conference of Pelagic Biogeography 2: 1-11.
ARA, K., 2001. Daily egg production rate of the planktonic calanoid copepod Acartia lilljeborgi Giesbrecht in the Cananéia Lagoon estuarine system, São Paulo, Brazil. Hydrobiologia 445: 205-215.
ARA, K., 2004. Temporal variability and production of the planktonic copepod community in the Cananéia Lagoon estuarine system, São Paulo, Brazil. Zoological Studies 43(2): 179-186.
BJÕRNBERG, T. K. S., 1981. Copepoda. In: D. BOLTOVSKOY (Ed.): Atlas del zooplancton del Atlantico Sudoccidental y métodos de trabajo con el zooplancton marino: 587-679. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata.
BOLTOVSKOY, D., 1981. Atlas del zooplancton del Atlantico Sudoccidental y métodos de trabajos con el zooplancton marino: 1-936. Instituto Nacional de Investigación y Desarrollo Pesquero, Mar del Plata.
BRADFORD-GRIEVE, J. M., E. L. MARKHASEVA, C. E. F. ROCHA & B. ABIAHY 1999. Copepoda. In: D. BOLTOVSKOY (Ed.): South Atlantic Zooplankton: 869-1098. Backhuys, Netherlands.
BRUGNOLI-OLIVERA, E. & A. MORALES-RAMÍREZ, 2008. Trophic planktonic dynamics in a tropical estuary, Gulf of Nicoya, Pacific coast of Costa Rica during El Niño 1997 event. Biología Marina y Oceanografia 43(1): 75-89.
BUSKEY, E. J., K. H. DUNTON & P. L. PARKER, 1999. Variations in stable carbon isotope ratio of the copepod Acartia tonsa during the onset ofthe Texas brown tide. Estuaries and Coasts 22(4): 995-1003.
CALEF, G. W. & G. D. GRICE, 1967. Influence of the Amazon River outflow on the ecology of the western tropical Atlantic. II. Zooplankton abundance, copepod distribution, with remarks on the fauna of low-salinity areas. Journal of Marine Research 25(1): 84-94.
CAPO, S., A. SOTTOLICHIO, I. BRENON, P. CASTAING & L. FERRY, 2006. Morphology, hydrography and sediment dynamics in a mangrove estuary: the Konkoure estuary, Guinea. Marine Geology 230(3-4): 199-215.
CERVETTO, G., R. GAUDY & M. PAGANO, 1999. Influence of salinity on the distribution of Acartia tonsa (Copepoda, Calanoida). Journal of Experimental Marine Biology and Ecology 239: 33-45.
CLARKE, K. R. & R. M. WARWICK, 1994. Change in marine communities: an approach to statistical analysis and interpretation: 1-144. Plymouth Marine Laboratory, Plymouth.
CLOERN, J. E., T. M. POWELL & L. M. HUZZLEY, 1989. Spatial and temporal variability in South Francisco Bay (USA): temporal changes in salinity, suspended sediments, phytoplankton biomass and productivity over tidal time scales. Estuarine, Coastal and ShelfScience 28(2): 599-613.
CONOVER, W. J., 1971. Practical nonparametric statistics: 1-462. John Wiley & Sons, New York.
COSTA, K. G., L. C. C. PEREIRA & R. M. COSTA, 2008. Short and long-term temporal variation of the zooplankton in a tropical estuary (Amazon region, Brazil). Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 3(2): 127-141.
COSTA, R. M., N. R. LEITE & L. C. C. PEREIRA, 2009. Mesozooplankton of the Curuçá Estuary (Amazon Coast, Brazil). Journal of Coastal Research 56: 400-404.
DAHL, F., 1894. Die Copepoden fauna des unteren Amazonas. Berichte der Naturforschenden Gesellschaft zu Freiburg i. Br. 8: 10-23.
DAVID, V., B. SAUTOUR & P. CHARDY, 2007. Successful colonization of the calanoid copepod Acartia tonsa in the oligo-mesohaline area of the Gironde estuary (SW France) - Natural or anthropogenic forcing? Estuarine, Coastal and Shelf Science 71: 429-442.
DHN, 2008. Diretoria de Hidrografia e Navegação. Disponível em: <http://www.mar.mil.br/dhn/~tabuas>. Acesso em: 25 janeiro 2008.
DIAS, C. O. & S. L. C. BONECKER, 2008. Inter-annual variability of planktonic copepods in a tropical bay in Southeastern Brazil. Brazilian Archives of Biology and Technology 51(4): 731-742.
DURBIN, A. G. & E. G. DURBIN, 1981. Standing stock and estimated production rates of phytoplankton and zooplankton in Narragansett Bay, Rhode Island. Estuaries and Coasts 4(1): 24-41.
DYER, K. R., 1982. Localized mixing of low salinity patterns in a partially mixed estuary (Southampton water, England). In: V S. KENNEDY (Ed.): Estuarine Comparisons: 21-36. Academic Press, London.
ESCRIBANO, R. & P. HIDALGO, 2000. Spatial distribution of copepods in the North of the Humboldt Current region off Chile during coastal upwelling. Journal of Marine Biological Association 80: 283-290.
FRONEMAN, P. W., 2004. Zooplankton community structure and biomass in a southern African temporarily open/closed estuary. Estuarine, Coastal and Shelf Science 60: 125-132.
GIARRIZZO, T. & U. SAINT-PAUL, 2008. Ontogenetic and seasonal shifts in the diet of the pemecou sea catfish Sciades herzbergii (Siluriformes: Ariidae), from a macrotidal mangrove creek in the Curuçá estuary, Northern Brazil. Revista de Biología Tropical 56(2): 861-873.
HOFFMEYER, M. S., 1994. Seasonal succession of Copepoda in the Bahía Blanca estuary. In: F. D. FERRARI & B. P. BRADLEY (Eds.): Ecology and Morphology of Copepods. Hydrobiologia 292/293: 303-308.
HOFFMEYER, M. S. & E. R. TORRES, 2001. Morphometric variables and individual volume of Eurytemora americana and Acartia tonsa females (Copepoda, Calanoida) from the Bahía Blanca estuary, Argentina. Hydrobiologia 459: 73-82.
HOFFMEYER, M. S., A. A. BERASATEGUI, D. BEIGT & M. C. PICCOLO, 2009. Environmental regulation of the estuarine copepods Acartia tonsa and Eurytemora americana during coexistence period. Journal of the Marine Biological Association of the United Kingdom 89(2): 355-361.
HOPCROFT, R. R., J. C. ROFF & D. LOMBARD, 1998. Production of tropical copepods in Kingston Harbour, Jamaica: the importance of small species. Marine Biology 130(4): 593-604.
HUBAREVA, E., L. SVETLICHNY A. KIDEYS & M. ISINIBILIR, 2008. Fate of the Black Sea Acartia clausi and Acartia tonsa (Copepoda) penetrating into the Marmara Sea through the Bosphorus. Estuarine, Coastal and Shelf Science 76: 131-140.
INMET INSTITUTO NACIONAL DE METEOROLOGIA, 1992. Normas climatológicas (1961 - 1990). Brasília, Distrito Federal.
KAISER, M. J., M. J. ATTRILL, S. JENNINGS, D. N. THOMAS, D. K. A. BARNES, A. S. BRIERLEY, N. V. C. POLUNIN, D. G. RAFFAELLI & P. J. LE B. WILLIAMS, 2005. Marine Ecology: Processes, Systems, and Impacts: 1-557. Oxford University Press, USA.
KIBIRIGE, I. & R. PERISSINOTTO, 2003. The zooplankton community of the Mpenjati Estuary, a South African temporarily open/closed system. Estuarine, Coastal and Shelf Science 58: 727-741.
KRUMME, U. & T. H. LIANG, 2004. Tidal-induced changes in a copepod-dominated zooplankton community in a macrotidal mangrove channel in Northern Brazil. Zoological Studies 43(2): 404-414.
KRUMME, U., U. SAINT-PAUL & H. ROSENTHAL, 2004. Tidal and diel changes in the structure of a nekton assemblage in small intertidal mangrove creeks in northern Brazil. Aquatic Living Resources 17: 215-229.
LAM-HOAI, T., D. GUIRAL & C. ROUGIER, 2006. Seasonal change of community structure and size spectra of zooplankton in the Kaw River estuary (French Guiana). Estuarine, Coastal and Shelf Science 68(1-2): 47-61.
LAWRENCE, D., I. VALIELA & G. TOMASKY 2004. Estuarine calanoid copepod abundance in relation to season, salinity, and land-derived nitrogen loading, Waquoit Bay, MA. Estuarine, Coastal and Shelf Science 61: 547-557.
LEITE, N. R., J. G. S. SILVA, S. C. C. PINHEIRO, L. C. C. PEREIRA, F. ABRUNHOSA & R. M. COSTA, 2007. Occurrence and distribution of Cymbasoma longispinosum (Copepoda: Monstrilloida) in Curuçá estuary (Northern Brazil). In: M. J. PEREIRA, U. M. AZEITEIRO, F. GONÇALVES & I. JENKINSON (Eds.): Proceedings of Plankton Symposium IV. BDUA Journalof Biology 2: 88.
LENZ, J., 2005. Introduction. In: R. P. HARRIS, P. H. WIEBE, J. LENZ, H. R. SKJOLDAL & M. HUNTLEY (Eds.): Zooplankton Methodology Manual: 1-32. Elsevier, Amsterdam.
LO, W. T., C. L. C. CHUNG & C. T. SHIH, 2004. Seasonal distribution of copepods in Tapong Bay. Zoological Studies 43: 464-474.
LOPES, R. M., R. VALE & F. P. BRANDINI, 1998. Composição, abundância e distribuição espacial do zooplâncton no complexo estuarino de Paranaguá durante o inverno de 1993 e o verão de 1994. Revista Brasileira de Oceanografia 46(2): 195-211.
MAGALHÃES, A., R. M. COSTA, T. H. LIANG, L. C. C. PEREIRA & M. J. S. RIBEIRO, 2006. Spatial and temporal distribution in density and biomass of two Pseudodiaptomus species (Copepoda: Calanoida) in the Caeté River Estuary (Amazon region - North of Brazil). Brazilian Journal of Biology 66(2A): 421-430.
MAGALHÃES, A., N. R. LEITE, J. G. S. SILVA, L. C. C. PEREIRA & R. M. COSTA, 2009. Seasonal variation in the copepod community structure from a tropical Amazon estuary, Northern Brazil. Anaisda Academia Brasileira de Ciências 81(2): 187-197.
MARTINS, A. A. V., R. A. M. COSTA & L. C. C. PEREIRA, 2006. Distribuição espaço-temporal da comunidade zooplanctônica de uma lagoa costeira artificial na região amazônica, Bragança, Pará, Brasil. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 1(3): 103-111.
MARTINS, A. L. P., M. J. S. LOPES & O. T. MELO, 2006. Zooplâncton como bioindicador da qualidade ambiental no estuário do rio Anil, São Luís, Maranhão. Boletim do Laboratório de Hidrobiologia 19: 51-60.
MARTORANO, L. G., L. C. PEREIRA, E. G. M. CÉZAR & I. C. B. PEREIRA, 1993. Estudos climáticos do estado do Pará, classificação climática (Kóppen) e deficiência hídrica (Thornthwhite, Mather): 1-53. SUDAM/EMBRAPA/SNLCS, Belém.
MATNI, A. S., M. P. M. MENEZES & U. MEHLIG, 2006. Estrutura dos bosques de mangue da península de Bragança, Pará, Brasil. Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 1(3): 43-52.
MCEWEN, G. F., M. W. JOHNSON & T. R. FOLSOM, 1957. A statistical analysis of the performance of the Folsom plankton sample splitter, based upon test observations. Archives of Meteorology, Geophysics and Climatology (Serie A) 7: 502-527.
MCKINNON, A. D. & D. W. KLUMPP, 1998. Mangrove zooplankton of North Queensland, Australia. I. Plankton community structure and environment. Hydrobiologia 362: 127-143.
MEDEIROS, G. F., L. S. MEDEIROS, D. M. F. HENRIQUES, M. T. L. CARLOS, G. V. B. S. FAUSTINO & R. M. LOPES, 2006. Current distribution of the exotic copepod Pseudodiaptomus trihamatus Wright, 1937 along the northeastern coast of Brazil. Brazilian Journal of Oceanography 54(4): 241-245.
MESQUITA, S. S. A., R. M. COSTA, L. C. C. PEREIRA & A. MAGALHÃES, 2006. Composição, ocorrência e distribuição das hidromedusas no estuário do Rio Caeté, litoral do Estado do Pará (Norte do Brasil). Boletim do Museu Paraense Emílio Goeldi.Ciências Naturais 1(3): 113-119.
MORAES, B. C., J. M. N. COSTA, A. C. L. COSTA & M. H. COSTA, 2005. Variação espacial e temporal da precipitação no estado do Pará. Acta Amazonica 35(2): 207-214.
MORGADO, F., H. QUEIROGA, F. MELO & J.-C. SORBE, 2003. Zooplankton abundance in a coastal station off the Ria de Aveiro inlet (north-western Portugual): relations with tidal and day/night cycles. Acta Oecologica 24: S175-S181.
OMORI, M. & T. IKEDA, 1984. Methods in marine zooplankton ecology: 1-332. John Wiley, New York.
PAFFENHÕFER, G. A., 1991. Some characteristics of abundant subtropical copepods in estuarine, shelf and oceanic waters. Bulletin Plankton Society of Japan, Special Volume 201-216.
PIELOU, E. C., 1977. Mathematical Ecology: 1-385. Wiley, New York.
PLOURDE, S., J. J. DODSON, J. A. RUNGE & J.-C. THERRIAULT, 2002. Spatial and temporal variations in copepod community structure in the lower St. Lawrence Estuary, Canada. Marine Ecology Progress Series 230: 211-224.
RAMAIAH, N. & V. R. NAIR, 1997. Distribution and abundance of copepods in the pollution gradient zones of Bombay Harbour-Thana creek-Bassein creek, west coast of India. Indian Journal of Marine Sciences 26: 20-25.
SARKAR, S. K. & A. CHOUDHURY, 1998. Distribution of inshore copepod of the Bay of Bengal off Sagar Island: a multivariate analysis. Tropical Ecology 29: 146-158.
SCHAEFFER-NOVELLI, Y., 1995. Manguezal: ecossistema entre a terra e o mar: 1-64. Caribbean Ecological Research, São Paulo.
SCHORIES, D. & U. MEHLIG, 2000. CO2 gas exchange of benthic microalgae during exposure to air: a technique for the rapid assessment of primary production. Wetlands Ecology and Management 8: 273-280.
SHANNON, C. E., 1948. A mathematical theory of communication. Bell System Technical Journal 27: 379-423.
SILVA, T. A., S. NEUMANN-LEITÃO, R. SCHWAMBORN, L. M. O. GUSMÃO & D. A. NASCIMENTO-VIEIRA, 2003. Diel and seasonal changes in the macrozooplankton community of a tropical estuary in Northeastern Brazil. Revista Brasileira de Zoologia 20(3): 439-446.
SOUZA FILHO, P. W. M. & M. A. EL-ROBRINI, 1997. A influência das variações do nível do mar na sedimentação da Planície Costeira Bragantina durante o Holoceno - Nordeste do Pará, Brasil. In: M. L. COSTA & R. S. ANGÉLICA (Eds.): Contribuições à Geologia da Amazônia: 307-337. FINEP/SBG, Belém.
STATSOFT, 2001. STATISTICA (Data analysis software system), versão 6. Disponível em: <http://www.statsoft.com.br>. Acesso em: julho 2004.
STERZA, J. M. & L. L. FERNANDES, 2006. Zooplankton community ofthe Vitória Bay estuarine system (Southeastern Brazil). Characterization during a three-year study. Brazilian Journal of Oceanography 54(2/3): 95-105.
SULLIVAN, B. K. & L. T. MCMANUS, 1986. Factors controlling seasonal succession of the copepods Acartia hudsonica and A. tonsa in Narragansett Bay, Rhode Island: temperature and resting egg production. Marine Ecology Progress Series 28: 121-128.
THÚLLEN, N. & U. BERGER, 2000. A comparative examination of environmental factors at patchy mangrove seedling stands on the peninsula of Bragança, Northern Brazil. Ecotropica 6(1): 1-12.
TRÉGOUBOFF, G. & M. ROSE, 1957. Manuel de planctonologie méditerranéenne: 1-587. Centre National de la Recherche Scientifique, Paris.
TUNDISI, J. G., 1970. O plâncton estuarino. Contribuições Avulsas do Instituto Oceanográfico da Universidade de São Paulo, série Oceanográfica Biológica 19: 1-22.
UNDERWOOD, A. J., 1997. Experiments in ecology: their logical design and interpretation using analysis of variance: 1-504. Cambridge University Press, Cambridge.
UYE, S., 1994. Replacement of large copepods by small ones with eutrophication of embayments: cause and consequence. Hydrobiologia 292/293(1): 513-519.
UYE, S., H. KUWATA & T. ENDO, 1987. Standing stocks and production rates of phytoplankton and planktonic copepods in the Inland Sea of Japan. Journal of Oceanography 42: 421-434.
VIEIRA, L., U. AZEITEIRO, P. RÉ, R. PASTORINHO, J. C. MARQUES & F. MORGADO, 2003. Zooplankton distribution in a temperate estuary (Mondego estuary southern arm: Western Portugal). Act Oecologica 24: 163-173.
WALTER, T. C., 1986. The zoogeography of genus Pseudodiaptomus (Calanoida: Pseudodiaptomidae). Syllogeus 58: 502-508.
WOOLDRIDGE, T. & R. MELVILLE-SMITH, 1979. Copepod succession in two South African estuaries. Journal of Plankton Research 1: 329-342.
WRIGHT, S. A., 1936a. A revision of South American species of Pseudodiaptomus. Anais da Academia Brasileira de Ciências 8(1): 1-27.
WRIGHT, S. A., 1936b. Preliminary report on six new species of Diaptomus from Brazil. Anais da Academia Brasileira de Ciências 8(2): 79-85.
ZAR, J. H., 1999. Bioestatistical analysis: 1-929. Prentice Hall, New Jersey.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail:boletim@museu-goeldi.br
Recebido: 06/02/2009
Aprovado: 27/08/2009