Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Boletim do Museu Paraense Emílio Goeldi Ciências Naturais
versão impressa ISSN 1981-8114
Bol. Mus. Para. Emilio Goeldi Cienc. Nat. v.4 n.3 Belém dez. 2009
Aspectos taxonômicos e morfológicos do processo germinativo e da plântula de Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F. Silva (Leguminosae – Caesalpinioideae)
Taxonomic and morphological aspects of the germination and seedling of Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F. Silva (Leguminosae – Caesalpinioideae)
Maria Maricélia Félix-da-SilvaI; Maria de Nazaré do Carmo BastosII; Ely Simone Cajueiro GurgelIII
IMuseu Paraense Emílio Goeldi. Coordenação de Botânica. Belém, Pará, Brasil (mariafelix29@yahoo.com.br)
IIMuseu Paraense Emílio Goeldi. Coordenação de Botânica. Belém, Pará, Brasil (nazir@museu-goeldi.br)
IIIMuseu Paraense Emílio Goeldi. Coordenação de Botânica. Belém, Pará, Brasil (esgurgel@museu-goeldi.br)
RESUMO
Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F Silva, proveniente da região amazônica e conhecida popularmente como pau-roxo, fornece madeira de excelente qualidade, principalmente para a construção civil e marcenaria. Este trabalho apresentou o objetivo de descrever as estruturas reprodutivas, o processo germinativo e a morfologia da plántula da referida subespécie, além de apresentar ilustrações inéditas, visando subsidiar o reconhecimento dessa subespécie nas formações naturais e o manejo dela. As áreas de coleta foram o igarapé Caquajó e a grade do Programa de Pesquisa em Biodiversidade (PPBio), em Portel; em Melgaço, foram a área da Estação Científica Ferreira Penna (ECFPn) e o rio Curuá. O estudo foi realizado em laboratório e condições de viveiro. A identificação taxonômica da subespécie foi baseada principalmente em literatura especializada. Exsicatas representativas foram depositadas no herbário 'João Murça Pires' (MG), do Museu Paraense Emílio Goeldi. A subespécie apresentou inflorescencias em panículas terminais ou subterminais; bractéolas ovais ou orbiculares, rígidas e côncavas; flor com quatro sépalas, cinco pétalas e dez estames; fruto seco, indeiscente e monospérmico; e sementes largamente obovadas, com hilo terminal. A germinação é epígea e fanerocotiledonar. Aos 35 dias, a plántula estava completamente desenvolvida.
Palavras-chave: Pau-roxo. Caxiuanã. Igarapé Caquajó. Rio Curuá.
ABSTRACT
Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F Silva, from the Amazon region and known popularly as purpleheart, supplies wood of excellent quality, mainly for construction and carpentry. This study aimed to describe the reproductive structures, the germination and seedling morphology of this subspecies, and present unpublished illustrations and to support its recognition in the natural formations and its management. Collecting areas: Caquajó stream and plot of the Research Program in Biodiversity (PPBio) in Portel. In Melgaço, the area of the Ferreira Penna Research Station (ECFPn) and Curuá river. The study was conducted in laboratory and nursery conditions. The taxonomic identification of the subspecies was mainly based in literature. Representative specimens were deposited in the herbarium 'João Murça Pires' (MG), the Museu Paraense Emílio Goeldi. The subspecies presents the inflorescence in terminal or subterminal panicles; bracteoles oval or orbicular, rigid and concaves; flower with four sepals, five petals and ten stamens; fruit dry, indehiscent and monospermic; and seeds broadly obovate, with hilum terminal. The germination is epigeal and phanerocotylar. At thirty-five days, the seedling was fully developed.
Keywords: Purpleheart. Caxiuanã. Caquajó stream. Curuá river.
INTRODUÇÃO
Peltogyne Vogel (1837) é um gênero neotropical, podendo ser encontrado do México ao Panamá, Venezuela, Guiana, Suriname, Guiana Francesa, Colômbia, Bolívia e Brasil, tendo como centro de diversidade a Amazónia Central (Silva, 1976). Seus indivíduos têm porte variável e ocorre em diversos tipos de habitat. A madeira da maioria das espécies de Peltogyne sp. é avermelhada a violácea, empregada na movelaria, pela beleza de sua coloração, bem como na construção civil e hidráulica, por ser de excelente qualidade, pela durabilidade e resistência que oferece ao ataque de insetos. Outros segmentos, como o artesanato e o mercado joalheiro, estão utilizando a madeira como material alternativo - os resíduos ou aparas das indústrias madeireiras - na produção de bijuterias e joias, puramente feitas destes ou em combinação com outros materiais, como o metal, cristais, porcelana, acrílico e conchas, uma forma inteligente e responsável de utilizar os recursos da natureza e um estímulo a valorizar a diversidade de madeiras no mercado.
Esse gênero é subordinado à Leguminosae, a qual compreende 36 tribos, 727 gêneros, 19.325 espécies (Lewis et al., 2005; Engler, 1964) e à Caesalpinioideae, com cerca de 3.000 espécies (Martins & Silva, 1999), abrangendo, principalmente, árvores e arbustos (Martins & Silva, 1999; Lewis et al., 2005). Para o Brasil, estimam-se 178 gêneros e 1.550 espécies de leguminosas (Barroso et al., 1984).
Estudos iniciais sobre Peltogyne foram realizados por Bentham (1870). Uma das maiores contribuições sobre esse gênero foi publicada por Ducke (1938), o qual apresenta uma chave taxonómica e comentários sucintos sobre as espécies que ocorrem na Amazónia brasileira. O estudo mais recente sobre o gênero foi realizado por Silva (1976), que contempla as espécies amazônicas e extra-amazónicas. Neste estudo, a autora apresenta duas novas espécies: Peltogyne heterophylla M.F Silva e Peltogyne prancei M.F Silva, ambas da Amazónia brasileira, totalizando 23 espécies e a breve descrição de cinco táxons infraespecíficos: Peltogyne campestris var. rigida (Ducke) M.F. Silva, Peltogyne catingae subsp. glabra (W. Rodrigues) M.F Silva, Peltogyne paniculata subsp. pubescens (Benth.) M.F Silva, Peltogyne parvifolia var. glabra M.F Silva e Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F Silva. De acordo com Lewis et al. (2005), o gênero, atualmente, compreende 25 espécies.
A breve descrição realizada por Silva (1976) não inclui informações referentes aos aspectos morfológicos da germinação e da plántula. Esses estudos morfológicos auxiliam na identificação botánica da espécie e no reconhecimento dela em bancos de sementes do solo e em fase de plántulas em formações florestais. Além disso, informações sobre a morfologia do processo germinativo e da plántula contribuem para o estudo dos mecanismos de dispersão, sucessão e regeneração natural (Melo et al., 2004).
Os principais estudos de classificação de plántulas foram realizados por De Candolle (1825), Duke (1965, 1969), Vogel (1980), Duke & Polhill (1981), Garwood (1983), Parra (1984) e Miquel (1987), com base na posição, exposição, consistência e função dos cotilédones durante o processo de germinação e crescimento inicial, dentre outros fatores.No Brasil, estudos sobre as características morfológicas de sementes, germinação e plántulas são recentes e escassos se comparados ao número de ambientes (biomas) e táxons que ocorrem no país. De acordo com Miquel (1987), Oliveira & Beltrati (1992) e Garwood (1995), isso se deve, principalmente, à falta de tradição no uso dessas características e de informações sobre a biologia reprodutiva de alguns táxons. Entretanto, vários pesquisadores estão empenhados em preencher essa lacuna, desenvolvendo estudos sobre a morfologia da germinação e da plántula, envolvendo espécies florestais e não florestais, como demonstram as Dissertações de Mestrado de C. M. Beltrati, de 1973, intitulada "Morfologia das sementes e de sua germinação, em dezoito espécies de Eucalyptus", e de E. S. C. Gurgel, de 2000, intitulada "Morfologia de frutos, sementes, germinação e plántulas de leguminosas presentes em uma vegetação de mata secundária na Amazónia central", e a Tese de Doutorado de R. C. V Martins-da-Silva, de 2006, intitulada "Taxonomia das espécies de Copaifera L. (Leguminosae-Caesalpinioideae) ocorrentes na Amazônia brasileira", bem como as pesquisas de Melhem (1975), Silva et al. (1988), Varela & Ferraz (1991), Oliveira & Beltrati (1992), Oliveira (1993), Ferreira et al. (1998), Donadio & Demattê (2000), Oliveira (1999, 2001), Melo et al. (2004), Brum et al. (2007) e Lima et al. (2008).
As plântulas apresentam extraordinária diversidade morfológica (Garwood, 1996) e podem auxiliar na identificação de espécies em estudos de regeneração natural (Araújo Neto et al., 2002), recebendo, inclusive, uma classificação específica, fanerocotiledonar ou criptocotiledonar, em referência à liberação ou não dos cotilédones do tegumento da semente (Duke, 1965).
O presente estudo objetivou descrever e ilustrar as estruturas reprodutivas, o processo germinativo e a morfologia da plântula de Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F. Silva, e apresentar uma descrição mais detalhada, além de ilustrações inéditas, visando subsidiar o reconhecimento dessa subespécie (identificação) nas formações naturais e o manejo dela.
MATERIAL E MÉTODOS
ÁREA DE ESTUDO
A Floresta Nacional (FLONA) de Caxiuanã abrange uma área de 330.000 hectares com limites 1o 30' e 2o 30' latitude Sul e 51o 15' e 52o 15' longitude Oeste, na porção inferior do rio Anapu, Amazônia Oriental, nos municípios de Melgaço e Portel, estado do Pará, distando 400 km da cidade de Belém. As áreas de coleta foram a Estação Científica Ferreira Penna (1o 30' / 1o 50' S e 51o 15' / 51o 45' W) e a floresta ao longo do rio Curuá (1o 44' 29" S e 51o 25' 58" W), em Melgaço. Em Portel, as áreas foram a grade do Programa de Pesquisa em Biodiversidade (PPBio) (1o 58' 58" S e 51o 38' 16" W), uma área que compreende 25 km2, dividida em 30 parcelas permanentes de 250 m x 40 m, e a floresta às margens do igarapé Caquajó (1o 57' 37" S e 51o 37' 52" W), o qual dá acesso à referida grade (Figura 1).
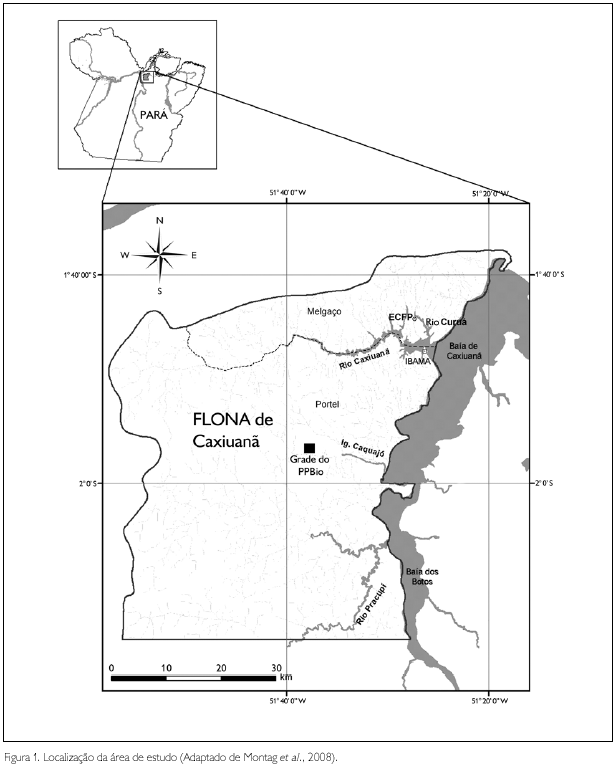
O clima da região é do tipo Am (classificação de Kõppen), clima tropical úmido (Lisboa et al., 1997), com temperatura média anual de 26 oC e umidade relativa do ar em torno de 85% (Lisboa & Ferraz, 1999). Geologicamente, a região de Caxiuanã apresenta sedimentos da formação Alter do Chão (Kern & Costa, 1997), com relevo plano a ondulado, sem grandes elevações e os Latossolos Amarelos representam a unidade mais importante daquela região (Costa et al., 2002).
A cobertura vegetal da FLONA de Caxiuanã é diversificada. Os ecossistemas típicos de floresta estão representados por áreas de terra firme e alagadas (igapó e várzea), além de manchas de vegetação secundária e vegetação não florestal, semelhantes a savanas (Lisboa & Ferraz, 1999).
TRABALHO DE CAMPO
As coletas do material botânico foram efetuadas em janeiro, fevereiro, julho e novembro de 2007. A coleta, a preservação e a herborização dos espécimes estão de acordo com as técnicas propostas por Fidalgo & Bononi (1984). Coletaram-se frutos diretamente da árvore, os quais foram acondicionados em saco de papel Kraft e, posteriormente, transportados ao Laboratório de Botânica do Museu Goeldi.
EXPERIMENTO, ANÁLISE E IDENTIFICAÇÃO DO MATERIAL
O experimento para a descrição e caracterização do tipo de germinação e morfologia da plântula foi conduzido em viveiro, à temperatura ambiente, no campus de pesquisa do Museu Paraense Emílio Goeldi.
Os frutos e as sementes foram medidos, descritos e fotografados. As sementes foram retiradas dos frutos manualmente. A semeadura (50 sementes) foi efetuada em bandejas de plástico de 80 x 40 x 20 cm, contendo terra preta como substrato, a ± 0,5 cm de profundidade. Todas as fases, a partir do intumescimento da semente até a formação da plântula, foram fotografadas. A partir da emissão da raiz primária, os indivíduos foram removidos e desidratados em estufa a gás, a fim de confeccionar as exsicatas. Durante o experimento, regas manuais foram efetuadas em dias alternados, a fim de manter umidade adequada para germinação das sementes e para o desenvolvimento das plântulas.
Considerou-se 'germinação' o período compreendido entre o intumescimento da semente até o rompimento do tegumento pela raiz primária e 'plântula completamente desenvolvida' a fase em que o primeiro par de eofilos estava totalmente formado.
Segundo Andrade & Damião Filho (1989) e Oliveira (1993), a germinação é chamada epígea quando os cotilédones se elevam acima do nível do solo, e hipógea quando permanecem enterrados até o final do processo de formação da plântula.
De acordo com Duke (1965), as plântulas podem ser classificadas em fanerocotiledonares ou criptocotiledonares, isto se refere à liberação ou não dos cotilédones do tegumento da semente. Nas fanerocotiledonares, os cotilédones saem por completo do tegumento e, nas criptocotiledonares, estes permanecem envolvidos pelo tegumento.
Para o processo germinativo e a morfologia da plántula, a terminologia empregada está de acordo com Duke (1965, 1969), Radford et al. (1974), Duke & Polhill (1981), Andrade & Damião Filho (1989), Stearn (1992) e Oliveira (1993).
Inflorescências foram desidratadas em estufa a gás. Posteriormente, foram dissecadas e montadas em suportes metálicos (stub) e metalizadas com ouro durante dois minutos e meio. O material foi analisado em microscópio eletrônico LEO modelo 1450 VP, pertencente ao Laboratório Institucional de Microscopia Eletrônica de Varredura do Museu Paraense Emílio Goeldi.
A terminologia utilizada para as estruturas morfológicas da planta matriz está baseada nos trabalhos de Hickey (1973), Radford et al. (1974) e Rizzini (1977). A identificação da subespécie foi baseada em literatura, associada ao método clássico da morfologia comparada, utilizando-se espécimes herborizados, identificados por especialistas. Exsicatas representativas foram depositadas no herbário 'João Murça Pires' (MG), do Museu Paraense Emílio Goeldi.
O material examinado foi citado de acordo com o Index Herbariorum (Holmgren & Holmgren, 1998). A abreviatura dos nomes dos autores dos táxons está de acordo com Brummitt & Powell (1992). As informações sobre distribuição geográfica, floração, frutificação e nomes vernaculares foram retiradas das etiquetas das exsicatas e da literatura.
RESULTADOS
Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F. Silva. Acta Amazonica 6(1): 50. Supl. 1976 (Figuras 2 e 3).
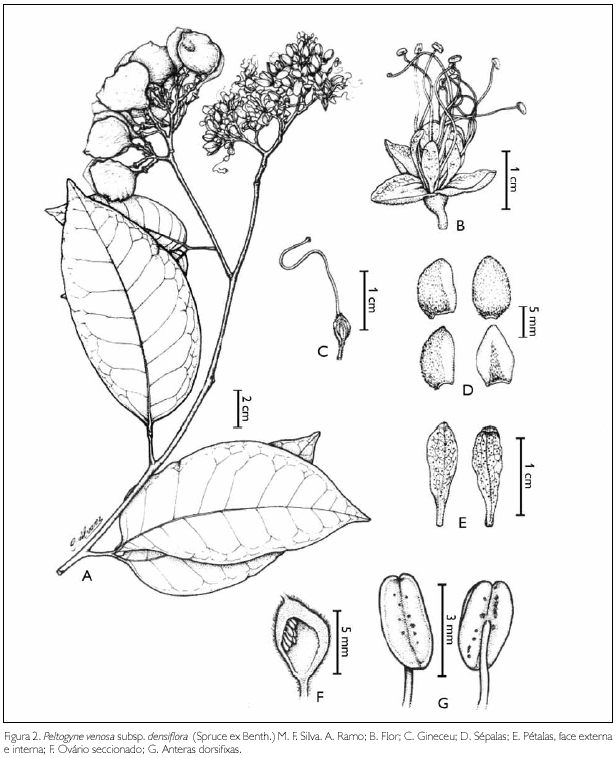

Peltogyne densiflora Spruce ex Benth., in Martius Fl. Bras. 15(2): 232-233. Pl. 60, f. 2. 1870. Tipo. Brasil. Pará. Ilha de Marajó, fr., Martius s.n. (isótipo M).
Peltogyne paraensis Huber, Bol. Mus. Para. Emílio Goeldi 6: 82. 1910.
Peltogyne venosa var. densiflora (Spruce ex Benth.) Amshoff, Meded. Bot. Mus. Herb. Rijks Univ. Utrecht 52: 15-16. 1939.
Árvore com 4-8 m de altura, fuste tortuoso, ramos com indumento, castanho-avermelhados. Estípulas ausentes. Folhas alternas, bifolioladas, com pecíolos de 1-2,5 cm de comprimento, sulcados a plano enrugados; peciólulos 2-5 mm de comprimento; folíolos 7-18 cm de comprimento, 2,5-9 cm de largura, oblongos a ovaloblongos, levemente falcados, margem inteira, glabra, ápice acuminado ou obtuso, base assimétrica, cuneada, obtusa, glabros na face adaxial, cartáceos, nervura central abaxial proeminente; plana a levemente sulcada na adaxial, venação broquidódroma, nervuras secundárias conspícuas e alternas, em ambas as faces, com glândulas distribuídas por todo o limbo. Inflorescências em panículas terminais ou subterminais, com tricomas simples e perolados; eixo pubescente, tricomas perolados; pedicelo 4-4,4 mm de comprimento, 1-1,3 mm de espessura; brácteas não observadas; bractéolas 5-6 mm de comprimento, 3-30 mm de largura, ovais ou orbiculares, rígidas, côncavas, face interna glabra, externa pilosa e carenada no dorso, margem ciliada. Botão floral 15-17,1 mm de comprimento, com indumento. Hipanto 4-4,4 mm de espessura, tomentoso. Sépalas 4, com 7-12 mm de comprimento, pilosas, brilhosas, com tricomas perolados, imbricadas, a sépala interna é totalmente pilosa e a externa possui as laterais glabras e glandulosas. As duas sépalas que são mais internas no cálice apresentam a parte interna pilosa e a externa glabra. Pétalas 5, com 8-13 mm de comprimento, 2-5 mm de largura, rosadas, glandulosas. Estames 10, com 3 cm de comprimento, rosados, glabros, localizados entre as pétalas, de dois em dois; anteras oblongas, rimosas e dorsifixas. Ovário obovado, 4-7,7 mm de comprimento, 4-5,5 mm de largura, 0,5-0,8 mm de espessura, densamente piloso, tricomas perolados, unilocular, com 6-8-óvulos, 0,9 mm de comprimento, 0,4 mm de largura, placentação parietal; estípite com tricomas perolados, concentrando-se mais no ápice; estilete 1-2,5 cm de comprimento, rosado, terminal, filiforme e glabro; estigma peltado, 1,16 mm de comprimento, 0,8 mm de largura. Fruto legume, 2,5-3,5 cm de comprimento, 2,5-3 cm de largura, 4-4,8 mm de espessura, seco, indeiscente, monospérmico, lenhoso, plano-comprimido, verde quando imaturo e castanho-avermelhado quando maduro, com tricomas simples na superfície, mesmo quando maduro. Semente largamente obovada, 13-14,5 mm de comprimento, 11,5-12,5 mm de largura, 3-3,8 mm de espessura, hilo terminal, com inserção apical pêndula no fruto, castanho-clara, glabra, com tegumento permeável.
Material examinado: Brasil. Amapá: rio Araguari, 04/09/1961 (fl.), J. M. Pires et al. 50710 (MG); Amazonas: Manaus, 07/08/1949 (fr.), R. L. Fróes 24932 (IAN); Novo Aripuanã, BR-230 (Rodovia Transamazônica), a 400 km de Humaitá, (fr.), C. A. C. Ferreira et al. 5928 (MG, INPA, NY); Rondônia: Guajará-Mirim, estrada para Lago do Pompeu, Guajará-Mirim, 16/09/1996 (fr.), L. C. B. Lobato et al. 1421 (MG); Pará: Melgaço, Floresta Nacional de Caxiuanã, Estação Científica Ferreira Penna, rio Caxiuanã, várzea, 14/10/1991 (fr.), A. S. L. Silva et al. 2413 (MG); ibid., rio Curuá, igapó, 14/01/1993, (fr.), L. C. B. Lobato et al. 559 (MG); ibid., rio Curuá, 23/07/2007 (fl., fr.), M. M. Félix-da-Silva et al. 334 (MG, IAN); Portel, Floresta Nacional de Caxiuanã, igarapé Caquajó, 30/01/2007 (fr.), M. M. Félix-da-Silva et al. 123 (MG, IAN); ibid., igarapé Caquajó, 08/07/2007 (fl., fr.), M. M. Félix-da-Silva et al. 234 (MG, IAN); Maranhão: Santa Luzia, rio Pindar, 05/04/1983 (fr.), M. F. F. Silva et al. 1010 (MG). Suriname: Sipaliwini, 4o 45' N, 56o 52' W 50 m, 20/11/1995, R. Evans & S. Koemar 2453 (IAN, MO); Sipaliwini, 4o 45' N, 56o 52' W 50 m, 05/08/1995 (fl.), R. Evans & E. Bakboord 2385 (IAN, MO).
Distribuição geográfica: Venezuela, Guiana, Suriname, Guiana Francesa e Brasil (Silva, 1976; Silva et al., 1998).
Nomes vernaculares: no Brasil, é conhecido como 'pau-roxo', 'roxinho', 'violeta', 'pau violeta', 'jutaí açu'; na Venezuela, 'palo de concha' e 'merecurillo'; na Guiana, 'purpleheart' e 'saka'; no Suriname, 'purpleheart' e 'paapati'; na Guiana Francesa como 'papaaty' e 'purpleheart' (Silva, 1976).
Usos: madeira para construção civil e naval, obras hidráulicas, carroceria e marcenaria (Corrêa, 1909).
Observações fenológicas: Peltogyne venosa subsp. densiflora floresce de março a dezembro e frutifica de junho a fevereiro.
Germinação e morfologia da plântula de Peltogyne venosa subsp. densiflora (Spruce ex Benth.) M.F. Silva (Figura 4).
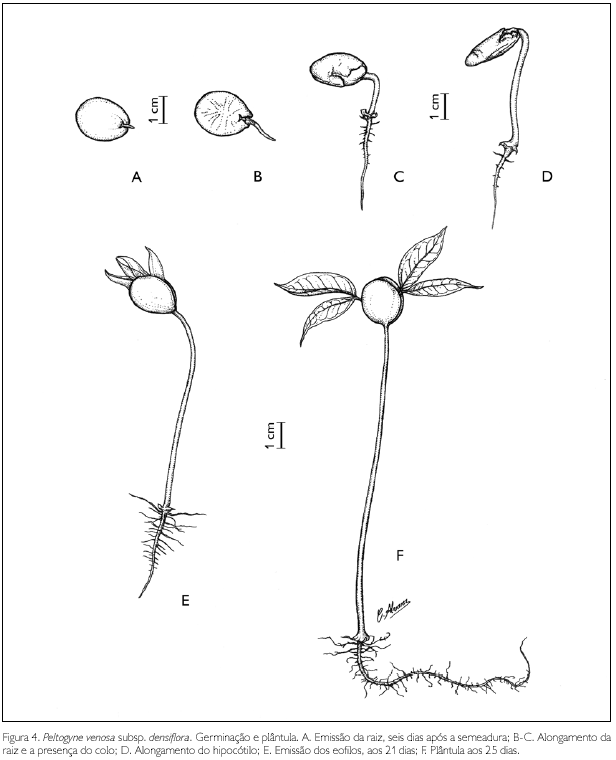
As sementes apresentaram taxa de germinação de 100%. A germinação é epígea e a plântula é fanerocotiledonar. As sementes ficam intumescidas, com o tegumento fissurado. A emissão da raiz primária ocorreu aos seis dias, próxima ao hilo; raiz com 2,7 mm de comprimento, branco-amarelada, glabra, nesta fase; em 11 dias ocorre o alongamento da raiz; presença de colo branco, com 5 mm de comprimento, 4,5 mm de espessura, carnoso, com margem ondulada, formando quatro ou mais lobos, superfície glabra; aos 18 dias, ocorre o alongamento do hipocótilo, arredondado em corte transversal, verde-claro, crasso, superfície glabra; cotilédones largamente obovados, 20-21 mm de comprimento, 16-18,5 mm de largura, carnosos, no ápice do hipocótilo, sésseis, epígeos, valvares, glabros, nervuras não evidentes, oblongos em corte transversal, branco-amarelados a creme com glândulas brancas e circulares por toda a superfície, principalmente próximo à base; os cotilédones começam a cair aos 29 dias, alguns perduram até 60 dias.
Aos 21 dias, surgem dois pares de eofilos, membranáceos, castanhos, com glândulas translúcidas que podem ser melhor visualizadas quando os eofilos tornam-se verdes; entre 25-35 dias, a plântula torna-se completamente desenvolvida, quando os eofilos se mostram verdes e subcoriáceos. A plântula apresenta raiz principal axial com 6-10 cm de comprimento, sublenhosa, com base e meio castanho-escura, ápice branco a branco-amarelado ou totalmente castanho-escura, assim como raízes laterais; o colo torna-se castanho-claro; hipocótilo 7-10 cm de comprimento, 1-1,3 mm de espessura, epígeo, glabro, canaliculado em corte transversal, base alaranjada, parte mediana castanho-clara e ápice esverdeado, localizado acima do colo, posteriormente torna-se castanho-avermelhado; pecíolos com 1-1,5 cm de comprimento, 0,8 mm de espessura; folíolos falcados a subfalcados, 3,5-4,5 cm de comprimento, 1,5-3 cm de largura, ápice acuminado, base assimétrica, consistência subcoriácea, margem glabra, face adaxial verde-oliva, face abaxial verde-prateado, superfície com glândulas translúcidas, venação broquidódroma; epicótilo epígeo, curto, reto, glabro, verde-claro.
DISCUSSÃO
Peltogyne venosa subsp. densiflora diferencia-se de P. venosa subsp. venosa pela presença de indumento no ovário e no fruto, pelo porte da árvore e pela cor da pétala. Na primeira, a flor apresenta pétalas rosadas, o ovário densamente piloso e seus frutos apresentam tricomas hialinos ou castanhos, mesmo quando maduros, e a árvore é de porte pequeno a mediano. Na segunda subespécie, a flor apresenta pétalas brancas, o ovário glabro a subglabro, com frutos glabros e árvore geralmente de grande porte (acima de 20 m de altura).
As bractéolas da subespécie estudada apresentaram margem ciliada, discordando do relato de Silva (1976), segundo o qual as bractéolas possuem margem glabra. Os espécimes estudados apresentaram de 6-8 óvulos (dado novo), igualmente a espécie Peltogyne pauciflora Benth.; e placentação parietal (dado novo).
Os espécimes encontrados na FLONA de Caxiuanã habitam as margens de rios e igarapés, concordando com Silva (1976). A referida subespécie foi encontrada às margens do igarapé Caquajó (Portel), do rio Curuá e do rio Caxiuanã, não sendo registrada, até o momento, na grade do PPBio (área de terra firme, com alguns canais de drenagem ou córregos).
Silva et al. (1988) estudaram a germinação e a morfologia da plântula de Peltogyne prancei M.F. Silva e analisaram 50 sementes semeadas em areia lavada em caixas de madeira. A germinação ocorreu aos 18 dias, atingindo a taxa de 26%. Os pesquisadores relataram que o baixo valor pode ter ocorrido devido ao tegumento rijo e impermeável das sementes dessa espécie, diferindo das características da subespécie objeto deste estudo, que apresenta tegumento permeável.
Melo et al. (2004) descreveram a germinação de Hymenaea intermedia var. adenotricha (Ducke) Lee & Lang. (Leguminosae-Caesalpinioideae) e encontraram alguns resultados iguais aos da subespécie em estudo, tais como: tipo de germinação, quantidade de dias para a emissão da raiz primária, localização e consistência dos cotilédones. Vale ressaltar que os cotilédones da plântula de P. venosa subsp. densiflora são persistentes e os eofilos apresentam glândulas translúcidas por todo o limbo, características que podem auxiliar no reconhecimento da subespécie no campo.
AGRADECIMENTOS
Agradecemos ao Coordenador do curso de Mestrado da Universidade Federal Rural da Amazônia/Museu Paraense Emílio Goeldi (UFRA/MPEG), prof. Dr. João Ubiratan M. Santos, pelas valiosas sugestões; ao Programa de Pesquisa em Biodiversidade (PPBio – Amazônia Oriental), pelo apoio logístico às viagens de campo para coleta de material botânico e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela bolsa concedida à primeira autora, no período de março de 2006 a fevereiro de 2008. Este trabalho é parte da Dissertação de Mestrado da primeira autora.
REFERÊNCIAS
ANDRADE, V. M. M. & C. F. DAMIÃO FILHO, 1989. Morfologia Vegetal: (1): 1-259. FUNEP/UNESP, Jaboticabal.
ARAÚJO NETO, J. C., I. B. AGUIAR, V. M. FERREIRA & R. C. PAULA, 2002. Caracterização morfológica de frutos e sementes e desenvolvimento pós-seminal de monjoleiro (Acacia polyphylla DC.). Revista Brasileira de Sementes 24(1): 203-211.
BARROSO, G. M., A. L. PEIXOTO, C. G. COSTA, C. L. F. ICHASO, E. F. GUIMARÃES & H. C. LIMA, 1984. Leguminosae. In: G. M. BARROSO, E. F. GUIMARÃES, C. L. F. ICHASO, C. G. COSTA & A. L. PEIXOTO (Eds.): Sistemática de angiospermas do Brasil: 2: 15-100. Universidade Federal de Viçosa, Viçosa.
BENTHAM, G., 1870. Peltogyne. In: C. F. P. von MARTIUS, A. W. EICHER & I. URBAN (Eds.). Flora Brasiliensis 15(2): 230-234.
BRUM, H. D., M. R. MESQUITA & I. D. K. FERRAZ, 2007. Descrição comparativa dos propágulos e plântulas de Copaifera multijuga Hayne e C. officinalis Jacq. (Fabaceae). Revista Brasileira de Biociências 5(1): 351-353.
BRUMMITT, R. K & C. E. POWELL, 1992. Authors of plant names: 1-732. Royal Botanic Gardens, Kew.
CORRÊA, M. P, 1909. Flora do Brasil: algumas plantas úteis, suas aplicações e distribuição geográfica: 1-154. Diretoria Geral de Estatística, Rio de janeiro.
COSTA, M. L., D. C. KERN, H. BEHLING & M. S. BORGES, 2002. Geologia e Solos. In: P. L. B. LISBOA (Ed.): Caxiuanã: Populações tradicionais, meio físico e diversidade biológica: 179-213. Museu Paraense Emílio Goeldi, Belém.
DE CANDOLLE, A. P., 1825. Leguminosae. In: A. P. DE CANDOLLE (Ed.): Prodromus systematis naturalis regni vegetabilis: 2: 93-423. Treuttel & Würtz, Paris.
DONADIO, N. M. M. & M. E. S. P. DEMATTÊ, 2000. Morfologia de frutos, sementes e plântulas de canafístula (Peltophorum dubium (Spreng.) Taub.) e jacarandá-da-bahia (Dalbergia nigra (Vell.) Fr. All. ex Benth.) - Fabaceae. Revista Brasileira de Sementes 22(1): 64-73.
DUCKE, A., 1938. Notes on the purpleheart trees (Peltogyne Vog.) of Brazilian Amazonia. Yale University: School of Forestry. Tropical Woods 54: 1-7.
DUKE, J. A., 1965. Key for the identification of seedlings of some prominent woody species in eight forest types in Puerto Rico. Annals of the Missouri Botanical Garden 52(3): 314-350.
DUKE, J. A., 1969. On tropical tree seedlings, systems and systematics. Annals of the Missouri Botanical Garden 56(2): 135-161.
DUKE, J. A. & R. M. POLHILL, 1981. Seedlings of Leguminosae. In: R. M. POLHILL & P. H. RAVEN (Eds.): Advances in legume systematics: part 2: 941-949. Royal Botanic Garden, Kew.
ENGLER, A., 1964. Syllabus der Pflanzenfamilien: 2: 193-242. Gebrüder Borntraeger, Berlin. Revisado por H. Melchior:
FERREIRA, R. A., S. A. BOTELHO, A. C. DAVIDE & M. M. MALAVASI, 1998. Caracterização morfológica de fruto, semente, plântula e muda de Dipteryx alata Vogel - Baru (Leguminosae -Papilionoideae). Revista Cerne 4(1): 73-87.
FIDALGO, O. & V L. R. BONONI, 1984. Técnicas de coleta, preservação e herborização do material botânico: 1-62. Instituto de Botânica (Manual, n. 4), São Paulo.
GARWOOD, N. C., 1983. Seed germination in a seasonal tropical forest in Panama: a community study. Ecological Monographs 53: 159-181.
GARWOOD, N. C., 1995. Studies in Annonaceae. XX. Morphology and ecology of seedlings, fruits and seeds of selected Panamanian species. Botanische Jahrbücher für Systematik, Pflanzengeschichte und Pflanzengeographie 117: 1-152.
GARWOOD, N. C., 1996. Functional morphology of tropical tree seedlings. In: M. D. SWAINE (Ed.): The ecology of tropical forest tree seedlings: 17: 59-129. Unesco & The Parthenon Publishing Group (Man and the biosphere series), Paris.
HICKEY, L. J., 1973. Classification of the arquitecture of dicotyledonous leaves. American Journal of Botany 60: 17-33.
HOLMGREN, P K. & N. H. HOLMGREN, 1998. Onwards (continuously updated). Index Herbariorum. New York Botanical Garden. Disponível em: <http://sciweb.nybg.org/science2/IndexHerbariorum.asp>. Acesso em: 10 fevereiro 2008.
KERN, D. C. & M. L. COSTA, 1997. Os solos antrópicos. In: P L. B. LISBOA (Org.): Caxiuanã: 105-119. Museu Paraense Emílio Goeldi, Belém.
LEWIS, G. P, B. D. SCHRIRE, B. MACKINDER & M. LOCK, 2005. Legumes of the world: 1-577. Royal Botanic Gardens, Kew.
LIMA, V. V. F., D. L. M. VIEIRA, A. C. SEVILHA & A. N. SALOMÃO, 2008. Germinação de espécies arbóreas de floresta estacional decidual do vale do rio Parana em Goiás após três tipos de armazenamento por até 15 meses. Biota Neotropica 8(3): 89-97.
LISBOA, P L. B., S. S. ALMEIDA & A. S. L. SILVA, 1997. Florística e estrutura dos ambientes. In: P L. B. LISBOA (Org.): Caxiuanã: 163-193. Museu Paraense Emílio Goeldi, Belém.
LISBOA, P L. B. & M. G. FERRAZ, 1999. Estação Científica Ferreira Penna: Ciência & desenvolvimento sustentável na Amazônia: 1-151. Museu Paraense Emílio Goeldi, Belém.
MARTINS, L. H. & M. F. SILVA, 1999. Leguminosae-Caesalpinioideae. In: F. MARTINS & M. R. PINHEIRO (Eds.): Flora da reserva Ducke: guia de identificação de plantas vasculares de uma floresta de terra-firme na Amazônia Central: 382-395. INPA, Manaus.
MELHEM, T. S., 1975. Desenvolvimento da plántula de Dipteryx alata Vog. (Leguminosae - Lotoideae). Hoehnea 5: 91-121.
MELO, M. G. G., M. S. MENDONÇA & A. M. S. MENDES, 2004. Análise morfológica de sementes, germinação e plántulas de jatobá (Hymenaea intermedia Ducke var. adenotricha (Ducke) Lee & Lang.) (Leguminosae - Caesalpinioideae). Acta Amazônica 34(1): 9-14.
MIQUEL, S., 1987. Morphologie fonctionelle de plantules d' espèces forestières du Gabon. Bulletin du Muséum National d'Histoire Naturelle 9(1): 101-121.
MONTAG, L. F. A., T. M. S. FREITAS, W. B. WOSIACKI & R. B. BARTHEM, 2008. Os peixes da Floresta Nacional de Caxiuanã (municípios de Melgaço e Portel, Pará - Brasil). Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais 3(1): 11-34.
OLIVEIRA, E. C., 1993. Morfologia de plántulas florestais. In: I. B. AGUIAR, F C. M. PIÑA-RODRIGUES & M. B. FIGLIOLA (Eds.): Sementes florestais tropicais: 175-214. ABRATES, Brasília.
OLIVEIRA, D. M. T., 1999. Morfologia de plántulas e plantas jovens de 30 espécies arbóreas de Leguminosae. Acta Botanica Brasilica 13(3): 263-269.
OLIVEIRA, D. M. T., 2001. Morfologia comparada de plántulas e plantas jovens de leguminosas arbóreas nativas: espécies de Phaseoleae, Sophoreae, Swartzieae e Tephrosieae. Revista Brasileira de Botânica 24(1): 85-97.
OLIVEIRA, D. M. T. & C. M. BELTRATI, 1992. Morfologia e desenvolvimento das plántulas de Inga fagifolia e Inga uruguensis.Turrialba 42(3): 306-313.
PARRA, P., 1984. Estudio de la morfología externa de plántulas de Calliandra gracilis, Mimosa albida, Mimosa arenosa, Mimosa camporum y Mimosa tenuiflora. Revista de la Facultad de Agronomía 13(1-4): 311-350.
RADFORD, A. E., W. C. DICKISON, J. R. MASSEY & C. R. BELL, 1974. Vascular plant systematics: 1-891. Harper & Row, New York.
RIZZINI, C. T., 1977. Sistematização terminológica da folha. Rodriguésia 29(42): 103-125.
SILVA, M. F., 1976. Revisão taxonómica do gênero Peltogyne Vog. (Leguminosae - Caesalpinioideae). Acta Amazonica 6(1): 1-61 (supl.).
SILVA, M. F., G. H. GOLDMAN, F. M. MAGALHÃES & F. W. MOREIRA, 1988. Germinação natural de 10 leguminosas arbóreas da Amazónia - 1. Acta Amazonica 18(1-2): 9-26.
SILVA, M. F., A. S. TAVARES & P. E. BERRY, 1998. Peltogyne Vog. In: J. S. STEYERMARK, P. E. BERRY & B. K. HOLST (Eds.): Flora of the Venezuelan Guayana. Caesalpiniaceae - Ericaceae: 4: 93-97. Missouri Botanical Garden, Portland.
STEARN, W. T., 1992. Botanical Latin: (4): 1-546. Oregon, Portland.
VARELA, V. P. & I. D. K. FERRAZ, 1991. Germinação de sementes de pau-de-balsa. Pesquisa Agropecuária Brasileira 26(10): 1685-1689.VOGEL, E. F, 1980. Seedlings of Dicotyledons: 1-150. Centre for Agricultural Publishing and Documentation, Wageningen.
 Endereço para correspondência:
Endereço para correspondência:
Museu Paraense Emílio Goeldi
Editor do Boletim do Museu Paraense Emílio Goeldi. Ciências Naturais
Av. Magalhães Barata, 376
São Braz – CEP 66040-170
Caixa Postal 399
Telefone/fax: 55-91- 3249 -1141
E-mail:boletim@museu-goeldi.br
Recebido: 19/03/2009
Aprovado: 28/12/2009
Responsabilidade editorial: Anna Luiza Ilkiu Borges













