Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.1 Ananindeua Mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100006
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Novas evidências sobre o valor diagnóstico da reação de imunofluorescência indireta e reação intradérmica de hipersensibilidade tardia na infecção humana por Leishmania (L.) infantum chagasi na Amazônia, Brasil
New evidences on the diagnostic value of indirect immunofluorescence test and delayed hypersensitivity skin test in human infection by Leishmania (L.) infantum chagasi in the Amazon, Brazil
Nueva evidencia sobre el valor diagnóstico de la prueba de inmunofluorescencia indirecta y la reacción intradérmica de hipersensibilidad retardada en la infección humana por Leishmania (L.) infantum chagasi en la Amazonia brasileña
Raimundo Nonato Pires BarbosaI; Zuila de Jesus Coelho CorrêaI; Roseli Conceição dos Santos de JesusI; Domingas Ribeiro EverdosaI; João Alves BrandãoI; Raimundo Negrão CoelhoI; Antonio Júlio de Oliveira MonteiroI; Raimundo Sérgio MachadoI; João Batista Palheta da LuzI; Antonio Francisco Pires MartinsI; Roberto Carlos Feitosa BrandãoI; José Aprígio Nunes LimaI; Iorlando da Rocha BarataI; Maria Sueli Barros PinheiroI; Edna de Freitas LeãoI; Fábio Márcio Medeiros da SilvaI; Maria das Graças Soares da SilvaI; Marliane Batista CamposI; Adelson Alcimar Almeida de SouzaI; Ralph LainsonI; Fernando Tobias SilveiraII
ISeção de Parasitologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IISeção de Parasitologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil. Núcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Estudo prospectivo realizado no período de maio/2006-setembro/2008, numa coorte de 1.099 indivíduos, ambos os sexos, com idades de 1 a 84 anos (média 24,4 anos), residente em área endêmica de leishmaniose visceral americana (LVA) no Município de Cametá, Pará, Brasil, objetivando analisar a prevalência e a incidência da infecção humana por Leishmania (L.) infantum chagasi, assim como a dinâmica da evolução dos seus perfis clínico-imunológicos previamente definidos: 1. Infecção assintomática (IA); 2. Infecção sintomática (IS=LVA); 3. Infecção subclínica oligossintomática (ISO); 4. Infecção subclínica resistente (ISR); e 5. Infecção inicial indeterminada (III). O diagnóstico da infecção baseou-se no uso simultâneo da reação de imunofluorescência indireta (RIFI) e reação intradérmica de hipersensibilidade tardia. Um total de 304 casos da infecção foi diagnosticado no período do estudo (187 na prevalência e 117 na incidência), gerando prevalência acumulada de 27,6%, cuja distribuição no âmbito dos perfis clinico-imunológicos foi da seguinte ordem: IA 51,6%, III 22,4%, ISR 20,1%, ISO 4,3% e, IS (=LVA) 1,6%. Com base na dinâmica da infecção, o principal achado recaiu no perfil III, que teve papel fundamental na evolução da infecção, dirigindo-a ora para o pólo imunológico de resistência, perfis ISR (21 casos - 30,8%) e IA (30 casos - 44,1%), ora para o pólo imunológico de susceptibilidade, perfil IS (um caso - 1,5%); além destes, 16 casos mantiveram o perfil III até o fim do estudo. Concluiu-se que esta abordagem diagnóstica pode ajudar no monitoramento da infecção na área endêmica, visando, principalmente, prevenir a morbidade da LVA, assim como reduzir o tempo e despesas com o tratamento.
Palavras-chave: Leishmania (L.) infantum chagasi; Infecção; Imunodiagnóstico; Hipersensibilidade Tardia; Técnica Indireta de Fluorescência para Anticorpo.
ABSTRACT
This is a prospective study on a cohort of 1099 individuals of both genders, aged 1-84 years (mean 24.4 years), living in an endemic area of American visceral leishmaniasis (AVL) in the municipality of Cametá, Brazil, from May 2006 to September 2008. It aimed to analyze the prevalence and incidence rates of human infection by Leishmania (L.) infantum chagasi, as well as the evolutional process of its previously defined clinical and immunological profiles: 1. Asymptomatic infection (AI); 2. Symptomatic infection (SI = AVL); 3. Subclinical oligosymptomatic infection (SOI); 4. Subclinical resistant infection (SRI); and 5. Indeterminate initial infection (III). The diagnosis was based on the simultaneous use of indirect immunofluorescence assay (IFA) and delayed hypersensitivity skin test. A total of 304 cases of infection were diagnosed during the period studied (187 for prevalence and 117 for incidence), generating an accumulated prevalence rate of 27.6%. The distribution regarding their clinical and immunological profiles presented the following order: AI 51.6%; III 22.4 %; SRI 20.1%; SOI 4.3%; and SI (= AVL) 1.6%. Based on the dynamics of the infection, the main discovery was about the III profile, which had an instrumental role in its evolution, directing it either to the resistant immunological pole - SRI (21 cases - 30.8%) and AI (30 cases - 44.1 %) profiles - or to the susceptible immunological pole - SI (1 case - 1.5%) profile. In addition, 16 cases remained within the III profile until the end of the study. It was concluded that this diagnostic approach can help monitor the infection in endemic areas, aiming mainly at preventing morbidity caused by AVL, and reducing the treatment time and expenses.
Keywords: Leishmania (L.) infantum chagasi; Infection; Immunologic Tests; Hypersensitivity, Delayed; Fluorescent Antibody Technique, Indirect.
RESUMEN
Estudio prospectivo realizado a partir de mayo de 2006 hasta septiembre de 2008 con una muestra de 1.099 individuos de ambos sexos, con edades de 1 a 84 años (media 24,4 años), residentes en un área endémica de leishmaniasis visceral americana (LVA) en el Municipio de Cametá (Estado de Pará, Brasil). Su objetivo es examinar la prevalencia y la incidencia de la infección humana por Leishmania (L.) infantun chagasi, así como la dinámica de la evolución de los perfiles clínicos e inmunológicos definidos previamente: 1. Infección asintomática (IA); 2. Infección sintomática (IS = LVA); 3. Infección subclínica oligosintomatica (ISO); 4. Infección subclínica resistente (ISR); y 5. Infección inicial indeterminada (III). El diagnóstico de la infección, se basa en la utilización simultánea de la reacción de inmunofluorescencia indirecta (RIFI) y reacción intradérmica de hipersensibilidad retardada. Se diagnosticaron un total de 304 casos de la infección durante el periodo de estudio (187 en la prevalencia y 117 en la incidencia), dando una prevalencia acumulada de 27,6%, cuya distribución, dentro de los perfiles clínicos e inmunológicos, fue del siguiente orden: IA 51,6%, III 22,4%, ISR 20,1%, ISO 4,3% e IS (= AVL) 1,6%. Con base en la dinámica de la infección, el principal hallazgo recae en el perfil III, que tuvo un papel decisivo en la evolución de la infección, dirigiéndola ora hacia el polo inmunológico de resistencia, perfiles ISR (21 casos, 30,8%) e IA (30 casos, 44,1 %), ora hacia el polo inmunológico de susceptibilidad, perfil IS (1 caso, 1,5%); además, de estos casos, 16 mantuvieron el perfil III hasta el final del estudio. Se concluyó que este método de diagnóstico puede contribuir al monitoreo de la infección en las zonas endémicas, con el objetivo principal de prevenir la morbilidad de la LVA, así como reducir el tiempo y los gastos con el tratamiento.
Palabras clave: Leishmania (L.) infantum chagasi; Infección; Pruebas Immunológicas; Hipersensibilidad Retardada; Técnica del Anticuerpo Fluorescente Indirecta.
INTRODUÇÃO
Atualmente, um dos aspectos de maior interesse relativo à interação entre a Leishmania (L.) infantum chagasi Shaw 2002 (=Leishmania chagasi Cunha e Chagas 1937), o agente etiológico da leishmaniose visceral americana (LVA), e a resposta imune do homem diz respeito ao espectro clínico e imunológico que pode resultar dessa interação. Desse modo, parece claro que um bom entendimento quanto a esse espectro, principalmente no que tange ao repertório de respostas do sistema imune do homem contra a infecção por esse agente, pode ser de crucial importância na condução de casos clínicos da infecção. Neste sentido, tem sido considerado, até recentemente, que o espectro clínico pode variar desde uma forma assintomática da infecção, registrada em indivíduos imunorresistentes com forte resposta imunecelular (respostas de hipersensibilidade tardia, de proliferação de linfócitos, e com produção de "gamma-interferon"), até uma forma sintomática encontrada em indivíduos imune suscetíveis, nos quais uma supressão destes parâmetros da resposta imune celular pode levar à forma clássica da LVA15,33. Entre estas duas formas polares, entretanto, existem certos indivíduos que podem apresentar uma forma intermediária, borderline, conhecida como infecção subclínica oligossintomática, cujos aspectos clínicos e imunológicos ainda não estão totalmente esclarecidos27,10.
No Brasil, têm sido realizados alguns estudos visando caracterizar o espectro clínico e imunológico da infecção humana por L. (L.) i. chagasi, porém, estes estudos têm sido baseados, principalmente, i) ou na resposta de anticorpos IgG (resposta humoral=susceptibilidade), ii) ou na resposta intradérmica de hipersensibilidade tardia (resposta imune celular=resistência) dos indivíduos infectados, o que tem promovido certa dificuldade no entendimento mais amplo da resposta imune do homem contra a infecção7,14,19. Em outras palavras, estes estudos têm usado, geralmente, ou um método sorológico, tal como o ensaio imunoenzimático ELISA, ou um método de natureza imune celular, como o teste intradérmico de hipersensibilidade tardia (delayed-type hipersensitivity), com o objetivo de determinar o diagnóstico da infecção ativa por L. (L.) i. chagasi. É notório, entretanto, que estes tipos de abordagens diagnósticas subestimam a possibilidade de que certos indivíduos que residem na área endêmica podem expressar, simultaneamente, os dois tipos de respostas imunes, a humoral e a celular, contra a infecção pela L. (L.) i. chagasi e que, por conta disso, esses tipos de abordagem não refletem a situação real da infecção na área endêmica.
Mais recentemente, entretanto, foi demonstrado através do uso simultâneo da reação de imunofluorescência indireta (RIFI) e da reação intradérmica de hipersensibilidade tardia (=reação intradérmica de Montenegro - RIM) a habilidade desses métodos no imunodiagnóstico da infecção humana, sintomática e assintomática, por L. (L.) i. chagasi em área endêmica. A alta especificidade desta abordagem diagnóstica, baseada no uso de formas amastigotas (para RIFI) e promastigotas (para RIM) do antígeno espécie-específico de L. (L.) i. chagasi, permitiu a identificação do mais amplo espectro clínico e imunológico da infecção humana por L. (L.) i. chagasi na Amazônia, Brasil, constituído pelos seguintes perfis clínico-imunológicos da infecção; Infecção Assintomática (IA), Infecção Sintomática (IS) (=LVA), Infecção Subclínica Oligossintomática (ISO), Infecção Subclínica Resistente (ISR) e Infecção Inicial Indeterminada (III)11,29. Portanto, conforme referido anteriormente, os três primeiros perfis (IA, IS e ISO) já são conhecidos da literatura especializada, porém, os dois últimos (ISR e III) representam novos perfis do espectro clínico-imunológico da infecção.
Com base nos comentários acima, consideramos de interesse apresentar aqui novas evidências sobre o valor diagnóstico do uso combinado da RIFI e da RIM na infecção humana por L. (L.) i. chagasi, as quais resultaram de um estudo prospectivo realizado em área endêmica de LVA no Município de Cametá, Estado do Pará, Brasil; o presente estudo veio reforçar os achados prévios sobre esta abordagem diagnóstica na infecção humana por L. (L.) i. chagasi, principalmente o diagnóstico precoce da infecção, o qual consistiu no reconhecimento dos indivíduos recém-infectados, com potencial para desenvolver a forma ativa da infecção, a LVA. A relevância do diagnóstico dos casos recém-infectados na área endêmica - aqueles representados pelo grupo clínico-imunológico III - no sentido de prevenir a morbidade da LVA grave, assim como de diminuir o tempo e os custos do tratamento, é discutida no presente trabalho.
MATERIAIS E MÉTODOS
ÁREA DE ESTUDO
Este estudo foi conduzido em quatro pequenas vilas (Ajó, Vacaria, Vacajó e Enseada) localizadas no Município de Cametá (01o 56' S: 54o 45' W), o qual fica situado à margem do rio Tocantins, na região nordeste do Estado do Pará, Brasil. O clima é tipicamente equatorial, com temperatura média de 28o C e alta umidade. A estação chuvosa nessa região é de cerca de 2.500 mm ou mais no período de janeiro a junho. A floresta primária da região já foi quase totalmente destruída, restando apenas plantações em meio à floresta secundária. Aproximadamente 70% dos habitantes residem em casas de madeira construídas em área de terra firme, enquanto o resto reside em área de várzea, coberta, principalmente, por vegetação baixa, e inundada duas vezes ao dia pela água do rio Tocantins. Desse modo, o clima e as condições ambientais desta área são muito semelhantes à área de outro estudo, realizado no Município de Barcarena, Estado do Pará, distante aproximadamente 150 km desta área no Município de Cametá, onde foi estudada, previamente, a dinâmica de transmissão da infecção humana por L. (L.) i. chagasi28.
POPULAÇÃO E TIPO DO ESTUDO
A população que tomou parte do estudo consistiu de uma coorte de 1.099 indivíduos (92,2% do total), sendo 596 do sexo masculino e 503 do sexo feminino, com idades de 1 a 84 anos (média de 24,4 anos), caracterizando uma população relativamente jovem. Quando o estudo iniciou, o número de habitantes na área era de 1.19216.
Além disso, considerando que o presente estudo planejava analisar a prevalência e a incidência da infecção humana por L. (L.) i. chagasi, assim como a dinâmica da evolução dos seus perfis clínico-imunológicos (IA, IS= LVA, ISO, ISR e III), foi necessário planejar um estudo prospectivo com o propósito de acompanhar a coorte (1.099 indivíduos) durante o período de dois anos (maio/2006-setembro/2008). Desse modo, a RIFI e a RIM foram usadas cronologicamente ao mesmo tempo para determinar a prevalência e a incidência; isto é, para todos os indivíduos previamente selecionados para a prevalência e, para as duas incidências, determinadas aos 12 e 24 meses; depois, estes testes foram realizados somente naqueles indivíduos que foram negativos na prevalência e na primeira incidência (aos 12 meses). Neste sentido, nos casos com reatividade somente para a RIM, a qual representa uma característica genética de resistência imunológica contra a infecção18, estes indivíduos foram removidos das avaliações subsequentes com a RIM, de maneira semelhante a um estudo longitudinal feito no Sudão34. Além disso, nos casos revelando reatividade para ambos os testes, os indivíduos foram testados novamente somente pela RIFI, já que esta não necessita injetar nova carga antigênica nos indivíduos testados, como no caso da RIM. Finalmente, nos casos de reatividade somente pela RIFI, o que, ao contrário da RIM, representa um estado imunológico de suscetibilidade à infecção, os indivíduos permaneceram sob investigação pelos dois testes, com o objetivo de analisar a evolução das duas respostas imunes; a humoral e a celular. Entretanto, por um número de razões, tais como férias ou viagens, por exemplo, houve uma perda de quase 5% (54 indivíduos) da amostra original durante o período de seguimento da coorte.
Por último, a população foi estratificada em três grupos etários, 1-10 (303), 11-20 (252) e ≥ 21 anos de idade (544 indivíduos), respectivamente, objetivando analisar a distribuição da infecção segundo a idade.
O desenho do presente estudo foi idealizado de forma similar a outros dois estudos prévios; um já publicado28, e outro aceito para publicação29.
AVALIAÇÃO CLÍNICA DOS INDIVÍDUOS INFECTADOS
Todos os indivíduos que apresentaram algum tipo de resposta imunológica, ou pela RIFI e/ou pela RIM, foram clinicamente examinados (exame físico, principalmente) com a finalidade de ser identificado algum sinal ou sintoma reconhecido do quadro clínico clássico da LVA ou da infecção sub-clínica oligossintomática. Contudo, faz-se importante salientar que somente os casos típicos de LVA receberam terapia convencional com antimônio pentavalente, conforme recomendação do Programa Nacional de Controle da LVA24. Os casos com diagnóstico da infecção subclínica oligossintomática foram acompanhados por período de até três meses, a fim de ser confirmada sua resolução clínica espontânea, conforme observação feita por outro estudo no Estado do Maranhão, Brasil14.
CRITÉRIOS DE IDENTIFICAÇÃO DA INFECÇÃO HUMANA
Considerando que a RIFI evidencia resposta humoral (suscetibilidade) e a RIM resposta imune celular (resistência) 3, a definição de caso humano da infecção por L. (L.) i. chagasi foi assumida como a presença de reatividade para um ou ambos os testes imunológicos. Entretanto, considerando que a co-infecção com o vírus da imunodeficiência humana adquirida (AIDS) pode interferir com esta abordagem diagnóstica, deve ser salientado que, no momento do início do estudo, nenhum caso humano de co-infecção com o vírus da AIDS havia sido registrado pela Secretaria de Saúde do Município de Cametá no seio da comunidade.
Considerando, ainda, a importância de ser estabelecida a especificidade dos dois testes imunológicos, da RIFI e da RIM, foi utilizada uma escala semi-quantitativa de resultados com escores (em cruzes) variando de + a ++++, da seguinte maneira: para a RIFI, títulos sorológicos (IgG) de 80-160 e de 320-640 receberam + e ++, e aqueles de 1.280-2.560 e de 5.120-10.240 receberam +++ e ++++, respectivamente. Para a RIM, reações intradérmicas fracas (5-8 mm) receberam +, reações moderadas (9-12 mm) ++, reações fortes (13-15 mm) +++ e reações exacerbadas (16 mm) ++++, respectivamente. Desse modo, foi assumido que reações sorológicas a partir de título 80 (IgG) e reações intradérmicas formando indurações com ≥ 5 mm de diâmetro foram consideradas ponto de corte positivas (cut-off) para a RIFI e a RIM, 23,31,28 respectivamente . Assim sendo, combinando o estado clínico dos indivíduos infectados com a escala semiquantitativa de resultados para a RIFI e a RIM, foi possível identificar os seguintes perfis imunológicos dos grupos clínicos da infecção: IA (RIM+/++++ e RIFI-), IS (=LVA) e ISO com o mesmo perfil imune (RIM- e RIFI+++/++++), ISR (RIM+/++++ RIFI+/++) e, III (RIM- e RIFI+/++)11,29.
PROCEDIMENTOS DOS TESTES IMUNOLÓGICOS
A realização da RIM seguiu os mesmos passos técnicos descritos em outros trabalhos visando o diagnóstico da leishmaniose tegumentar americana (LTA) 31,28. Entretanto, considerando que a área do presente estudo apresenta características epidemiológicas que sugerem a possibilidade de transmissão também da LTA, foi utilizado um antígeno de alta especificidade para a LVA, constituído de formas promastigotas de fase estacionária de cultivo (meio RPMI 1640) de uma cepa regional da L. (L.) i. chagasi (MCAO/BR/2003/M22697/Barcarena, Estado do Pará), isolada de um cão com leishmaniose visceral do município de Barcarena. As formas promastigotas do parasito foram fixadas com solução de mertiolate (1/10.000), em concentração final de, aproximadamente, 10x106 parasitos/mL. Como controle do antígeno, foi usada uma dose igual de 0,1 mL de uma suspensão de solução de mertiolate (1/10.000) para ser injetada, intradermicamente, no antebraço oposto de cada indivíduo. Note-se que, sendo o Instituto Evandro Chagas um laboratório vinculado à Secretaria de Vigilância em Saúde do Ministério da Saúde (MS, Brasil), todos os reagentes destinados à pesquisa humana são previamente avaliados por um programa de controle de qualidade antes do uso em humanos.
A realização da RIFI baseou-se em outra experiência23 prévia , a qual demonstrou que o antígeno de formas amastigotas de L. (L.) i. chagasi apresentou maior sensibilidade e especificidade do que antígenos de formas promastigotas do mesmo parasito e de Leishmania (L.) major-like (Bio-Manguinhos, Brasil), assim como, de formas amastigotas de L. (L.) amazonensis. Em resumo, os antígenos de formas amastigotas eram impregnados na superfície das lâminas da RIFI através da impressão de pequenos fragmentos de fígado, baço (L. i. chagasi) e pele (L. amazonensis) de hamster (Mesocricetus auratus) infectado com esses parasitos. No caso do diagnóstico laboratorial da leishmaniose visceral canina, este procedimento também se mostrou mais específico do que os kits comerciais para RIFI e ELISA de Bio-Manguinhos, Brasil20.
Estes procedimentos para realização dos dois testes imunológicos, RIM e RIFI, também já foram previamente publicados11,28.
ANÁLISE ESTATÍSTICA
Os resultados foram analisados através do programa Bio-Estat 4.04 e o X2 e o teste binomial foram usados para determinar a significância das diferenças entre os perfis clínico-imunológicos da infecção, com intervalo de confiança de 95%.
APROVAÇÃO POR COMITÊ DE ÉTICA
Este trabalho foi aprovado pelo Comitê de Ética em Pesquisa Humana do Instituto Evandro Chagas (IEC), com número de protocolo: CEP/IEC 16/2003.
RESULTADOS
DISTRIBUIÇÃO DOS PERFISCLÍNICO - IMUNOLÓGICOS DA INFECÇÃO HUMANA POR L. (L.) I. CHAGASI NO ÂMBITO DA PREVALÊNCIA
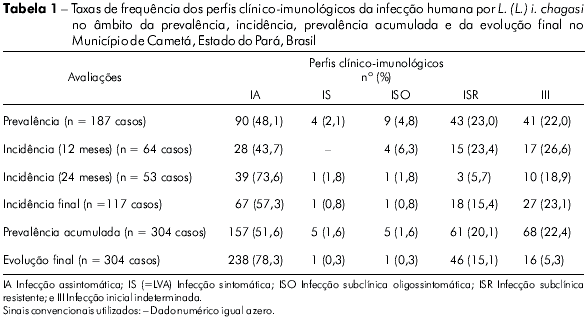
A prevalência real da infecção foi de 17% (187 casos/1.099 indivíduos); em outras palavras, isto significou 90 casos diagnosticados somente pela RIM (perfil clínico-imunológico IA), 54 somente pela RIFI (quatro casos do perfil IS=LVA, nove do perfil ISO e 41 do perfil III), e 43 por ambos os testes (perfil ISR). Desse modo, a distribuição desses perfis revelou uma frequência maior (P< 0,05) do perfil IA (48.1%) sobre os outros; ISR (23%), III (22%), ISO (4,8%) e, IS=LVA (2,1%) (Tabela 1), assim como revelou também que as frequências dos perfis ISR e III foram maiores (P<0,05) que as dos perfis ISO e IS, embora não tenham sido observadas diferenças (P> 0,05) entre os perfis ISR versus III, e ISO versus IS. Além disso, estes resultados demonstraram, ainda, que a grande maioria dos indivíduos infectados (93% /174) era assintomática (perfis IA, ISR e III).
DISTRIBUIÇÃO DOS PERFIS CLINICO-IMUNOLÓGICOS DA INFECÇÃO HUMANA POR L. (L.) I. CHAGASI NO ÂMBITO DA INCIDÊNCIA
A primeira incidência da infecção, estimada 12 meses após o início do estudo, foi de 7,2% (64 casos novos / 892 indivíduos não infectados provenientes da prevalência); o que significou 28 casos novos diagnosticados somente pela RIM (perfil IA), 21 somente pela RIFI (quatro casos do perfil ISO e 17 do perfil III), e 15 por ambos os testes (perfil ISR). A distribuição dos perfis clínico-imunológicos mostrou que o perfil IA teve novamente uma frequência (43,7%) maior (P<0,05) que as dos outros perfis; III (26,6%), ISR (23,4%) e, ISO (6,3%) (Tabela 1). Notou-se, portanto, que não houve nenhum caso de LVA (=perfil SI) entre os casos novos da infecção (primeiro ano do estudo). Estes resultados demonstraram também que as frequências dos perfis III e ISR foram maiores (P<0,05) que a do perfil ISO, embora não tenha sido observada diferença (P>0,05) entre as frequências dos perfis III versus ISR.
A segunda incidência da infecção, calculada 24 meses após o começo do estudo, foi de 6,6% (53 casos novos / 802 indivíduos não infectados procedentes da primeira incidência); estes resultados significaram 39 casos novos da infecção diagnosticados somente pela RIM (perfil IA); 11 somente pela RIFI (perfil SI=LVA um caso e perfil III dez casos); e três casos por ambos os testes (perfil ISR). A distribuição dos perfis clínico-imunológicos demonstrou, mais uma vez, que o perfil IA (73,6%) foi mais frequente (P<0,05) que os outros; III (18,9%), ISR (5,7%) e SI (1,8%) (Tabela 1). Desta vez, o perfil ISO não esteve presente entre os casos novos da infecção (segundo ano do estudo). Estes resultados mostraram, ainda, que a frequência do perfil III (18,9%) foi maior (P<0,05) que as dos perfis ISR (5,7%) e SI (1,8%) e, finalmente, que a frequência do perfil ISR foi maior (P<0,05) que a do SI.
A título de esclarecimento sobre o número de indivíduos esperados para tomar parte nessas incidências: é importante frisar que, na primeira incidência, esperava-se examinar 912 indivíduos não infectados, provenientes da prevalência; porém foram examinados somente 892 (97,8%), o que gerou uma perda de 20 (2,2%) indivíduos; na segunda incidência, esperava-se examinar 828 indivíduos não infectados, procedentes da primeira incidência; porém, foram examinados 802 (96,8%), o que gerou também uma perda de 26 (3,2%) indivíduos. Desse modo, durante o acompanhamento da coorte (1.099 indivíduos) nos dois anos do estudo, houve uma perda total de 46 (5,4%) indivíduos, o que representa uma perda pequena, não significativa.
Em resumo, as duas incidências da infecção registraram um total de 117 casos novos em dois anos de estudo; o perfil IA apresentou a mais alta frequência (57,3%), seguido dos perfis III (23,1%), ISR (15,4%), ISO (3,4%) e IS=LVA (0,8%) (Tabela 1). Portanto, percebe-se que a grande maioria dos casos novos da infecção (95,7%) era, também, assintomática (perfis IA, III e ISR).
DISTRIBUIÇÃO DOS PERFIS CLINICO-IMUNOLÓGICOS DA INFECÇÃO HUMANA POR L. (L.) I. CHAGASI NO ÂMBITO DA PREVALÊNCIA ACUMULADA
Após as três avaliações (prevalência e duas incidências), um total de 304 casos da infecção humana por L. (L.) i. chagasi foram registrados, com prevalência acumulada de 27,6%; o perfil IA foi o mais prevalente (51,6%), seguido do III (22,4%), ISR (20,1%), ISO (4,3%) e, finalmente, o IS = LVA (1,6%) (Tabela 1).
DISTRIBUIÇÃO, POR IDADE, DOS PERFIS CLINICO-IMUNOLÓGICOS DA INFECÇÃO HUMANA POR L. (L.) I. CHAGASI NO ÂMBITO DA PREVALÊNCIA E INCIDÊNCIA
Considerando a distribuição, por idade, dos perfis clínico-imunológicos da infecção na prevalência (187 casos), observou-se que, na faixa de 1-10 anos (23% - 43 casos), não houve diferença (P>0,05) entre as frequências dos perfis IA (30,2% - 13), ISR (30,2% - 13) e III (25,6% - 11), as quais foram superiores (P<0,05) às dos perfis SI (9,3% - 4) e ISO (4,7% - 2); na faixa de 11-20 anos (23,5% - 44 casos), não houve diferença (P>0,05) entre as frequências dos perfis IA (47,7% - 21) e III (34,1% - 15), as quais foram maiores (P<0,05) que as dos perfis ISR (13,6% - 6) e ISO (4,6% - 2); por último, na faixa de ≥ 21 anos (53,5% - 100 casos), notou-se uma frequência mais elevada (P<0,05) do perfil IA (56% - 56) sobre as dos outros perfis: ISR (24% - 24), III (15% - 15), e ISO (5% - 5). Por outro lado, comparando-se a distribuição, por idade, dos casos da infecção no mesmo perfil, três pontos mereceram destaque na prevalência: i) notou-se um aumento crescente na frequência dos casos do perfil IA com a idade, ou seja, na faixa de 1-10 anos ocorreram 13 casos (14,5%), de 11- 20 anos 21 casos (23,3%) e, a partir de 21 anos 56 casos (62,2%), sugerindo um efeito acumulativo do perfil IA com a idade; ii) os quatro casos do perfil IS (=LVA) foram diagnosticados nos indivíduos da faixa etária menor, de 1-10 anos; e, iii) entre os casos do perfil III (44 casos), não houve diferença (P>0,05) da frequência entre as faixas de idade, ou seja, de 1-10 anos, ocorreram 11 casos (26,8%), de 11-20 anos, 15 casos (36,6%) e, = 21 anos, mais 15 casos (36,6%) (Tabela 2).
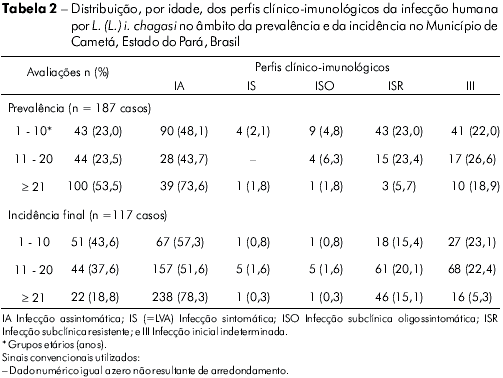
No tocante às duas incidências (117 casos), chamou atenção que a maior frequência dos casos ocorreu nas duas faixas menores de idade: i) na faixa de 1-10 anos (43,6% - 51 casos), o perfil IA apresentou frequência (58,8% - 30 casos) superior (P<0,05) à do III (27,5% - 14 casos), do ISR (5,9% - 3 casos), do ISO (5,9% - 3 casos) e, finalmente, do IS (1,9% - 1 caso); ii) na faixa de 11-20 anos (37,6% - 44 casos), o perfil IA apresentou frequência (68,2% - 30 casos) superior (P<0,05) à do ISR (18,2% - 8 casos) e do III (13,6% - 6 casos). Na faixa com ≥ 21 anos (18,8% - 22 casos), ocorreu não só a menor frequência da infecção, como também, taxas iguais (P>0,05) de frequência para os perfis IA (31,8% - 7 casos), ISR (31,8% - 7 casos) e III (31,8% - 7 casos); e a menor frequência para o perfil ISO (4,6% - 1 caso). Por outro lado, quando a frequência da infecção foi comparada nos mesmos perfis, dois fatos chamaram atenção: i) tanto no perfil IA como no III, as maiores frequências de casos, 89,5% - 60 casos e 74% - 20 casos, respectivamente, ocorreram nas duas faixas menores de idade (1-10 e 11-20 anos), indicando uma frequência mais alta dos casos novos da infecção abaixo de 21 anos; e, ii) o único caso da doença (perfil IS=LVA) ocorreu, mais uma vez, na faixa menor de idade, de 1-10 anos (Tabela 2).
DINÂMICA DA EVOLUÇÃO CLÍNICA E IMUNOLÓGICA DA INFECÇÃO HUMANA POR L. (L.) I. CHAGASI
Os resultados relativos à dinâmica da evolução clínica e imunológica da infecção podem ser vistos na tabela 1 e figura 1 (evolução final da infecção). Entretanto, objetivando tornar mais claro esse processo, foi decidido fazê-lo a partir dos resultados encontrados na prevalência acumulada (total dos casos diagnosticados na prevalência e incidência) para, em seguida, chegar à evolução final dos casos da infecção. Desse modo, iniciando pelos casos recentes da infecção, perfil III (RIFI+/++ e RIM-), foi observado que dos 68 (22,4%) casos diagnosticados (41 na prevalência e 27 na incidência), 21 (30,9%) evoluíram para o perfil ISR (converteram positivamente a RIM+/++++), 30 (44,1%) para o perfil IA (converteram positivamente a RIM+/++++ e, negativamente a RIFI-), 1 (1,5%) para o perfil IS (=LVA) (ampliou a RIFI+++/++++) e 16 (23,5%) conservaram o mesmo perfil até o final do estudo. Em seguida, dos 61 (20,1%) casos (43 na prevalência e 18 na incidência) do perfil ISR (RIFI+/++ e RIM +/++++), 47 (77%) evoluíram para o perfil IA (converteram negativamente a RIFI-) e 14 (23%) mantiveram o mesmo perfil; entretanto, como 21 casos do perfil III evoluíram para o perfil ISR, assim como outros oito do perfil ISO e três do perfil IS também evoluíram para o perfil ISR, o resultado foi que a evolução final do perfil ISR acabou em 15,1% (46 casos). Com relação ao perfil ISO (RIFI+++/++++ e RIM-), dos 13 (4,3%) casos diagnosticados (nove na prevalência e quatro na incidência), oito (61,5%) evoluíram para o perfil ISR (converteram positivamente a RIM+/++++ e reduziram a RIFI+/++), dois (15,4%) evoluíram para o perfil IA (converteram positivamente a RIM+/++++ e negativamente a RIFI-) e, finalmente, três (23,1%) mantiveram o perfil. Continuando, dos cinco (1,6%) casos de LVA (RIFI+++/++++ e RIM-), quatro diagnosticados na prevalência e um na incidência, o resultado do tratamento clínico com antimonial pentavalente levou três (60%) casos para o perfil ISR (converteram positivamente a RIM+/++++ e reduziram a RIFI+/++), um (20%) para o perfil IA (converteu positivamente a RIM+/++++ e, negativamente a RIFI-) e um (20%) manteve a resposta imune inicial até o fim do estudo, porém, de maneira assintomática (curado clinicamente). Finalmente, com relação aos 157 casos (51,6%) do perfil IA (RIM+/++++ e RIFI-), 90 diagnosticados na prevalência e 67 na incidência, como estes não evoluem, já que representam o pólo genético de resistência da infecção, somaram-se a eles 30 provenientes do perfil III, 47 do ISR, dois do ISO e um do SI (=LVA), o que gerou evolução final de 78,3% (238 casos).
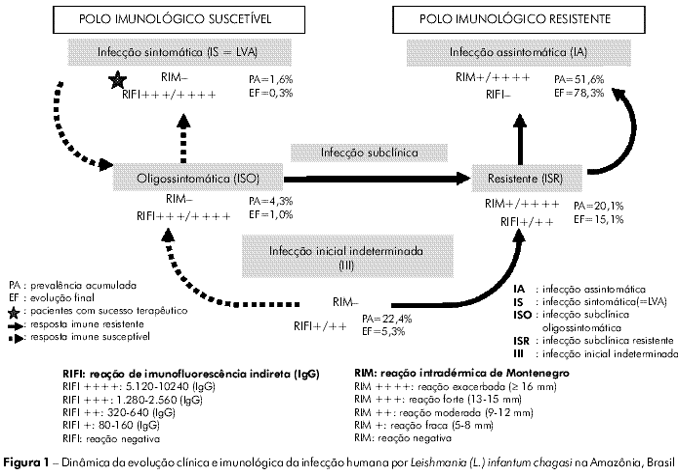
Em resumo, o único perfil que somou com a dinâmica da evolução clínica e imunológica da infecção foi o perfil IA (51,6% - 78,3%), enquanto os outros perfis perderam: IS (1,6% - 0,3%), ISO (4,3% - 1%), ISR (20,1% - 15,1%) e, principalmente, o III que registrou a maior perda (22,4% - 5,3%).
Por último, faz-se importante assinalar que durante todo o período do estudo não foi detectado nenhum caso de leishmaniose cutânea entre os indivíduos reativos tanto pela RIM como pela RIFI, o que veio reforçar a especificidade das reações imunológicas, RIM e RIFI, no diagnóstico dos casos humanos da infecção por L. (L.) i. chagasi. Da mesma forma, nenhum caso de coinfecção com o vírus da AIDS foi assinalado entre os indivíduos que tomaram parte no estudo.
DISCUSSÃO
Inicialmente, parece não haver dúvida quanto à importância do perfil IA no contexto do espectro clínico-imunológico da infecção humana por L. (L.) i. chagasi; os resultados do presente trabalho demonstraram, mais uma vez, que o perfil IA foi o mais frequente de todos os perfis diagnosticados em todas as avaliações e, em especial, na análise da prevalência acumulada (casos antigos e novos da infecção), na qual representou 51,6% de todos os casos diagnosticados, seguido dos perfis III (22,4%), ISR (20,1%), ISO (4,3%) e, finalmente, o IS = LVA (1,6%) (Tabela 1). Desse modo, é possível interpretar que a elevada frequência do perfil IA pode estar refletindo um breve período de tempo que se desenvolve entre o estágio inicial da infecção (perfil III) e o seu estágio final (perfil IA), indicando que a maioria dos casos do perfil III apresenta um breve período de resposta humoral (RIFI+), seguido de rápida conversão da resposta de hipersensibilidade tardia (perfil ISR) e, por último, a conversão negativa da RIFI-.
Em trabalho prévio29, situação semelhante já havia sido diagnosticada em área endêmica de LVA no Município de Barcarena, Estado do Pará, distante cerca de 150 km do local do presente estudo, na qual o perfil IA correspondeu a 73,2% dos casos da infecção no âmbito da prevalência acumulada. Portanto, considerando que a hipersensibilidade tardia representa forte expressão genética18 de resistência imune celular33,10 contra a infecção humana por L. (L.) i. chagasi, estes resultados vêm confirmar que a grande maioria (evolução final do perfil IA 78,3%) dos indivíduos infectados na área endêmica é geneticamente resistente contra a infecção. Além disso, considerando que o perfil ISR (evolução final 15,1%) representa um estágio evolutivo da infecção no sentido do pólo de resistência (perfil IA), essa taxa pode chegar próximo de 90% da infecção na área endêmica.
Nesse sentido, se a hipersensibilidade tardia pode ser considerada uma característica genética definitiva de resistência imune celular contra a infecção, é provável que alguns relatos sobre a perda dessa condição (hipersensibilidade tardia) poderiam resultar de imunossupressão2 ou de baixa especificidade dos antígenos de Leishmania usados para estimular a hipersensibilidade tardia13. Na Amazônia brasileira, entretanto, foi observada uma especificidade significativamente maior para as reações de hipersensibilidade tardia (16 x 12 mm) usando o antígeno espécie-específico de L. (L.) i. chagasi deste trabalho do que as reações (11 x 6 mm) produzidas por antígeno de L. (L.) amazonensis, um agente causal da leishmaniose tegumentar americana (LTA), em dois indivíduos adultos (30 anos de idade) naturais de área endêmica (Município de Igarapé-Miri) de LVA no Estado do Pará, Brasil, sugerindo não só que a imunidade celular tem longa duração (memória imunológica), como também, resulta de resposta imune espécie-específica30.
Quanto ao perfil ISR, o qual representa um novo estágio da infecção no contexto desta abordagem diagnóstica, a sua performance não se mostrou muito diferente daquela observada antes29; a sua frequência no âmbito da prevalência (23%) foi relativamente superior à encontrada na incidência final (15,4%), sugerindo ser um estágio evolutivo mais presente entre os casos antigos da infecção e, consequentemente, com maior probabilidade de continuar sua evolução no sentido do pólo de resistência da infecção (perfil IA). Este fato foi confirmado no presente estudo em 47 (77%) dos 61 casos diagnosticados deste perfil através da conversão negativa da resposta humoral e a manutenção da hipersensibilidade tardia (RIFI- e RIM+/++++). Neste sentido, como a expressão da hipersensibilidade tardia é controlada geneticamente, a partir do momento em que o indivíduo recém-infectado (perfil III) converte a hipersensibilidade tardia (perfil ISR), ele evoluirá, naturalmente, para o perfil de resistência (perfil IA).
Com respeito ao perfil III, o qual constitui não só o outro estágio novo da infecção mas, também o mais recente estágio da infecção neste contexto diagnóstico, foi interessante notar que, diferentemente do estudo anterior no Município de Barcarena (Estado do Pará, Brasil), onde a prevalência da infecção foi 12,6%, os casos recentes da infecção mostraram-se extremamente regulares em todas as fases do presente estudo, tais como: prevalência 22%; incidência aos 12 meses 26,6%; incidência aos 24 meses 18,9%; incidência final 23,1%; e prevalência acumulada 22,4%, o que denota expressiva regularidade da transmissão da infecção em nível mais elevado na área do estudo atual no Município de Cametá (mesmo Estado e País), onde a prevalência da infecção foi, coincidentemente, mais alta (17%). Além disso, considerando que a incidência final do perfil III foi de 23,1%, espera-se que, pelo menos, 20-23% dos casos novos da infecção nesta área devam requerer monitoramento clínico, uma vez que aproximadamente 5-6% desses casos apresentam potencial para desenvolver as formas clínicas suscetíveis da infecção, a ISO e a IS (= LVA). Assim sendo, estes achados deveriam ser levados em consideração a quando da elaboração de novos programas de controle da LVA.
Os perfis ISO e IS (= LVA) foram os de menor frequência em todas as fases do presente estudo, embora o primeiro tenha apresentado uma prevalência acumulada (4,3%) quase três vezes maior que o segundo (1,6%). De qualquer modo, assim como no primeiro estudo29, os dois perfis juntos (prevalência acumulada de 5,9%) não superaram a faixa de 6% do total de casos da infecção na área endêmica da Amazônia brasileira, o que parece um dado bem diferente da Região Nordeste do Brasil; no Estado da Bahia, a forma subclínica oligossintomática (ISO) foi detectada em 60% de 86 crianças infectadas abaixo de 15 anos de idade6 e, no Estado do Maranhão, esta forma foi diagnosticada em 17,4% de 189 crianças infectadas na mesma faixa de idade14. Deve-se salientar, entretanto, que nas duas ocasiões o diagnóstico final da doença (ISO) baseou-se no parâmetro clínico, apoiado somente pelo teste sorológico (ELISA). Portanto, é possível que as diferenças observadas nesses dois estudos da Região Nordeste do Brasil devam-se à restrição da faixa de idade (até 15 anos) dos indivíduos participantes (as crianças apresentam maior suscetibilidade à infecção sintomática), embora no presente estudo tenha sido observado que sete (53,8%) dos 13 casos do perfil ISO estavam nas duas faixas menores de idade (1-10 e 11-20 anos). Por outro lado, no caso do perfil IS (=LVA) a sua incidência foi quase insignificante (0,2/1.000 hab.) perto de taxas bem mais elevadas registradas na Região Nordeste do Brasil6,9,25, o que faz supor uma transmissão mais intensa da infecção e/ou uma suscetibilidade maior dos indivíduos infectados para desenvolver a doença ativa.
Quando a distribuição dos perfis clínico-imunológicos foi considerada em razão da idade, foi demonstrado, novamente, que o perfil IA foi mais frequente que os outros perfis em quase todos os grupos analisados (1-10, 11-20 e ≥ 21 anos), tanto na prevalência como na incidência (Tabela 2), com exceção na faixa de 1-10 anos na prevalência, cuja frequência (30,2%) foi igual à do perfil ISR e, na faixa de ≥ 21 anos na incidência, cuja frequência (31,8%) foi também igual às dos perfis ISR e III - desse modo conferindo ao perfil IA a condição do perfil mais frequente nas diferentes faixas de idade e situações temporais (prevalência e incidência).
Por outro lado, quando a frequência da infecção foi comparada no âmbito dos mesmos perfis, os seguintes achados mereceram atenção: i) enquanto na prevalência notou-se um efeito acumulativo do perfil IA com a idade, o que pode ser interpretado como clara evidência de que a hipersensibilidade tardia (imunidade celular adquirida) aumenta com a idade6,13,26,1, isto, de fato, está somente refletindo que os indivíduos com idade mais avançada (≥ 21 anos) tiveram tempo maior de exposição à infecção do que os mais jovens (1-10 e 11-20 anos); por outro lado, na incidência, houve um efeito diminutivo (contrário) do perfil IA com a idade, com importante redução dos casos a partir das faixas menores (1-10 e 11-20 anos: 30 - 44,8% - casos, cada) no sentido da maior (≥ 21 anos: 7 - 10,4% - casos), demonstrando que, entre os casos novos da infecção, o maior contingente de indivíduos do perfil IA está representado por crianças e adolescentes; ii) os quatro casos de LVA (perfil IS) ocorreram na faixa etária menor (1- 10 anos), confirmando que a LVA é uma doença tipicamente de crianças de baixa idade; iii) entre os casos do perfil ISO, notou-se uma distribuição quase equitativa entre as faixas etárias, com sete (53,8%) casos para as duas faixas menores (1-10 e 11-20 anos) e seis (46,2%) casos para a maior (≥ 21 anos); iv) no tocante ao perfil ISR, notou-se, na prevalência, uma concentração maior de casos na faixa de ≥ 21 anos (55,8%) em relação às faixas de 1-10 e 11-20 anos (44,2%), sugerindo uma presença maior do perfil IA entre os indivíduos com infecção mais antiga, numa faixa de idade mais avançada; porém, na incidência, entre os casos mais recentes da infecção, essa tendência se mostrou inversa, com maior concentração de casos nas faixas de 1-10 e 11-20 anos (61,1%) em relação à faixa mais avançada (38,9%); v) por último, com respeito ao perfil III, ficou evidente, justo na incidência (casos novos da infecção), uma concentração significativamente maior de casos nas faixas de 1-10 e 11-20 anos (74%) sobre a faixa de ≥ 21 anos (26%), sugerindo, mais uma vez, que a transmissão da infecção ocorre, principalmente, no intradomicílio ou na área peridomiciliar, onde as crianças e adolescentes são infectados21,22,32.
Com respeito à dinâmica da evolução da infecção, não se pode omitir a importância dos achados relativos ao perfil III, já que no contexto desta abordagem diagnóstica esse perfil clínico-imunológico tem o papel fundamental de abastecer os outros perfis da infecção humana. Desse modo, foi visto no presente estudo que, dos 68 casos diagnosticados, 30 (44,1%) evoluíram para o perfil IA e 21 (30,8%) para o perfil ISR, o que representa quase 75% (74,9%) dos casos com evolução para o pólo imunológico de resistência da infecção (perfil IA), cuja evolução final foi de 78,3%. Além destes, um (1,5%) caso evoluiu para o pólo de suscetibilidade da infecção (perfil IS=LVA) e 16 (23,5%) não sofreram evolução até o final do estudo. Desse modo, estes resultados parecem estar em pleno acordo com a proposta desta abordagem diagnóstica29, na qual, a evolução da infecção a partir do perfil III pode progredir, dependendo do perfil genético da resposta imune celular do indivíduo8,17, ou para o pólo de resistência (perfil IA) ou para o pólo de suscetibilidade da infecção (perfil IS) (Figura 1).
Com base na premissa acima, consideramos prioritária a evolução dos perfis com suscetibilidade à infecção, ISO e IS (=LVA), os quais, embora tenham sido identificados com o mesmo perfil imunológico (RIM-e RIFI+++/++++), puderam ser distinguidos, principalmente, pelo fato do primeiro (ISO) ter apresentado evolução clínica espontânea para cura em dez (77%) dos 13 casos diagnosticados (oito evoluíram para o perfil ISR, dois para o IA e, três mantiveram-se inalterados até o fim do estudo), enquanto o segundo (LVA) precisou de terapia antimonial pentavalente para evoluir favoravelmente para a cura também (três evoluíram para o perfil ISR, um para o IA e um conservou o perfil imunológico inicial, porém, de forma assintomática). A este respeito, faz-se importante mencionar os resultados obtidos sobre a evolução da forma ISO nos Estados do Maranhão14 e Ceará15, nos quais, 33 casos do Maranhão e 12 do Ceará tiveram evolução semelhante à encontrada neste estudo. Além disso, outro estudo realizado no Estado da Bahia5 documentou que indivíduos da forma ISO foram capazes de produzir maior quantidade de gammainterferon  em cultura de células mononucleares do sangue periférico do que indivíduos com LVA, o que pode ajudar no melhor entendimento sobre a performance dessas formas sintomáticas da infecção humana por L. (L.) i. chagasi.
em cultura de células mononucleares do sangue periférico do que indivíduos com LVA, o que pode ajudar no melhor entendimento sobre a performance dessas formas sintomáticas da infecção humana por L. (L.) i. chagasi.
Com respeito aos perfis com resistência à infecção, ISR e IA, a impressão que ficou foi que o ISR parece representar um estágio de desenvolvimento no sentido do perfil IA, uma vez que a maioria (77%) dos casos converteu negativamente a RIFI-, assumindo o status imune do perfil IA; este fato pode ajudar a explicar a alta frequência encontrada do perfil IA neste estudo e, também, no estudo anterior29. Por outro lado, embora em alguns poucos casos do perfil IA, provenientes somente da prevalência, tenha sido observada a soroconversão transitória da RIFI+ em baixos níveis (+/++) (seguida, portanto, da reconversão negativa) - fato interpretado como um possível impulso antigênico de curta duração produzido por uma reinfecção abortada pela resposta imune celular desses indivíduos -, a grande maioria dos casos permaneceu com o perfil imune inalterado, sugerindo que o perfil IA representa o fim da linha da infecção (Figura 1).
Finalmente, a dinâmica da infecção mostrou que somente o perfil IA teve evolução positiva com o processo, mudando de 51,6% na prevalência acumulada para 78,3% ao final da sua evolução, enquanto os outros perfis sofreram perdas importantes com essa evolução, tais como: IS (=LVA) de 1,6% para 0,3%, ISO de 4,3% para 1,0%, ISR de 20,1% para 15,1% e, principalmente, o perfil III de 22,4% para 5,3%. Portanto, considerando o papel dos perfis ISR e III no contexto desta abordagem diagnóstica, parece indiscutível a importância desses novos estágios clínico-imunológicos na promoção da evolução da infecção, especialmente o perfil III, que pode ser de grande valor na prevenção da morbidade da LVA, assim como na redução do tempo e despesas com o tratamento.
APOIO FINANCEIRO
Este trabalho foi realizado com apoio financeiro do Instituto Evandro Chagas (Secretaria de Vigilância em Saúde, Ministério da Saúde, Brasil) e da Fundação Wellcome Trust (London, UK).
REFERÊNCIAS
1 Ali A, Ashford RW. Visceral leishmaniasis in Ethiopia. I. Cross-sectional leishmanin skin test in an endemic locality. Ann Trop Med Parasitol. 1993 Apr;87(2):157-61. [ Links ]
2 Ali A, Ashford RW. Visceral leishmaniasis in Ethiopia. II. Annual leishmanin transformation in a population: is positive leishmanin reaction a life-long phenomenon? Ann Trop Med Parasitol. 1993 Apr;87(2):163-7. [ Links ]
3 Awasthi A, Mathur RK, Saha B. Immune response to Leishmania infection. Indian J Med Res. 2004 Jun;119(6):238-58. [ Links ]
4 Ayres M, Ayres Júnior M, Ayres D, Santos AS. Bioestat 4.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2004.
5 Bacellar O, Barral-Neto M, Badaró R, Carvalho EM. Gamma interferon production by lymphocytes from children infected with L. chagasi. Braz J Med Biol Res. 1991;24(8):791-5. [ Links ]
6 Badaró R, Jones TC, Carvalho EM, Sampaio D, Reed SG, Barral A, et al. New perspectives on a subclinical form of visceral leishmaniasis. J Infect Dis. 1986 Dec;154(6):1003-11. [ Links ]
7 Badaró R, Jones TC, Lorenço R, Cerf BJ, Sampaio D, Carvalho EM, et al. A prospective study of visceral leishmaniasis in an endemic area of Brazil. J Infect Dis. 1986 Oct;154(4):639-49. [ Links ]
8 Blackwell JM, Mohamed HS, Ibrahim ME. Genetics and visceral leishmaniasis in the Sudan: seeking a link. Trends Parasitol. 2004 Jun;20(6):268-74. DOI:10.1016/j.pt.2004.04.003 [ Links ]
9 Caldas AJM, Costa JML, Silva AAM, Vinhas V, Barral A. Risk factors associated with infection by Leishmania chagasi in north-east Brazil. Trans Roy Soc Trop Med Hyg. 2002 Jan-Feb;96(1):21-8. [ Links ]
10 Costa SR, D'Oliveira Júnior A, Bacellar O, Carvalho EM. T cell response of asymptomatic Leishmania chagasi infected subjects to recombinant leishmania antigens. Mem Inst Oswaldo Cruz. 1999 May-Jun;94(3):367-70. [ Links ]
11 Crescente JAB, Silveira FT, Lainson R, Gomes CMC, Laurenti MD, Corbett CEP. A cross-sectional study on the clinical and immunological spectrum of human Leishmania (L.) infantum chagasi infection in the Brazilian Amazon region. Trans Roy Soc Trop Med Hyg. 2009 Dec; 103(12):1250-6. DOI:10.1016/j.trstmh.2009.06.010 [ Links ]
12 Cunha AM, Chagas E. Nova espécie de protozoário do gênero Leishmania patogênico para o homem. Leishmania chagasi n.sp. Nota prévia. Hospital (Rio J). 1937;11:3-9.
13 Davies CR, Mazloumi Gavgani AS. Age, acquired immunity and the risk of visceral leishmaniasis: a prospective study in Iran. Parasitology. 1999 Sep;119(Pt 3):247-57. [ Links ]
14 Gama MEA, Costa JML, Gomes CMC, Corbett CEP. Subclinical form of the American visceral leishmaniasis. Mem Inst Oswaldo Cruz. 2004 Dec;99(8):889-93. DOI:10.1590/S0074-02762004000800018 [ Links ]
15 Holaday BJ, Pompeu MM, Evans T, Braga DN, Texeira MJ, Sousa AQ, et al. Correlates of Leishmania-specific immunity in the clinical spectrum of infection with Leishmania chagasi. J Inf Dis. 1993 Feb;167(2):411-7. [ Links ]
16 Instituto Brasileiro de Geografia e Estatística. Contagem nacional de populações. Rio de Janeiro: Superintendência de Estudos Geográficos e Sócio-Econômicos; 2004.
17 Jamieson SE, Miller EM, Peacock CS, Fakiola M, Wilson ME, Bales-Holst A, et al. Genome-wide scan for visceral leishmaniasis susceptibility genes in Brazil. Genes Immun. 2007 Jan;8(1):84-90. DOI:10.1038/sj.gene.6364357 [ Links ]
18 Jerônimo SMB, Holst AK, Jamieson SE, Francis R, Bezerra FL, Ettinger NA, et al. Genes at human chromosome 5q31.1 regulate delayed-type hypersensitivity responses associated with Leishmania chagasi infection. Genes Immun. 2007 Oct;8(7):539-51. DOI:10.1038/sj.gene.6364422 [ Links ]
19 Jerônimo SMB, Teixeira MV, Sousa AQ, Thielking P, Pearson RD, Evans TG. Natural history of Leishmania (Leishmania) chagasi infection in Northeastern Brazil: Long-term follow-up. Clin Infec Dis. 2000 Mar;30(3):608-9. DOI: 10.1086/313697 [ Links ]
20 Jesus RCS, Corrêa ZC, Everdosa DR, Martins AP, Eliseu LS, Campos MC, et al. Comparação das técnicas de RIFI (ag. IEC x ag. Bio-Manguinhos) e ELISA no sorodiagnóstico da leishmaniose visceral canina, estado do Pará, Brasil. Rev Soc Bras Med Trop. 2003;36:323.
21 Lainson R, Rangel EF, editores. Flebotomíneos no Brasil. Rio de Janeiro: FIOCRUZ; 2003. Ecologia das leishmanioses: Lutzomyia longipalpis e a ecoepidemiologia da leishmaniose visceral americana (LVA) no Brasil. p. 311-36. [ Links ]
22 Lainson R, Rangel EF. Lutzomyia longipalpis and the eco-epidemiology of American visceral leishmaniasis, with particular reference to Brazil a review. Mem Inst Oswaldo Cruz. 2005 Dec;100(8):811-27. DOI:10.1590/S0074-02762005000800001 [ Links ]
23 Lima LVR, Souza AAA, Jennings YL, Corrêa Z, Jesus R, Everdosa D, et al. Comparison of the reactivity between antigens of Leishmania (L.) chagasi, L. (L.) amazonensis e Leishmania sp. (Bio-Manguinhos) in the serodiagnosis of visceral leishmaniasis by the indirect fluorescent antibody test (IFAT). Rev Inst Med Trop Sao Paulo. 2003;45 Suppl 13:147.
24 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Manual de Vigilância e Controle da Leishmaniose Visceral. Brasília; 2003. p. 1-120.
25 Nascimento MDSB, Souza EC, Silva LM, Leal PC, Cantanhede KL, Bezerra GFB, et al. Prevalência de infecção por Leishmania chagasi utilizando os métodos de ELISA (rK39 e CRUDE) e intradermorreação de Montenegro em área endêmica do Maranhão, Brasil. Cad Saude Publica. 2005;21:1801-07. DOI:10.1590/S0102-311X2005000600028b [ Links ]
26 Pampiglione S, Manson-Bahr PEC, La Placa M, Borgatti MA, Musumeci S. Studies in Mediterranean leishmaniasis: 3. The leishmanin in skin test kala-azar. Trans Roy Soc Trop Med Hyg. 1975;69(1):60-8. [ Links ]
27 Pearson RD, Souza AQ. Clinical spectrum of leishmaniasis. Clin Inf Dis. 1996;22:1-13.
28 Silveira FT, Blackwell JM, Ishikawa EA, Braga RR, Shaw JJ, Quinnell RJ, et al. T cell responses to crude and defined leishmanial antigens in patients from the lower Amazon region of Brazil infected with different species of Leishmania of the subgenera Leishmania and Viannia. Parasite Immunol. 1998 Jan;20(1):19-26. DOI:10.1046/j.1365-3024.1998.t01-1-00126.x [ Links ]
29 Silveira FT, Lainson R, Souza AAA, Crescente JAB, Campos MB, Gomes CMC, et al. A prospective study on the dynamics of clinical and immunological evolution of human Leishmania (L.) infantum chagasi infection in the Brazilian Amazon region. Trans Roy Soc Trop Med Hyg. In Press 2009.
30 Silveira FT, Lainson R, Souza AAA, Ishikawa EAY, Laurent MD, Corbett CEP. Failure of natural immunity induced by asymptomatic Leishmania chagasi-infection in protecting against to Leishmania braziliensis-cutaneous disease. Poster Section presented at: Immune Response. 3rd World Congress on Leishmaniasis; 2005; Palermo-Terrasini, Sicily, Italy; 2005. p. 278.
31 Silveira FT, Lainson R, Shaw JJ, Souza AA, Ishikawa EAI, Braga RR. Cutaneous leishmaniasis due to Leishmania (Leishmania) amazonensis in Amazonian Brazil, and the significance of a negative Montenegro skin-test in human infections. Trans R Soc Trop Med Hyg. 1991 Nov-Dec;85(6):735-8. [ Links ]
32 Silveira FT, Shaw JJ, Bichara CNC, Costa JML. Leishmaniose visceral americana. In: Leão RNQ, coordenador. Doenças infecciosas e parasitárias: enfoque amazônico. Belém: CEJUP; 1997. p. 631-44. [ Links ]
33 Vinhas V, Freire M, Bacellar O, Cunha S, Rocha H, Carvalho EM. Characterization of T cell responses to purified leishmania antigens in subjects infected with Leishmania chagasi. Braz J Med Biol Res. 1994 May;27(5):1199-205. [ Links ]
34 Zijlstra EE, El-Hassan AM, Ismael A, Ghalib HW. Endemic kala-azar in eastern Sudan: a longitudinal study on the incidence of clinical and subclinical infection and postkala-azar dermal leishmaniasis. Am J Trop Med Hyg. 1994 Dec;51(6):826-36. [ Links ]
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Instituto Evandro Chagas,
Rodovia BR 316, km 7, s/nº, Bairro: Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
E-mail:fernandotobias@iec.pa.gov.br
Fernando Tobias Silveira
Seção de Parasitologia
Recebido em/Received/Recibido en: 22/6/2009
Aceito em/Accepted/Aceito en: 17/10/2009











 text in
text in 

