Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100012
ARTÍCULO ORIGINAL
Epidemiología del virus de la encefalitis de Saint Louis en la Amazonia brasileña y en el Estado de Mato Grosso do Sul (Brasil): alta prevalencia de anticuerpos en equinos
Sueli Guerreiro RodriguesI; Otávio Pinheiro OlivaII; Francisco Anilton Alves AraujoIII; Lívia Carício MartinsIII; Janiffer Oliveira ChiangI; Daniele Freitas HenriquesI; Eliana Vieira Pinto da SilvaI; Daniela Sueli Guerreiro RodriguesI; Assis do Socorro Correa dos PrazeresI; José Tavares-NetoIV; Pedro Fernando da Costa VasconcelosI
ISeção de Arbovirologia e Febres Hemorrágicas, Instituto
Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIPan American Health Organization, Washington, DC, EUA
IIICOVEV/CGDT/DEVEP, Secretaria de Vigilância em Saúde, Ministério
da Saúde, Brasília, Distrito Federal, Brasil
IVDepartamento de Medicina, Faculdade de Medicina da Bahia, Universidade Federal
da Bahia, Salvador, Bahia, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMEN
La inmunidad de los equinos (n = 1401) contra el virus de la encefalitis de Saint Louis (VESL) fue investigado en la Amazonia brasileña (Bragança/Pará, Salvaterra/Pará, Macapá/Amapá y Rio Branco/Acre) y Maracaju en el Estado de Mato Grosso do Sul, a través de pruebas de inhibición de la hemaglutinación (IH) y la neutralización por reducción de placas (PRNT). Se detectaron anticuerpos IH y neutralizantes específicos (reacciones monotípicas, RM) para VESL y otros flavivirus incluidos en las pruebas, así como reacciones cruzadas (RC) para flavivirus. En la prueba de IH se observaron RM en 248 (17,7%) muestras de suero, 137 (55,2%) para VESL, y las RC fueron detectadas en 380 (27,1%). La frecuencia de RM del VESL y la RC fue significativamente mayor en Macapá y Salvaterra, respectivamente. Por el PRNT, se observó la neutralización del VESL en 713 (50,9%) muestras, y la prevalencia de anticuerpos neutralizantes fue significativamente mayor en Macapá, si se compara con Salvaterra (p = 0,0083). Este estudio proporciona nuevos datos sobre la inmunidad de los equinos frente al VESL en Brasil, y confirma la amplia distribución del VESL y la diversidad de flavivirus en este país, así como la aparente ausencia de enfermedad en los equinos infectados por el VESL.
Palabras clave: Encefalitis de Saint Louis; Caballos; Pruebas Serológicas; Encefalitis por Arbovirus.
INTRODUCCIÓN
El virus de la encefalitis de Saint Louis (SLEV) es un arbovirus encefalitogénico perteneciente al complejo del virus de la encefalitis japonesa, género Flavivirus, familia Flaviviñdae2. El SLEV está ampliamente distribuido en el hemisferio occidental; sin embargo, las cepas aisladas en Estados Unidos y Canadá son aparentemente más virulentas que las aisladas en el Caribe y en América Central y del Sur4. Mosquitos del género Culex y aves silvestres sirven como huéspedes primarios de amplificación del SLEV21,24,16. Los equinos, que normalmente son huéspedes terminales de otros arbovirus encefalitogénicos, no presentan viremia elevada o enfermedad clínica cuando infectados con SLEV por picada de mosquito o vía inoculación subcutánea16,24. A pesar de haber sido detectados anticuerpos contra el SLEV en equinos infectados naturalmente10,9, no hay datos suficientes a respecto del real papel de esos animales en el ciclo de transmisión del SLEV en la naturaleza.
La encefalitis es una de las manifestaciones clínicas más graves de infecciones por arbovirus, y puede llevar a la muerte o dejar secuelas graves, que se caracterizan por disfunción motora residual y/o psicológica en los supervivientes. La infección por arbovirus, por lo tanto, se constituye en un importante problema de salud pública y veterinaria21,24. En humanos, las infecciones por el SLEV no siempre causan manifestaciones clínicas de encefalitis y muchas veces pasan desapercibidas, excepto cuando ocurren durante el curso de una epidemia16. Dependiendo de la virulencia de la cepa del SLEV y del histórico de infección de la población, las proporciones entre infección aparente e inaparente, evaluadas a partir de datos colectados durante epidemias, varían entre 1:16 y 1:42511,16. Las tasas de letalidad normalmente alcanzan 5-20%22, y son siempre más elevadas entre ancianos (>75 años de edad)16.
En Brasil, especialmente en la Amazonía brasileña, se han realizado diversos aislamientos del SLEV a partir de artrópodos hematófagos y aves. Sin embargo el aislamiento del SLEV a partir de seres humanos ha sido raro, a pesar de haber estudios serológicos registrando una prevalencia de anticuerpos inhibidores de hemaglutinación variando entre 1% y 5%21,23,24. En la década de 1980, se registraron cuatro pequeñas epizootias causadas por el SLEV en el Estado de Pará, en los bosques adyacentes a Belém, involucrando aves silvestres y animales centinelas23. Sin embargo no hay informaciones a respecto de tasas de inmunidad al SLEV en equinos en el país.
En Brasil, hay registro de tres cepas aisladas de la sangre de pacientes sin síntomas neurológicos: dos de pacientes del Estado de Pará, que presentaban fiebre e ictericia14,24, y una de São Paulo, con sospecha clínica de dengue17. Recientemente, el SLEV fue detectado por medio de técnicas moleculares en cuatro muestras de suero de pacientes con sospecha clínica de dengue y en dos pacientes con sospecha de meningoencefalitis viral, todos del Municipio de São José do Rio Preto, Estado de São Paulo12,13.
Se debe destacar que, la interpretación de los resultados serológicos para flavivirus exige atención especial debido a la compleja combinación de reactividad cruzada entre los anticuerpos y las infecciones secuenciales (secundarias) causadas por diferentes flavivirus8. En pruebas serológicas, los anticuerpos producidos durante una infección normalmente reaccionan contra los antígenos de varios flavivirus. Esta reactividad cruzada es mayor aun durante infecciones secundarias. La especificidad monotípica de IgG en infecciones primarias, i.e., la producción de anticuerpos contra antígenos de un flavivirus apenas, fue identificada anteriormente8. Como 11 diferentes flavivirus ya han sido aislados en Brasil, los análisis serológicos para su detección en la población brasileña tienden a presentar altas tasas de reactividad cruzada3,2,25.
La reactividad cruzada entre flavivirus puede ser claramente demostrada en pruebas de inhibición de la hemaglutinación (IH), un método que permite analizar simultáneamente un gran número de muestras ante diferentes arbovirus. Consecuentemente, su aplicación suministra informaciones sobre la respuesta inmunológica de una determinada población contra los arbovirus.
La reconocida especificidad de la prueba de neutralización generalmente permite la identificación del agente viral responsable por una infección primaria. No obstante, este hecho no se aplica a las infecciones secundarias cuando la prueba se utiliza para el serodiagnóstico in vitro. Actualmente, la prueba de neutralización por reducción de placas (PRNT) es la más utilizada como prueba in vitro. Sin embargo, a pesar de la importancia del PRNT para evaluar la eficacia de vacunas y para confirmar serodiagnósticos, debido a su alta especificidad y sensibilidad, la falta de un procedimiento estándar y de criterios diagnósticos ha resultado en una gran variación entre laboratorios8,18.
Este estudio investigó la inmunidad de equinos al SLEV en cuatro municipios de la Amazonía brasileña y del Estado de Mato Grosso do Sul, con el objetivo de contribuir a una mayor comprensión a respecto de la epidemiología del SLEV.
MATERIALES Y MÉTODOS
DISEÑO DEL ESTUDIO
Estudio observacional transversal descriptivo.
SUEROS DE EQUINOS
Se colectaron muestras de suero de 1401 equinos, obtenidos por conveniencia, entre marzo y setiembre de 2005. Los estudios serológicos fueron realizados en estancias en los Municipios de Bragança (n = 244) y Salvaterra (n = 272), en el Estado de Pará, Macapá (n = 179), en el Estado de Amapá; y en ferias agropecuarias estaduales en Rio Branco (n = 333), en el Estado de Acre, y Maracaju (n = 373), en el Estado de Mato Grosso do Sul (Figura 1). Los equinos se presentaban saludables al momento de la colecta de sangre y no tenían historial de vacunación contra flavivirus.
Este estudio hace parte de una investigación más amplia sobre virus de encefalitis equinas y el virus del Nilo Occidental (WNV) involucrando a diversos países de América Latina, conducido por la Organización Panamericana de Salud (OPAS)/Centros de Control y Prevención de Enfermedades (CDC).
PRUEBA DE INHIBICIÓN DE LA HEMAGLUTINACIÓN
Por la prueba de IH adaptada para microplacas19, las muestras de suero fueron analizadas contra antigenos de los flavivirus SLEV, Rocio (ROCV), Ilhéus (ILHV), Cacipacoré (CPCV) y Bussuquara (BSQV). Inicialmente los sueros fueron analizados en la dilución de 1:20 en contra de los antigenos que contenían 4 unidades hemaglutinantes, y las muestras positivas se titularon hasta la dilución (factor 2) de 1:1280.
PRUEBA DE NEUTRALIZACIÓN POR REDUCCIÓN DE PLACAS
La PRNT se realizó simultáneamente para el SLEV y para otro flavivirus relacionado genéticamente (WNV), siguiendo el protocolo para la detección de anticuerpos contra flavivrus (virus de la fiebre amarilla)20. Fueron utilizadas placas de microtitulación y células Vero a una concentración de 1,6 x 105. Las muestras fueron analizadas en diluciones seriadas (2x) (1:10 a 1:640) contra un promedio de 20 unidades formadoras de placas (UFP) del SLEV (ChimeriVax-SLEV) y 16 UFP de WNV (ChimeriVax-WNV). Las placas se incubaron por siete y seis días, respectivamente. La titulación de los anticuerpos neutralizantes se definió como la recíproca de la dilución del suero que redujo el número de placas en 50%. Las muestras que contenían anticuerpos neutralizantes para ambos virus fueron consideradas positivas para uno de ellos cuando el título del anticuerpo fue cuatro veces mayor que el obtenido para el otro; de otro modo, las muestras fueron consideradas con reactividad cruzada para los virus en cuestión6.
Como la realización del PRNT para el SLEV y el WNV requiere un laboratorio con nivel de bioseguridad 3 (NB-3), quimeras altamente atenuadas de esos virus con la cepa vacinal 17D del virus de la fiebre amarilla desarrollada para uso en diagnóstico y vigilancia15,7 fueron gentilmente donadas por el CDC al Instituto Evandro Chagas.
En este estudio, reactividad monotípica se refiere a la presencia de anticuerpos contra apenas un flavivirus; reactividad cruzada se refiere a la presencia de anticuerpos contra dos o más flavivirus6,8,19 (Tabla 1).

ANÁLISIS ESTADÍSTICO
Las tasas de prevalencia de anticuerpos IH y neutralizantes fueron comparadas por medio de una prueba binomial de proporciones para muestras independientes con el nivel de significación ajustado en 5% (0,05). El análisis estadístico se realizó utilizando el programa BioEstat, versión 5.01.
RESULTADOS
Fueron detectados anticuerpos IH contra los flavivirus analizados en 628 (44,8%) de las 1.401 muestras de sueros de equinos, de las cuales 380 (27,1%) presentaron reactividad cruzada para flavivirus y 248 (17,7%) presentaron reactividad monotípica contra los siguientes virus: SLEV (n = 137; 9,8%), ILHV (n = 64; 4,6%), ROCV (n = 30; 2,1%), CPCV (n = 16; 1,1%) y BSQV (n = 1; 0,1%). De las 248 muestras presentando reactividad monotípica, 137 (55,2%) eran para SLEV.
El análisis de la distribución de los anticuerpos IH por municipio (Figura 2) reveló mayores prevalencias en equinos en los Municipios de Macapá (67%) y Salvaterra (62,9%). El número de muestras presentando reactividad monotípica contra el SLEV fue significativamente mayor en Macapá que en Bragança (p = 0,0022), Salvaterra (p = 0,0031), Rio Branco (p = 0,0043) o Maracaju (p = 0,0063).
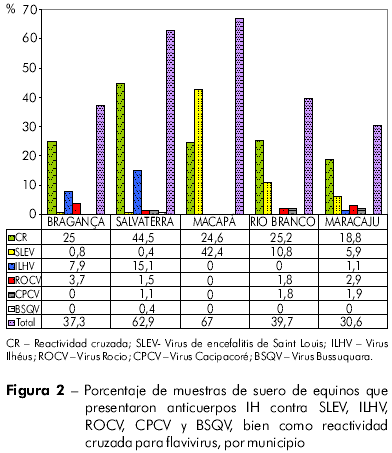
Las muestras de Salvaterra presentaron reacciones monotípicas a los antígenos de todos los flavivirus incluidos en la prueba. La mayor frecuencia de esas reacciones fue para el ILHV (n = 41; 15,5%) (Figura 2). La tasa de reacciones cruzadas entre los flavivirus, por su vez, fue significativamente mayor en las muestras procedentes de Salvaterra (p = 0,037) que en las de Macapá u otros municipios.
Por PRNT, se detectaron anticuerpos neutralizantes contra el SLEV en 713 (50,9%) muestras, y su frecuencia presentó una variación de 34,6% (n = 94), en Salvaterra, a 60,9% (n = 109), en Macapá (Figura 3).
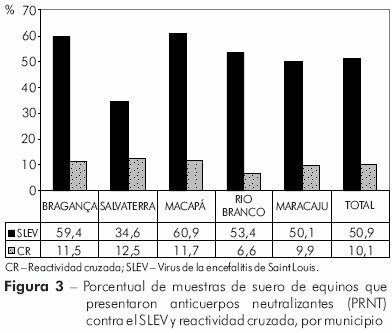
La prevalencia de anticuerpos neutralizantes en las muestras procedentes de Macapá fue significativamente mayor cuando comparada con las de Salvaterra (p = 0,0083) y Maracaju (p = 0,0176), aunque no se verificó una diferencia significativa entre las mismas y las procedentes de Bragança (p = 0,7608) o de Rio Branco (p = 0,1058).
La reactividad cruzada fue detectada por PRNT en 142 (10,1%) muestras de suero de los cinco municipios, con frecuencias variando entre 6,6%, en Rio Branco, y 12,5%, en Salvaterra. Además, 123 (19,5%) de las muestras positivas por la prueba de IH arrojaron resultado negativo para SLEV y WNV en el PRNT.
Este estudio - el primero de este tipo realizado en Brasil - detectó anticuerpos IH y neutralizantes contra el SLEV en equinos naturalmente infectados en cinco municipios distantes geográficamente (Figuras 1, 2 y 3). Nuestros resultados demuestran la amplia dispersión del virus, y están de acuerdo con estudios realizados anteriormente en humanos y vertebrados silvestres en Brasil (especialmente en la Amazonia brasileña), que registraron una prevalencia de anticuerpos IH entre 0,1 y 5,0%21,24.
É importante destacar que los equinos de Rio Branco y Maracaju eran provenientes de diversas regiones del Estado, mientras que los animales de los Municipios de Macapá, Salvaterra y Bragança pertenecían a una área especifica de cada municipio y no presentaban ningún historial de desplazamiento o vacunación previa, lo que indica que las infecciones en esas áreas fueron autóctonas.
Los resultados de la prueba de IH sugieren una gran ocurrencia de infección por SLEV en el Municipio de Macapá, en donde se observó una alta frecuencia de anticuerpos debido a la reactividad monotipica al SLEV Además, se observó una predominancia de reacción monotipica al ILHV en Bragança y Salvaterra, Estado de Pará. Este virus tiene vasta diseminación en las Américas Central y del Sur, y la prevalencia de anticuerpos neutralizantes contra el ILHV en la Región Amazónica varia entre 3 y 36%21,25. La reacción monotipica al ILHV también fue detectada en equinos que participaban de feria agropecuaria estadual en Maracaju, Estado de Mato Grosso do Sul, lo que está de acuerdo con una observación anterior de anticuerpos contra el ILHV en equinos del pantanal brasileño5.
La prueba de IH también demostró que las poblaciones de equinos estudiadas poseian un patrón de respuesta inmune consistente con el de una población expuesta a infecciones por diferentes flavivirus, corroborando la ya demostrada diversidad de flavivirus en Brasil21,3,2,25. Además, la variedad de reacciones monotipicas contra otros flavivirus sugiere que el SLEV esté posiblemente, co-circulando con eles. Este hecho fue bien documentado en el Municipio de Salvaterra, en donde muestras presentaron mayor frecuencia de reactividad cruzada y reacción monotipica contra antigenos de todos los flavivirus incluidos en el estudio. A este respecto, los resultados del PRNT, por su vez, sugieren la ocurrencia de infección por otros flavivirus en las poblaciones equinas investigadas, siendo que 10,1% de las muestras presentaron respuesta cruzada y 19,5% de las muestras positivas para IH fueron negativas para el SLEV y WNV.
La evidencia serológica presentada por este estudio y la falta de registros de epizootia en equinos sugieren la ocurrencia de infecciones inaparentes, subclinicas u oligosintomáticas, lo que corrobora estudios anteriores, que sugieren que el SLEV normalmente no causa enfermedades clinicas aparentes en equinos24,16.
En conclusión, la actividad del SLEV en equinos y la posible co-circulación de otros flavivirus verificada en el presente estudio, confirman las investigaciones que estudiaron casos humanos de infección por el SLEV diagnosticadas en São Paulo, los que presentaban dengue como principal sospecha clínica17,12,13. El bajo número de casos humanos de infección por el SLEV se debe probablemente a la ocurrencia de infección inaparente, pero también puede ser resultado de la subdetección de casos clínicos debido a la dificultad de realizar el diagnóstico diferencial.
AGRADECIMIENTOS
Agradecemos a Basílio Silva Buna, Luiz Roberto Oliveira da Costa y Geraldo Mendes da Silva por el apoyo recibido en el trabajo de campo y en las actividades desarrolladas en laboratorio. Se deben agradecimientos también a la Dra. Barbara Johnson (CDC), por la cesión de las quimeras (ChimeriVax-SLE y ChimeriVax-WN). El presente trabajo recibió apoyo financiero del Instituto Evandro Chagas/SVS/MS, OPAS (Carta Acuerdo 109/2005) y del Consejo Nacional de Desarrollo Científico y Tecnológico – CNPq (proceso Nº. 300460/2005-8).
REFERENCIAS
1 Ayres M, Ayres Júnior M, Ayres DL, Santos AS. Bioestat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2007.
2 Calisher CH, Gould EA. Taxonomy of the virus family Flaviviridae. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 59, p. 1-19.
3 Figueiredo LT. The Brazilian flaviviruses. Microbes Infect. 2000 Nov;2(13):1643-9. DOI:10.1016/S1286-4579(00)01320-4 [ Links ]
4 Gubler DJ, Kuno G, Markoff L. Flaviviruses. In: Knipe DM, Howley PM, editors. Fields virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2007. p. 1153-252.
5 Iversson LB, Silva RA, Travassos da Rosa AP, Barros VL. Circulation of eastern equine encephalitis, western equine encephalitis, Ilhéus, Maguari and Tacaiuma viruses in equines of the Brazilian Pantanal, South America. Rev Inst Med Trop Sao Paulo. 1993 Jul-Aug;35(4):355-9. DOI: 10.1590/S0036-46651993000400009 [ Links ]
6 Johnson BW, Kosoy O, Martin DA, Noga AJ, Russell BJ, Johnson AA, et al. West Nile virus infection and serologic response among persons previously vaccinated against yellow fever and Japanese encephalitis viruses. Vector Borne Zoonotic Dis. 2005;5(2):137-45. [ Links ]
7 Komar N, Langevin S, Monath TP. Use of a surrogate chimeric virus to detect west Nile virus-neutralizing antibodies in avian and equine sera. Clin Vaccine Immunol. 2009 Jan;6(1):134-5. DOI: 10.1128/CVI.00220-08 [ Links ]
8 Kuno G. Serodiagnosis of flaviviral infections and vaccinations in humans. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 61, p. 3-65.
9 Marlenee NL, Loroño-Pino MA, Beaty BJ, Blitvich BJ, Fernández Salas I, Contreras Cordero JF, et al. Detection of antibodies to west Nile and Saint Louis encephalitis viruses in horses. Salud Publica Mex. 2004 Sep-Oct;46(5):373-5. DOI: 10.1590/S0036-36342004000500002 [ Links ]
10 Mettler NE, Fernández AS, Di Santo MI, Pardo DA. Flavivirus: serological survey in horses from the Tandil area. Rev Argent Microbiol. 1985;17(1):47-9. [ Links ]
11 Monath TP, editor. St. Louis encephalitis. Washington: American Public Health Association; 1980. Epidemiology. p. 239-312.
12 Mondini A, Bronzoni R, Cardeal I, Santos T, Lázaro E, Nunes S, et al. Simultaneous infection by DENV-3 and SLEV in Brazil. J Clin Virol. 2007 Sep;40(1):84-6.
13 Mondini A, Cardeal ILS, Lázaro E, Nunes SH, Moreira CC, Rahal P, et al. Saint Louis encephalitis virus, Brazil. Emerg Infect Dis. 2007 Jan;13(1):176-8. [ Links ]
14 Pinheiro FP, LeDuc JW, Travassos da Rosa AP, Leite OF. Isolation of St. Louis encephalitis virus from a patient in Belém, Brazil. Am J Trop Med Hyg. 1981 Jan;30(1):145-8. [ Links ]
15 Pugachev KV, Guirakhoo F, Mitchell F, Ocran SW, Parsons M, Johnson BW, et al. Construction of yellow fever/St. Louis encephalitis chimeric virus and the use of chimeras as a diagnostic tool. Am J Trop Med Hyg. 2004 Nov;71(5):639-45. [ Links ]
16 Reisen WK. Epidemiology of St. Louis encephalitis virus. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 61, p. 139-83.
17 Rocco IM, Santos CL, Bisordi I, Petrella SM, Pereira LE, Souza RP, et al. St. Louis encephalitis virus: first virus isolation from a human in São Paulo State, Brazil. Rev Inst Med Trop Sao Paulo. 2005 Sep-Oct;47(5):281-5. DOI: 10.1590/S0036-46652005000500008 [ Links ]
18 Roehrig JT, Hombach J, Barrett AD. Guidelines for plaque-reduction neutralization testing of human antibodies to dengue viruses. Viral Immunol. 2008 Jun;21(2):123-32. [ Links ]
19 Shope RE. The use of a microhemagglutination-inhibition test to follow antibody response after arthropod-borne virus infection in a community of forest animals. An Microbiol. 1963;11:167-71.
20 Stefano I, Sato HK, Pannuti CS, Omoto TM, Mann G, Freire MS, et al. Recent immunization against measles does not interfere with the efficacy of yellow fever vaccination. Vaccine. 1999 Mar;17(9-10):1042-6. [ Links ]
21 Travassos da Rosa APA, Travassos da Rosa JFS, Pinheiro FP, Vasconcelos PFC. Arboviroses. In: Leão RNQ, coordenador. Doenças infecciosas e parasitárias: enfoque amazônico. Belém: CEJUP; 1997. p. 208-225. [ Links ]
22 Tsai TF, Mitchell CJ. St. Louis encephalitis. In: Monath TP, editor. The arboviruses: epidemiology and ecology. Boca Raton: Academic Press; 1989. p. 431-58.
23 Vasconcelos PFC, Travassos da Rosa JFS, Travassos da Rosa APA, Dégallier N, Pinheiro FP, Sá Filho GC. Epidemiologia das encefalites por arbovírus na Amazônia brasileira. Rev Inst Med Trop Sao Paulo. 1991 nov-dec;33(6):465-76. [ Links ]
24 Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Shope RE, Travassos da Rosa JFS, Rodrigues SG, et al. Arboviruses pathogenic for man in Brazil. In: Travassos da Rosa APA, Vasconcelos PFC, Travassos da Rosa JFS, editors. An overview of arbovirology in Brazil and neighbouring countries. Belém: CEJUP; 1998. p. 72-99. [ Links ]25 Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa JFS. Arboviroses. In: Focaccia R, Veronesi R, editores. Tratado de infectologia. São Paulo: Atheneu; 2005. Vol. 1, p. 289-302.
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Sueli Guerreiro Rodrigues
Instituto Evandro Chagas
Rodovia BR316, km 7, s/no, Levilândia
CEP: 67030-000
Ananindeua-Pará-Brasil
E-mail:suelirodrigues@iec.pa.gov.br
Recebido em / Received / Recibido en: 29/7/2009
Aceito em / Accepted / Aceito en: 28/9/2009











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI