Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100012
Epidemiologia do vírus da Encefalite de Saint Louis na Amazônia brasileira e no Estado do Mato Grosso do Sul, Brasil: elevada prevalência de anticorpos em equinos
Sueli Guerreiro RodriguesI; Otávio Pinheiro OlivaII; Francisco Anilton Alves AraujoIII; Lívia Carício MartinsIII; Janiffer Oliveira ChiangI; Daniele Freitas HenriquesI; Eliana Vieira Pinto da SilvaI; Daniela Sueli Guerreiro RodriguesI; Assis do Socorro Correa dos PrazeresI; José Tavares-NetoIV; Pedro Fernando da Costa VasconcelosI
ISeção de Arbovirologia e Febres Hemorrágicas, Instituto
Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIPan American Health Organization, Washington, DC, EUA
IIICOVEV/CGDT/DEVEP, Secretaria de Vigilância em Saúde, Ministério
da Saúde, Brasília, Distrito Federal, Brasil
IVDepartamento de Medicina, Faculdade de Medicina da Bahia, Universidade Federal
da Bahia, Salvador, Bahia, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Epidemiology of Saint Louis encephalitis virus in the Brazilian Amazon region and in the State of Mato Grosso do Sul, Brazil: elevated prevalence of antibodies in horses. Traduzido por: André Diniz.
RESUMO
A imunidade de equinos (n = 1401) contra o vírus da Encefalite de Saint Louis (SLEV) foi investigada na Amazônia brasileira (Bragança e Salvaterra/PA, Macapá/AP e Rio Branco/AC) e Maracaju, no Estado do Mato Grosso do Sul, por meio de testes de inibição da hemaglutinação (IH) e neutralização por redução de placas (PRNT). Foram detectados anticorpos IH e neutralizantes específicos (reações monotípicas – RM) para SLEV e outros flavivírus incluídos nos testes, assim como reações cruzadas para flavivírus. Pelo teste de IH, reações monotípicas foram observadas em 248 (17,7%) amostras de soro, 137 (55,2%) para SLEV, e reações cruzadas foram detectadas em 380 (27,1%). A frequência de reações monotípicas para SLEV e para reações cruzadas foi significativamente maior em Macapá e Salvaterra, respectivamente. Pelo PRNT, foi observada a neutralização de SLEV em 713 (50,9%) amostras, e a prevalência de anticorpos neutralizantes foi significativamente maior em Macapá, em comparação com Salvaterra (p = 0,0083). Este estudo traz novos dados a respeito da imunidade de equinos contra SLEV no Brasil, e confirma a ampla distribuição de SLEV e a diversidade de flavivírus no País, bem como a aparente ausência de doenças em equinos infectados por SLEV.
Palavras-chave: Encefalite de St. Louis; Cavalos; Testes Sorológicos; Encefalitis por Arbovirus.
INTRODUÇÃO
O vírus da encefalite de Saint Louis (SLEV) é um arbovírus encefalitogênico pertencente ao complexo do vírus da encefalite japonesa, gênero Flavivirus, família Flaviviridae2. O SLEV é amplamente distribuído no hemisfério ocidental; entretanto, as cepas isoladas nos Estados Unidos e no Canadá são aparentemente mais virulentas que as isoladas no Caribe e nas Américas Central e do Sul4. Mosquitos do gênero Culex e aves silvestres servem de hospedeiros primários de amplificação do SLEV21,24,16. Equinos, que são normalmente hospedeiros terminais de outros arbovírus encefalitogênicos, não apresentam viremia elevada ou doença clínica quando infectados com SLEV mediante picada de mosquito ou via inoculação subcutânea16,24. Apesar de serem detectados anticorpos contra o SLEV em equinos infectados naturalmente10,9, não há dados suficientes a respeito do real papel desses animais no ciclo de transmissão do SLEV na natureza.
A encefalite é uma das mais graves manifestações clínicas de infecções por arbovírus, e pode levar à morte ou deixar sequelas graves, que se caracterizam por disfunção motora residual e/ou psicológica nos sobreviventes. A infecção por arbovírus, portanto, constitui um importante problema de saúde pública e veterinária21,24. Em humanos, infecções pelo SLEV nem sempre causam manifestações clínicas de encefalite e muitas vezes passam despercebidas, exceto quando ocorrem durante o curso de uma epidemia16. Dependendo da virulência da cepa do SLEV e do histórico de infecção da população, as proporções entre infecção aparente e inaparente, estimadas a partir de dados coletados em epidemias, variam entre 1:16 a 1:42511,16. As taxas de letalidade normalmente alcançam 5-20%22, sendo sempre mais elevadas entre idosos (>75 anos de idade)16.
No Brasil, em especial na Amazônia brasileira, já foram realizados diversos isolamentos do SLEV a partir de artrópodes hematófagos e aves. Porém, o isolamento do SLEV a partir de seres humanos tem sido raro, apesar de haver estudos sorológicos registrando uma prevalência de anticorpos inibidores de hemaglutinação variando entre 1% e 5%21,23,24. Na década de 1980, foram registradas quatro pequenas epizootias causadas pelo SLEV no Estado do Pará, nas florestas adjacentes a Belém, envolvendo aves silvestres e animais sentinelas23. Entretanto, não há informações a respeito de taxas de imunidade ao SLEV em equinos no país.
No Brasil, há o registro de três cepas isoladas do sangue de pacientes sem sintomas neurológicos: duas de pacientes do Estado do Pará, que apresentavam febre e icterícia14,24, e uma de São Paulo, com suspeita clínica de dengue17. Recentemente, o SLEV foi detectado por meio de técnicas moleculares em quatro amostras de soro de pacientes com suspeita clínica de dengue e em dois pacientes com suspeita de meningoencefalite viral, todos do Município de São José do Rio Preto, Estado de São Paulo12,13.
Deve-se ressaltar que a interpretação dos resultados sorológicos para flavivírus exige atenção especial devido à complexa combinação de reatividade cruzada entre os anticorpos e as infecções sequenciais (secundárias) causadas por diferentes flavivírus8. Em testes sorológicos, os anticorpos produzidos durante uma infecção normalmente reagem contra os antígenos de vários flavivírus. Esta reatividade cruzada é ainda maior durante infecções secundárias. A especificidade monotípica de IgG em infecções primárias, i.e., a produção de anticorpos contra antígenos de um flavivírus apenas, foi anteriormente identificada8. Como 11 diferentes flavivírus já foram isolados no Brasil, testes sorológicos visando a sua detecção na população brasileira tendem a apresentar altas taxas de reatividade cruzada3,2,25.
A reatividade cruzada entre flavivírus pode ser claramente demonstrada em testes de inibição da hemaglutinação (IH), um método que permite testar simultaneamente um grande número de amostras ante diferentes arbovírus. Consequentemente, sua aplicação fornece informações sobre a resposta imunológica de uma determinada população contra os arbovírus.
A reconhecida especificidade do teste de neutralização geralmente permite a identificação do agente viral responsável por uma infecção primária. Contudo, este fato não se aplica às infecções secundárias quando o teste é utilizado para o sorodiagnóstico in vitro. Atualmente, o teste de neutralização por redução de placas (PRNT) é o mais utilizado para testes in vitro. No entanto, apesar da importância do PRNT para avaliar a eficácia de vacinas e para confirmar sorodiagnósticos, devido à sua alta especificidade e sensibilidade, a falta de um procedimento padrão e de critérios diagnósticos tem resultado em uma grande variação entre laboratórios8,18.
Este estudo investigou a imunidade de equinos ao SLEV em quatro municípios da Amazônia brasileira e do Estado do Mato Grosso do Sul, com o objetivo de contribuir para uma maior compreensão a respeito da epidemiologia do SLEV
MATERIAIS E MÉTODOS
DESENHO DO ESTUDO
Estudo observacional transversal descritivo.
SOROS DE EQUINOS
Foram coletadas amostras de soro de 1401 equinos, obtidos por conveniência, entre março e setembro de 2005. Os inquéritos sorológicos foram realizados em fazendas nos Municípios de Bragança (n = 244) e Salvaterra (n = 272), no Estado do Pará, Macapá (n = 179), no Estado do Amapá; e em feiras agropecuárias estaduais em Rio Branco (n = 333), no Estado do Acre, e Maracaju (n = 373), no Estado do Mato Grosso do Sul (Figura 1). Os equinos apresentavam-se saudáveis no momento da coleta de sangue e não tinham histórico de vacinação contra flavivírus.
Esse estudo faz parte de uma investigação mais ampla sobre vírus de encefalites equinas e o vírus do Nilo Ocidental (WNV) envolvendo diversos países da América Latina, conduzido pela Organização Pan-Americana de Saúde (OPAS)/Centros de Controle e Prevenção de Doenças (CDC).
TESTE DE INIBIÇÃO DA HEMAGLUTINAÇÃO
Pelo teste de IH adaptado para microplacas19, as amostras de soro foram testadas contra antígenos dos flavivírus SLEV, Rocio (ROCV), Ilhéus (ILHV), Cacipacoré (CPCV) e Bussuquara (BSQV). Inicialmente os soros foram triados na diluição de 1:20 contra os antígenos que continham 4 unidades hemaglutinantes, e as amostras positivas foram tituladas até a diluição (fator 2) de 1:1280.
TESTE DE NEUTRALIZAÇÃO POR REDUÇÃO DE PLACA
O PRNT foi realizado simultaneamente para o SLEV e outro flavivírus relacionado geneticamente (WNV), seguindo o protocolo para a detecção de anticorpos contra flavivírus (vírus da febre amarela)20. Foram utilizadas placas de microtitulação e células Vero a uma concentração de 1,6 x 105. As amostras foram testadas em diluições seriadas (2x) (1:10 a 1:640) contra uma média de 20 unidades formadoras de placas (UFP) do SLEV (ChimeriVax-SLEV) e 16 UFP de WNV (ChimeriVax-WNV). As placas foram incubadas por sete e seis dias, respectivamente. A titulação dos anticorpos neutralizantes foi definida como a recíproca da diluição do soro que reduziu o número de placas em 50%. As amostras que continham anticorpos neutralizantes para ambos os vírus foram consideradas positivas para um deles quando o título do anticorpo foi quatro vezes maior que o obtido para o outro; de outro modo, as amostras foram consideradas com reatividade cruzada para os vírus em questão6.
Como a realização do PRNT para o SLEV e o WNV requer um laboratório com nível de biossegurança 3 (NB-3), quimeras altamente atenuadas desses vírus com a cepa vacinai 17D do vírus da febre amarela desenvolvidas para uso em diagnóstico e vigilância15,7 foram gentilmente doadas pelo CDC ao Instituto Evandro Chagas.
Neste estudo, reatividade monotípica refere-se à presença de anticorpos contra apenas um flavivírus; reatividade cruzada refere-se à presença de anticorpos contra dois ou mais flavivírus6,8,19 (Tabela 1).

ANÁLISE ESTATÍSTICA
As taxas de prevalência de anticorpos IH e neutralizantes foram comparadas por meio de um teste binomial de proporções para amostras independentes com o nível de significância ajustado em 5% (0,05). A análise estatística foi realizada utilizando-se o programa BioEstat, versão 5.01.
RESULTADOS
Foram detectados anticorpos IH contra os flavivírus testados em 628 (44,8%) das 1.401 amostras de soros de equinos, das quais 380 (27,1%) apresentaram reatividade cruzada para flavivírus e 248 (17,7%) apresentaram reatividade monotípica contra os seguintes vírus: SLEV (n = 137; 9,8%), ILHV (n = 64; 4,6%), ROCV (n = 30; 2,1%), CPCV (n = 16; 1,1%) e BSQV (n = 1; 0,1%). Das 248 amostras apresentando reatividade monotípica, 137 (55,2%) eram para SLEV.
A análise da distribuição dos anticorpos IH por município (Figura 2) revelou maiores prevalências em equinos dos Municípios de Macapá (67%) e Salvaterra (62,9%). O número de amostras apresentando reatividade monotípica contra o SLEV foi significativamente maior em Macapá que em Bragança (p = 0,0022), Salvaterra (p = 0,0031), Rio Branco (p = 0,0043) ou Maracaju (p = 0,0063).
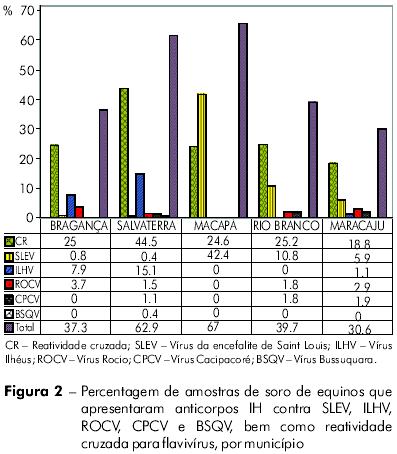
As amostras de Salvaterra apresentaram reações monotípicas aos antígenos de todos os flavivírus incluídos no teste. A maior frequência dessas reações foi para o ILHV (n = 41; 15,5%) (Figura 2). A taxa de reações cruzadas entre os flavivírus, por sua vez, foi significativamente maior nas amostras procedentes de Salvaterra (p = 0,037) do que nas de Macapá ou outros municípios.
Pelo PRNT, foram detectados anticorpos neutralizantes contra o SLEV em 713 (50,9%) amostras, e sua frequência apresentou uma variação de 34,6% (n = 94), em Salvaterra, a 60,9% (n = 109), em Macapá (Figura 3).
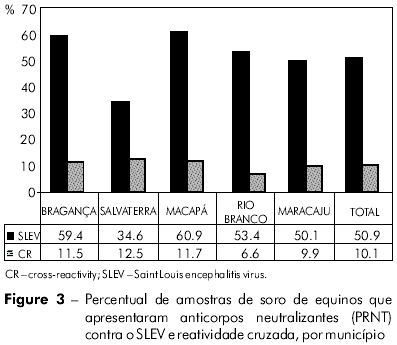
A prevalência de anticorpos neutralizantes nas amostras procedentes de Macapá foi significativamente maior quando comparadas com as de Salvaterra (p = 0,0083) e Maracaju (p = 0,0176), porém não foi verificada uma diferença significativa entre aquelas e as procedentes de Bragança (p = 0,7608) ou de Rio Branco (p = 0,1058).
A reatividade cruzada foi detectada por PRNT em 142 (10,1%) amostras de soro de todos os cinco municípios, com frequência variando entre 6,6%, em Rio Branco, e 12,5%, em Salvaterra. Ademais, 123 (19,5%) das amostras positivas pelo teste de IH deram resultado negativo para SLEV e WNV no PRNT.
DISCUSSÃO
Este estudo - o primeiro deste tipo realizado no Brasil -detectou anticorpos IH e neutralizantes contra o SLEV em equinos naturalmente infectados em cinco municípios distantes geograficamente (Figuras 1, 2 e 3). Nossos resultados demonstram a ampla dispersão do vírus, e concordam com estudos anteriormente realizados em humanos e vertebrados silvestres no Brasil (especialmente na Amazônia brasileira), que registraram uma prevalência de anticorpos IH entre 0,1 e 5,0%21,24.
É importante ressaltar que os equinos de Rio Branco e Maracaju eram provenientes de diversas regiões do Estado, enquanto que os animais dos Municípios de Macapá, Salvaterra e Bragança pertenciam a uma área específica de cada município e não apresentavam qualquer histórico de deslocamento ou vacinação prévia, o que indica que as infecções nessas áreas foram autóctones.
Os resultados do teste de IH sugerem uma grande ocorrência de infecção por SLEV no Município de Macapá, onde foi observada uma alta frequência de anticorpos devido à reatividade monotípica ao SLEV. Além disso, foi observada uma predominância de reação monotípica ao ILHV em Bragança e Salvaterra, Estado do Pará. Este vírus tem vasta disseminação nas Américas Central e do Sul, e a prevalência de anticorpos neutralizantes contra o ILHV na Região Amazônica varia entre 3 e 36%21,25. A reação monotípica ao ILHV também foi detectada em equinos que participavam de feira agropecuária estadual em Maracaju, Estado de Mato Grosso do Sul, o que está de acordo com uma observação anterior de anticorpos contra o ILHV em equinos do pantanal brasileiro5.
O teste de IH também demonstrou que as populações de equinos estudadas possuíam um padrão de resposta imune consistente com o de uma população exposta a infecções por diferentes flavivírus, corroborando a já demonstrada diversidade de flavivírus no Brasil21,3,2,25. Além disso, a variedade de reações monotípicas contra outros flavivírus sugere que o SLEV esteja possivelmente cocirculando com eles. Este fato foi bem documentado no Município de Salvaterra, onde amostras apresentaram a maior frequência de reatividade cruzada e reação monotípica contra antígenos de todos os flavivírus incluídos no estudo. A este respeito, os resultados do PRNT, por sua vez, sugerem a ocorrência de infecção por outros flavivírus nas populações equinas pesquisadas, sendo que 10,1% das amostras apresentaram resposta cruzada e 19,5% das amostras positivas para IH foram negativas para o SLEV e WNV.
A evidência sorológica apresentada por este estudo e a falta de registros de epizootia em equinos sugerem a ocorrência de infecções inaparentes, subclínicas ou oligossintomáticas, o que corrobora estudos anteriores, que sugerem que o SLEV normalmente não causa doenças clínicas aparentes em equinos24,16.
Em conclusão, a atividade do SLEV em equinos e a possível cocirculação de outros flavivírus verificada no presente estudo confirmam as pesquisas que investigaram casos humanos de infecção pelo SLEV diagnosticadas em São Paulo, os quais apresentavam dengue como principal suspeita clínica17,12,13. O baixo número de casos humanos de infecção pelo SLEV se deve provavelmente à ocorrência de infecção inaparente, mas também pode ser resultado da subdetecção de casos clínicos devido à dificuldade em se realizar o diagnóstico diferencial.
AGRADECIMENTOS
Agradecemos a Basílio Silva Buna, Luiz Roberto Oliveira da Costa e Geraldo Mendes da Silva pelo apoio recebido no trabalho de campo e nas atividades desenvolvidas em laboratório. Agradecimentos também são devidos à Dra. Barbara Johnson (CDC), pela cessão das quimeras (ChimeriVax-SLE e ChimeriVax-WN). O presente trabalho recebeu apoio financeiro do Instituto Evandro Chagas/SVS/MS, OPAS (Carta Acordo 109/2005) e do Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq (processo no. 300460/2005-8).
REFERÊNCIAS
1 Ayres M, Ayres Júnior M, Ayres DL, Santos AS. Bioestat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2007.
2 Calisher CH, Gould EA. Taxonomy of the virus family Flaviviridae. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 59, p. 1-19.
3 Figueiredo LT. The Brazilian flaviviruses. Microbes Infect. 2000 Nov;2(13):1643-9. DOI:10.1016/S1286-4579(00)01320-4 [ Links ]
4 Gubler DJ, Kuno G, Markoff L. Flaviviruses. In: Knipe DM, Howley PM, editors. Fields virology. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2007. p. 1153-252.
5 Iversson LB, Silva RA, Travassos da Rosa AP, Barros VL. Circulation of eastern equine encephalitis, western equine encephalitis, Ilhéus, Maguari and Tacaiuma viruses in equines of the Brazilian Pantanal, South America. Rev Inst Med Trop Sao Paulo. 1993 Jul-Aug;35(4):355-9. DOI: 10.1590/S0036-46651993000400009 [ Links ]
6 Johnson BW, Kosoy O, Martin DA, Noga AJ, Russell BJ, Johnson AA, et al. West Nile virus infection and serologic response among persons previously vaccinated against yellow fever and Japanese encephalitis viruses. Vector Borne Zoonotic Dis. 2005;5(2):137-45. [ Links ]
7 Komar N, Langevin S, Monath TP. Use of a surrogate chimeric virus to detect west Nile virus-neutralizing antibodies in avian and equine sera. Clin Vaccine Immunol. 2009 Jan;6(1):134-5. DOI: 10.1128/CVI.00220-08 [ Links ]
8 Kuno G. Serodiagnosis of flaviviral infections and vaccinations in humans. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 61, p. 3-65.
9 Marlenee NL, Loroño-Pino MA, Beaty BJ, Blitvich BJ, Fernández Salas I, Contreras Cordero JF, et al. Detection of antibodies to west Nile and Saint Louis encephalitis viruses in horses. Salud Publica Mex. 2004 Sep-Oct;46(5):373-5. DOI: 10.1590/S0036-36342004000500002 [ Links ]
10 Mettler NE, Fernández AS, Di Santo MI, Pardo DA. Flavivirus: serological survey in horses from the Tandil area. Rev Argent Microbiol. 1985;17(1):47-9. [ Links ]
11 Monath TP, editor. St. Louis encephalitis. Washington: American Public Health Association; 1980. Epidemiology. p. 239-312.
12 Mondini A, Bronzoni R, Cardeal I, Santos T, Lázaro E, Nunes S, et al. Simultaneous infection by DENV-3 and SLEV in Brazil. J Clin Virol. 2007 Sep;40(1):84-6.
13 Mondini A, Cardeal ILS, Lázaro E, Nunes SH, Moreira CC, Rahal P, et al. Saint Louis encephalitis virus, Brazil. Emerg Infect Dis. 2007 Jan;13(1):176-8. [ Links ]
14 Pinheiro FP, LeDuc JW, Travassos da Rosa AP, Leite OF. Isolation of St. Louis encephalitis virus from a patient in Belém, Brazil. Am J Trop Med Hyg. 1981 Jan;30(1):145-8. [ Links ]
15 Pugachev KV, Guirakhoo F, Mitchell F, Ocran SW, Parsons M, Johnson BW, et al. Construction of yellow fever/St. Louis encephalitis chimeric virus and the use of chimeras as a diagnostic tool. Am J Trop Med Hyg. 2004 Nov;71(5):639-45. [ Links ]
16 Reisen WK. Epidemiology of St. Louis encephalitis virus. In: Maramorosch K, Murphy FA, Shatkin AJ, editors. Advances in virus research. San Diego: Academic Press; 2003. Vol. 61, p. 139-83.
17 Rocco IM, Santos CL, Bisordi I, Petrella SM, Pereira LE, Souza RP, et al. St. Louis encephalitis virus: first virus isolation from a human in São Paulo State, Brazil. Rev Inst Med Trop Sao Paulo. 2005 Sep-Oct;47(5):281-5. DOI: 10.1590/S0036-46652005000500008 [ Links ]
18 Roehrig JT, Hombach J, Barrett AD. Guidelines for plaque-reduction neutralization testing of human antibodies to dengue viruses. Viral Immunol. 2008 Jun;21(2):123-32. [ Links ]
19 Shope RE. The use of a microhemagglutination-inhibition test to follow antibody response after arthropod-borne virus infection in a community of forest animals. An Microbiol. 1963;11:167-71.
20 Stefano I, Sato HK, Pannuti CS, Omoto TM, Mann G, Freire MS, et al. Recent immunization against measles does not interfere with the efficacy of yellow fever vaccination. Vaccine. 1999 Mar;17(9-10):1042-6. [ Links ]
21 Travassos da Rosa APA, Travassos da Rosa JFS, Pinheiro FP, Vasconcelos PFC. Arboviroses. In: Leão RNQ, coordenador. Doenças infecciosas e parasitárias: enfoque amazônico. Belém: CEJUP; 1997. p. 208-225. [ Links ]
22 Tsai TF, Mitchell CJ. St. Louis encephalitis. In: Monath TP, editor. The arboviruses: epidemiology and ecology. Boca Raton: Academic Press; 1989. p. 431-58.
23 Vasconcelos PFC, Travassos da Rosa JFS, Travassos da Rosa APA, Dégallier N, Pinheiro FP, Sá Filho GC. Epidemiologia das encefalites por arbovírus na Amazônia brasileira. Rev Inst Med Trop Sao Paulo. 1991 nov-dec;33(6):465-76. [ Links ]
24 Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Shope RE, Travassos da Rosa JFS, Rodrigues SG, et al. Arboviruses pathogenic for man in Brazil. In: Travassos da Rosa APA, Vasconcelos PFC, Travassos da Rosa JFS, editors. An overview of arbovirology in Brazil and neighbouring countries. Belém: CEJUP; 1998. p. 72-99. [ Links ]25 Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa JFS. Arboviroses. In: Focaccia R, Veronesi R, editores. Tratado de infectologia. São Paulo: Atheneu; 2005. Vol. 1, p. 289-302.
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Sueli Guerreiro Rodrigues
Instituto Evandro Chagas
Rodovia BR316, km 7, s/no, Levilândia
CEP: 67030-000
Ananindeua-Pará-Brasil
E-mail:suelirodrigues@iec.pa.gov.br
Recebido em / Received / Recibido en: 29/7/2009
Aceito em / Accepted / Aceito en: 28/9/2009











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI
