Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.1 Ananindeua Mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100013
La aparición de Bocavirus Humano asociado con las infecciones respiratorias agudas en niños de 0 a 2 años de edad en Belém (Estado de Pará, Brasil)
Allan Kaio SilvaI; Mirleide Cordeiro dos SantosII; Wyller Alencar de MelloII; Rita Catarina Medeiros de SousaI
INúcleo de Medicina Tropical,
Universidade Federal do Pará, Belém, Pará, Brasil
IIInstituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Dirección para correspondencia
Endereço para correspondência
Correspondence
Título original: Ocorrência de Bocavírus Humano associado às infecções respiratórias agudas em crianças de 0 a 2 anos de idade na Cidade de Belém, Pará, Brasil. Traducido por: Rocio Tamara (resumen) y Lota Moncada (artículo)
RESUMEN
INTRODUCCIÓN: Las infecciones
respiratorias agudas (IRA) siguen siendo uno de los principales problemas de
salud pública en todo el mundo. La gran mayoría de estas infecciones
están asociadas con diversos patógenos, entre los que los virus
son prevalentes. Recientemente, un nuevo parvovirus llamado Bocavirus Humano
(BovH) fue descrito. Las investigaciones son todavía escasas sobre la
asociación de este nuevo agente con casos de IRA en la población
en general. En este contexto, este artículo relata la investigación
de BovH en un segmento de la población de la Amazonía.
MATERIALES Y MÉTODOS: Este estudio analizó las muestras
de aspirados nasofaríngeos de pacientes con diagnostico de IRA atendidos
ambulatoriamente en Belém (Pará, Brasil). La investigación
e identificación de laboratorio del virus se realizó empleando
la técnica de reacción en cadena de polimerasa, utilizando pares
de oligonucleotideos específicos, seguida de un análisis filogenético
de las secuencias de nucleótidos encontradas.
RESULTADOS: De las 397 muestras clínicas analizadas, dieron positivo
las muestras de tres pacientes, de las que una era una coinfección con
el virus respiratorio sincicial.
DISCUSIÓN: El porcentaje de resultados positivos obtenidos con
la investigación demostró ser inferior a lo descrito por la literatura.
Sin embargo, cabe señalar que los estudios anteriores se hicieron con
pacientes hospitalizados, a diferencia del grupo de población aquí
estudiado. El análisis filogenético reveló una considerable
similitud de los virus encontrados con las cepas de virus ya descritos.
CONCLUSIÓN: Esta investigación, se caracteriza por ser
el primer informe que asocia el BovH con el IRA en la Región Amazónica.
Palabras claves: Infecciones del Sistema Respiratorio; Bocavirus; Infecciones por Parvoviridae.
INTRODUCCIÓN
Las Infecciones Respiratorias Agudas (IRA) permanecen como uno de los principales problemas de salud pública en todo el mundo, dada su alta morbilidad y mortalidad, principalmente en países en desarrollo7,28. Estas infecciones generalmente se encuentran asociadas a diversos patógenos, teniendo a los virus como prevalentes6,13. Entre estos podemos citar los virus Influenza A y B (Flu A y Flu B), Parainfluenza 1, 2 y 3 (HPIV), Adenovirus (AdV), Virus Respiratorio Sincicial (VRS), Rinovirus (HRV), Coronavirus (HCoV) y el Metapneumovirus Humano (hMPV)3,18.
Varios estudios continúan siendo conducidos con el objetivo de determinar la etiología de las infecciones del trato respiratorio, siendo que en 12% a 39% de los casos ningún agente conocido es encontrado. Basado en eso, Allander et al2 describieron el desarrollo de una nueva metodología fundamentada en técnicas de biología molecular, para investigación de posibles nuevos agentes relacionados a infecciones del trato respiratorio, a partir de la cual detectó un parvovirus previamente denominado Bocavirus Humano (HBoV), clasificado taxonómicamente dentro del género Bocavirus, subfamilia Parvovirinae, familia Parvoviridae2,14.
El HBoV es un virus carente de envoltorio, de simetría icosaédrica, que mide de 18 a 26 nm. de diámetro, con cápside formada por cerca de 60 capsómeros. El genoma viral se presenta no segmentado, compuesto por ácido desoxirribonucleico (DNA) de cadena simple, sentido positivo y negativo con aproximadamente 5.3 Kb. Posee tres matrices de lectura (ORFs) codificando cuatro proteínas: VP1 y VP2 proteínas estructurales del virión; NS1, proteína no estructural; y la nucleoproteína NP1, de función desconocida.
Estudios han demostrado que el HBoV aparentemente posee una distribución mundial5,9,11,16,23,25,27, con una frecuencia que varía de 1,5%5 a 19%1. Pocos estudios han sido realizados en América Latina con relación a la asociación del HBoV a otras infecciones respiratorias. Merece destaque el alto porcentual (5 - 85%) en que este virus se encuentra como coinfección, tanto con virus, como con otros patógenos12,25,27.
La transmisión del HBoV se muestra indefinida, dado haber sido encontrado, diversas veces, en el trato respiratorio5,9,23,27, suero15 , sangre1,17 , orina24 y en gastroenteritis4,24; sin embargo, estudios muestran que el HBoV es el cuarto agente más frecuentemente detectado en pacientes de hasta 2 años de edad, hospitalizados con cuadro de infección del trato respiratorio inferior1,24, sugiriendo que la vía aérea es la principal vía de transmisión.
La sintomatología observada en los casos de infección por HBoV incluye la de un resfriado común, con fiebre y rinorrea, y también silbidos y disnea. En la ocurrencia de complicaciones, generalmente se registra el desarrollo de bronquitis, bronquiolitis y neumonía11,20,23. Estudios sugieren que el HBoV puede establecer infecciones latentes o persistentes de linfocitos de la mucosa, o contribuir para hiperplasia tonsilar22.
El perfil estacional de los casos de infección por el HBoV todavía no está bien establecido. No obstante, en los países de clima templado la ocurrencia de este virus es más acentuada en el invierno y el inicio de la primavera11,27.
Hasta el momento, estudios muestran la existencia de tres tipos de HBoV (HBoV1, HBoV2 y HBoV3) siendo que el tipo 3 solo ha sido encontrado en heces4 y el tipo 2 encontrado en sangre y heces4,17. Asociado a IRA, aparece tan sólo el HBoV1.
Con relación a la variabilidad genética, Allander et al2 describieron dos cepas (ST1 e ST2) muy conservadas. Este virus parece ser muy estable, con pocas mutaciones demostradas en las secuencias de los genes VP1 y VP2. Las divergencias observadas en las secuencias nucleotidicas son causadas por mutaciones puntuales, que resultan en pocos cambios en la cadena aminoacídica16,25.
En los países de clima tropical, así como Brasil, se han hecho pocas investigaciones sobre la ocurrencia de HBoV, bien como de su variabilidad genética. Delante de este contexto, se refuerza la necesidad de la realización de estudios que posibiliten la generación de datos epidemiológicos sobre este agente, para mejor definir el papel del HBoV en los casos de IRA en la Amazonía.
MATERIALES Y MÉTODOS
POBLACIÓN ESTUDIADA
Entre los anos de 2004 a 2007, muestras de swab combinado (narina/garganta) y aspirado nasofaríngeo fueron colectadas en ambulatorio por el Sistema de Vigilancia Virológica de la Red de Influenza, del Laboratorio de Virus Respiratorios (LVR) del Instituto Evandro Chagas (IEC). Se hizo una selección entre niños con hasta dos años de edad, que presentaban señales y síntomas de IRA con hasta cinco días de evolución.
PROCESAMIENTO DE LAS MUESTRAS
Las muestras colectadas fueron centrifugadas a 1.000 rpm durante 10'. Con los sedimentos del centrifugado, se prepararon láminas siguiendo la orientación del kit comercial Light Diagnostics™ Respiratory Panel I Viral Screening and Identification IFA para Inmunofluorescencia Indirecta (IFI), utilizadas para la investigación del virus Influenza A y B, Parainfluenza 1-3, Adenovirus y VRS. El sobrenadante fue utilizado para intento de aislamiento del HBoV por técnicas de biología molecular.
IDENTIFICACIÓN POR BIOLOGÍA MOLECULAR
Para la extracción, se estandarizó un protocolo por el cual, inicialmente, se colocó en un microtubo 150 µL de tampón TNE (Tris-Na-EDTA), 20 µL de dodecil sulfato de sodio (SDS) al 10% y 10 µL de proteinaza K (10mg/ml) sumado a 120 µL de la muestra. Se incubó a una temperatura de 56o C por 30' en termobloc (Eppendorf). Posteriormente, fueron añadidos 200 µL de fenol saturado, seguido de agitación durante 1' en vortex y centrifugado a 10.000 rpm a 20o C por 3'. Se transfirieron 150 UL del sobrenadante para un microtubo conteniendo 150 µL de fenol/cloroformo/alcohol-isoamílico. Nuevamente la mezcla se agita en vortex por 1' y se centrifuga a 10.000 rpm a 20o C por 3'. Se transfieron 100 µL del sobrenadante para un microtubo conteniendo 100 µL de cloroformo, se agitó en vortex por 1' y se centrifugó por 10.000 rpm a 20o C por 3'. Por fin, se retira cuidadosamente 40 µL del sobrenadante, siendo conservado a temperatura de -20o C.
La reacción en cadena de la polimerasa (PCR) se dio utilizando pares de oligonucleotideos específicos BoV 118F, BoV 542R (NP1); VP/+/1, VP/-/726 (VP1) y VP/+/1005, VP/-/2072 (VP2), conforme a los iniciadores y tamaños del amplicón, se encuentra en el cuadro 1.
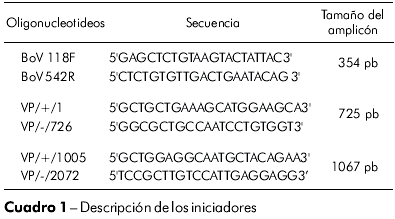
Para todos los genes, se usó reacción con volumen final de 50 µL conteniendo: 5 µL del DNA extraído, 0,5 µL de cada iniciador (50 pmol/µL), 5 µL de tampón de reacción (10x), 2 µL de dNTP (5 mM), 5 µL de MgCl2 (25 mM), 1,25 U de Taq DNA polimerasa y 31,5 µL de agua libre de DNAse/RNAse. El programa adoptado fue el especificado por Allander et al2.
Muestras PCR positivas para HBoV fueron examinadas para el gen VP1/VP2 habiendo sido preparadas para la secuenciación parcial con el Kit Big Dye® terminator Cycle Sequencing (Applied Biosystem) siguiendo instrucciones del fabricante, y secuenciado utilizando el secuenciador automático ABIPrism 3130xl (Applied Biosystem).
Todas las reacciones fueron realizadas en termociclador automático Mastercycler ep Gradient S (Eppendorf) siempre con controles negativos y positivos, a fin de evitar contaminación con DNA exógeno.
ANÁLISIS Y EDICIÓN DE LAS SECUENCIAS Y CONSTRUCCIÓN DEL ÁRBOL FILOGENÉTICO
Las secuencias nucleotidicas obtenidas del HBoV se analizaron y editaron utilizando el programa BioEdit v 7.0, y comparadas a secuencias de otros virus aislados y disponibles en el banco de datos de GenBank (http://www.ncbi.nlm.nih.gov), utilizando los programas Clustal W v 1.726 y Mega v 3.121. Los árboles filogenéticos se construyeron utilizándose el método neighbor joining (NJ), implementado en el programa Mega v 3.1. La matriz de distancia en el método de NJ se calculó a partir de las secuencias alineadas usando la fórmula de dos parámetros de Kimura19. El análisis de bootstrap usando 2 mil réplicas fue utilizado para generar una mayor confiabilidad en los valores de los grupamentos10.
RESULTADOS
Se analizaron 397 muestras, y se obtuvo positividad comprobada por secuenciación para infección por HBoV en tres de ellas (0,76%).
En todos los casos positivos se observó la infección en el período no lluvioso, acometiendo a niños de sexo masculino, con edad de 29 semanas, en promedio, y que en todos los casos, presentaban coriza y tos. Un caso mostró coinfección HBoV/VRS; el niño presentaba también fiebre y congestión nasal (Cuadro 2).

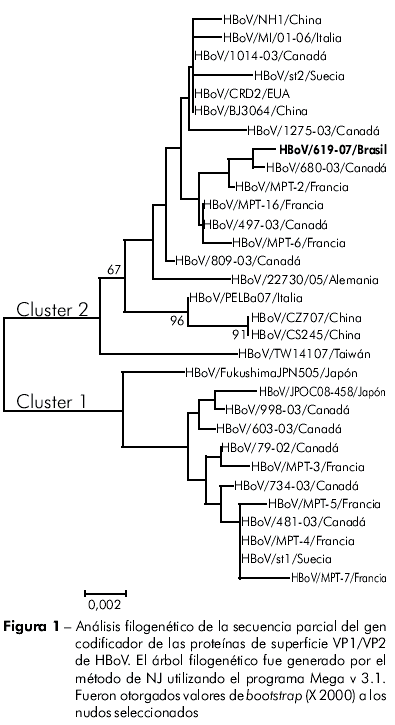
Con relación al análisis filogenético, el acompañamiento NP1 mostró 100% de similitud cuando comparado a las cepas descriptas por Allander et al2. Por ocasión del análisis de las secuencias del gen VP1/VP2, una muestra fue secuenciada en la que se observó similitud de 98,3 a 99,7%, comparada a las secuencias de cepas disponibles en el GenBank (Figura 1).
DISCUSIÓN
Entre enero de 2004 y diciembre de 2007, se diagnosticaron tres casos de infección respiratoria aguda (0,76%) asociados al Bocavirus Humano, en la Ciudad de Belém, Pará. Dos muestras se detectaron en el año de 2004 y la otra en 2007.
Estos datos revelan un porcentual bajo de positividad para HBoV, cuando comparado con datos disponibles en la literatura, los que refieren frecuencia de detección en hasta 19% de los casos investigados1. Vale resaltar, sin embargo, que las muestras de este estudio, son originarias de pacientes atendidos en ambulatorio, distinto a los estudios en los que fueron halladas tasas mayores de asociación, ya que estos abarcaban a pacientes hospitalizados9,27.
La baja positividad hallada no permitió inferir estándares epidemiológicos de prevalencia y estacionalidad ocasionados por el virus en la población estudiada. No obstante destacamos la ocurrencia del virus en el período de menor índice pluviométrico de la estación.
Una de las muestras presentó coinfección con VRS. Efectivamente, en la literatura se describe un alto nivel de incidencia del HBoV asociado a otros virus, siendo frecuente su asociación al VRS2,8.
Comparando las secuencias obtenidas a las existentes en el GenBank, se observó 100% de similitud con relación al gen NP1, y 98,6 a 99,3% cuando se refería a secuencias parciales de los genes VP1/VP2. Estos datos comprueban lo descrito referente a la alta conservación del gen NP1 y refuerzan la baja mutabilidad genómica de los segmentos VP1/VP216,25.
CONCLUSIÓN
Los estudios muestran un bajo índice (0,76%) de HBoV en niños de 0 a 2 años de edad atendidas en ambulatorio en la capital de Pará, con existencia de coinfección con otros virus respiratorios.
Las cepas circulantes en el local estudiado se presentaron con pocas mutaciones, siendo que, cuando analizadas por su proteína no estructural, mostraron similitud total a las cepas denominadas ST1, en estudio realizado en Suecia.
Destacamos en este estudio las primeras detecciones de infecciones respiratorias asociadas al HBoV en la región de la Amazonía Legal.
REFERENCIAS
1 Allander T, Jartti T, Gupta S, Niesters HGM, Lehtinen P, Osterback R, et al. Human bocavirus and acute wheezing in children. Clin Infect Dis. 2007 Apr;44(7):904-10. DOI:10.1086/512196 [ Links ]
2 Allander T, Tammi MT, Eriksson M, Bjerkner A, Tiveljung-Lindell A, Andersson B. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci U S A. 2005 Sep;102(36):12891-6. Erratum in: Proc Natl Acad Sci U S A. 2005;102(43):15712. DOI:10.1073/pnas.0504666102 [ Links ]
3 Arruda E, Cintra AOL, Hayden FG. Respiratory tract viral infections. In: Guerrant RL, Walker DH, Weller PF, editors. Tropical infectious disease: principles, pathogens, and practice. Philadelphia: Churchill Livingstone Elsevier; 2006. p. 637-59.
4 Arthur JL, Higgins GD, Davidson GP, Givney RC, Ratcliff RM. A novel bocavirus associated with acute gastroenteritis in Australian children. PLoS Pathog. [Internet]. 2009 Apr [citado 2009 jun 6];5(4):1-11. Disponível em: http://www.plospathogens.org/article/info:doi/10.1371/journal.ppat.1000391. DOI:10.1371/journal.ppat.1000391. [ Links ]
5 Bastien N, Brandt K, Dust K, Ward D, Li Y. Human bocavirus infection, Canada. Emerg Infect Dis. 2006 May;12(5):848-50. [ Links ]
6 Beckett CG, Kosasih H, Ma'roef C, Listiyaningsih E, Elyazar IR, Wuryadi S, et al. Influenza surveillance in Indonesia: 1999-2003. Clin Infect Dis. 2004 Aug;39(4):443-9. DOI:10.1086/422314 [ Links ]
7 Chiesa AM, Westphal MF, Kashiwagi NM. Geoprocessing and health promotion: social and environmental inequalities, Brazil. Rev Saude Publica. 2002 Oct;36(5):559-67. DOI:10.1590/S0034-89102002000600004. [ Links ]
8 Christensen A, Nordbø SA, Krokstad S, Rognlien AG, Døllner H. Human bocavirus commonly involved in multiple viral airway infections. J Clin Virol. 2008 Jan;41(1):34-7. DOI:10.1016/j.jcv.2007.10.025 [ Links ]
9 Chung JY, Han TH, Kim CK, Kim SW. Bocavirus infection in hospitalized children, South Korea. Emerg Infect Dis. 2006 Aug;12(8):1254-6. [ Links ]
10 Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap. Evolution. 1985 Jul;39(4):783-91. [ Links ]
11 Foulongne V, Olejnik Y, Perez V, Elaerts S, Rodière M, Segondy M. Human bocavirus in French children. Emerg Infect Dis. 2006 Aug;12(8):1251-3. [ Links ]
12 Gagliardi TB, Iwamoto MA, Paula FE, Proença-Modena JL, Saranzo AM, Criado MF, et al. Human bocavirus respiratory infections in children. Epidemiol Infect. 2009 Jul;137(7):1032-6. DOI:10.1017/S0950268808001842 [ Links ]
13 Galiano M, Videla C, Puch SS, Martínez A, Echavarría M, Carballal G. Evidence of human metapneumovirus in children in Argentina. J Med Virol. 2004 Feb;72(2):299-303. DOI:10.1002/jmv.10536 [ Links ]
14 International Committee on Taxonomy of Viruses. Virus index database [Internet]. 2009. [citado 2009 jul 5]. Disponível em: http://www.danforthcenter.org/iltab/ictvnet/asp/iVirusIndex.asp. [ Links ]
15 Jones MS, Kapoor A, Lukashov VV, Simmonds P, Hecht F, Delwart E. New DNA viruses identified in patients with acute viral infection syndrome. J Virol. 2005 Jul;79(13):8230-6. DOI:10.1128/JVI.79.13.8230-8236.2005 [ Links ]
16 Kaplan NM, Dove W, Abu-Zeid AF, Shamoon HE, Abd-Eldayem SA, Hart CA. Human bocavirus infection among children, Jordan. Emerg Infect Dis. 2006 Sep;12(9):1418-20. [ Links ]
17 Kapoor A, Slikas E, Simmonds P, Chieochansin T, Naeem A, Shaukat S, et al. A newly identified bocavirus species in human stool. J Infect Dis. 2009 Jan;199(2):196-200. DOI:10.1086/595831 [ Links ]
18 Kesson AM. Respiratory virus infections. Paediatr Respir Rev. 2007 Sep;8(3):240-8. DOI:10.1016/j.prrv.2007.07.003 [ Links ]
19 Kimura M. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences. J Mol Evol. 1980 Dec;16(2):111-20. [ Links ]
20 Kleines M, Scheithauer S, Rackowitz A, Ritter K, Häusler M. High prevalence of human bocavirus detected in young children with severe acute lower respiratory tract disease by use of a standard PCR protocol and a novel real-time PCR protocol. J Clin Microbiol. 2007 Mar;45(3):1032-4. DOI:10.1128/JCM.01884-06 [ Links ]
21 Kumar S, Tamura K, Nei M. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment. Brief Bioinform. 2004 Jun;5(2):150-63. [ Links ]
22 Lu X, Gooding LR, Erdman DD. Human bocavirus in tonsillar lymphocytes. Emerg Infect Dis. 2008 Aug;14(8):1332-4. [ Links ]
23 Ma X, Endo R, Ishiguro N, Ebihara T, Ishiko H, Ariga T, et al. Detection of human bocavirus in Japanese children with lower respiratory tract infections. J Clin Microbiol. 2006 Mar;44(3):1132-4. DOI:10.1128/JCM.44.3.1132-1134.2006 [ Links ]
24 Pozo F, García-García ML, Calvo C, Cuesta I, Pérez-Breña P, Casas I. High incidence of human bocavirus infection in children in Spain. J Clin Virol. 2007 Nov;40(3):224-8. DOI:10.1016/j.jcv.2007.08.010 [ Links ]
25 Smuts H, Hardie D. Human bocavirus in hospitalized children, South Africa. Emerg Infect Dis. 2006 Sep;12(9):1457-8. [ Links ]
26 Thompson JD, Higgins DG, Gibson TJ. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 1994 Nov;22(22):4673-80. [ Links ]
27 Weissbrich B, Neske F, Schubert J, Tollmann F, Blath K, Blessing K, et al. Frequent detection of bocavirus DNA in German children with respiratory tract infections. BMC Infect Dis. 2006 Jul;6:109. DOI:10.1186/1471-2334-6-109 [ Links ]
28 World Health Organization. The world health report 2005: make every mother and child count [Internet]. Geneva; 2005. [citado 2006 mai 15]. Disponível em: http://www.who.int/whr/2005/annex/annexes3-4_en.pdf. [ Links ]
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Allan Kaio Silva
Universidade Federal do Pará
Núcleo de Medicina Tropical
E-mail:alansilva@iec.pa.gov.br
Recebido em/Received/Recibido en: 30/07/2009
Aceito em/Accepted/Aceito en: 01/10/2009











 text in
text in 

