Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.1 Ananindeua Mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100016
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Vigilância da leishmaniose visceral em localidades epidemiologicamente distintas em Juruti, um município minerário do Estado do Pará, Brasil
Surveillance of visceral leishmaniasis in epidemiologically distinct locations in Juruti, a mining municipality in Pará State, Brazil
Vigilancia de la leishmaniasis visceral en localidades epidemiológicamente diferentes en Juruti, municipio minero del Estado de Pará (Brasil)
Lourdes Maria GarcezI; Joyce Favacho CardosoII; Anadeiva Portela ChagasII; Jefferson Francisco Correia MirandaII; Gilberto César Rodrigues de SouzaII; Daniela Cristina SoaresIII; Lucilândia Maria BezerraIV; Habib FraihaV; Jeffrey Jon ShawVI; Hiro GotoVI
IInstituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil.Universidade do Estado do Pará, Belém, Pará, Brasil
IIInstituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIIInstituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil.Secretaria de Estado de Saúde Pública do Pará (SESPA)
IVUniversidade Federal do Tocantins, Palmas, Tocantins, Brasil
VUniversidade Federal do Pará, Belém, Pará, Brasil
VIUniversidade de São Paulo, São Paulo, São Paulo, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Realizaram-se ações de vigilância para leishmaniose visceral humana (LVH) em Juruti, município minerário do Estado do Pará. Foram selecionadas as localidades de Santa Maria (SM), periurbana, e Capiranga (CA), rural, com e sem LVH, respectivamente, para quatro inquéritos sorológicos semestrais (ELISA-Lisado) nas populações caninas (SM = 94; CA = 45) e três levantamentos entomológicos (armadilhas luminosas CDC, 18-6hx4). Posteriormente, investigaram-se status clínico e infecção por Leishmania em 53 cães (SM = 28; CA = 25) com diagnóstico parasitológico (medula/linfa, Giemsa), molecular (leucócitos do sangue periférico, kDNA-PCR) e sorológico (ELISA), avaliando-se diferentes antígenos (Lisado, k39, Hsp83 - screen test, curva ROC). Soroprevalências variaram em SM (45; 40; 15; 15%) e CA (22; 30; 8,5; 0%), com médias crescentes de IgG em SM (320; 378; 951; 1866; p<0,05), apesar da eutanásia de cães após segundo inquérito; e estáveis em CA (100; 159, 141; 0), onde não houve eutanásia. A frequência de Lutzomyia longipalpis/Lutzomyia spp diferiu em SM (279/296) e CA (4/6). Os resultados clínicos e laboratoriais assemelharam-se para cães de SM e CA, respectivamente, quanto à infecção (parasitológico: 86 e 84%; kDNA-PCR: 100%), status clínico (assintomáticos: 43 e 56%; sintomáticos: 57 e 44%) e especificidade no ELISA (100%), mas variaram sensibilidades (Lisado: 44 e 18%; Hsp83: 48 e 27%; k39: 48 e 41%) e níveis de IgG (≤ 6.400; ≤ 200). O perfil da infecção canina nas localidades com e sem transmissão de LVH diferiu apenas em níveis/evolução de IgG, o que torna necessária a temporalidade dos inquéritos sobretudo em áreas silenciosas, isoladas, com baixa densidade do vetor, onde seria dispensável a eutanásia de cães. O melhor teste sorológico foi ELISA-k39.
Palavras-chave: Leishmaniose Visceral; Cães; ELISA; Reação em Cadeia da Polimerase Leishmania; Insetos Vetores; Vigilância epidemiológica.
ABSTRACT
Surveillance actions for human visceral leishmaniasis (HVL) were carried out in Juruti, a mining municipality in Pará State. A peri-urban (Santa Maria-SM) and a rural (Capiranga-CA) location were selected with or without HVL, respectively, for the execution of four biannual serologic inquiries (lysate ELISA) in canine populations (SM = 94, CA = 45) and three entomological surveys (CDC light traps, 18-6 h x4). Subsequently, the clinical status, as well as the infection by Leishmania, was investigated in 53 dogs (SM = 28; CA = 25) with parasitological (bone marrow/lymph, Giemsa), molecular (peripheral blood leukocytes, kDNA-PCR) and serological (ELISA) diagnoses assessing different antigens (lysate, K39, Hsp83 - screen test, ROC curve). Seroprevalence varied in SM (45; 40; 15; 15%) and in CA (22; 30; 8.5; 0%), presenting increasing average IgG rates in SM (320; 378; 951; 1866; p <0.05) despite the euthanasia of dogs after the second survey, and stable average IgG rates in CA (100; 159; 141; 0), where euthanasia was not conducted. The frequency rates of Lutzomyia longipalpis/Lutzomyia spp. differed in SM (279/296) and CA (4/6). Clinical and laboratory results were similar for dogs from SM and CA, respectively: infection (parasitological examination: 86 and 84%; kDNA-PCR: 100%), clinical status (asymptomatic: 43 and 56%; symptomatic: 57 and 44%), and specificity by ELISA (100%). On the other hand, sensitivity (lysate: 44 and 18%; Hsp83: 48 and 27%; K39: 48 and 41%) and IgG levels (≤ 6,400; ≤ 200) varied, respectively. The profile of canine infection in localities with or without HVL transmission differed only in terms of the level/evolution of IgG, which makes the temporality of investigations necessary, especially in quiet and isolated areas that present a low vector density and where the euthanasia of dogs would become unnecessary. The best serological test was ELISA-K39.
Keywords: Leishmaniasis, Visceral; Dogs; Enzyme-Linked Immunosorbent Assay; Polymerase Chain Reaction; Insect Vectors; Epidemiologic Surveillance.
RESUMEN
Se realizaron actividades de vigilancia para la leishmaniasis visceral humana (LVH) en Juruti, un municipio minero en el Estado de Pará. Se seleccionaron zonas periurbanas (Santa María-SM) y rurales (Capiranga-CA), con y sin LVH respectivamente, para cuatro estudios serológicos semestrales (ELISA lisado) en la población canina (SM = 94, CA = 45) y tres encuestas entomológicas (trampas de luz CDC, 18-6hx4). Posteriormente, se investigó el estado clínico y la infección por Leishmania en 53 perros (SM = 28, CA = 25) con diagnóstico parasitológico (médula ósea o linfa, Giemsa), molecular (leucocitos de sangre perférica, kDNA-PCR) y serológico (ELISA), evaluando diferentes antígenos (Lysate, K39, Hsp83 - screen test, curva ROC). La seroprevalencia varió en SM (45; 40; 15; 15%) y CA (22; 30; 8.5; 0%), con media creciente de IgG en SM (320; 378; 951; 1866; p<0,05), a pesar de la eutanasia en los perros después de la segunda encuesta, y estable CA (100; 159, 141; 0), en que no hubo eutanasia. La frecuencia de Lutzomyia longipalpis/Lutzomyia spp difiere en SM (279/296) y CA (4/6). Los resultados clínicos y de laboratorio se asemejan para perros de SM y AC, respectivamente, respecto a la infección (parásitos: 86 y 84%, kDNA-PCR: 100%), situación clínica (asintomática: 43, 56%; sintomáticas: 57, 44%) y especificidad en ELISA (100%), pero se registró variación en la sensibilidad (lisado: 44 y 18; Hsp83: 48 y 27%; K39: 48 y 41%) y en los niveles de IgG (≤ 6.400; ≤ 200). El perfil de la infección canina en las localidades con y sin transmisión de la LVH difería sólo en los niveles o en la evolución de IgG, que hace necesaria la temporalidad de las investigaciones, principalmente en zonas tranquilas y aisladas, de baja densidad del vector, donde seria innecesaria la eutanasia en perros. La mejor prueba serologica fue ELISA-K39.
Palabras clave: Leishmaniasis Visceral; Perro; Prueba ELISA; Reacción en Cadena de la Polimerasa; Insectos Vectores; Vigilancia Epidemiológica.
INTRODUÇÃO
A leishmaniose visceral humana (LVH) é uma doença grave e potencialmente fatal sem diagnóstico e tratamento precoces. No continente americano é causada pelo protozoário Leishmania (Leishmania) infantum chagasi, cuja transmissão a hospedeiros vertebrados é feita pela espécie Lutzomyia longipalpis (Diptera: Psychodidae: Phlebotominae), o vetor mais definido da LVH nas Américas. A raposa (Cerdocyon thous) atua como reservatório do parasito na manutenção de um ciclo silvestre14,11, mas o cão doméstico (Canis familiaris) tem importância epidemiológica na transmissão aos humanos, por ser o reservatório no ciclo doméstico do protozoário e a principal fonte de infecção ao vetor15.
A leishmaniose visceral encontra-se em expansão, com tendência à urbanização no Estado do Pará. Algumas áreas de transmissão intensa da doença compreendem municípios do oeste do Estado. Nesta região, Juruti é classificado como município de transmissão esporádica para LVH; entretanto, tem divisa, a leste, com Santarém, segunda maior cidade do Estado e área de transmissão intensa da doença. O grande potencial minerário (bauxita) de Juruti tem atraído empreendimentos que, apesar de contribuírem para o desenvolvimento econômico da região, provocam velozes transformações ambientais, com impactos na saúde pública.
As características socioeconômicas e ambientais influenciam a efetividade das estratégias operadas nos municípios brasileiros para o controle da LVH20,7. Por esse motivo, a compreensão da evolução da doença no contexto de grandes transformações, orientaria as ações voltadas à vigilância, prevenção e controle da leishmaniose visceral20,4.
Analisaram-se, em um seguimento de 18 meses, fatores de risco para LVH (reservatório doméstico e vetor) em dois microambientes de Juruti, representados por localidades rurais sentinelas, com e sem transmissão de LVH e sob influência direta e indireta de um empreendimento minerário. Em seguida, investigou-se o perfil de cães infectados em cada localidade, com o uso de métodos de diagnóstico clínico e laboratorial (parasitológico, molecular e sorológico). O desempenho de antígenos, bruto e recombinantes, no ensaio imunoenzimático (ELISA) para o diagnóstico sorológico nessas áreas epidemiologicamente distintas, foi estabelecido. Discutiram-se ainda as implicações da eutanásia de cães nas ações de controle.
MATERIAIS E MÉTODOS
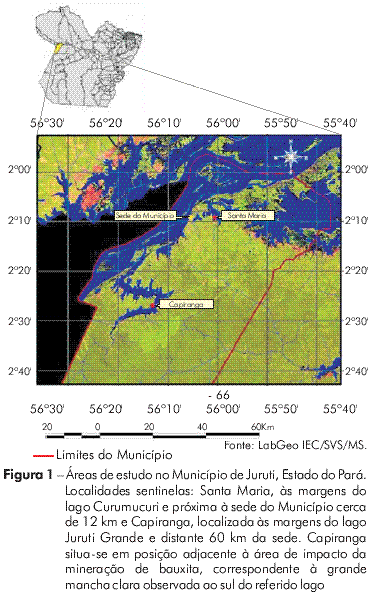
ÁREAS DE ESTUDO
A pesquisa sobre leishmaniose visceral canina (LVC) foi realizada em duas localidades sentinelas, Santa Maria e Capiranga, do Município de Juruti/Pará, distantes do centro urbano, respectivamente, 12 e 60 km (Figura 1). Na localidade rural Capiranga, situada no entorno do sítio de prospecção mineral, não há casos de LVH relatados pela comunidade residente e tampouco notificados nos últimos cinco anos investigados. Em Santa Maria, periurbana e classificada como localidade de transmissão da doença, havia um caso de LV humana notificado há três anos, conforme informado pela Secretaria de Saúde do Município de Juruti.
POPULAÇÃO CANINA
A população canina correspondia a 30% da população humana, tanto em Santa Maria (94/303) quanto em CA (45/149) no início do estudo (11/2006).
DESENHO DO ESTUDO E AMOSTRA
Dois grupos de amostra foram utilizados nas duas localidades. O primeiro (G1), para o seguimento da LVC por meio de inquéritos sorológicos, e o segundo (G2) para a determinação do perfil da LVC e do desempenho diagnóstico de diferentes antígenos em testes sorológicos. A amostra do G1 consistiu apenas de plasmas. Sendo assim, em um seguimento temporal de 18 meses realizaram-se quatro inquéritos sorológicos a intervalos semestrais: novembro/2006, abril/2007, outubro/2007 e abril/2008. O número de animais variou a cada inquérito, na dependência do tamanho da população canina e do encontro dos cães nos arredores das residências. Em Santa Maria, as amostras do primeiro ao quarto inquérito somaram 217 plasmas (55, 57, 47 e 58), enquanto em Capiranga totalizaram 90 (27, 10, 23 e 30). A amostra do G2 compôs-se de diferentes espécimes: plasma, leucócitos do sangue periférico (LSP) e aspirado medular/linfático de 53 cães (Santa Maria: 28 e Capiranga: 25), obtidos dois meses após a conclusão do seguimento sorológico. Nessa amostra investigou-se o perfil da LVC nas duas localidades, considerando critérios clínicos e laboratoriais para determinação de infecção e/ou doença.
COLETA DE ESPÉCIMES E EXAMES LABORATORIAIS
O total de 5mL de sangue (para G1 ou G2) foi coletado de cada animal por punção venocefálica em tubo a vácuo contendo EDTA (Shandong, USA). O plasma foi então obtido por centrifugação à temperatura ambiente (3700g/10'/TA) e mantido a -20o C para posterior análise por meio do ensaio imunoenzimático (ELISA) com uso de antígeno bruto de Leishmania, que consistiu em lisado de promastigotas de L. (L.) infantum chagasi18. Para G2 utilizaram-se no ELISA, além do antígeno bruto de Leishmania, antígenos recombinantes Hsp832 e k3923 . O desempenho dos testes sorológicos para o diagnóstico da LVC com os três antígenos foi comparado nas diferentes áreas em relação ao padrão ouro estabelecido. Para este grupo (G2), também obtiveram-se LSP, que foram preservados a -20o C até o momento de uso e destinaram-se ao diagnóstico pela kDNA-PCR13 . Amostras de linfonodo (pré-escapular e/ou poplíteo) ou medula óssea foram também obtidas dos mesmos cães, por punção aspirativa, e o material destinou-se ao preparo de esfregaços corados pelo Giemsa e examinados ao microscópio óptico (40x) para a pesquisa de amastigotas16.
EXAME CLÍNICO DOS CÃES
Os cães do G2 foram examinados quanto a seis sinais da doença: alopécia, dermatite, ulcerações cutâneas, conjuntivite, onicogrifose e linfadenopatia. Cada sinal foi pontuado em uma escala semiquantitativa de 0 (ausente) a 3 (severo), e a soma revelou o total da pontuação clínica. Cães com pontuação total de 0 a 2 foram arbitrariamente classificados como assintomáticos, de 3 a 6 oligossintomáticos e de 7 a 18 polissintomáticos19.
PADRÃO OURO PARA COMPARAÇÃO DOS TESTES
Na amostra obtida após o seguimento, o exame parasitológico direto e o ELISA-lisado foram utilizados em associação para se determinar um painel de amostras padrão ouro. Estabeleceu-se um consenso entre os dois testes, no qual os plasmas positivos para pelo menos um deles, e os negativos para ambos, foram considerados os grupos padrão ouro positivo e negativo, respectivamente.
ESTATÍSTICAS
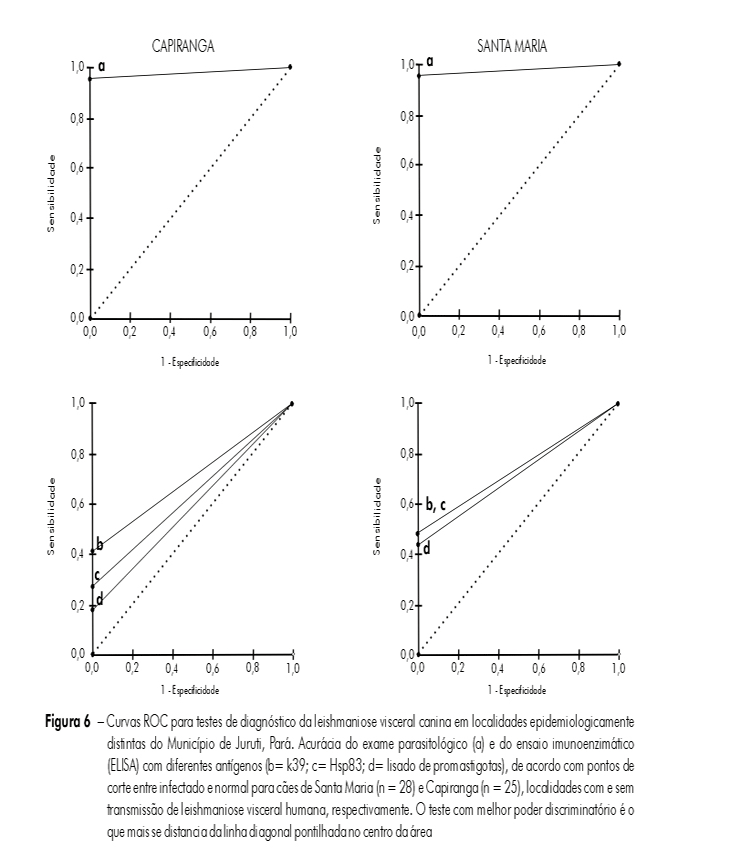
Utilizou-se o teste exato de Fisher e a análise de variância (ANOVA) para comparação entre grupos, com nível de significância igual a 5%. Como parte da análise do perfil da infecção/doença em amostra de cães de Santa Maria (28) e Capiranga (25), os resultados dos testes de ELISA com os três antígenos nessa amostra foram comparados àqueles obtidos com o padrão ouro para a determinação do desempenho do teste com cada antígeno (ELISA-lisado, ELISA-Hsp83 e ELISA-k39). Assim, utilizou-se o screen test, onde: a = verdadeiros positivos, b = falsos positivos, c = falsos negativos e d = verdadeiros negativos. Foram calculados a sensibilidade (a/a+c x 100), especificidade (d/b+d x 100) e os valores de predição positivo (a/a+b x 100) e negativo (d/c+d x 100), além da prevalência (a+c/a+b+c+d). O contrabalanço entre sensibilidade e especificidade foi expresso na curva ROC (do inglês, receiver operator caracteristic) para definição do teste com melhor poder discriminatório em cada localidade8.
LEVANTAMENTOS ENTOMOLÓGICOS
Realizaram-se três levantamentos entomológicos com armadilhas luminosas CDC em períodos do verão (abril e julho/2007) e do inverno amazônicos (janeiro/2008). Cinco estações de coleta entomológica foram utilizadas por localidade e cada captura teve a duração de quatro noites (18 - 6 h x 4), perfazendo um esforço de captura igual a 144 h em cada localidade. As armadilhas luminosas (CDC) foram estabelecidas em pares dentro das casas e fora delas, às proximidades de anexos abrigando animais em um raio inferior a 20 m. A identificação dos flebotomíneos foi feita pelo método morfológico22.
RESULTADOS
Os resultados obtidos por meio da vigilância do reservatório canino (Canis familiaris) e do vetor flebotomíneo (Luzomyia longipalpis) em Santa Maria e Capiranga revelaram fatores de risco para leishmaniose visceral humana em ambas as localidades.
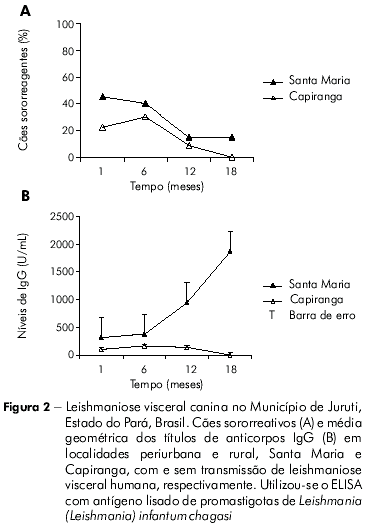
O seguimento de cães das populações de Santa Maria e Capiranga durante 18 meses, por meio de inquéritos sorológicos, revelou frequências de soropositividade para LVC (ELISA-Lisado) mais altas em Santa Maria do que em Capiranga, especialmente nos dois primeiros pontos de coleta (Figura 2A). Os níveis de anticorpos IgG também foram elevados para os cães de Santa Maria (≤ 6400), com nítida ascensão de sua média geométrica ao longo do tempo (320, 378, 951, 1866; p<0,05). Nos animais de Capiranga detectaram-se baixos níveis de IgG (≤ 200), sem alterações significantes durante todo o seguimento (100, 159, 141, 0; p>0,05), como mostra a figura 2B.
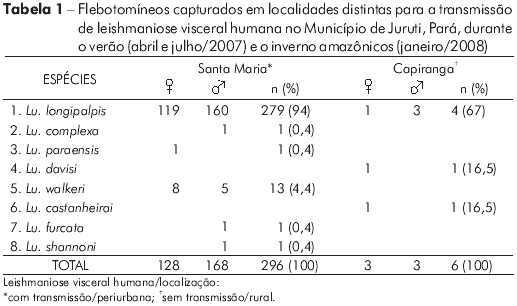
As capturas entomológicas simultâneas ao seguimento dos cães, duas no verão e uma no inverno amazônicos, revelaram a presença de flebotomíneos sinantrópicos nas duas localidades, com predominância de Lutzomyia longipalpis em relação a Lutzomyia spp. A frequência daquela espécie na amostra foi maior em Santa Maria (279/296) que em Capiranga (4/6), com densidade mais elevada no peridomicílio. No intradomicílio a espécie foi capturada em baixa frequência nas duas localidades (Santa Maria: 3/279 e Capiranga: 2/4). A tabela 1 apresenta as oito espécies identificadas e suas respectivas frequências na amostra. Nenhum espécime apresentou infecção natural por Leishmania.
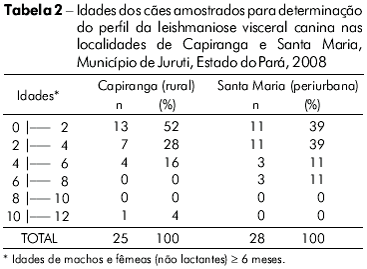
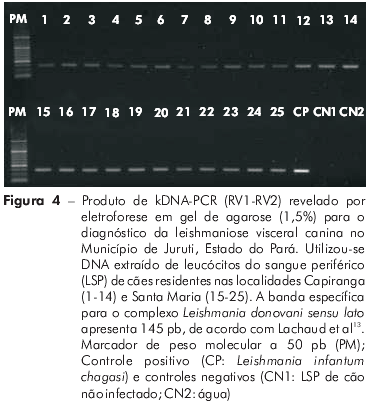
A abordagem transversal para comparação do perfil da infecção/doença indicou semelhanças entre os cães de Santa Maria (28) e Capiranga (25). A maioria, aproximadamente 80%, tinha idade igual ou inferior a quatro anos, nas duas localidades (Tabela 2). Também não diferiu, entre as localidades, o número de animais nas diferentes categorias clínicas: assintomáticos (SM = 12 e CA = 14), oligossintomáticos (SM = 11 e CA = 9) e polissintomáticos (SM = 5 e CA = 2), sendo o percentual de assintomáticos (SM = 43% e CA = 56%) e de sintomáticos (SM = 57% e CA = 44%) semelhantes em ambas. A frequência de infecção confirmada parasitologicamente foi igualmente alta em Santa Maria (86%) e Capiranga (84%) e atingiu 100% quando usado o kDNA-PCR (Figura 3). A amplificação específica do DNA (145 pares de bases) confirmou tratar-se de infecção por L. (L.) infantum chagasi (Figura 4).
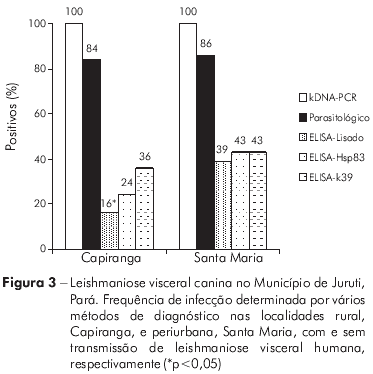
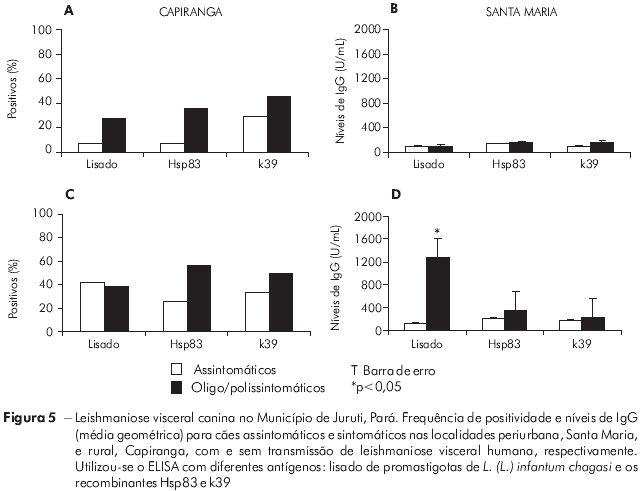
As diferenças entre o perfil de infecção/doença para os cães de Santa Maria e Capiranga foram apenas observadas na resposta humoral de anticorpos IgG à infecção por Leishmania. A frequência de cães sororreagentes diferiu nas duas áreas, na dependência do antígeno utilizado para o ELISA (Figura 3). O k39 foi mais sensível que o lisado e o Hsp83 na detecção de cães infectados assintomáticos, sendo o único a revelar semelhança entre as frequências de soropositivos assintomáticos das duas localidades, haja vista os demais se mostrarem sensíveis para cães infectados assintomáticos somente em Santa Maria (Figura 5A e 5C). Os níveis de IgG em cães, à semelhança do observado nos inquéritos sorológicos realizados durante o seguimento, foram mais elevados em animais de Santa Maria do que naqueles de Capiranga, sobretudo quando utilizado o ELISA-Lisado (Figura 5B e 5D).
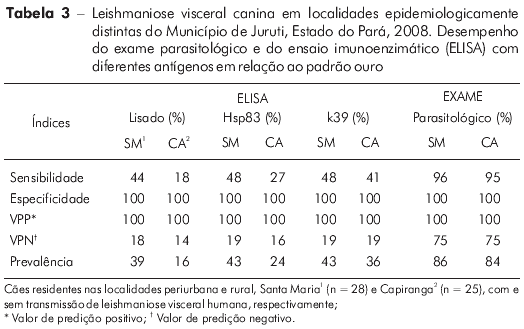
A tabela 3 apresenta o desempenho dos testes de diagnóstico em relação ao padrão ouro, destacando a superior sensibilidade do exame parasitológico para detecção de infecção por Leishmania e as variações em prevalência determinadas pelo método de diagnóstico utilizado. Entre os testes sorológicos, o ELISA-k39 foi o que apresentou maior poder discriminatório no sorodiagnóstico da LVC em ambas as localidades (Figura 6).
DISCUSSÃO
O grande potencial minerário de Juruti, no oeste do Estado do Pará, tem atraído empreendimentos que, a despeito de contribuírem com o desenvolvimento econômico da região, provocam rápidas transformações ambientais capazes de influenciar a epidemiologia da leishmaniose visceral e produzir impactos na saúde pública20,7. O fortalecimento das ações de vigilância, incluindo a investigação detalhada dos fatores de risco, deve propiciar o conhecimento necessário para a elaboração das estratégias de controle a serem operadas pelo Município.
Neste estudo, executaram-se ações de vigilância para leishmaniose visceral (LV) ao longo de 18 meses, durante fase de prospecção da bauxita em Juruti. As ações foram centradas no reservatório canino e no vetor. Utilizaram-se espaços rurais epidemiologicamente distintos e denominados localidades sentinelas: Santa Maria, com transmissão de LVH e exposta a influências urbanas pela sua localização periférica à sede municipal, da qual dista apenas 12 km, e Capiranga, a 60 km da área urbana, onde não há registros de LVH. Esta segunda localidade, entretanto, situa-se no entorno da mina de bauxita, onde estão em curso atividades relacionadas à extração do minério.
Inicialmente, foram investigadas as variações temporais da frequência de infecção determinada pela sorologia (ELISA) na população canina das localidade em estudo. Em seguida, buscou-se estabelecer o perfil da infecção/doença nos cães em cada localidade, a fim de obter subsídios à discussão do potencial das ações de controle, tendo como alvo o reservatório cão.
Ao se determinar a prevalência de cães sororreagentes para leishmaniose visceral no início do seguimento, sobretudo no segundo inquérito semestral, ambas as localidades pareciam expostas ao mesmo risco (Figura 2A). Com base nesses resultados e na ocorrência de um novo caso de LVH em Santa Maria durante a pesquisa, a equipe de vigilância do Município decidiu pela eutanásia dos cães sororreagentes, o que foi parcialmente realizado apenas em Santa Maria. Os terceiro e quarto inquéritos sorológicos caninos revelaram crescentes níveis de IgG nos cães de Santa Maria, mesmo na vigência da intervenção, mas em Capiranga, onde não houve eutanásia de cães e tampouco casos de LVH, os níveis de IgG mantiveram-se baixos ou indetectáveis durante os 18 meses de seguimento (Figura 2B).
Em áreas de transmissão intensa, os níveis de anticorpos IgG anti-Leishmania em cães são elevados ou estão em ascensão19, e se relacionam à parasitemia7,21, o que estaria ocorrendo com os cães de Santa Maria. Os baixos níveis de IgG, por sua vez, semelhantes àqueles descritos para a população canina de Capiranga, sugerem controle da infecção canina (neste caso, Capiranga seria uma localidade silenciosa) ou são consequência de reações inespecíficas na sorologia, passíveis de ocorrer devido à alta sensibilidade do ELISA, pois os cães estão expostos a diversas outras doenças infecciosas9,3,10 que induzem linfócitos B à produção de IgG com eventual reação cruzada com antígenos de L. (L.) infantum chagasi1.
Diferenças entre as populações caninas das duas localidades não teriam sido reveladas se considerada apenas a frequência de cães sororreagentes constatada, por exemplo, no segundo inquérito sorológico (Santa Maria: 40% e Capiranga: 30%, como mostra a figura 2A). Ações de vigilância da leishmaniose visceral focadas no reservatório canino, portanto, devem considerar a necessária temporalidade dos inquéritos sorológicos e a investigação dos níveis de IgG, especialmente quando levantamentos entomológicos não são factíveis pela carência de suporte técnico local.
Os intrigantes baixos níveis de IgG em cães de Capiranga, com ausência total de reatividade no último inquérito (Figura 2B), suscitaram uma investigação do perfil da infecção/doença canina em amostras das duas localidades, a fim de se compararem os resultados. Cães de Santa Maria e de Capiranga, com idades semelhantes (Tabela 2), revelaram-se idênticos quanto à apresentação clínica da leishmaniose visceral, considerando a intensidade de sinais e o número de animais distribuídos nas categorias assintomáticos, oligossintomáticos e polissintomáticos. A frequência de infecção confirmada parasitologicamente foi igualmente alta em Santa Maria (86%) e Capiranga (84%) e, com o uso da kDNA-PCR (Figuras 3 e 4), alcançou 100% em cães de ambas as localidades, indicando que a enzootia atinge toda a população canina nas duas áreas.
A ocorrência da LV humana em uma determinada área depende, basicamente, da presença de dois fatores, o 11 vetor infectado e o hospedeiro humano suscetível . Mesmo existindo o cão infectado (reservatório doméstico) nas duas localidades em igual proporção, a alta frequência de Lutzomyia longipalpis em Santa Maria, mas não em Capiranga (Tabela 1), diferenciou as duas localidades quanto ao risco de transmissão da leishmaniose visceral aos humanos. O hábito de se fazer fogueiras noturnas em Capiranga, incorporado da cultura indígena local, certamente contribui para inibir a presença de flebotomíneos no peridomicílio e a consequente transmissão de L. (L.) infantum chagasi aos humanos. Esta hipótese merece ser investigada com um estudo sobre conhecimentos, atitudes e práticas (CAP) dos habitantes dessas localidades em relação à leishmaniose visceral e sua prevenção.
Embora o exame parasitológico garanta a confirmação absoluta da infecção, na prática é necessário trabalhar com testes que não são altamente sensíveis e específicos. Na mesma amostra, o ELISA revelou frequência de positivos muito inferior ao real número de cães infectados, e com variações de sensibilidade em função do antígeno utilizado (Figura 3). Embora o lisado bruto de promastigotas de L. (L.) infantum chagasi tenha se apresentado mais sensível para detectar altos níveis de IgG em cães sintomáticos (Figura 5D), para animais infectados assintomáticos não teve o mesmo desempenho nas duas áreas. Os dois antígenos recombinantes (Hsp83 e k39) foram os mais sensíveis nessas circunstâncias, mas o ELISA-k39 foi o que apresentou maior poder discriminatório (Figura 6), detectando cães infectados assintomáticos tanto em Santa Maria quanto em Capiranga (Figura 5A e C).
Para este tipo de análise é desejável utilizar cães semelhantes aos que receberão aplicação de teste sorológico na prática de vigilância, bem como é importante que a escolha do teste padrão ouro, inexistente no caso da LVC, seja adequada8. Foi necessário, então, estabelecer um padrão ouro para efeito de cálculo dos índices de desempenho dos diferentes antígenos, que consistiu na associação dos dois exames mais tradicionais, o parasitológico e o ELISA-lisado. Este fato e, sobretudo, a inusitada natureza da amostra em CA (84% dos cães infectados), influenciaram a estimativa de especificidade e demais índices relacionados, como o valor de predição negativo, extremamente baixo em função do pequeno número de padrões negativos (Tabela 3). Esses índices precisam ainda ser investigados em cães provenientes de localidades com baixa frequência de infecção por L. (L.) infantum chagasi, pois apesar do ELISA ser o método de escolha para pesquisas epidemiológicas11, é importante considerar variações de performance associadas à carga de doença (ou intensidade de transmissão) em determinada localidade. A sensibilidade e especificidade do ELISA são também significativamente reduzidas no período latente da infecção canina7. Sendo assim, sob diferentes condições (ou em populações caninas distintas), sua sensibilidade poderia se apresentar ainda mais baixa do que a descrita neste estudo.
A inexistência de registros oficiais nos últimos cinco anos, ou de relatos dos moradores, da ocorrência de LVH em Capiranga (onde não se realizou a eutanásia de cães), associada aos fatores de risco descritos nesse estudo, confirma a necessidade da vigilância da LV dirigida às demais localidades no entorno da mina de bauxita e fundamentada nas características epidemiológicas locais, para o alcance da efetividade.
Em Capiranga, a vigilância entomológica é preferencial à eutanásia de cães, pois, nas condições ali existentes, o potencial destes de infectar flebótomos, com subsequente transmissão aos humanos, é limitado. Os achados em Santa Maria, contudo, indicam iminente risco de urbanização da LV e medidas rigorosas devem ser operadas de imediato para evitar sua expansão, incluindo ações de educação ambiental, monitoramento de vetores vislumbrando o controle químico, eutanásia de cães polissintomáticos e a busca de novos focos nas redondezas, em localidades rurais e urbanas.
Algumas ações que podem ser desenvolvidas para o controle químico da população de vetores são a borrifação de residências com inseticidas e o uso de coleiras para cães ou de mosquiteiros para humanos, ambos impregnados com deltamentrina5. Recentemente, em um estudo inédito na América Latina, demonstrou-se que o banho de cães com esse piretróide tem efeito residual (eficácia entomológica) de 5,2 meses, semelhante ao observado com o uso das coleiras, com a vantagem do baixo custo (US$0.06-0.10) em comparação a estas (US$10-15)6.
A despeito das intervenções possíveis, já disponíveis ou em experimentação, qualquer ação de controle químico do vetor depende de estudos entomológicos prévios16 que os municípios amazônicos comumente não conseguem executar. Em contrapartida, o controle efetivo da LV por meio da eliminação de cães exige que uma grande proporção de cães infectados, e infectantes ao vetor, seja removida da localidade7, o que geralmente não é factível, sobretudo quando toda a população canina se encontra infectada, como demonstrado neste estudo.
A melhor maneira de controlar a LVC e, consequentemente, prevenir a doença humana, seria uma vacina efetiva para cães, o que ainda não está disponível. As pesquisas associadas ao tema indicam promissores compostos candidatos17, e os avanços na compreensão dos mecanismos pelos quais parasitos do gênero Leishmania infectam e se evadem da resposta imune de hospedeiros mamíferos estão abrindo frentes de pesquisa em busca de novas vacinas contra a doença12.
Na indisponibilidade de uma vacina para cães, ainda que o método de diagnóstico ideal para a detecção de infecção canina seja encontrado, ele não será efetivo sem a solução dos problemas locais enfrentados pela maioria dos municípios amazônicos, como as deficiências em gestão, a escassez de recursos humanos e financeiros e os frequentes conflitos entre autoridades sanitárias e a população local, relacionados à prática da eutanásia de cães nos moldes atuais.
Os resultados deste estudo revelam a ocorrência e a extensão da enzootia de LVC em Capiranga e, consequentemente, a possibilidade de emergência da LVH não apenas nesta localidade, mas também em outras silenciosas (similares a Capiranga) e expostas ao impacto direto de grandes transformações ambientais relacionadas às atividades minerárias. Demonstrou-se ainda o risco da expansão do número de casos de LVH em áreas de transmissão expostas a crescentes influências urbanas (Santa Maria e similares). Os resultados orientam ações de vigilância, prevenção e controle da LVH em Juruti, nas localidades rurais, no entorno da mina e naquelas periurbanas.
AGRADECIMENTOS
Às comunidades Santa Maria e Capiranga, pela sempre calorosa recepção e adesão à pesquisa. À dra. Ana Márcia Souza da Cunha Oliveira e demais profissionais da Secretaria Municipal de Saúde de Juruti, pelo apoio e participação. Às equipes técnicas do Instituto Evandro Chagas, sobretudo aquelas dos Laboratórios de Imunologia e Epidemiologia (Seção de Parasitologia) e de Geoprocessamento. Às técnicas Rosângela Barros e Rita Félix, aos estudantes Eduardo Mota e Luís Dickson e ao dr. Nelson Veiga, pelo inestimável apoio técnico. À dra. Nazaré Souza, da Universidade Federal Rural da Amazônia. À mineradora Alcoa Alumínio S/A, à Secretaria de Ciência, Tecnologia e Insumos Estratégicos (DECIT/SCTIE) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo suporte financeiro.
REFERÊNCIAS
1 Alves WA, Bevilacqua PD. Quality of diagnosis of canine visceral leishmaniasis in epidemiological surveys: an epidemic in Belo Horizonte, Minas Gerais, Brazil, 1993-1997. Cad Saude Publica. 2004 Jan-Feb;20(1):259-65. [ Links ]
2 Celeste BJ, Angel SO, Castro LG, Gidlund M, Goto H. Leishmania infantum heat shock protein 83 for the serodiagnosis of tegumentary leishmaniasis. Braz J Med Biol Res. 2004 Nov;37(11):1591-3.
3 Colpo CB, Monteiro SG, Stainki DR, Colpo ETB, Henriques GB. Natural infection by Trypanosoma cruzi in dogs. Cienc Rural. 2005 May-Jun;35(3):717-19.
4 Costa CHN, Vieira JBF. Mudanças no controle da leishmaniose visceral no Brasil. Rev Soc Bras Med Trop. 2001 mar-abr;34(2):223-228. DOI: 10.1590/S0037-86822001000200013 [ Links ]
5 Courtenay O, Gillingwater K, Gomes PAF, Garcez LM, Davies CR. Deltamethrin-impregnated bednets reduce human landing rates of sandfly vector Lutzomyia longipalpis in Amazon households. Med Vet Entomol. 2007 Jun;21(2):168-76. DOI: 10.1111/j.1365-2915.2007.00678 [ Links ]
6 Courtenay O, Kovacic V, Gomes PA, Garcez LM, Quinnell RJ. A long-lasting topical deltamethrin treatment to protect dogs against visceral leishmaniasis. Med Vet Entomol. 2009 Sep;23(3):245-56. [ Links ]
7 Courtenay O, Quinnell RJ, Garcez LM, Shaw JJ, Dye C. Infectiousness in a cohort of brazilian dogs: why culling fails to control visceral leishmaniasis in areas of high transmission. J Infect Dis. 2002;186(9):1314-20. DOI: 10.1086/344312 [ Links ]
8 Fletcher RH, Fletcher SW. Epidemiologia clínica: elementos essenciais. Porto Alegre: Artmed; 2006. 288 p.
9 Garcez LM, Souza NF, Mota EF, Dickson LAJ, Abreu WU, Cavalcanti VF, et al. Focos de dirofilariose canina na Ilha do Marajó: um fator de risco para a saúde humana. Rev Soc Bras Med Trop. 2006 jul-ago;39(4):333-6. [ Links ]
10 Glaser B, Gothe R. Imported arthropod-borne parasites and parasitic arthropods in dogs. Species spectrum and epidemiologic analysis of the cases diagnosed in 1995/96. Tierarztl Prax Ausg K Klientiere Heimtiere. 1998 Feb;26(1):40-6. [ Links ]
11 Gontijo CMF, Melo MN. Leishmaniose visceral no Brasil: quadro atual, desafios e perspectivas. Rev Bras Epidemiol. 2004 set;7(3):338-49. [ Links ]
12 Khamesipour A, Rafati S, Davoudi N, Maboudi F, Modabber F. Leishmaniasis vaccine candidates for development: a global overview. Indian J Med Res. 2006 Mar;123(3):423-38. [ Links ]
13 Lachaud L, Marchergui-Hammami S, Chabbert E, Dereure J, Dedet JP, Bastien PJ. Comparison of six PCR methods using peripheral blood for detection of canine visceral leishmaniasis. J Clin Microbiol. 2002 Jan;40(1):210-5. DOI: 10.1128/JCM.40.1.210-215.2002 [ Links ]
14 Lainson R, Shaw JJ, Lins ZC. Leishmaniasis in Brazil. IV. The fox Cerdocyon thous (L) as a reservoir of Leishmania donovani in Pará state. Brazil. Trans R Soc Trop Med Hyg. 1969;63(6):741-5.
15 Lainson R, Shaw JJ. Evolution, classification and geographical distribution. In: Peters WE, Killick-Kendrick R, editors. The leishmaniasis in biology and medicine. London: Academic Press; 1987. p. 2-118. [ Links ]
16 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Manual de vigilância e controle da leishmaniose visceral. Brasília; 2006. 120 p. [ Links ]
17 Nogueira FS, Moreira MAB, Borja-Cabrera GP, Santos FN, Menz I, Parra LE, et al. Leishmune® vaccine blocks the transmission of canine visceral leishmaniasis: absence of Leishmania parasites in blood, skin and lymph nodes of vaccinated exposed dogs. Vaccine. 2005 Sep;23(40):4805-10. DOI:10.1016/j.vaccine.2005.05.011 [ Links ]
18 Quinnell RJ, Courtenay O, Davidson S, Garcez L, Lambson B, Ramos P, et al. Detection of Leishmania infantum by PCR, serology and cellular immune response in a cohort study of Brazilian dogs. Parasitology. 2001 Mar;122(Pt3):253-61. [ Links ]
19 Quinnell RJ, Courtenay O, Garcez LM, Kaye PM, Shaw MA, Dye C, et al. IgG subclass responses in a longitudinal study of canine visceral leishmaniasis. Vet Immunol Immunopathol. 2003 Feb;91(3-4):161-8. DOI:10.1016/S0165-2427(02)00311-2 [ Links ]
20 Werneck GL, Pereira TJCF, Farias GC, Silva FO, Chaves FC, Gouvêa MV, et al. Avaliação da efetividade das estratégias de controle da leishmaniose visceral na cidade de Teresina, Estado do Piauí, Brasil: resultados do inquérito inicial 2004. Epidemiol Serv Saúde. 2008 abr-jun;17(2):87-96. [ Links ]
21 Xiong G, Jin C, Cheng X, Su Z. Deltamethrin bath of domestic dog in the prevention of sandfly bite. End Dis Bull. 1994;9:32-34.
22 Yong DG, Duncan MA. Guide to the identification and geographic distribution of Lutzomyia sandflies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Memoirs of the American Entomological Institute, 54, Florida: Associated Publishers; 1994. 881p.
23 Zijlstra EE, Daifalla NS, Kager PA, Khalil EAG, El-Hassan AM, Reed SG, et al. rk39 enzyme-linked Immunosorbent assay for diagnosis of Leishmania donovani infection. Clin Diagn Lab Immunol. 1998 Sep;5(5):717-20. [ Links ]
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Lourdes Maria Garcez
Instituto Evandro Chagas
Seção de Parasitologia, Laboratório de Imunologia e Epidemiologia
Rodovia BR 316, km 7, s/no, Bairro: Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
E-mail: lourdesgarcez@iec.pa.gov.br
Recebido em/Received/Recibido en: 31/7/2009
Aceito em/Accepted/Aceito en: 21/9/2009











 text in
text in 
 Curriculum ScienTI
Curriculum ScienTI
