Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100021
ARTIGO ORIGINAL
Caracterização molecular de norovírus, sapovírus e astrovírus em crianças com gastroenterite aguda em Belém, Pará, Brasil
Glicélia Cruz Aragão; Darleise de Souza Oliveira; Mirleide Cordeiro dos Santos; Joana D'Arc Pereira Mascarenhas; Consuelo Silva de Oliveira; Alexandre da Costa Linhares; Yvone Benchimol Gabbay
Seção de Virologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para
correspondência
Correspondence
Dirección para correspondencia
RESUMO
A importância dos norovírus (NoVs), sapovírus (SaVs) e astrovírus humanos (HAstVs) como causa de surtos de gastroenteritis já está bem definida. Entretanto, poucos estudos têm descrito casos esporádicos de gastroenterites aguda causados por esses agentes. O objetivo deste estudo foi determinar o papel destes vírus na etiologia da gastroenterite aguda em crianças atendidas durante uma vigilância intensiva realizada em hospitais e ambulatórios de Belém, Brasil, de março a setembro de 2003. Um total de 305 espécimes fecais de pacientes com gastrenterite grave foram coletados e testados por reação em cadeia da polimerase precedida de transcrição reversa (RT-PCR), utilizando iniciadores específicos Mon 269 e Mon 270 para os HAstVs; p289 e p290 para os calicivírus humanos (HuCVs); e Mon 431/433 e Mon 432/434 para os NoVs. Sequenciamento dos amplicons de HAstV, HuCVs e NoVs, obtidos por RT-PCR, foi realizado usando os mesmos iniciadores. Das 305 amostras testadas, 96 (31,5%) apresentaram resultados positivos, sendo que 51 diagnosticadas como HuCVs, 40 como HAstVs e cinco infecções mistas. Das 56 (18,4%) amostras de HuCVs sequenciadas, 30 foram NoVs (9,8%) pertencentes aos genogrupos GI-4 e GII-4, e 15 (4,9%) SaVs dos grupos GI-1, GI-2 e GII-1. HAstVs foram detectados em 45 (14,7%) das amostras, incluindo os genótipos 1, 8 e 2. Esta pesquisa ressalta a importância destas viroses como causa de gastrenterite aguda e demonstra a circulação de diferentes genótipos durante o período de estudo. Estes resultados reforçam a necessidade de se estabelecer uma vigilância intensiva das gastrenterite causadas por estes vírus, de forma a poder avaliar o impacto da doença e monitorar os genótipos circulantes.
Palavras-chave: Norovírus; Sapovírus; Astrovírus Humano; Gastroenterite; Dados de Sequência Molecular.
INTRODUÇÃO
A gastrenterite aguda é uma das principais causas de morbimortalidade na infância, especialmente em países em desenvolvimento. Estima-se que mais de um bilhão de casos de diarreia aguda envolvendo crianças e adultos ocorra anualmente no mundo, fato este responsável por uma taxa de mortalidade de cerca de seis milhões entre crianças menores de cinco anos de idade32. Além de bactérias e parasitas, muitos vírus estão associados a esses episódios de gastrenterite. Dentre eles, destacam-se os rotavírus do grupo A, como principal patógeno. No entanto, a importância dos norovírus (NoVs), sapovírus (SaVs), astrovírus humanos (HAstV) e adenovírus entéricos tem aumentado devido à utilização de novas metodologias47.
NoVs e SaVs pertencem à família Caliciviridae, e acometem principalmente humanos. São vírus pequenos, não envelopados, com simetria icosaédrica, de RNA de fita simples e polaridade positiva2. Análises filogenéticas classificaram os NoVs em cinco genogrupos distintos (GI-GV). Os genogrupos GI, GII e GIV são encontrados em humanos, sendo que o GII tem sido descrito como o mais prevalente mundialmente44. Os SaVs são divididos em sete genogrupos (GI-GVII), dentre os quais GI, GII, GIV e GV são conhecidos por infectar o homem34.
Os NoVs são mundialmente considerados como principal causa de surtos de gastrenterite, sendo responsáveis por cerca de 80-90% dos casos, e sua transmissão ocorre principalmente por água e alimentos contaminados. Estudos recentes também descrevem estes vírus como um dos principais responsáveis por casos esporádicos de gastrenterite aguda detectados em hospitais e em comunidades. Os SaVs também têm sido associados tanto a surtos como a casos esporádicos de gastrenterite aguda33.
Os HAstVs pertencem ao gênero Mamastrovirus (família Astroviridae). Estão associados a surtos, sendo reconhecidos como uma causa comum de gastrenterite não só em crianças, como também em idosos e indivíduos imunocomprometidos27. São vírus pequenos, esféricos (28-30 nm de diâmetro), não envelopados, com polaridade positiva e genoma de RNA poliadenilado de fita simples (ssRNA), de aproximadamente 7 kb de comprimento13. Até o momento, já foram descritos oito genótipos de HAstVs (HAstV-1-HAstV-8), sendo HAstV-1 o mais prevalente tanto em países desenvolvidos como em desenvolvimento66,46.
A importância dos NoVs, SaVs e HAstVs como causa de surtos de gastrenterite aguda já está bem definida, entretanto poucas pesquisas têm descrito o envolvimento destes vírus em casos esporádicos, especialmente em países em desenvolvimento. Por esta razão, este estudo visa determinar o papel destes agentes na etiologia das gastrenterites agudas. Para isto, foram analisadas amostras fecais de crianças atendidas durante uma vigilância intensiva realizada em hospitais e ambulatórios de Belém de março a setembro de 2003. Os principais objetivos desta vigilância foram criar uma rede envolvendo as unidades de saúde locais e treinar a equipe tanto dos hospitais como do Instituto Evandro Chagas (IEC), visando pesquisas futuras com vacina contra rotavírus do grupo A (RV-A). Este estudo teve como enfoque principal a prevalência desses agentes, bem como sua caracterização molecular, a fim de determinar os genótipos circulantes.
MATERIAIS E MÉTODOS
PACIENTES E ESPÉCIMES
Os espécimes fecais foram coletados de episódios graves de diarreia aguda durante vigilância para RV-A realizada em Belém, Estado do Pará, região norte do Brasil, de março a setembro de 2003. No momento do atendimento, um termo de consentimento foi obtido dos pais ou dos responsáveis legais das crianças participantes. O estudo foi aprovado pelo Comitê de Ética do IEC. Um levantamento inicial foi conduzido em todos os hospitais pediátricos, ambulatórios e unidades de saúde localizadas em Belém, que forneciam assistência a crianças menores de três anos de idade, principalmente àquelas provenientes de famílias de baixa-renda que viviam sob condições sanitárias precárias e em elevados índices de aglomerados humanos. Foram feitos contatos prévios em todos esses locais e a vigilância das gastrenterites foi realizada por meio de visitas diárias, a fim de detectar qualquer episódio de diarreia, definido por três ou mais evacuações líquidas ou semilíquidas em um período de 24 h, com duração inferior a 14 dias. Um total de 762 amostras fecais foi obtido durante os seis meses de pesquisa. As amostras foram inicialmente testadas quanto à presença dos RV-A e adenovírus entéricos, utilizando "kits" comerciais de ensaio imunoenzimático (EIE). No presente estudo, todos os espécimes negativos para ambos os vírus (305) foram testados para os HAstVs e HuCVs pela reação em cadeia da polimerase precedida da transcrição reversa (RT-PCR).
OBTENÇÃO E AMPLIFICAÇÃO DO RNA VIRAL
O ssRNA viral foi extraído de 300 µL de uma suspensão fecal a 10% utilizando sílica/tiocianato de guanidina, conforme descrito por Boom et al3, incluindo modificações introduzidas por Cardoso et al6. Na reação de transcriptase reversa foi usado um iniciador randômico [hexamer pd (N) 6-50 A260 units; Amersham Biosciences] para obtenção do cDNA. Foi realizada a reação de PCR usando os pares de iniciadores Mon 269/270 (região ORF2) para os HastVs30 e p289/290 (região da RNA polimerase) para os HuCVs23. Os produtos obtidos por RT-PCR foram aplicados em gel de agarose a 1%, corados com brometo de etídio e fotografados em aparelho Gel Doc 1000 (BioRad). As amostras que apresentaram fragmentos específicos de 449 pb, 319 pb e 331 pb, foram consideradas positivas para HAstVs, NoVs e SaVs, respectivamente. Amostras positivas para HAstVs e HuCVs e água Milli-Q estéril foram incluídas em todas as reações como controles positivos e negativo, respectivamente. Algumas amostras que apresentaram baixa concentração de produto (bandas fracas) com os iniciadores para HuCVs também foram testadas com os iniciadores Mon 432/434 e Mon 431/433 (região da RNA polimerase), específicos para os NoVs dos genogrupos GI e GII, respectivamente11.
SEQUENCIAMENTO DOS AMPLICONS DE HASTVS, HUCVS E NOVS OBTIDOS POR RT-PCR
Os produtos foram purificados com o "kit" de extração de gel QiaQuick® (QIAGEN), conforme orientação do fabricante, e quantificados em gel de agarose a 1% com o marcador de peso molecular "Low DNA Mass Ladder" (Invitrogen). As sequências de nucleotídeos foram determinadas por ciclo direto usando o "Big Dye Terminator Cycle Sequencing Ready Reaction Kit" (Applied Biosystems) com os iniciadores Mon 269 e Mon 270 para HAstVs, p289 e p209 para HuCVs e Mon 431/433 e Mon 432/434 para NoVs. Os fragmentos amplificados foram purificados por precipitação com isopropanol (60 e 70%). Os produtos foram analisados no sequenciador automático "3130X/Genetic Analyzer" (AB Applied Biosystems/Hitachi).
ANÁLISE FILOGENÉTICA
Os dados das sequências de ambas as fitas foram alinhados e editados usando o programa "BioEdit Sequence Alignment Editor" (v. 7.0.5.3) e comparados com outras sequências padrão disponíveis no Banco de dados (GenBank). Os dendrogramas foram construídos utilizando o método de Neighbor-Joining (NJ) e software MEGA, versão 4.042. A análise do "Bootstrap" foi realizada com 2 mil réplicas14.
NÚMERO DE ACESSO DAS SEQUÊNCIAS DE NUCLEOTÍDEOS
As sequências de nucleotídeos determinadas neste estudo foram depositadas no banco de dados "GenBank" com os seguintes números de acesso: GU012316 a GU012345 para NoVs, GQ984294 a GQ984308 para SaVs e GQ920650 a GQ920672 para HAstVs.
RESULTADOS
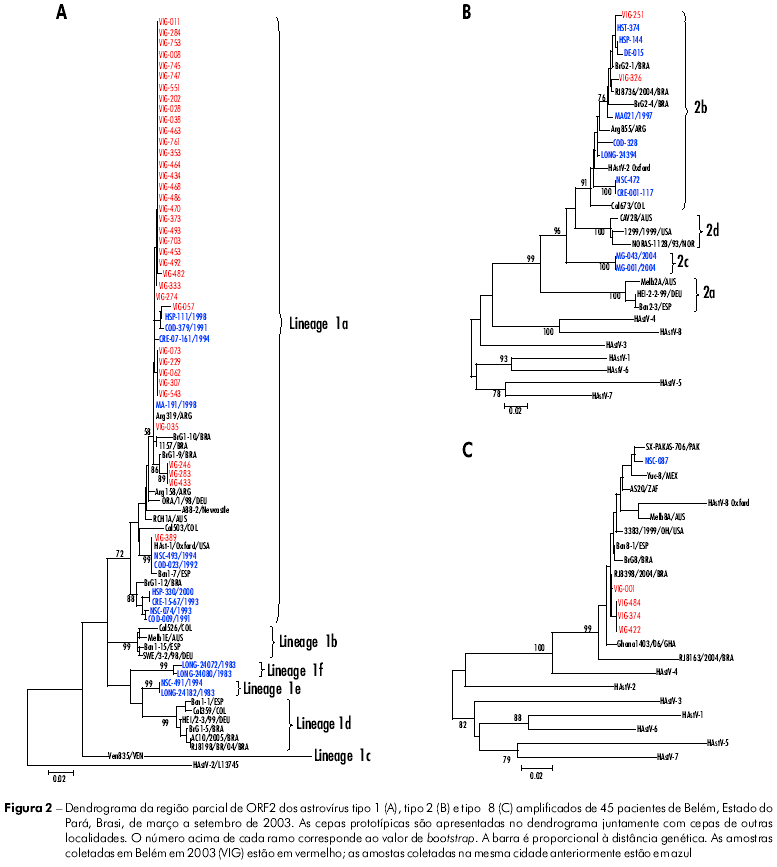
De um total de 305 amostras testadas por RT-PCR, 96 (31,5%) apresentaram resultados positivos, sendo 51 classificadas como HuCVs, 40 como HAstVs e cinco infecções mistas. Dos 56 (1 8,4%) espécimes positivos para HuCVs, 45 foram sequenciados: 30 (66,7%) classificados como NoVs, genogrupos GI-4 (1; 3,3%) e GII-4 (29; 96,7%), e 15 (33,3%) como SaVs, genogrupos GI-1 (3; 20%), GI-2 (2; 13,3%) e GII-1 (10; 66,7%) (Figura 1, Tabela 1). As 11 amostras que apresentaram um fragmento amplificado com baixa concentração (banda fraca) na PCR foram testadas novamente usando iniciadores específicos para NoVs; em oito foram observados fragmentos específicos e três foram negativas. Após sequenciamento, apenas uma amostra resultou positiva para o genogrupo GII-4, e nas outras sete, como alguns nucleotídeos não puderam ser definidos, suas cepas não foram incluídas no dendrograma. Das 45 (14,7%) amostras classificadas como HAstVs, 37 (82,2%) pertenciam ao genótipo 1, quatro (8,9%) ao genótipo 8, duas (4,4%) ao genótipo 2 e duas (4,4%) não foram sequenciadas (Figura 2, Tabela 1). Observaram-se cinco infecções mistas: quatro envolvendo NoV/GII-4 e HAstV-1 e uma SaV/GII-1 e HAstV-8.
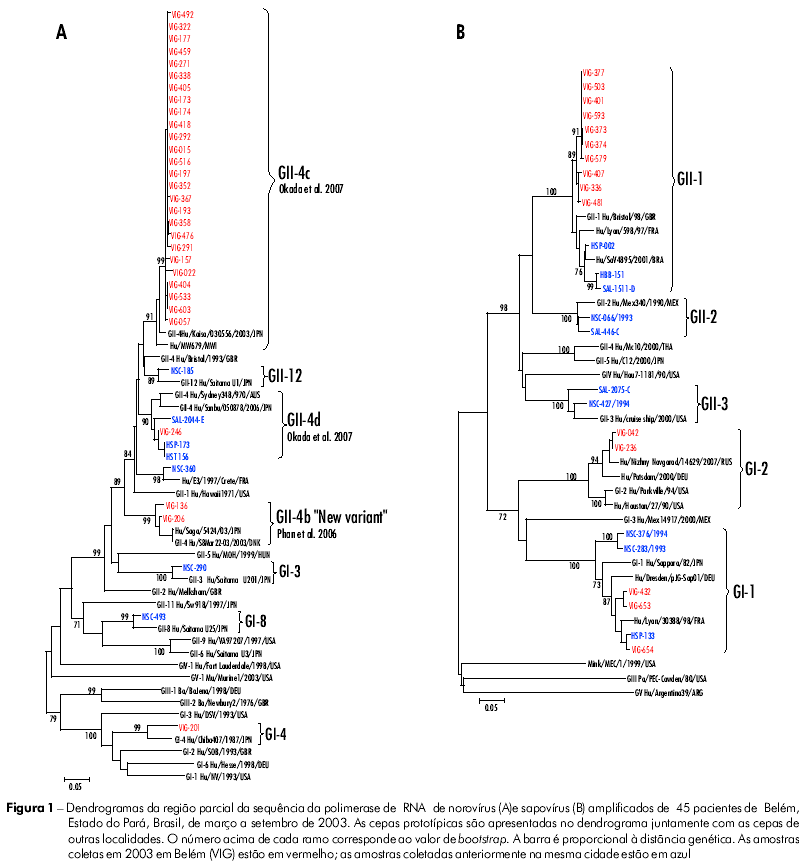

As amostras classificadas como NoVs/GII-4 foram agrupadas em três sub-linhagens distintas: GII-4b "Nova variante" (2/29; 6,9%), GII-4c (26/29; 89,6%) e GII-4d (1/29; 3,4%). A divergência média observada entre as amostras classificadas como NoV GII-4c e GII-4b "Nova variante" foi de 0,5% e 2,9%, respectivamente, e com o protótipo específico foi de 3,1% (GII-4b "Nova variante"), 3% (GII-4c), 4,9% (GII-4d) e 11,3% (GI-4). As análises envolvendo somente amostras de Belém demonstraram uma divergência média de 9,6% entre GII-4c e GII-4d, e 16,4% entre GII-4b e GII-4d. Em relação à GI-4, esta variação foi maior que 49,3%. Uma pequena divergência foi observada quando os espécimes classificados no genogrupo GII-4 foram analisados com relação à sequência de aminoácidos (dados não mostrados).
Entre os SaVs, uma variação mínima foi observada dentro de cada um dos três genogrupos detectados: GII-1 (0,9%), GI-2 (0,3%) e GI-1 (3,1%). Em relação aos protótipos, a divergência média foi: GII-1 (4,1%), GI-2 (10,3%) e GI-1 (10,3%). Usando a sequência de aminoácidos do protótipo Bristol (AJ 249939; aminoácido 1460 a 1555) como referência, muitas substituições foram notadas, caracterizando os diversos genogrupos/genótipos analisados. Contudo, nenhuma substituição exclusiva foi observada com relação às amostras de Belém (dados não mostrados).
Todas as cepas de HAstV detectadas neste estudo pertenciam à linhagem 1a e divergiram de 0 - 3,6% (média de 0,6%) e 2,7% em relação ao protótipo Oxford HAstV-1. Nenhuma substituição significante de aminoácido foi observada para a região analisada (dados não mostrados).
Os espécimes deste estudo foram provenientes de 21 hospitais e 11 unidades de saúde. A comparação das taxas de positividade obtidas nos hospitais para NoVs (13,2% -37/281), SaVs (5,3% - 15/281) e HAstVs (14,6% -41/281) com as das unidades de saúde - 4,2% (1/24), 0% e 16,7% (4/24), respectivamente - não revelou diferença estatística significante quando aplicado o teste de Fisher (p <0.05). No entanto, quando considerados juntos NoVs e SaVs (como HuCVs), esta diferença foi significante (p = 0.04).
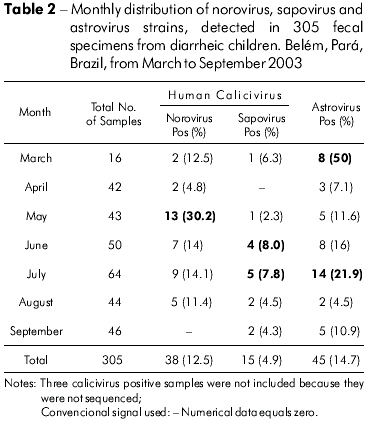
A tabela 2 demonstra a percentagem de positividade obtida para NoVs, SaVs e HAstVs em casos de gastrenterites observados durante o período de estudo (março a setembro de 2003). Verificaram-se picos de incidência para NoVs em maio (13/43; 30,2%); SaVs em junho (4/50; 8,0%) e julho (5/64; 7,8%); e HAstVs em março (8/16; 50%) e julho (14/64; 21,9%).
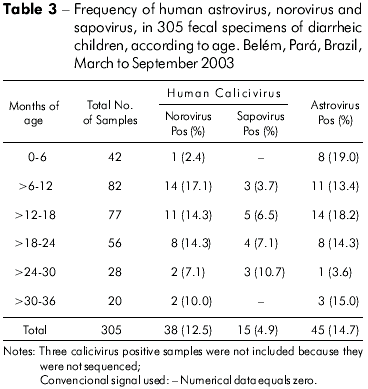
A distribuição por faixa etária dos casos positivos para NoVs e SaVs e HAstVs estão demonstrados na tabela 3. A maior taxa de detecção para os NoVs foi verificada em crianças com 6 a 12 meses de idade (17,1%), e, para os SaVs, a faixa etária foi maior, 24 a 30 meses (10,7%). Com relação aos HAstVs as taxas foram semelhantes (19,0% e 18,2%) para as idades de 0 a 6 e 12 a18 meses de vida.
A maioria dos espécimes foi coletada no período de 42 h da hospitalização ou do atendimento nas unidades de saúde. Os principais sintomas observados nos casos positivos para essas viroses foram: diarreia, vômitos, febre e desidratação, porém sintomas similares foram observados nos casos negativos (dados não mostrados).
DISCUSSÃO
No presente estudo, pelo menos um agente viral foi detectado em 31,5% das amostras testadas. Esse resultado foi um pouco superior à taxa de 29% encontrada em uma vigilância conduzida durante cinco anos na Província de Gyeonggi, Coréia do Sul22. As taxas de detecção obtidas em Belém para HuCVs, NoVs, SaVs e HAstVs foram de: 18,4%, 12,5%, 4,9% e 14,7%, respectivamente. Em hospitais de Campo Grande (7,6%), Goiânia e Brasília-DF (8,6%) e Salvador (9%), as taxas obtidas para os HuCVs foram inferiores às registradas em Belém1,4,48. Quanto aos NoVs, a positividade observada (12,5%) foi menor que as registradas em crianças da Coréia (36,2%) e Espírito Santo (39,7%), porém semelhante às encontradas em dois estudos conduzidos no Rio de Janeiro (14,5% e 20%) e São Paulo (15,7%) e superiores às de uma pesquisa realizada na Tailândia (6,5%)24,26,28,37,41,44.
A investigação de SaVs no Brasil ainda é limitada em razão da maioria dos trabalhos utilizarem iniciadores específicos para os NoVs. Contudo, estes vírus já foram detectados em uma amostra de Salvador (0,7%) e descritos em espécimes diarréicos coletados em um hospital (5,9%) e em uma unidade de saúde (3%) de Belém em percentuais similares ao do estudo atual (4,9%)29,40,48. Este percentual foi semelhante aos relatados na Tailândia e Austrália (4,8% e 4,1%, respectivamente) e menor que os da índia (10,2%)20,21,35. Nesta pesquisa, três amostras que se apresentaram positivas para HuCVs, foram negativas para NoVs (quando se utilizou iniciadores específicos), sugerindo que elas provavelmente pertenciam ao gênero SaVs, o que aumentaria a taxa de detecção desses vírus para 5,9%.
A taxa de positividade para os HAstV (14,7%) foi semelhante às registradas em ambulatórios e/ou hospitais da Coréia do Sul, Cidade de Córdoba e Rio de Janeiro (11,%, 12,4% e 14%, respectivamente)19,22,45. Este percentual foi maior que os obtidos anteriormente em diferentes estudos conduzidos em Belém durante 18 anos envolvendo hospitais, unidade de saúde, comunidade e creche, que variaram entre 2,7% e 9,9%15.
O dendrograma de NoVs mostrado no presente estudo foi construído com base nas sequências obtidas com os iniciadores 289/290, que codificam parte da RNA polimerase, e que foram usados por detectarem tanto os NoVs como os SaVs. Em contrapartida, a maioria dos estudos realizados no Brasil utiliza outros pares de iniciadores que amplificam a região B da RNA polimerase e são específicos para NoVs. Como esses iniciadores codificam a mesma região da RNA polimerase, foi possível comparar os resultados desta pesquisa com outras conduzidas no Brasil. No presente estudo, o genogrupo GII-4 foi detectado em 96,7% das amostras analisadas. Estes resultados confirmam os obtidos no Rio de Janeiro (64%) e em São Paulo (76,9%)7,44. Este genogrupo também foi o mais encontrado em amostras coletadas em Belém nos anos de 1992-1994 e 1998-2000 (dados não mostrados). Muitos artigos relatam um aumento significativo na circulação de cepas de GII-4 desde a década de 1990, com uma grande variabilidade genética, relacionados tanto a surtos extensivos como a casos esporádicos5,31,43.
Três diferentes genogrupos de SaVs foram encontrados neste estudo, sendo o GII-1 o mais prevalente (66,7%). Este também foi detectado em uma amostra de Salvador, o único outro lugar no Brasil em que este vírus foi descrito48. No entanto, em estudos realizados anteriormente em Belém40, o genogrupo mais frequente foi o GI-1. Uma ocorrência semelhante desta cepa também foi observada em Bangladesh, em crianças diarreicas8.
Três diferentes genótipos de HAstVs cocircularam em Belém durante os seis meses de estudo, sendo HAstV-1 o mais prevalente (82,2%), como também relatado em outros locais6,16,39,45. A circulação simultânea de outros genótipos foi observada em outras regiões do Brasil e do mundo6,10,36,39. Todas as amostras positivas para HAstVs-1 foram classificadas como sendo da linhagem 1a. Pesquisas anteriores realizadas em Belém demonstraram que 93,8% (76/81) das cepas de HAstVs-1 detectadas ao longo de 18 anos (1982-2000) pertenciam à linhagem 1a15. Porém, estudos conduzidos em outras localidades do Brasil, como nas cidades do Rio de Janeiro e Goiânia, de 2003 a 2005, demonstraram a circulação da linhagem 1d38,45. Os dados obtidos neste trabalho, a partir de amostras coletadas em 2003, mostraram que não ocorreu nenhuma alteração em Belém, visto que a linhagem 1a continuou sendo a única em circulação. Vale ressaltar que o HAstVs tipo 8 foi encontrado em 8,9% das amostras. Este genótipo é considerado raro, embora já tenha sido observado em outros estudos realizados em Belém, porém em menor frequência. Resultados semelhantes foram observados no Rio de Janeiro17,45.
Coinfecção envolvendo os três vírus foi verificada em 1,6% dos casos. Esta situação é relativamente comum em episódios de gastrenterite, conforme descrito por outros autores9,18,25,36,44. Este fato provavelmente reflete as precárias condições de saneamento e o baixo nível socioeconômico a que essas crianças pertencem.
Este estudo envolveu amostras coletadas em hospitais e unidades de saúde. Foi observada uma maior frequência destes vírus nos nosocômios, o que indica maior gravidade da associação desses agentes a quadros de gastrenterite. No entanto, o número de espécimes (42) coletados nas unidades de saúde foi muito pequeno para permitir uma melhor análise.
Observou-se também que os NoVs foram mais prevalentes entre crianças de 6 a 12 meses, enquanto que os SaVs o foram entre as de 24-30 meses de idade. Estes dados estão de acordo com os descritos na literatura, o que indica que os SaVs são mais frequentemente detectados em crianças de maior idade12. Um padrão de sazonalidade para esses três agentes não pôde ser definido porque este estudo envolveu somente seis meses de vigilância.
Deste modo, os dados obtidos demonstram a importância destes vírus nos casos de gastrenterite aguda tanto em hospitais como em unidades de saúde. A detecção de SaVs reforça a necessidade de se estabelecer um sistema de monitoramento para avaliar o impacto destes vírus em outras regiões do Brasil. A caracterização molecular desses agentes demonstrou que diferentes genótipos circulam ao longo do tempo (ou seja, não foram os mesmos nesta pesquisa e em outras previamente realizadas em Belém). Portanto, estudos moleculares adicionais são necessários para monitorar essas variações. A introdução recente de vacina para RV-A no Programa Nacional de Imunização Pediátrica do Brasil reforça a necessidade de investigações permanentes sobre estas viroses.
AGRADECIMENTOS
Agradecemos o apoio técnico prestado por Maria Silvia Sousa de Lucena, Jones Anderson Monteiro Siqueira, Ian Carlos Lima, Dielle Monteiro Teixeira e Jefferson Oliveira, bem como a toda equipe de campo e aos médicos que trabalharam durante o projeto "Vigilância Intensiva das Diarréias em Hospitais". Este trabalho teve o apoio financeiro do IEC/SVS/MS.
REFERÊNCIAS
1 Andreasi MS, Cardoso DD, Fernandes SM, Tozetti IA, Borges AM, Fiaccadori FS, et al. Adenovirus, calicivirus and astrovirus detection in fecal samples of hospitalized children with acute gastroenteritis from Campo Grande, MS, Brazil. Mem Inst Oswaldo Cruz. 2008 Nov;103(7):741-4. DOI:10.1590/S0074-02762008000700020 [ Links ]
2 Atmar RL, Estes MK. Diagnosis of noncultivatable gastroenteritis viruses, the human caliciviruses. Clin Microbiol Rev. 2001 Jan;14(1):15-37. DOI: 10.1128/CMR.14.1.15–37.2001 [ Links ]
3 Boom R, Sol CJ, Salimans MM, Jansen CL, Wertheim-van Dillen PM, Noordaa J. Rapid and simple method for purification of nucleic acids. J Clin Microbiol. 1990 Mar;28(3):495-503. [ Links ]
4 Borges AM, Teixeira JM, Costa PS, Giugliano LG, Fiaccadori FS, Franco RC, et al. Detection of calicivirus from fecal samples from children with acute gastroenteritis in the West Central region of Brazil. Mem Inst Oswaldo Cruz. 2006 Nov;101(7):721-4. DOI:10.1590/S0074-02762006000700003 [ Links ]
5 Bull RA, Tu ET, McIver CJ, Rawlinson WD, White PA. Emergence of a new norovirus genotype II. 4 variant associated with global outbreaks of gastroenteritis. J Clin Microbiol. 2006 Feb;44(2):327-33. DOI: 10.1128/JCM.44.2.327-333.2006 [ Links ]
6 Cardoso DDP, Fiaccadori FS, Souza MBLD, Martins RM, Leite JPG. Detection and genotyping of astroviruses from children with acute gastroenteritis from Goiania, Goiás, Brazil. Med Sci Monit. 2002 Sep;8(9):CR624-8. [ Links ]
7 Castilho JG, Munford V, Resque HR, Fagundes-Neto U, Vinjé J, Rácz ML. Genetic diversity of norovirus among children with gastroenteritis in São Paulo State, Brazil. J Clin Microbiol. 2006 Nov;44(11):3947-53. DOI:10.1128/JCM.00279-06 [ Links ]
8 Dey SK, Phan TG, Nguyen TA, Nishio O, Salim AF, Yagyu F, et al. Prevalence of sapovirus infection among infants and children with acute gastroenteritis in Dhaka City, Bangladesh during 2004-2005. J Med Virol. 2007 May;79(5):633-8. [ Links ]
9 Dove W, Cunliffe NA, Gondwe JS, Broadhead RL, Molyneux ME, Nakagomi O, et al. Detection and characterization of human caliciviruses in hospitalized children with acute gastroenteritis in Blantyre, Malawi. J Med Virol. 2005 Dec;77(4):522-7. [ Links ]
10 Espul A, Martinez N, Noel JS, Cuello H, Abrile C, Grucci S, et al. Prevalence and characterization of astroviruses in Argentinean children with acute gastroenteritis. J Med Virol. 2004 Jan;72(1):75-82. [ Links ]
11 Fankhauser RL, Monroe SS, Noel JS, Humphrey CD, Bresee JS, Parashar UD, et al. Epidemiological and molecular trends of "Norwalk-like viruses" associated with outbreaks of gastroenteritis in the United States. J Infect Dis. 2002 Jul;186(1):1-7. [ Links ]
12 Farkas T, Deng X, Ruiz-Palacios G, Morrow A, Jiang X. Development of an enzyme immunoassay for detection of sapovirus-specific antibodies and its application in a study of seroprevalence in children. J Clin Microbiol. 2006 Oct;44(10):3674-9. DOI:10.1128/JCM.01087-06 [ Links ]
13 Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA. Family Astroviridae. In: Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA, editors. Virus taxonomy: eighth report of the International Committee on the taxonomy of viruses. San Diego: Elsevier Academic Press; 2005. p. 859-64.
14 Felsenstein J. PHYLIP, Version 3.57c. Seatle, WA: Department of Genetics, University of Washington; 1995.
15 Gabbay YB, Leite JP, Oliveira DS, Nakamura LS, Nunes MR, Mascarenhas JD, et al. Molecular epidemiology of astrovirus type 1 in Belém, Brazil, as an agent of infantile gastroenteritis, over a period of 18 years (1982-2000): identification of two possible new lineages. Virus Res. 2007 Nov;129(2):166-74. [ Links ]
16 Gabbay YB, Linhares AC, Cavalcante-Pepino EL, Nakamura LS, Oliveira DS, Silva LD, et al. Prevalence of human astrovirus genotypes associated with acute gastroenteritis among children in Belém, Brazil. J Med Virol. 2007 May;79(5):530-8. [ Links ]
17 Gabbay YB, Linhares AC, Oliveira DS, Nakamura LS, Mascarenhas JD, Gusmão RH, et al. First detection of a human astrovirus type 8 in a child with diarrhea in Belém, Brazil: comparison with other strains worldwide and identification of possible three lineages. Mem Inst Oswaldo Cruz. 2007 Jun;102(4):531-4. DOI:10.1590/S0074-02762007005000032 [ Links ]
18 Gabbay YB, Luz CR, Costa IV, Cavalcante-Pepino EL, Sousa MS, Oliveira KK, et al. Prevalence and genetic diversity of astroviruses in children with and without diarrhea in São Luís, Maranhão, Brazil. Mem Inst Oswaldo Cruz. 2005 Nov;100(7):709-14. DOI: 10.1590/S0074-02762005000700004 [ Links ]
19 Giordano MO, Martinez LC, Isa MB, Paez Rearte M, Nates SV. Childhood astrovírus-associated diarrhea in the ambulatory setting in a public hospital in Cordoba City, Argentina. Rev Inst Med Trop Sao Paulo. 2004 Mar-Apr;46(2):93-6. DOI: 10.1590/S0036-46652004000200007 [ Links ]
20 Hansman GS, Katayama K, Maneekarn N, Peerakome S, Khamrin P, Tonusin S, et al. Genetic diversity of norovirus and sapovirus in hospitalized infants with sporadic cases of acute gastroenteritis in Chiang Mai, Thailand. J Clin Microbiol. 2004 Mar;42(3):1305-7. DOI: 10.1128/JCM.42.3.1305-1307.2004 [ Links ]
21 Hansman GS, Takeda N, Katayama K, Tu ET, Mclver CJ, Rawlinson WD, et al. Genetic diversity of sapovirus in children, Australia. Emerg Infect Dis. 2006 Jan;12(1):141-3. [ Links ]
22 Huh JW, Kim HW, Moon SG, Lee JB, Lim YH. Viral etiology and incidence associeted with acute gastroenteritis in a 5-year survey in Gyeonggi province, South Korea. J Clin Virol. 2009 Feb;44(2):152-6. [ Links ]
23 Jiang X, Huang PW, Zhong WM, Farkas T, Cubitt DW, Matson DO. Design and evaluation of a primer pair that detects both Norwalk- and Sapporo-like caliciviruses by RT-PCR. J Virol Methods. 1999 Dec;83(1-2):145-54. [ Links ]
24 Kittigul L, Pombubpa K, Taweekate Y, Yeephoo T, Khamrin P, Ushijima H. Molecular characterization of rotaviruses, noroviruses, sapovirus, and adenoviruses in patients with acute gastroenteritis in Thailand. J Med Virol. 2009 Feb;81(2):345-53. [ Links ]
25 Klein EJ, Boster DR, Stapp JR, Wells JG, Qin X, Clausen CR, et al. Diarrhea etiology in a Children's Hospital Emergency Department: a prospective cohort study. Clin Infect Dis. 2006 Oct;43(7):807-13. DOI: 10.1086/507335 [ Links ]
26 Koh H, Baek SY, Shin JI, Chung KS, Je YM. Coinfection of viral agents in Korean children with acute watery diarrhea. J Korean Med Sci. 2008 Dec;23(6):937-40.
27 Méndez E, Arias CF. Astroviruses. In: Knipe DM, Howley PM, editors. Fields virology. 5th ed. Philadelphia: Lippincott Williams and Wilkins; 2007. p. 981-1000.
28 Morillo SG, Cilli A, Carmona RC, Timenetsky MC. Identification and molecular characterization of norovirus in São Paulo State, Brazil. Braz J Microbiol. 2008 Dec;39(4):619-22. DOI:10.1590/S1517-83822008000400004 [ Links ]
29 Nakamura LS, Oliveira DS, Silva PF, Lucena MS, Mascarenhas JD, Gusmão RH, et al. Molecular characterization of calicivirus in feces of children with acute diarrhea, attending a public hospital, in Belém, Pará. In: XVII National Meeting of Virology; 2006 19-22; Campos do Jordão: Sociedade Brasileira de Virologia; 2006. p. 95. (Virus Reviews & Research; vol. 11; supl. 1).
30 Noel JS, Lee TW, Kurtz JB, Glass RI, Monroe SS. Typing of human astroviruses from clinical isolates by enzyme immunoassay and nucleotide sequencing. J Clin Microbiol. 1995 Apr;33(4):797-801. [ Links ]
31 Okada M, Ogawa T, Yoshizumi H, Kubonoya H, Shinozaki K. Genetic variation of the norovirus GII-4 genotype associated with a large number of outbreaks in Chiba prefecture, Japan. Arch Virol. 2007;152(12):2249-52. DOI: 10.1007/s00705-007-1028-8 [ Links ]
32 Parashar UD, Gibson CJ, Breese JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis. 2006 Feb;12(2):304-6. [ Links ]
33 Patel MM, Widdowson MA, Glass RI, Akazawa K, Vinjé J, Parashar UD. Systematic literature review of role of noroviruses in sporadic gastroenteritis. Emerg Infect Dis. 2008 Aug;14(8):1224-31. DOI: 10.3201/eid1408.071114 [ Links ]
34 Phan TG, Khamrin P, Quang TD, Dey SK, Takanashi S, Okitsu S, et al. Emergence of intragenotype recombinant sapovirus in Japan. Infect Genet Evol. 2007 Jul;7(4):42-6. DOI: 10.1016/j.meegid.2007.02.004 [ Links ]
35 Rachakonda G, Choudekar A, Parveen S, Bhatnagar S, Patwari A, Broor S. Genetic diversity of noroviruses and sapoviruses in children with acute sporadic gastroenteritis in New Delhi, India. J Clin Virol. 2008 Sep;43(1):42-8. DOI:10.1016/j.jcv.2008.05.006 [ Links ]
36 Resque HR, Munford V, Castilho JG, Schmich H, Caruzo TA, Rácz ML. Molecular characterization of astrovirus in stool samples from children in São Paulo, Brazil. Mem Inst Oswaldo Cruz. 2007 Dec;102(8):969-74. DOI: 10.1590/S0074-02762007000800012 [ Links ]
37 Ribeiro LR, Giuberti RS, Barreira DM, Saick KW, Leite JP, Miagostovich MP, et al. Hospitalization due to norovirus and genotypes of rotavirus inpediatric patients, state of Espírito Santo. Mem Inst Oswaldo Cruz. 2008 Mar;103(2):201-6. DOI: 10.1590/S0074-02762008000200013 [ Links ]
38 Silva PA, Cardoso DD, Schreier E. Molecular characterization of human astroviruses isolated in Brazil, including the complete sequences of astrovirus genotypes 4 and 5. Arch Virol. 2006 Jul;151(7):1405-17. DOI 10.1007/s00705-005-0704-9 [ Links ]
39 Silva PA, Santos RA, Costa PS, Teixeira JM, Giugliano LG, Andreasi MS, et al. The circulation of human astrovirus genotypes in the Central West Region of Brazil. Mem Inst Oswaldo Cruz. 2009 Jul;104(4):655-8. DOI: 10.1590/S0074-02762009000400021 [ Links ]
40 Siqueira JM, Aragão GC, Nascimento IS, Oliveira DS, Santos MC, Lima IC, et al. Estudos da prevalência de calicivírus humanos em crianças com gastroenterite atendidas em um posto de saúde de Belém-Pará no período de 1998-1999. In: Anais do II Congresso Norte Nordeste de Infectologia; 2008 nov. 28-30; Belém: Sociedade Brasileira de Infectologia; 2008.
41 Soares CC, Santos N, Beard RS, Albuquerque MC, Maranhão AG, Rocha LN, et al. Norovirus Detection and genotyping for children with gastroenteritis, Brazil. Emerg Infect Dis. 2007 Aug;13(8):1244-6. [ Links ]
42 Tamura K, Dudley J, Nei M, Kumar S. MEGA4: Molecular Evoutinary Genetics Analysis (MEGA) software version 4.0. Mol Biol Evol. 2007 Aug;24(8):1596-9. DOI:10.1093/molbev/msm092 [ Links ]
43 Tu ET, Bull RA, Greening GE, Hewitt J, Lyon MJ, Marshall JA, et al. Epidemics of gastroenteritis during 2006 Were Associated with the Spread of Norovirus GII.4 Variants 2006a and 2006b. Clin Infect Dis. 2008 Feb;46(3):413-20. DOI: 10.1086/525259 [ Links ]
44 Victoria M, Carvalho-Costa FA, Heinemann MB, Leite JP, Miagostovich M. Prevalence and molecular epidemiology of noroviruses in hospitalized children with acute gastroenteritis in Rio de Janeiro, Brazil, 2004. Pediatr Infect Dis J. 2007 Jul;26(7):602-6. [ Links ]
45 Victoria M, Carvalho-Costa FA, Heinemann MB, Leite JP, Miagostovich MP. Genotypes and molecular epidemiology of human astroviruses in hospitalized children with acute gastroenteritis in Rio de Janeiro, Brazil. J Med Virol. 2007 Jul;79(7):939-44. [ Links ]
46 Walter JE, Mitchell DK, Guerrero ML, Berke T, Matson DO, Monroe SS, et al. Molecular epidemiology of human astrovirus diarrhea among children from a Periurban community of Mexico City. J Infect Dis. 2001 Mar;183(5):681-6. [ Links ]
47 Wilhelmi I, Roman E, Sánchez-Fauquier A. Viruses causing gastroenteritis. Clin Microbiol Infect. 2003 Apr;9(4):247-62. [ Links ]
48 Xavier MP, Oliveira SA, Ferreira MS, Victoria M, Miranda V, Silva MF, et al. Detection of caliciviruses associated with acute infantile gastroenteritis in Salvador, an urban center in Northeast Brazil. Braz J Med Biol Res. 2009 May;42(5):438-44. DOI: 10.1590/S0100-879X2009000500007 [ Links ]
 Corresponding
/ Correspondência / Correspondencia:
Corresponding
/ Correspondência / Correspondencia:
Yvone Benchimol Gabbay
Instituto Evandro Chagas, Seção de Virologia
Rodovia BR316, km 7, s/nº, Levilândia
CEP: 67.030-000 Ananindeua, Pará, Brasi
E-mail:yvonegabbay@iec.pa.gov.br
Recebido em / Received / Recibido en: 31/7/2009
Aceito em / Accepted / Aceito en: 19/10/2009










 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI