Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100022
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Ocorrência de uma floração de cianobactérias tóxicas na margem direita do Rio Tapajós, no Município de Santarém (Pará, Brasil)
Occurrence of toxic cyanobacterial bloom in the left margin of the Tapajós river, in the Municipality of Santarém (Pará State, Brazil)
Floración de cianobacterias tóxicas en la orilla derecha del río Tapajós, en el Municipio de Santarém (Pará, Brasil)
Lena Líllian Canto de SáI; José Maria dos Santos VieiraII; Rosivaldo de Alcântara MendesIII; Samara Cristina Campelo PinheiroI; Elivam Rodrigues ValeI; Francisco Arimatéia dos Santos AlvesI; Iracina Maura de JesusIV; Elisabeth Conceição de Oliveira SantosV; Vanessa Bandeira da CostaI
ILaboratório de Microbiologia Ambiental, Seção de Meio Ambiente, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIFaculdade de Farmácia, Instituto de Ciências da Saúde, Universidade Federal do Pará, Belém, Pará, Brasil
IIILaboratório de Toxicologia, Seção de Meio Ambiente, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IVSeção de Meio Ambiente, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
VDiretoria, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
A presença de florações de cianobactérias e seus subprodutos interfere diretamente na qualidade da água, podendo introduzir efeitos negativos, tanto de ordem estética, como de saúde pública, devido à produção de compostos potencialmente tóxicos e carcinogênicos. O tipo mais comum de intoxicação envolvendo cianobactérias é ocasionado por microcistina-LR (hepatotoxina), a qual pode causar severos danos ao fígado. Assim, o objetivo deste estudo foi identificar os gêneros causadores de uma floração de cianobactérias no rio Tapajós (Santarém, Pará, Brasil) no mês de março de 2007, bem como realizar bioensaios de toxicidade aguda, utilizando camundongos Swiss-webster. As amostragens foram realizadas em cinco pontos de coleta distribuídos na margem direita do Rio Tapajós, onde foram realizados arrastos horizontais, com o auxílio de uma rede para plâncton de 20 μm; e foram também coletadas amostras de água bruta (5.000 mL) em garrafas de polipropileno do tipo âmbar. Para a identificação dos organismos utilizou-se microscopia ótica. A determinação de microcistinas-LR foi realizada por meio das técnicas de Ensaio Imunoadsorvente Enzima-Associado e Cromatografia Líquida de Alta Pressão. As análises demonstraram que na altura dos pontos P01 e P02 ocorreu um desequilíbrio ecológico na comunidade fitoplanctônica, caracterizado pela proliferação intensa dos gêneros Anabaena e Microcystis. Nas amostras de água bruta, as concentrações de microcistina-LR registradas estão abaixo dos valores máximos permitidos na legislação brasileira para água de consumo; entretanto, é importante ressaltar que a floração, visualizada in loco, ocupava cerca de 10 cm da superfície da coluna d'água, e que, portanto, continha células de cianobactérias suficientes para provocar irritações cutâneas em pessoas que usassem o rio como balneário nesse período.
Palavras-chave: Cianobactérias; Microcistinas; Qualidade da Água.
ABSTRACT
The presence of cyanobacterial blooms and their subproducts interferes directly in water quality and may cause negative effects, both aesthetically and to public health, due to the production of potentially toxic and carcinogenic compounds. The most common type of intoxication involving cyanobacteria is caused by microcystin-LR (hepatotoxin), which can cause severe damage to the liver. The objective of this study was to identify the genera that caused cyanobacterial blooms in the Tapajós River (Santarém, Pará, Brazil) in March 2007, as well as to execute acute toxicity bioassays in Swiss-webster mice. Sample collection was performed at five sampling points throughout the left margin of the Tapajós River, by horizontal dragging with the aid of a 20 μm plankton net. Samples of raw water (5,000 ml) were also collected in amber propylene bottles. Optical microscopy was applied to identify the organisms, and the determination of microcystin-LR was executed through ELISA and HPLC. The analyses showed that, at P01 and P02, there was an ecological imbalance in the phytoplanktonic community, characterized by an intense proliferation of the genera Anabaena and Microcystis. The concentrations of microcystin-LR reported in the raw water samples were below the maximum values permitted by Brazil's legislation for drinking water. However, it is important to note that the blooming observed in locu occupied around 10 cm of the water column surface and therefore presented cyanobacterial cells enough to cause rashes in people who swam or bathed in the rivers during this period.
Keywords: Cyanobacteria; Microcystins; Water Quality.
RESUMEN
La presencia de floraciones de cianobacterias y de sus subproductos afecta directamente a la calidad del agua, pudiendo producir impactos negativos tanto estéticos como de salud pública, debido a la producción de compuestos potencialmente tóxicos y cancerígenos. El tipo más común de intoxicación involucrando cianobacterias se debe a la microcistina LR (hepatotoxinas), que puede causar graves daños al hígado. El objetivo de este estudio fue identificar el género causante de la floración de cianobacterias en el río Tapajós (Santarém, estado de Pará, Brasil) en marzo de 2007, así como realizar bioensayos de toxicidad aguda utilizando ratones Swiss-Webster. Las muestras se tomaron en cinco puntos de muestreo, distribuidos en la margen derecha del río Tapajós, donde fueron realizados arrastres horizontales, con la ayuda de una red de plancton de 20 μm y fueron recogidas también muestras de agua cruda (5.000 ml) en botellas de polipropileno color ámbar. Para la identificación de los organismos se utilizó la microscopía óptica, y la determinación de microcistina LR se realizó por medio de las técnicas de ELISA y HPLC. El análisis puso de manifiesto que a la altura de los puntos P01 y P02 ocurrió un desequilibrio ecológico en la comunidad de fitoplancton caracterizado por la proliferación de los géneros Anabaena y Microcystis. En las muestras de agua cruda, las concentraciones de microcistina LR registradas, están por debajo del valor máximo permitido en la legislación brasileña para el agua potable, aunque es importante destacar que la floración vista in situ ocupaba cerca de 10 cm de la superficie de la columna de agua y que, por lo tanto, contenía suficientes células de cianobacterias para ocasionar erupciones cutáneas en las personas que pudieran utilizar los bañarse en los ríos en ese período.
Palabras clave: Cianobacterias; Microcistinas; Calidad del Agua.
INTRODUÇÃO
As cianobactérias são organismos procarióticos capazes de fixar carbono através da fotossíntese, fazendo parte da comunidade fitoplanctônica e contribuindo, deste modo, com grande parte da produtividade primária e do fluxo de energia em ecossistemas aquáticos17. Estes microorganismos habitam uma grande variedade de ambientes (dulcícolas, salobros, marinhos e terrestres)24 e estão presentes em todos os biótopos aquáticos (interface água/ar, coluna d’água e sedimento)14.
A presença das cianobactérias em um corpo d’água está associada a um conjunto de fatores ambientais (concentração de N e P, temperaturas elevadas e disponibilidade de luz), que, ao sofrerem alterações, podem levar ao aparecimento de florações, fenômeno caracterizado pelo intenso crescimento desses microorganismos na água10.
A ocorrência das florações vem sendo frequentemente atribuída ao acelerado processo de eutrofização dos ambientes aquáticos, produzido principalmente pela atividade humana (esgoto doméstico e agro-industrial). A presença de florações de cianobactérias e seus subprodutos em rios, lagos e reservatórios destinados ao abastecimento, interfere diretamente na qualidade da água, podendo introduzir efeitos negativos tanto de ordens estética e organoléptica, pela produção de cor, odor e sabor, como de saúde pública, devido à produção de compostos potencialmente tóxicos e carcinogênicos7.
Há diversos registros de morte por envenenamento de gado bovino, cavalos, porcos, ovelhas, cães, peixes e invertebrados, pela ingestão ou contato com essas florações tóxicas16. Outro exemplo observado da ação dessas toxinas foi a morte de 60 pacientes de hemodiálise em Caruaru, Pernambuco, devido à presença de hepatotoxinas na água utilizada34.
Segundo Falconer16, as toxinas produzidas por cianobactérias são divididas em neurotoxinas; dermatotoxinas; e hepatotoxinas, segundo seus efeitos tóxicos em mamíferos. As espécies já identificadas como produtoras de hepatotoxinas estão incluídas nos gêneros Microcystis, Anabaena, Nodularia, Oscillatoria, Nostoc e Cylindrospermopsis10. A espécie Microcystis aeruginosa é considerada de distribuição mais ampla no território nacional, e Anabaena, o gênero com maior número de espécies potencialmente tóxicas, conforme Carmichael25. O tipo mais comum de intoxicação envolvendo cianobactérias é ocasionado por hepatotoxinas11, destacando-se as microcistinas (-LR, -LL e -YA), as quais podem causar severos danos ao fígado23.
Levando em consideração a relevância dos fatos acima citados e a necessidade de maior conhecimento dos problemas relacionados às florações de cianobactérias e da qualidade da água em geral, este estudo teve por objetivo identificar os gêneros causadores de uma floração de cianobactérias na margem direita do rio Tapajós (Santarém, Pará, Brasil), verificar a produção de microcistinas por essa floração, assim como determinar a toxicidade dessas cianobactérias, através de testes de toxicidade com camundongos.
MATERIAIS E MÉTODOS
DESCRIÇÃO DA ÁREA DE ESTUDO E AMOSTRAGEM
As coletas foram realizadas no dia 21 de março de 2007, na margem direita do rio Tapajós, em Santarém, Pará, Brasil em cinco pontos ao longo do rio. Os pontos de coleta foram: P01 - praia Arariá (54o44'10,28'' S; 2o24'33,20'' W); P02 - praia Carapanari (50o44'29,66'' S; 2o24'55,01'' W); P03 - enseada da Ponta de Pedra (54o53'43,71'' S; 2o26'04,78'' W); P04 - em frente à entrada do furo do Sururu, nessa época sob influência do rio Amazonas (54o51'02,36'' S, 2o17'06,24 W); e P05 - leito do rio, área sob influência do rio Arapiuns (54o58'44,59'' S, 2o20'20,29'' W) (Figura 1).
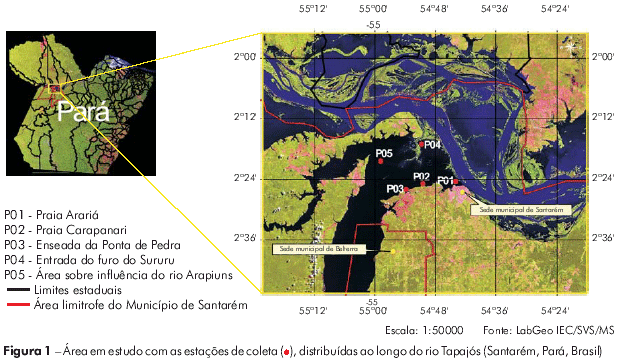
METODOLOGIA
Coleta das amostras
As amostras destinadas ao estudo qualitativo das cianobactérias foram obtidas através de arrastos horizontais, na superfície da água, com o auxílio de uma rede para plâncton de 20 μm de abertura de malha, através da qual foram filtrados aproximadamente 2.000 L de água. Uma alíquota de 100 mL foi fixada em formol a 4% e uma alíquota de 250 mL foi mantida resfriada. Foram também realizadas coletas de água bruta superficial com o auxílio de uma garrafa de polipropileno do tipo âmbar, de 5.000 mL. Estas amostras foram armazenadas em isopor com gelo reciclável até o momento das análises.
Identificação das espécies
No laboratório, as amostras foram analisadas através da montagem de lâminas temporárias observadas sob um microscópio binocular. A identificação e nomenclatura das espécies foram realizadas de acordo com a literatura especializada2,3,18,15.
Determinação de microcistinas na água pela técnica de ELISA
No laboratório, uma alíquota de 100 mL de água bruta foi filtrada em membranas Millipore AP-20, após ter passado por um sonicador com o objetivo de promover a lise das células e liberação das toxinas na água. Uma alíquota de 20 μL do filtrado foi submetida à análise através do método descrito por An e Carmichael1 utilizando o kit da empresa Envirologix Inc. Ep 022, de acordo com as recomendações do fabricante, o qual detecta microcistina-LR por meio de anticorpos policlonais. Todas as análises foram realizadas em duplicatas, tendo sido considerada a média dos resultados como a concentração da amostra.
Determinação de microcistinas na água por HPLC
A determinação de microcistinas em amostras de água foi realizada a partir da extração de 2 L de amostras de água por SPE (extração em fase sólida) com posterior análise por Cromatografia Líquida de Alta Precisão (HPLC). A extração por SPE foi realizada a partir da metodologia proposta por TSUJI e colaboradores28 e consistiu em: ativação de um cartucho C18-ODS com 20 mL de metanol e 20 mL de água deionizada; adição, em vácuo, de 2 L de amostras de água no cartucho C18-ODS ativado; adição de 20 mL de água deionizada para a limpeza (clean-up) do cartucho C-18 ODS ativado; adição de 20 mL de metanol no cartucho C18-ODS ativado para a eluição da toxina; secagem total, em evaporador rotativo, da fração metanólica que contém a toxina; ressuspensão, com 1 mL de metanol; e filtragem da solução em um filtro de náilon de 0,45 μm. Para a análise cromatográfica das amostras foi utilizado um HPLC (Varian) nas seguintes condições: coluna fase reversa C-18, ODS, 5 μm, 250 mm x 4 mm (Varian); fase móvel acetonitrila: acetato de amônio 20 mM, pH 5.0 (28:72 v/v), fluxo - 1,0 mL/min; detecção arranjo de fotodiodo (PDA) a 238 nm; volume de injeção 20 μL; tempo de análise 30 min; e padrão Microcistina-LR proveniente de M. aeruginosa (Sigma M-2912).
Determinação de microcistinas nas células liofilizadas por HPLC
Após o processo de liofilização de 250 mL da amostra coletada por meio de arrastos horizontais com rede para plâncton (20 μm), a amostra foi extraída com butanol: metanol: água bideionizada (1:4:15, v/v) em uma proporção de 20 mL para cada 100 mg de material liofilizado, seguindo-se a metodologia de Krishnamurthy e colaboradores 19, modificada por Domingos e colaboradores13. O material obtido foi agitado por 1 h e as células fragmentadas foram removidas por centrifugação a 3.000 g por 10 min, repetindo-se esse procedimento por duas vezes, para garantir a extração total das microcistinas. Os sobrenadantes das extrações foram combinados, evaporados a 400o C para 30% do volume inicial, e passados por um cartucho de octadesilsilano (C18) (Bond-Elut Varian). Em seguida, foram lavados com uma sequência de 20 mL de água bideionizada e 20 mL de metanol a 100%, para eluição das toxinas. A fração eluída com metanol foi coletada, evaporada até secar e diluída em 1 mL de metanol a 50%. Em seguida, a solução foi filtrada em um filtro de náilon de 0,45 μm e as toxinas identificadas por HPLC, nas mesmas condições cromatográficas utilizadas para a análise das amostras de água.
Bioensaios de toxicidade aguda com camundongos
O material liofilizado foi dissolvido em solução salina esterilizada e sonicado por cinco ciclos de 30 s a 100 W para liberação das toxinas22. A toxicidade foi determinada por injeção intraperitoneal do extrato das células liofilizadas diluído em solução salina, com concentrações de 1.200, 1000 e 100 mg/Kg em camundongos Swiss- Webster, machos, pesando entre 20-25 g, para obtenção da dose letal (DL50), utilizando-se cinco camundongos para cada dose. A solução foi aplicada em volume de 0,1 mL para cada 10 g de peso do camundongo, para alcançar a concentração esperada. Os sinais de intoxicações, tempo de sobrevivência e o exame, pos-mortem, do fígado, foram considerados para a confirmação de toxicidade aguda e determinação da DL505,6,26,20. Para cada concentração testada, dois animais controles foram inoculados com solução salina usada na diluição do extrato.
RESULTADOS
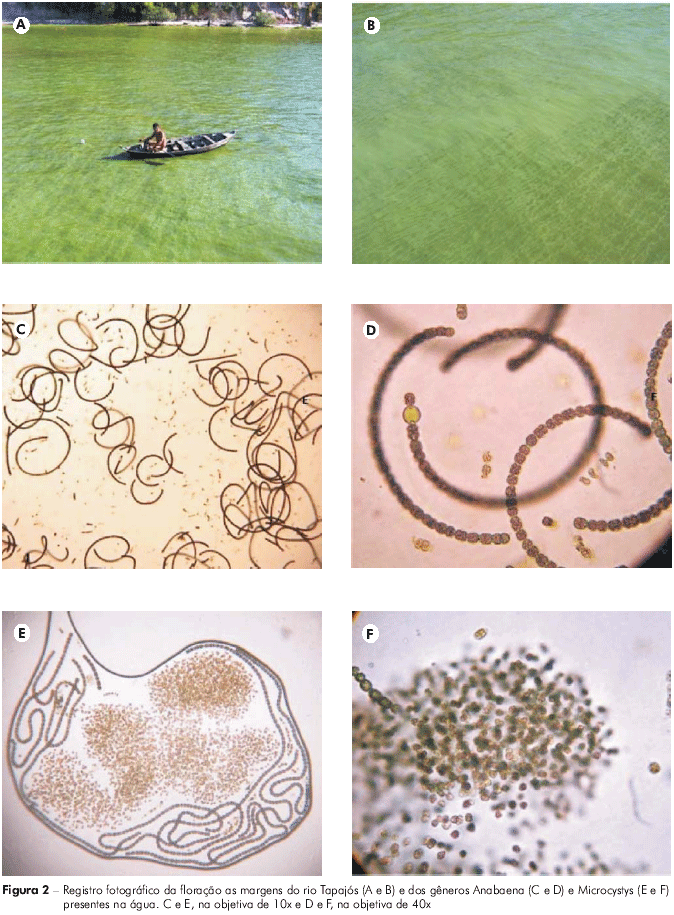
No momento da coleta das amostras observou-se que na altura dos pontos P01 e P02 ocorria um evidente desequilíbrio ecológico na comunidade fitoplanctônica, caracterizado pela visualização da floração (Figuras 2A e B). A análise das amostras coletadas nesses mesmos pontos confirmou a presença do gênero Anabaena (Figuras 2C e D), constituído por espécies com tricomas espiralados, apresentando distribuição mundial e destacando-se em diferentes corpos d'água, especialmente de ambientes eutróficos; e Microcystis (Figuras 2E e F) microorganismos com uma densa mucilagem e que são reconhecidos por frequentemente formarem florações superficiais.
A tabela 1 apresenta os resultados das análises realizadas por meio de microscopia direta e a quantificação da microcistina através dos métodos de ELISA e HPLC em amostras de água concentrada (liofilizada) e bruta.

A detecção de microcistinas realizada pela técnica de ELISA foi negativa para todos os pontos, nas amostragens de água bruta. Já nas amostras concentradas (liofilizadas), demonstrou-se positiva apenas nos pontos P01 e P02 em concentrações acima de 3 ppb. Já a análise de microcistina-LR por HPLC registrou concentrações de cianotoxinas nestes mesmos pontos, tanto em amostras de água bruta (P01=3,25 μg.L-1 e P02=12,39 μg.L-1) quanto nas concentradas e liofilizadas (P01=0,23 μg.L-1 e P02=0,55 μg.L-1) (Tabela 1).
Os testes de toxicidade com camundongos demonstraram que, apesar dos animais apresentarem dificuldade de locomoção e sinais de contrações abdominais minutos após a aplicação, não ocorreram mortes durante e após os sete dias de observação, em nenhuma das concentrações testadas, demonstrando assim que a floração observada não apresenta concentração de toxinas suficiente para desenvolver uma toxicidade aguda que se reflita em danos imediatos à saúde humana.
DISCUSSÃO
No Brasil, até meados da década de 90, a relação da degradação dos mananciais com a saúde pública se restringia à contaminação da água por agentes causadores das doenças de veiculação hídrica, principalmente várias espécies de bactérias, protozoários, vermes e alguns vírus. Apenas no ano de 1996, após o trágico caso que culminou com a morte de cerca de 60 pacientes renais crônicos submetidos à hemodiálise em uma clínica na cidade de Caruaru, Pernambuco, constatou-se que havia um outro fator muito importante e, muitas vezes, desconsiderado pelas autoridades competentes e pela própria população, que poderia ser responsável pela morte do homem via ingestão de água: as toxinas produzidas biologicamente, que poderiam estar presentes na água servida à população25. Após esse episódio, as florações de cianobactérias tóxicas foram reconhecidas como um problema de saúde pública e foram estabelecidos limites máximos permitidos para estas toxinas em água de abastecimento 21 e de usos múltiplos12.
Os efeitos tóxicos das cianotoxinas têm recebido uma atenção crescente de pesquisadores de todo o mundo. As microcistinas de ação hepatocarcinogênica em camundongos são as cianotoxinas mais frequentemente encontradas nos corpos hídricos do mundo todo4. No Brasil, já foi observada a ocorrência de cianobactérias tóxicas em reservatórios de águas destinadas ao consumo humano em vários estados5. No Pará, temos acompanhado eventos significativos de florações de cianobactérias tóxicas desde 1999, comprovando que este fato é preocupante. Em 1999, durante um estudo de monitoramento de cianobactérias na represa do Utinga, que abastece a Cidade de Belém, Pará, foi constatada a presença de cepas tóxicas de Radiocystis fernandoi e Microcystis viridis, e presença de microcistinas na água bruta da represa31,29,32,30. Durante uma floração de Cylindrospermopsis raciborskii nos rios Iriri e Xingu (Altamira, Pará) houve uma grande mortandade de peixes, com a presença de saxitoxinas nas águas33.
No presente estudo, as concentrações de microcistina-LR encontradas nas amostras de água bruta no rio Tapajós estão abaixo dos valores máximos permitidos na Legislação Brasileira para água de consumo21 o que descarta, neste momento, a possibilidade de intoxicações agudas em humanos. Porém, é importante destacar o efeito cumulativo desses heptapeptídeos no organismo, o que pode acarretar problemas futuros de saúde.
Todos os gêneros de cianobactérias são portadores, em sua parede celular, de dermatotoxinas (LPS), que são toxinas irritantes ao contato com a pele27, e que podem também causar irritação nos olhos, conjuntivite, urticária, obstrução nasal e asma8.
Têm sido relatados casos de dermatite de contato em humanos, associados ao uso de águas de recreação9. Deste modo, não se pode desconsiderar a possibilidade de eventuais irritações cutâneas, em pessoas (principalmente crianças, imunodeprimidos e idosos) que frequentem os balneários de Arariá e Carapanari, que estão entre os mais visitados do Município de Santarém, Pará.
A confirmação de que a floração observada na margem direita do rio Tapajós foi constituída por dois gêneros de cianobactérias (Anabaena e Microcystis) potencialmente produtores de cianotoxinas, chama atenção para a necessidade de monitoramento ambiental nessa região, a fim de determinar as causas e/ou origens dessas ocorrências.
CONCLUSÃO
Considerando sua importância para a saúde pública; a contribuição deste tipo de estudo para o conhecimento da biodiversidade local e da elucidação dos processos naturais e antrópicos que possam estar relacionados a esses eventos, que vêm ocorrendo ano após ano no rio Tapajós; faz-se necessário o monitoramento das cianobactérias em suas águas, uma vez que, no período estudado, foram encontradas florações de dois gêneros de cianobactéria (Anabaena e Microcystis) produtores de toxinas, além da detecção de microcistina-LR na água bruta. Ao longo dos anos, estas florações podem tornar-se cada vez mais abundantes e acarretarem riscos à saúde da população ribeirinha local, que utiliza essa água para consumo, pesca e recreação.
AGRADECIMENTOS
Os autores são gratos a Raimundo Pio Girard pelo auxílio na coleta do material e à Marinha do Brasil (posto Santarém) pelo auxílio no trabalho de campo.
REFERÊNCIAS
1 An J, Carmichael WW. Use of a colorimetric protein phosphatase inhibition assay and enzyme linked immunosorbent assay for the study of microcystins and nodularins. Toxicon. 1994 Dec;32(12):1495-507. [ Links ]
2 Anagnostidis K, Komárek J. Modern approach to the classification system of cyanophytes. 1 - Introduction. Arch Hydrobiol. 1985;38-39(Suppl 71):291-302.
3 Anagnostidis K, Komárek J. Modern approach to the classification system of cyanophytes. 3 - Oscillatoriales. Arch Hydrobiol. 1988;50-53(Suppl 80):327-472.
4 Azevedo SMFO, Carmichael WW, Jockimsen EM, Rinehart KL, Lau S, Shaw GR, et al. Human intoxication by microcystins during renal dialysis treatment in Caruaru-Brazil. Toxicology. 2002 Dec;181-182:441-6. DOI:10.1016/S0300-483X(02)00491-2 [ Links ]
5 Azevedo SMFO, Evans WR, Carmichael WW, Namikoshi M. First report of microcystins from a Brazilian isolate of the cyanobacterium Microcystis aeruginosa. J Appl Phycology. 1994;6:261-5. DOI: 10.1007/BF02181936 [ Links ]
6 Baker PD, Humpage AR. Toxicity associated with commonly ocurring cyanobacteria in surface waters of the Murray-Darling Basin, Australia. Aust J Mar Freshwater Res. 1994;45:773-86. DOI:10.1071/MF9940773 [ Links ]
7 Bernardo L. Algas e suas influências na qualidade das águas e nas tecnologias de tratamento. Rio de Janeiro: Associação Brasileira de Engenharia Sanitária e Ambiental; 1995. 127 p.
8 Calijuri MC, Alves MSA, Santos ACA. Cianobactérias e cianotoxinas em águas continentais. São Carlos: Rima; 2006. 118 p.
9 Carmichael WW. Freshwater blue-green algae (Cyanobacteria) toxins - A review. In: Carmichael WW, editor. The water environment Algal Toxins and Health. New York: Plenum Press; 1981. p. 1-13.
10 Carmichael WW. The toxins of cyanobacteria. Sci Am. 1994 Jan;270(1):78-86.
11 Chorus I, Bartram J. Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. New York: E & FN Spon; 1999. 416 p. [ Links ]
12 Conselho Nacional de Meio Ambiente (BR). Resolução no 357, de 17 de março de 2005. Diário Oficial da União; 17 mar. 2005. [ Links ]
13 Domingos P, Rubim TK, Molica RJR, Azevedo SMFO, Carmichael WW. First report of microcystin production by picoplanctonik cyanobacteria isolated froma northeast Brazilian drinking water supply. Environ Toxicol. 1999;14(1):31-5.
14 Esteves FA. Fundamentos de limnologia. 2. ed. Rio de Janeiro: Interciência; 1998. 602 p.
15 Ettl H, Gartner G, Heynig H, Mollenhauer D. Subwasserflora von mitteleuropa. In: Komárek J, Anagnostidis K, editors. Cyanoprokaryota. Berlin: Verlag; 1999. 548 p. Teil Chroococcales.
16 Falconer IR. An overview of problem caused by toxic blue-green algae (Cyanobacteria) in drinking and recreational water. Environ Toxicol. 1999;14:5-12. [ Links ]
17 Ferrão-Filho AS, Molica R, Azevedo SM. Ecologia, ecofisiologia e toxicologia de cianobactérias. Oecol Bras. 2009;13(2):225-8. [ Links ]
18 Komárek J, Anagnostidis K. Modern approach to the classification system of cyanophytes. 4 - Nostocales. Arch Hydrobiol. 1989;56(Suppl 83):291-302.
19 Krishnamurthy T, Carmichael WW, Sarvier EW. Toxic peptides freshwater cyanobacteria (blue-green algae). I. Isolation, purification and characterization of peptides from Microcystis aeruginosa and Anabaena flos-aquae. Toxicon. 1986;24(9):865-73. DOI: 10.1016/0041-0101(86)90087-5 [ Links ]
20 Magalhães VF, Soares RM, Azevedo SMFO. Microcystin contamination in fish from the Jacarepaguá Lagoon (Rio de Janeiro, Brazil): ecological implication and human health risk. Toxicon. 2001 Jul;39(7):1077-85. DOI: 10.1016/S0041-0101(00)00251-8 [ Links ]
21 Ministério da Saúde (BR). Portaria no 518, de 25 de março de 2004. Diário Oficial da União; 26 mar. 2004. [ Links ]
22 Negri AP, Jones GJ. Bioaccumulation of paralytic shellfish poisoning (PSP) toxins from the cyanobacterium Anabaena circinalis by the freshwater mussel Alathyria condola. Toxicon. 1995 May;33(5):667-78. [ Links ]
23 Nishiwaki-Matsushima R, Ohta T, Nishiwaki S, Suganuma M, Kohyama K, Ishikawa T, et al. Liver tumor promotion by the cyanobacterial cyclic peptide toxin microcystin-LR. J Cancer Res Clin Oncol. 1992;118(6):420-4. [ Links ]
24 Sant'Anna CL, Azevedo MTP, Agujaro LF, Carvalho LR, Souza RCR. Manual ilustrado para identificação e contagem de cianobactérias planctônicas de águas continentais brasileiras. Rio de Janeiro: Interciência; 2006. 58 p.
25 Sant'anna CL, Azevedo MTP. Contribution to the knowledge of potentially toxic cyanobacteria from Brazil. Nova Hedwigia. 2000;71:359-85.
26 Sedmack B, Kosi G. Microcystins in Slovene freshwaters (Central Europe) First report. Nat Toxins. 1997;5(2):64-73. [ Links ]
27 Sivonen K, Jones G. Cianobacterial toxins. In: Chorus I, Bartram J, editors. Toxin Cyanobacteria in water: A guide to their Public Health Consequences, Monitoring and Management. Londres: E & FN Spon; 1999. p. 42-111.
28 Tsuji K, Naito S, Kondo F, Watanabe M, Suzuki S, Nakazawa H, et al. A clean-up method for analysis of trace amounts of microcystins in lake water. Toxicon. 1994;32(10):1251-9. [ Links ]
29 Vieira JMS, Azevedo MTP, Azevedo SMO, Honda RY, Correa B. Microcystin production by Radiocystis fernandoi (Chroococcales, Cyanobacteria) isolated from a drinking water reservoir in the city of Belém, PA, Brazilian Amazonic region. Toxicon. 2003 Dec;42(7):709-13. [ Links ]
30 Vieira JMS, Azevedo MTP, Azevedo SMO, Honda RY, Corrêa B. Toxic cyanobacteria and microcystin concentrations in a public water supply reservoir in the Brazilian Amazonia region. Toxicon. 2005 Jun;45(7):901-9. [ Links ]
31 Vieira JMS, Azevedo MTP, Honda RY, Azevedo SMFO, Correa B. Produção de microcistinas por Radiocystis fernandoi (Cyanobacteria/Chroococcales) isolada da represa de abastecimento da cidade de Belém-PA [resumos]. In: 8o Congresso Brasileiro de Limnologia, 2001, João Pessoa, PB: Sociedade Brasileira de Limnologia; 2001. p. 217.
32 Vieira JMS, Sá LLC, Santos ECO, Lima MO, Bernardo RR, Azevedo SMFO. Ocorrência de Cylindrospermopsis raciberskii e saxitoxinas durante uma mortandade de peixes nos rios Iriri e Xingu, Altamira, Pará, Brasil [resumos]. In: 22o Congresso Brasileiro de Microbiologia, 2003, Florianópolis, SC: Sociedade Brasileira de Microbiologia; 2003.
33 Vieira JMS, Vieira ABR. Floração de Microcystis sp (Cianobacteria) em uma praia de rio da Região Amazônica do Brasil [resumos]. In: 22o Congresso Brasileiro de Microbiologia, 2003, Florianópolis, SC: Sociedade Brasileira de Microbiologia; 2003.
34 Yuan M, Carmichael WW, Hilborn ED. Microcystin analysis in human sera and liver from human fatalities in Caruaru, Brasil 1996. Toxicon. 2006 Nov;48(6):627-40. DOI: 1016/j.toxicom.2006.07.031 [ Links ]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Lena Líllian Canto Sá
Instituto Evandro Chagas,
Seção de Meio Ambiente
Rodovia BR 316, km 7, s/no,
Bairro: Levilândia
CEP:67030-000
Ananindeua-Pará-Brasil
E-mail:lenasa@iec.pa.gov.br
Recebido em / Received / Recibido en: 31/7/2009
Aceito em / Accepted / Aceito en: 25/9/2009











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI
