Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100022
Floración de cianobacterias tóxicas en la orilla derecha del río Tapajós, en el Municipio de Santarém (Pará, Brasil)
Lena Líllian Canto de SáI; José Maria dos Santos VieiraII; Rosivaldo de Alcântara MendesIII; Samara Cristina Campelo PinheiroI; Elivam Rodrigues ValeI; Francisco Arimatéia dos Santos AlvesI; Iracina Maura de JesusIV; Elisabeth Conceição de Oliveira SantosV; Vanessa Bandeira da CostaI
ILaboratório de Microbiologia
Ambiental, Seção de Meio Ambiente, Instituto Evandro Chagas/SVS/MS,
Ananindeua, Pará, Brasil
IIFaculdade de Farmácia,
Instituto de Ciências da Saúde, Universidade Federal do Pará,
Belém, Pará, Brasil
IIILaboratório de Toxicologia,
Seção de Meio Ambiente, Instituto Evandro Chagas/SVS/MS, Ananindeua,
Pará, Brasil
IVSeção de Meio
Ambiente, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
VDiretoria, Instituto Evandro
Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Ocorrência de uma floração de cianobactérias tóxicas na margem direita do Rio Tapajós, no Município de Santarém (Pará, Brasil). Traducido por: Rocio Tamara (resumen) y Lota Moncada (artículo)
RESUMEN
La presencia de floraciones de cianobacterias y de sus subproductos afecta directamente a la calidad del agua, pudiendo producir impactos negativos tanto estéticos como de salud pública, debido a la producción de compuestos potencialmente tóxicos y cancerígenos. El tipo más común de intoxicación involucrando cianobacterias se debe a la microcistina LR (hepatotoxinas), que puede causar graves daños al hígado. El objetivo de este estudio fue identificar el género causante de la floración de cianobacterias en el río Tapajós (Santarém, estado de Pará, Brasil) en marzo de 2007, así como realizar bioensayos de toxicidad aguda utilizando ratones Swiss-Webster. Las muestras se tomaron en cinco puntos de muestreo, distribuidos en la margen derecha del río Tapajós, donde fueron realizados arrastres horizontales, con la ayuda de una red de plancton de 20 μm y fueron recogidas también muestras de agua cruda (5.000 ml) en botellas de polipropileno color ámbar. Para la identificación de los organismos se utilizó la microscopía óptica, y la determinación de microcistina LR se realizó por medio de las técnicas de ELISA y HPLC. El análisis puso de manifiesto que a la altura de los puntos P01 y P02 ocurrió un desequilibrio ecológico en la comunidad de fitoplancton caracterizado por la proliferación de los géneros Anabaena y Microcystis. En las muestras de agua cruda, las concentraciones de microcistina LR registradas, están por debajo del valor máximo permitido en la legislación brasileña para el agua potable, aunque es importante destacar que la floración vista in situ ocupaba cerca de 10 cm de la superficie de la columna de agua y que, por lo tanto, contenía suficientes células de cianobacterias para ocasionar erupciones cutáneas en las personas que pudieran utilizar los bañarse en los ríos en ese período.
Palabras clave: Cianobacterias; Microcistinas; Calidad del Agua.
INTRODUCCIÓN
Las cianobactérias son organismos procarióticos capaces de fijar carbono a través de fotosíntesis, hacen parte de la comunidad fitoplanctónica, contribuyendo, de este modo, con gran parte de la productividad primaria y el flujo de energía en ecosistemas acuáticos17. Estos microorganismos habitan una gran variedad de ambientes (dulcícolas, salobres, marinos y terrestres)24 y están presentes en todos los biotopos acuáticos (interfaz agua/aire, columna de agua y sedimento)14.
La presencia de las cianobacterias en un cuerpo de agua, está asociada a un conjunto de factores ambientales (concentración deNyP temperaturas elevadas y disponibilidad de luz), que, al sufrir alteraciones, pueden llevar al aparecimiento de floraciones, fenómeno caracterizado por el intenso crecimiento de esos microorganismos en el água10.
La ocurrencia de floraciones ha sido frecuentemente atribuida al acelerado proceso de eutrofización de los ambientes acuáticos, producido principalmente por la actividad humana (desagüe doméstico y agro-industrial). La presencia de floraciones de cianobacterias y sus subproductos en ríos, lagos y reservorios destinados al suministro, interfiere directamente en la calidad del agua, pudiendo introducir efectos negativos tanto de orden estético y organoléptica, por la producción de color, olor y sabor, como de salud pública, debido a la producción de compuestos potencialmente tóxicos y carcinogénicos7.
Hay diversos registros de muerte por envenenamiento de ganado bovino, caballos, cerdos, ovejas, perros, peces e invertebrados, por la ingesta o contacto con esas floraciones tóxicas16. Otro ejemplo observado de la acción de esas toxinas fue la muerte de 60 pacientes de hemodiálisis en Caruaru, Pernambuco, debido a la presencia de hepatotoxinas en el agua utilizada34.
Según Falconer16, las toxinas producidas por cianobacterias se dividen en neurotoxinas; dermatotoxinas; y hepatotoxinas, conforme sus efectos tóxicos en mamíferos. Las especies ya identificadas como productoras de hepatotoxinas están incluidas en los géneros Microcystis, Anabaena, Nodularia, Oscillatoria, Nostoc y Cylindrospermopsis10. La especie Microcystis aeruginosa está considerada como de más amplia distribución en el territorio nacional, y la Anabaena, el género con mayor número de especies potencialmente tóxicas, conforme Carmichael25. El tipo más común de intoxicación involucrando cianobacterias se ocasiona por hepatotoxinas11, destacándose las microcistinas (-LR, -LL y -YA), las que pueden causar severos daños al hígado23.
Llevando en consideración la relevancia de los hechos citados y la necesidad de más conocimiento sobre los problemas relacionados a las floraciones de cianobacterias y de la calidad del agua en general, este estudio tuvo como objetivo identificar los géneros causadores de una floración de cianobacterias en el margen derecho del río Tapajós (Santarém, Pará, Brasil), verificar la producción de microcistinas por esa floración, bien como determinar la toxicidad de esas cianobacterias, a través de análisis de toxicidad con ratones.
MATERIALES Y MÉTODOS
DESCRIPCIÓN DEL ÁREA DE ESTUDIO Y MUESTREO
Las colectas se realizaron el día 21 de marzo de 2007, en el margen derecho del río Tapajós, en Santarém, Pará, Brasil en cinco puntos a lo largo del río. Los puntos de colecta fueron: P01 - playa Arariá (54o44'10,28" S; 2o24'33,20" W); P02 - playa Carapanari (50o44'29,66" S; 2o24'55,01" W); P03 - ensenada de la Ponta de Pedra (54o53'43,7r S; 2o26'04,78" W); P04 - en frente a la entrada del agujero del Sururu, en esa época bajo influencia del río Amazonas (54o51'02,36" S, 2o17'06,24 W); y P05 - lecho del río, área bajo influencia del río Arapiuns (54o58'44,59" S, 2o20'20,29" W) (Figura 1).
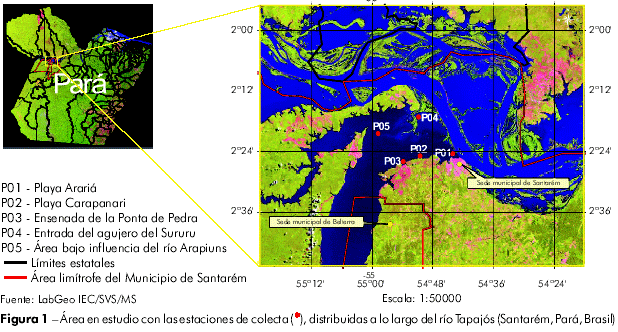
METODOLOGÍA
Colecta de las muestras
Las muestras destinadas al estudio cualitativo de las cianobacterias se obtuvieron a través de barridos horizontales, en la superficie del agua, con el auxilio de una red para plancton de 20 µm de apertura de malla, a través de la cual, se filtraron aproximadamente 2.000 L de agua. Una alícuota de 100 mL fue fijada en formol a 4% y una alícuota de 250 mL se mantuvo resfriada. También se realizaron colectas de agua bruta superficial con el auxilio de una botella de polipropileno del tipo ámbar, de 5.000 mL. Estas muestras se guardaron en heladera portátil con hielo reciclable hasta el momento de los análisis.
Identificación de las especies
En el laboratorio, las muestras se analizaron por montado en láminas temporales observadas en microscopio binocular. La identificación y nomenclatura de las especies fue realizada de acuerdo a la literatura especializada2,3,18,15.
Determinación de microcistinas en el agua por la técnica de ELISA
En el laboratorio una alícuota de 100 mL de agua bruta se filtró en membranas Millipore AP-20, después de haber pasado por sonicación con el objeto de promover la lisis celular y la liberación de las toxinas en el agua. Una alícuota de 20 µL del filtrado se sometió a análisis a través del método descrito por An y Carmichael1 utilizando el kit de la empresa Envirologix Inc. Ep 022, de acuerdo a las recomendaciones del fabricante, que detecta microcistina-LR por medio de anticuerpos policlonales. Todos los análisis se hicieron por duplicado, el promedio de los resultados fue considerado como la concentración de la muestra.
Determinación de microcistinas en el agua por HPLC
La determinación de microcistinas en muestras de agua se realizó a partir de la extracción de 2 L de muestras de agua por SPE (extracción en fase sólida) con posterior análisis por Cromatografía Líquida de Alta Precisión (HPLC). La extracción por SPE se realizó a partir de la metodología propuesta por TSUJI y colaboradores28 y consistió en: activar un cartucho C18-ODS con 20 mL de metanol y 20 mL de agua desionizada; adición, al vacío, de 2 L de muestras de agua al cartucho C18-ODS activado; adición de 20 mL de agua desionizada para la limpieza (clean-up) del cartucho C-18 ODS activado; adición de 20 mL de metanol al cartucho C18-ODS activado para la elución de la toxina; secado total, en evaporador rotativo, de la fracción metanólica que contiene la toxina; resuspensión, con 1 mL de metanol; y filtrado de la solución en un filtro de nylon de 0,45 µm. Para el análisis cromatográfico de las muestras se utilizó un HPLC (Varian) en las siguientes condiciones: columna fase reversa C-18, ODS, 5 µm, 250 mm. x 4 mm. (Varian); fase móvil acetonitrilo: acetato de amonio 20 mM, pH 5.0 (28:72 v/v), flujo - 1,0 mL/min.; detección de arreglo de fotodiodo (PDA) a 238 nm.; volumen de inyección 20 µL; tiempo de análisis 30 min.; y patrón Microcistina-LR proveniente de M. aeruginosa (Sigma M-2912).
Determinación de microcistinas en las células liofilizadas por HPLC
Después del proceso de liofilización de 250 mL de la muestra colectada por medio de barridos horizontales con red para plancton (20 µm), la muestra se extrajo con butanol: metanol: agua bidesionizada (1:4:15, v/v) en una proporción de 20 mL para cada 100 mg. de material liofilizado, siguiendo la metodología de Krishnamurthy y colaboradores19, modificada por Domingos y colaboradores13. El material obtenido fue agitado por 1 h y las células fragmentadas fueron removidas por centrifugación a 3.000 g por 10 min., repitiendo este procedimiento por dos veces, para garantizar la extracción total de las microcistinas. Los sobrenadantes de las extracción fueron combinados, evaporados a 400o C. para 30% del volumen inicial, y pasados por un cartucho de octadecilsilano (C18) (Bond-Elut Varian). En seguida, fueron lavados con una secuencia de 20 mL de agua bidesionizada y 20 mL de metanol a 100%, para elución de las toxinas. La fracción eluida con metanol fue colectada, evaporada hasta secar y diluida en 1 mL de metanol a 50%. En seguida, la solución fue filtrada en filtro de nylon de 0,45 µm y las toxinas identificadas por HPLC, en las mismas condiciones cromatográficas utilizadas para el análisis de las muestras de agua.
Bioensayos de toxicidad aguda con ratones
El material liofilizado fue disuelto en una solución salina esterilizada y sometido a sonicación por cinco ciclos de 30s a 100 W para liberar las toxinas22. La toxicidad fue determinada por inyección intraperitoneal del extracto de las células liofilizadas diluido en solución salina, con concentraciones de 1.200, 1000 y 100 mg/Kg. en ratones Swiss-Webster, machos, pesando entre 20-25 g, para obtener la dosis letal (DL50), utilizando cinco ratones para cada dosis. La solución fue aplicada en volumen de 0,1 mL para cada 10 g de peso del ratón, para alcanzar la concentración esperada. Las señales de intoxicaciones, tiempo de supervivencia y el examen, pos-mortem del hígado, fueron llevados en cuenta para la confirmación de la toxicidad aguda y determinación de la DL505,6,26,20. Para cada concentración probada, dos animales control fueron inoculados con solución salina usada en la dilución del extracto.
RESULTADOS
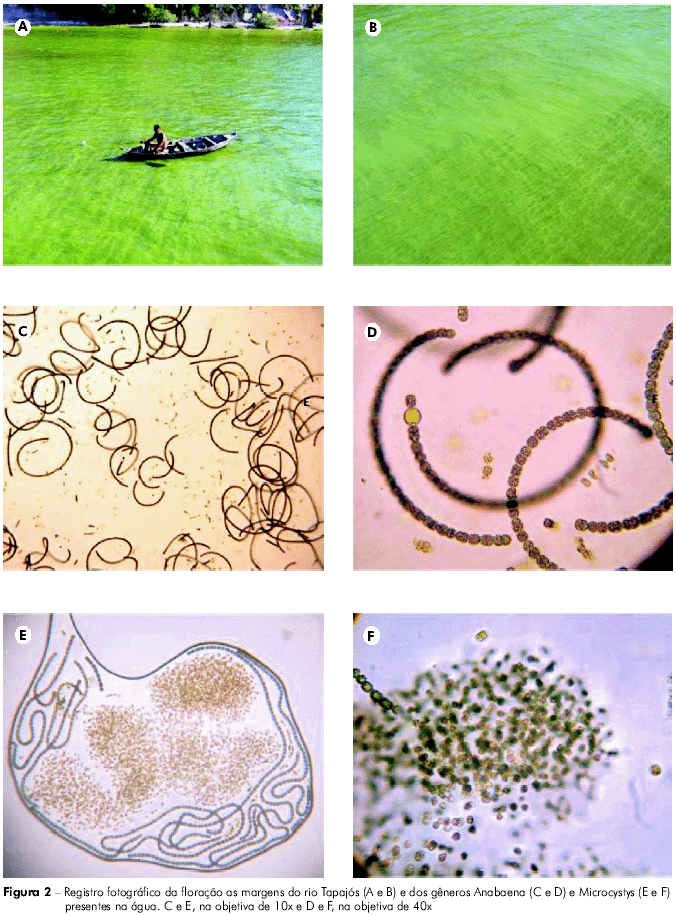
Al momento de la colecta de las muestras se observó que a la altura de los puntos P01 y P02 ocurría un evidente desequilibrio ecológico en la comunidad fitoplanctónica, caracterizado por la visualización de la floración (Figuras 2A y B). El análisis de las muestras colectadas en esos mismos puntos confirmó la presencia del género Anabaena (Figuras 2C y D), constituido por especies con tricomas espirales, presentando distribución mundial y destacándose en diferentes cuerpos de agua, especialmente de ambientes eutróficos; y Microcystis (Figuras 2E y F) microorganismos con un denso mucílago y que son reconocidos porque frecuentemente forman floraciones superficiales.
El tabla 1 presenta los resultados de las análisis realizados por medio de microscopia directa y la cuantificación de la microcistina a través de los métodos de ELISA y HPLC en muestras de agua concentrada (liofilizada) y bruta.

La detección de microcistinas realizada por la técnica de ELISA fue negativa para todos los puntos, en las muestras de agua bruta. En las muestras concentradas (liofilizadas), se demostró positiva apenas en los puntos P01 y P02 en concentraciones superiores a 3 ppb. Ya el análisis de microcistina-LR por HPLC registró concentraciones de cianotoxinas en estos mismos puntos, tanto en muestras de agua bruta (P01=3,25 µg.L-1 y P02 = 12,39 µg.L-1) con relación a las concentradas y liofilizadas (P01 =0,23 µg.L-1 y P02=0,55 µg.L-1)(Tabla 1).
Los análisis de toxicidad con ratones demostraron que, a pesar de que los animales presentan dificultad de locomoción y señales de contracciones abdominales minutos después de la aplicación, no ocurrieron muertes durante y después de los siete días de observación, en ninguna de las concentraciones analizadas, demostrando así que la floración observada no presenta concentración de toxinas suficiente para desarrollar una toxicidad aguda que se refleja en daños inmediatos a la salud humana.
DISCUSIÓN
En Brasil, hasta mediados de la década de 90, la relación de degradación de los manantiales con la salud pública se restringía a la contaminación del agua por agentes causadores de las enfermedades de vehiculación hídrica, principalmente varias especies de bacterias, protozoarios, gusanos y algunos virus. Apenas en el año de 1996, después del trágico caso que culminó con la muerte de cerca de 60 pacientes renales crónicos sometidos a hemodiálisis en una clínica en la ciudad de Caruaru, Pernambuco, se constató que había otro factor muy importante y, muchas veces, no considerado por las autoridades competentes y por la propia población, que podría ser responsable por la muerte del hombre vía ingestión de agua: las toxinas producidas biológicamente, que podrían estar presentes en el agua suministrada a la población25. Después de ese episodio, las floraciones de cianobacterias tóxicas fueron reconocidas como un problema de salud pública y fueron establecidos límites máximos permitidos para estas toxinas en agua de abastecimiento21 y para usos múltiples12.
Los efectos tóxicos de las cianotoxinas han recibido una creciente atención de investigadores de todo el mundo. Las microcistinas de acción hepatocarcinogénica en ratones son las cianotoxinas más frecuentemente encontradas en los cuerpos hídricos de todo el mundo4. En Brasil, ya ha sido observada la ocurrencia de cianobacterias tóxicas en reservorios de aguas destinadas al consumo humano en varios estados5. En Pará, hemos acompañado eventos significativos de floraciones de cianobacterias tóxicas desde 1999, comprobando que este hecho es preocupante. En 1999, durante un estudio de monitoreo de cianobacterias en la represa de Utinga, que abastece la Ciudad de Belém, Pará, fue constatada la presencia de cepas tóxicas de Radiocystis fernandoi y Microcystis viridis, y presencia de microcistinas en el agua bruta de la represa31,29,32,30. Durante una floración de Cylindrospermopsis raciborskii en los ríos Iriri y Xingu (Altamira, Pará) hubo una gran mortandad de peces, con la presencia de saxitoxinas en las aguas33.
En el presente estudio, las concentraciones de microcistina-LR encontradas en las muestras de agua bruta en el río Tapajós están por debajo de los valores máximos permitidos en la Legislación Brasileña para agua de consumo21 lo que descarta, en este momento, la posibilidad de intoxicación aguda en humanos. Sin embargo, es importante destacar el efecto acumulativo de esos heptapéptidos en el organismo, lo que puede acarrear problemas futuros de salud.
Todos los géneros de cianobacterias son portadores, en su pared celular, de dermatotoxinas (LPS), que son toxinas irritantes en contacto con la piel27, y que pueden también causar irritación en los ojos, conjuntivitis, urticaria, obstrucción nasal y asma8.
Han sido relatados casos de dermatitis de contacto en humanos, asociados al uso de aguas de recreación9. De esta manera, no es posible desconsiderar la posibilidad de eventuales irritaciones cutáneas, en personas (principalmente en niños, inmunodeprimidos y ancianos) que frecuenten los balnearios de Arariá y Carapanari, que están entre los más visitados del Municipio de Santarém, Pará.
La confirmación de que la floración observada en el margen derecho del río Tapajós fue constituida por dos géneros de cianobacterias (Anabaena y Microcystis) potencialmente productores de cianotoxinas, llama la atención para la necesidad de monitoreo ambiental en esa región, con el fin de determinar las causas y/u orígenes de esas ocurrencias.
CONCLUSIÓN
Considerando su importancia para la salud pública; la contribución de este tipo de estudio para el conocimiento de la biodiversidad local y de la elucidación de los procesos naturales y antrópicos que puedan estar relacionados a esos eventos, que vienen sucediendo a cada año en el río Tapajós; es necesario el monitoreo de las cianobacterias en sus aguas, una vez que, en el período estudiado, se encontraron floraciones de dos géneros de cianobacteria (Anabaena y Microcystis) productores de toxinas, además de la detección de microcistina-LR en el agua bruta. A lo largo de los años, estas floraciones se pueden volver cada vez más abundantes y resultar en riesgo para la salud de la población ribereña local, que utiliza esa agua para consumo, pesca y recreación.
AGRADECIMIENTOS
Los autores le son gratos a Raimundo Pio Girard por el auxilio en la colecta del material y a la Marina de Brasil (puesto Santarém) por el auxilio en el trabajo de campo.
REFERENCIAS
1 An J, Carmichael WW. Use of a colorimetric protein phosphatase inhibition assay and enzyme linked immunosorbent assay for the study of microcystins and nodularins. Toxicon. 1994 Dec;32(12):1495-507. [ Links ]
2 Anagnostidis K, Komárek J. Modern approach to the classification system of cyanophytes. 1 - Introduction. Arch Hydrobiol. 1985;38-39(Suppl 71):291-302.
3 Anagnostidis K, Komárek J. Modern approach to the classification system of cyanophytes. 3 - Oscillatoriales. Arch Hydrobiol. 1988;50-53(Suppl 80):327-472.
4 Azevedo SMFO, Carmichael WW, Jockimsen EM, Rinehart KL, Lau S, Shaw GR, et al. Human intoxication by microcystins during renal dialysis treatment in Caruaru-Brazil. Toxicology. 2002 Dec;181-182:441-6. DOI:10.1016/S0300-483X(02)00491-2 [ Links ]
5 Azevedo SMFO, Evans WR, Carmichael WW, Namikoshi M. First report of microcystins from a Brazilian isolate of the cyanobacterium Microcystis aeruginosa. J Appl Phycology. 1994;6:261-5. DOI: 10.1007/BF02181936 [ Links ]
6 Baker PD, Humpage AR. Toxicity associated with commonly ocurring cyanobacteria in surface waters of the Murray-Darling Basin, Australia. Aust J Mar Freshwater Res. 1994;45:773-86. DOI:10.1071/MF9940773 [ Links ]
7 Bernardo L. Algas e suas influências na qualidade das águas e nas tecnologias de tratamento. Rio de Janeiro: Associação Brasileira de Engenharia Sanitária e Ambiental; 1995. 127 p.
8 Calijuri MC, Alves MSA, Santos ACA. Cianobactérias e cianotoxinas em águas continentais. São Carlos: Rima; 2006. 118 p.
9 Carmichael WW. Freshwater blue-green algae (Cyanobacteria) toxins - A review. In: Carmichael WW, editor. The water environment Algal Toxins and Health. New York: Plenum Press; 1981. p. 1-13.
10 Carmichael WW. The toxins of cyanobacteria. Sci Am. 1994 Jan;270(1):78-86.
11 Chorus I, Bartram J. Toxic cyanobacteria in water. A guide to their public health consequences, monitoring and management. New York: E & FN Spon; 1999. 416 p. [ Links ]
12 Conselho Nacional de Meio Ambiente (BR). Resolução no 357, de 17 de março de 2005. Diário Oficial da União; 17 mar. 2005. [ Links ]
13 Domingos P, Rubim TK, Molica RJR, Azevedo SMFO, Carmichael WW. First report of microcystin production by picoplanctonik cyanobacteria isolated froma northeast Brazilian drinking water supply. Environ Toxicol. 1999;14(1):31-5.
14 Esteves FA. Fundamentos de limnologia. 2. ed. Rio de Janeiro: Interciência; 1998. 602 p.
15 Ettl H, Gartner G, Heynig H, Mollenhauer D. Subwasserflora von mitteleuropa. In: Komárek J, Anagnostidis K, editors. Cyanoprokaryota. Berlin: Verlag; 1999. 548 p. Teil Chroococcales.
16 Falconer IR. An overview of problem caused by toxic blue-green algae (Cyanobacteria) in drinking and recreational water. Environ Toxicol. 1999;14:5-12. [ Links ]
17 Ferrão-Filho AS, Molica R, Azevedo SM. Ecologia, ecofisiologia e toxicologia de cianobactérias. Oecol Bras. 2009;13(2):225-8. [ Links ]
18 Komárek J, Anagnostidis K. Modern approach to the classification system of cyanophytes. 4 - Nostocales. Arch Hydrobiol. 1989;56(Suppl 83):291-302.
19 Krishnamurthy T, Carmichael WW, Sarvier EW. Toxic peptides freshwater cyanobacteria (blue-green algae). I. Isolation, purification and characterization of peptides from Microcystis aeruginosa and Anabaena flos-aquae. Toxicon. 1986;24(9):865-73. DOI: 10.1016/0041-0101(86)90087-5 [ Links ]
20 Magalhães VF, Soares RM, Azevedo SMFO. Microcystin contamination in fish from the Jacarepaguá Lagoon (Rio de Janeiro, Brazil): ecological implication and human health risk. Toxicon. 2001 Jul;39(7):1077-85. DOI: 10.1016/S0041-0101(00)00251-8 [ Links ]
21 Ministério da Saúde (BR). Portaria no 518, de 25 de março de 2004. Diário Oficial da União; 26 mar. 2004. [ Links ]
22 Negri AP, Jones GJ. Bioaccumulation of paralytic shellfish poisoning (PSP) toxins from the cyanobacterium Anabaena circinalis by the freshwater mussel Alathyria condola. Toxicon. 1995 May;33(5):667-78. [ Links ]
23 Nishiwaki-Matsushima R, Ohta T, Nishiwaki S, Suganuma M, Kohyama K, Ishikawa T, et al. Liver tumor promotion by the cyanobacterial cyclic peptide toxin microcystin-LR. J Cancer Res Clin Oncol. 1992;118(6):420-4. [ Links ]
24 Sant'Anna CL, Azevedo MTP, Agujaro LF, Carvalho LR, Souza RCR. Manual ilustrado para identificação e contagem de cianobactérias planctônicas de águas continentais brasileiras. Rio de Janeiro: Interciência; 2006. 58 p.
25 Sant'anna CL, Azevedo MTP. Contribution to the knowledge of potentially toxic cyanobacteria from Brazil. Nova Hedwigia. 2000;71:359-85.
26 Sedmack B, Kosi G. Microcystins in Slovene freshwaters (Central Europe) First report. Nat Toxins. 1997;5(2):64-73. [ Links ]
27 Sivonen K, Jones G. Cianobacterial toxins. In: Chorus I, Bartram J, editors. Toxin Cyanobacteria in water: A guide to their Public Health Consequences, Monitoring and Management. Londres: E & FN Spon; 1999. p. 42-111.
28 Tsuji K, Naito S, Kondo F, Watanabe M, Suzuki S, Nakazawa H, et al. A clean-up method for analysis of trace amounts of microcystins in lake water. Toxicon. 1994;32(10):1251-9. [ Links ]
29 Vieira JMS, Azevedo MTP, Azevedo SMO, Honda RY, Correa B. Microcystin production by Radiocystis fernandoi (Chroococcales, Cyanobacteria) isolated from a drinking water reservoir in the city of Belém, PA, Brazilian Amazonic region. Toxicon. 2003 Dec;42(7):709-13. [ Links ]
30 Vieira JMS, Azevedo MTP, Azevedo SMO, Honda RY, Corrêa B. Toxic cyanobacteria and microcystin concentrations in a public water supply reservoir in the Brazilian Amazonia region. Toxicon. 2005 Jun;45(7):901-9. [ Links ]
31 Vieira JMS, Azevedo MTP, Honda RY, Azevedo SMFO, Correa B. Produção de microcistinas por Radiocystis fernandoi (Cyanobacteria/Chroococcales) isolada da represa de abastecimento da cidade de Belém-PA [resumos]. In: 8o Congresso Brasileiro de Limnologia, 2001, João Pessoa, PB: Sociedade Brasileira de Limnologia; 2001. p. 217.
32 Vieira JMS, Sá LLC, Santos ECO, Lima MO, Bernardo RR, Azevedo SMFO. Ocorrência de Cylindrospermopsis raciberskii e saxitoxinas durante uma mortandade de peixes nos rios Iriri e Xingu, Altamira, Pará, Brasil [resumos]. In: 22o Congresso Brasileiro de Microbiologia, 2003, Florianópolis, SC: Sociedade Brasileira de Microbiologia; 2003.
33 Vieira JMS, Vieira ABR. Floração de Microcystis sp (Cianobacteria) em uma praia de rio da Região Amazônica do Brasil [resumos]. In: 22o Congresso Brasileiro de Microbiologia, 2003, Florianópolis, SC: Sociedade Brasileira de Microbiologia; 2003.
34 Yuan M, Carmichael WW, Hilborn ED. Microcystin analysis in human sera and liver from human fatalities in Caruaru, Brasil 1996. Toxicon. 2006 Nov;48(6):627-40. DOI: 1016/j.toxicom.2006.07.031 [ Links ]
 Correspondência
/ Correspondence / Correspondencia:
Correspondência
/ Correspondence / Correspondencia:
Lena Líllian Canto Sá
Instituto Evandro Chagas,
Seção de Meio Ambiente
Rodovia BR 316, km 7, s/no,
Bairro: Levilândia
CEP:67030-000
Ananindeua-Pará-Brasil
E-mail:lenasa@iec.pa.gov.br
Recebido em / Received / Recibido en: 31/7/2009
Aceito em / Accepted / Aceito en: 25/9/2009











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI
