Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.1 Ananindeua mar. 2010
http://dx.doi.org/10.5123/S2176-62232010000100024
Reevaluación de la vacuna tetravalente (RRV-TV) en el contexto de la prevención de la gastroenteritis por rotavirus
Consuelo Silva de OliveiraI; Alexandre da Costa LinharesI; Nildo Alves BatistaII
IInstituto Evandro Chagas/SVS/MS,
Ananindeua, Pará, Brasil
IIUniversidade Federal de São Paulo, São Paulo, São
Paulo, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Reanálise da vacina tetravalente (RRV-TV) no contexto da prevenção das gastrenterites por rotavírus. Traducido por: Rocio Tamara (resumen) y Lota Moncada (artículo)
RESUMEN
El rotavirus es la principal causa de gastroenteritis aguda en niños menores de cinco años, especialmente en países en desarrollo. La vacunación en los primeros meses de vida constituye la medida más eficaz en materia de salud pública para el control y la prevención de las infecciones por estos agentes. A pesar de la reciente concesión de licencias para el uso de dos vacunas de rutina en recién nacidos (Rotarix® y Rota Teq®), la investigación continúa con nuevas alternativas para la prevención y tratamiento. En este contexto, se procedió a la revisión de la Rhesus-Human Reassortant Rotavirus Tetravalent Vaccine (RRV-TV), con énfasis en la eficacia clínica frente a los parámetros clínicos en los serotipos que predominan en la región, la ocurrencia de eventos adversos graves (invaginación intestinal) y la protección selectiva de mayor gravedad. Los datos clínicos y epidemiológicos se obtuvieron de los registros médicos de 91 episodios de diarrea en niños, en el ámbito de una investigación anterior realizada en Belém (estado de Pará). Se consideraron indicadores de gravedad los parámetros clínicos y un sistema de puntuación que se aplica comúnmente a los estudios de eficacia de la RRV-TV. Se examinan a la luz de los conocimientos actuales sobre el tema los resultados más llamativos del estudio y la significativa protección (p < 0,05) brindada por la RRV-TV en cinco de las siete condiciones clínicas evaluadas, la eficacia acumulada de 100% para los episodios con la puntuación clínica superior a 14 en relación con el serotipo G2, la eficiencia de 75% contra los episodios graves y la no ocurrencia de invaginación intestinal.
Palabras clave: Vacunas contra Rotavirus; Gastroenteritis; Infecciones por Rotavirus.
INTRODUCCIÓN
Las gastroenteritis agudas por rotavirus constituyen un grave problema de salud pública, principalmente en países en desarrollo, en donde la enfermedad está asociada a aproximadamente 600 mil óbitos, por año, de niños por debajo de los 5 años de edad, con la mayor concentración en África y Asia. En los Estados Unidos, a pesar de las bajas tasas de mortalidad (20 a 60 óbitos por año), tales agentes son responsables por un 30% a un 70% de todas las hospitalizaciones por gastroenteritis1.
Con los estudios realizados por Bishop et al3 en Melbourne, Australia, surgieron las primeras evidencias de la diarrea aguda relacionada a los rotavirus. En Brasil, a partir de los hallazgos pioneros de Linhares et al18 en la Región Norte, los estudios epidemiológicos se sucedieron en otras regiones del País, confirmando la importancia de los rotavirus en la morbilidad infantil por diarrea, con índices de 30% de los casos hospitalizados y 10% de ocurrencia en la comunidad22. Las recientes investigaciones epidemiológicas realizadas en Brasil revelan una estimativa de 120.513 hospitalizaciones y 2.475 óbitos asociados a estos virus7.
Los rotavirus presentan una gran diversidad antigénica, responsable por la multiplicidad de serotipos, siendo los tipos de G1 a G4 y G9 los de mayor prevalencia y responsables por 95% de los episodios diarreicos en niños en el mundo21. En Brasil, merece destaque una reciente revisión conducida por Leite et al12 en un número expresivo de muestras oriundas de varias regiones del País (2.691), en el período de 1982 a 2007, en las que se identificaron los serotipos G1, G2, G3, G4, G5 y G9, como los de mayor circulación en el País.
Las infecciones por rotavirus exhiben un patrón estacional bien definido, particularmente en las regiones de clima templado, donde se observa una nítida prevalencia de los casos en los meses más fríos. En las áreas tropicales, la estacionalidad es menos pronunciada, con una mayor concentración de los casos en los meses más secos del año1.
Con base en las observaciones de que la mejoría de las condiciones de saneamiento no interfiere en las elevadas tasas de prevalencia de diarrea por rotavirus en los países desarrollados y en desarrollo, y delante de las elevadas tasas de hospitalización, aún cuando se usa en larga escala el suero de rehidratación oral, la estrategia de vacunación se considera la medida más efectiva de control y prevención de las infecciones por tales agentes.
La obtención de una vacuna eficaz e inocua es una prioridad en el marco de la Organización Mundial de Salud (OMS), para ser administrada principalmente en niños hasta los dos primeros años de vida, quienes cuando enferman, pueden evolucionar para deshidratación y óbito. Los estudios con las candidatas a la vacuna ideal evolucionaron desde los llamados procedimientos Jennerianos - los que utilizan cepas de rotavirus originarios de animales -, seguidos por las vacunas de segunda generación, hasta las estrategias de comprenden técnicas de ingeniería genética.
Entre las varias estrategias de vacunación estudiadas, se destaca la Rhesus-human Reassortant Rotavirus Tetravalent Vaccine (RRV-TV), primera vacuna contra rotavirus evaluada en Brasil, a mediados de los años 90, en Belém, Pará14. La referida vacuna involucra reingeniería genética entre cuatro cepas atenuadas con origen en simios y humanos (4x104 pfu/dosis) y ha sido objeto de varios estudios clínicos, realizados en países desarrollados11 y en América del Sur (Perú, Brasil y Venezuela). Los resultados indicaron eficacia en relación a episodios más graves, alcanzando índices comparables a los otros estudios con tal inmunizante en concentraciones más elevadas10,24. El análisis de los resultados alcanzados en los varios ensayos clínicos proporcionó el licenciamiento de la primera vacuna contra rotavirus en EUA (Rotashield®) en julio de 1998, con la recomendación de un esquema de tres dosis, a los 2, 4 y 6 meses de edad5. Sin embargo, nueve meses después, con más de 1 millón de dosis aplicadas en aproximadamente 500 mil niños, la vacuna fue retirada del programa de inmunización, decisión fundamentada en amplia evaluación de casos notificados de intususcepción asociada a la vacuna6. Los análisis subsiguientes de los datos registrados confirmaron esta correlación, aunque con un riesgo estimado entre 1/10.000 y 1/32.000, y con mayor frecuencia entre el tercero y el décimo cuarto día después de la primeira dosis, en niños con más de 3 meses de edad, lo que evidencia nítida asociación a la franja etaria20. Vale destacar que los ensayos clínicos con la vacuna, en curso en el mundo, fueron discontinuados.
Actualmente se cree que hubo una superestimación de los riesgos de intususcepción, en los EUA, considerando que un 35% de los niños recibió las primeras dosis en edad superior a la indicada en los estudios actuales25. Por lo tanto, se admite que en los países en desarrollo los beneficios resultantes de esta vacuna podrían ser más importantes que el eventual riesgo de intususcepción. En este contexto, se justifican los análisis retrospectivos de las experiencias acumuladas con la vacuna tetravalente, en el intento de elucidar cuestiones que permanecen obscuras, en el esfuerzo global por acelerar la introducción de nuevas vacunas en los programas de inmunización, particularmente en países como India, Indonesia y China, en donde un tercio de los óbitos se atribuyen a los rotavirus9.
MATERIAL Y MÉTODOS
El presente estudio procedió a un análisis de la vacuna tetravalente (RRV-TV) producida por el laboratorio Wyeth-Ayerst Research (Filadelfia, Pensilvania, EUA) frente a 91 episodios diarreicos ocurridos en niños, participantes de una investigación previa realizada en Belém, Pará. Tal investigación fue aprobada por el Comité de Ética Médica del Instituto Evandro Chagas, por el Consejo Regional de Medicina del Estado de Pará, por la Secretaría Estadual de Salud del Estado de Pará, por el Ministerio de Salud de Brasil y por la Comisión de Ética de la OMS, Ginebra, Suiza.
La referida investigación se desarrolló en la ciudad de Belém, localizada al Norte de Brasil, Amazonia Oriental. El estudio básico transcurrió a lo largo de dos años, y fue de carácter prospectivo, randomizado, con control doble-ciego, en el que se administró vacuna o placebo, en la proporción de 1:1, a 540 niños. El esquema de vacunación consistía en tres dosis, iniciando al primer mes de vida, seguida de otras dos al tercero y quinto mes, abarcando 540 niños en la primer dosis, 513 en la segunda, 495 (92%) recibieron las tres dosis del esquema de vacunación y, de éstos, 466 (94%) fueron acompañados hasta el final del estudio. Las diferencias observadas en la cantidad de niños está relacionada a la obediencia al protocolo de investigación, como límites predefinidos de franja etaria para cada una de las tres dosis preconizadas en el esquema de vacunación.
Para el cálculo del porcentual de eficacia de la vacuna se consideraron apenas los episodios de diarrea por rotavirus registrados después de transcurridas dos semanas de la administración de la tercera dosis, hasta completar dos años de observación.
Los parámetros clínicos analizados se obtuvieron a partir de las fichas clínicas utilizadas en el control de los episodios diarreicos del referido estudio básico. En esta investigación, cada niño, transcurrida la primer semana de la vacunación, era sometido a un control sistemático de los episodios diarreicos, el que consistía en dos visitas semanales hasta el final del estudio, con el objetivo de determinar la incidencia de los episodios diarreicos. Frente a un caso de diarrea, se realizaban visitas diarias hasta el final del episodio. Los criterios clínicos indicativos de gravedad fueron: a) diarrea - tres o más evacuaciones líquidas o semilíquidas en un período de 24 h (definición adoptada por la OMS para estudios con la vacuna contra los rotavirus); b) presencia de vómitos; c) fiebre - temperatura rectal > 38° C; d) señales de deshidratación (criterios establecidos por la OMS); e) número máximo de evacuaciones líquidas o semilíquidas > 6 em 24 h; f) número promedio de evacuaciones líquidas o semilíquidas > 6 en 24 h; y g) visita a hospitales o centros de salud. Al mismo tiempo, se utilizó en el análisis de eficacia un sistema de puntaje clínico8, corrientemente aplicado a los estudios de eficacia de la RRV-TV y que reúne señales y síntomas con el puntaje correspondiente y total máximo de 20 puntos (Tabla 1). Episodios con puntajes clínicos de 0 a 8, 9 a 14 y superior a 14, se definieron como leves, moderados a graves y muy graves, respectivamente.

Hubo registro de 131 episodios diarreicos por rotavirus en el período del estudio, pero solamente se consideraron 91, por traducir los episodios que iniciaron luego de 15 días de la tercera dosis. Para la definición diagnóstica de esos casos, los especímenes fecales y, en menor número, los hisopados rectales, se obtuvieron luego de la detección de un episodio diarreico y las muestras sometidas como de rutina, al método ELISA para detección de rotavirus (o sus antígenos), utilizándose el kit Dakopatts (Copenhague, Dinamarca), recomendado por la OMS.
RESULTADOS
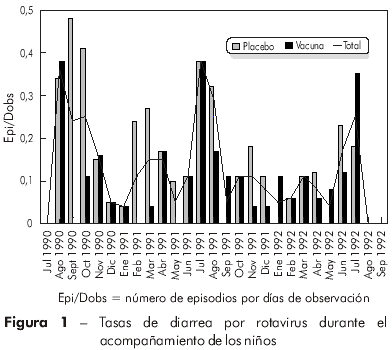
El análisis de la incidencia (número de episodios/días de observación) de los 91 episodios diarreicos por rotavirus, en los tres años de acompañamiento, reveló índices significativamente superiores en los meses de junio a setiembre (p = 0,007), cuando comparados a los de otros meses en el mismo período de estudio. Ese período corresponde a los meses más secos del año (Figura 1).
En lo que se refiere a la eficacia de la RRV-TV frente a las condiciones clínicas relacionadas a la gravedad, se observó efecto protector en casi todos los parámetros, excepto delante de la fiebre, en que la vacuna no ofreció protección en los dos años de estudio (Tabla 2).
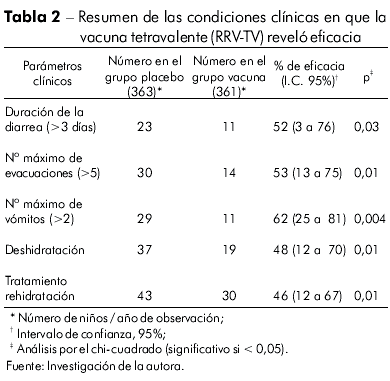
La eficacia relativa de la vacuna en relación al número máximo de evacuaciones superior a cinco, en los dos años de estudio fue significativa frente a todos los episodios: 53% (p = 0,01%). En lo que se refiere a la duración de los vómitos, se registró total protección (100%, p = 0,03) en el segundo año de acompañamiento, considerados los casos de diarrea relacionados al serotipo G2.
Durante los dos años de evaluación, se observó expresiva eficacia de la RRV-TV con relación a la deshidratación en todos los episodios diarreicos, similar a lo observado con relación a la necesidad de rehidratación. Tales porcentuales fueron de 48% (p = 0,01) y 46 % (p = 0,01), respectivamente.
El análisis de la eficacia de la RRV-TV frente a todos los episodios diarreicos, de acuerdo a las franjas de gravedad clínica (Tabla 3) reveló que la vacuna no exhibió niveles protectores contra los episodios clasificados como de leve intensidad (puntaje de de 0 a 8) e indujo moderada protección contra todos los casos con puntajes clínicos de 9 a 14. Con relación a los cuadros considerados muy graves (puntaje > 14) a RRV-TV les confirió niveles expresivos de protección, 75% (p = 0,02).

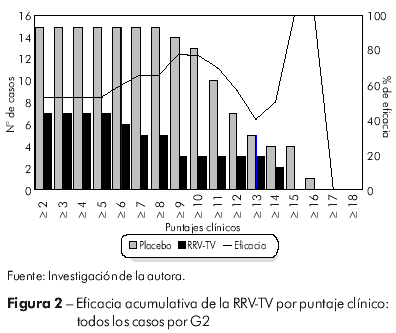
La figura 2 exhibe la eficacia de la vacuna frente a todos los casos asociados al serotipo G2, observando que la curva no exhibe variaciones en el intervalo entre los puntajes clínicos de ≥ 2 a ≥ 5 (53%), con elevación a partir del puntaje ≥ 6 hasta ≥ 10 (60% a 77%, respectivamente), decreciendo a seguir a niveles de protección de 40% (≥ 13). A partir de los puntajes ≥ 14 hasta ≥ 16, la curva de eficacia vuelve a ascender, alcanzando niveles máximos de 100% contra los casos revestidos de mayor gravedad.
Con relación a la ocurrencia de evento adverso grave, no hubo registro en los dos años de acompañamiento.
DISCUSIÓN
Los rotavirus presentan una amplia distribución en todo el mundo. En el presente estudio, se identificó un perfil similar al descrito para las regiones tropicales, pero de carácter inusitado, si comparado con las observaciones anteriores que registraban la ocurrencia de los episodios por rotavirus durante todo el año22. Este perfil, sin embargo, puede sufrir modificaciones, según los recientes análisis realizados por el CDC, que correlacionan el patrón estacional de las infecciones con el uso en larga escala de vacunas, actual situación de Brasil, con la reciente introducción de la vacuna monovalente [Rotarix®] en el Programa Nacional de Inmunización (PNI)4.
En lo que concierne a la eficacia frente a los serotipos prevalentes, los hallazgos demuestran que la protección otorgada por la vacuna debe contemplar los serotipos prevalentes en la región. En este particular, los estudios retrospectivos realizados por Linhares et al17 en poblaciones urbanas de nuestra región, a lo largo de la década de 80 hasta 1992, revelaron mayor prevalencia del serotipo 1, principalmente durante el primer año de vida, seguido del tipo 2. En el estudio se observaron variaciones en la curva de eficacia de la RRV-TV frente a todos los casos asociados al serotipo G2, que pueden reflejar los períodos de mayor y menor circulación del serotipo en la región, y quedó demostrada la expresiva protección de la vacuna en los episodios con puntaje clínico ≥ 14, definidos como los de mayor gravedad. Sin embargo, los números absolutos de pequeña monta relacionados a los puntajes más elevados, pueden delinear tasas aparentemente más expresivas.
Hay que resaltar que no fue posible, en el estudio en análisis, mostrar protección a los serotipos considerados emergentes (por ejemplo: G9], que se constituyen un gran desafío en el contexto actual de las vacunas licenciadas. Delante de la amplia variación temporal y geográfica de los serotipos, la emergencia de nuevos tipos de relevancia epidemiológica y la posible cocirculación en una misma región, se justifica plenamente el monitoreo sistemático de los serotipos circulantes, principalmente en los estudios pos licenciamiento21.
El riesgo de intususcepción (IS) asociado a la vacuna Rotashield ha estimulado una amplia y minuciosa revisión de los casos registrados, con resultados preliminares identificando la edad de inicio de la vacunación como factor de riesgo para la ocurrencia de IS2. La experiencia con esta vacuna en los EUA siguió la recomendación de la primera dosis a los 2 meses de edad, seguidas de dosis a los 4 y 6 meses de edad. Las reevaluaciones subsiguientes demostraron, sin embargo, que un 61% de las niños iniciaron la vacunación a los 3 meses de edad o más y que un 80% de los casos de IS asociados a la vacuna, ocurrió en esta franja de edad, período de mayor incidencia del agravo en la población en general2. Admitiéndose tal asociación, se justifica la recomendación para que, en los ensayos clínicos con vacunas, haya reducción del esquema de vacunación para dos dosis, con la primera administrada todavía en el período neonatal y el beneficio adicional de atenuar otros eventos adversos, como la fiebre, comúnmente asociada a la vacuna tetravalente28.
Se acumulan evidencias de que la vacuna ideal contra los rotavirus debe asegurar protección frente a los casos revestidos de mayor gravedad, responsables por los elevados índices de morbilidad y mortalidad infantil en todo el mundo. En el estudio en cuestión, se observó una expresiva protección de la vacuna en cinco de las siete condiciones clínicas indicadoras de gravedad, tales como: la duración de la diarrea, el número máximo de evacuaciones y de vómitos, la deshidratación y la necesidad de rehidratación. Vale resaltar que condiciones clínicas similares fueron identificadas en anteriores investigaciones, destacándose las que fueron realizadas en nuestra región por Linhares et al13 en las que los vómitos, el número de evacuaciones líquidas y la deshidratación, asociados a los episodios diarreicos por rotavirus, exhibieron mayor gravedad en comparación con los de otras etiologías. Estos índices de protección son comparables a los obtenidos en investigaciones hechas en otras regiones del mundo con formulaciones más concentradas10,24. El análisis de las señales y síntomas en conjunto, a la luz de puntajes clínicos, demostró la protección selectiva de la vacuna, induciendo protección a los episodios considerados muy graves (75%, p = 0,02), en consonancia con el objetivo principal de la vacunación contra los rotavirus15. Tales hallazgos se renuevan en los estudios más recientes que culminaron con el advenimiento de las vacunas RotaTeq® y Rotarix®, que ahora están licenciadas19,29.
La eficacia clínica de la vacuna tetravalente registrada en esta investigación fue reproducida en otros ensayos clínicos realizados en América Latina y Finlandia, y confirmada en los dos estudios pos licenciamiento de la Rotashield®, que encontraron 100% de protección en los cuadros de mayor gravedad, con el esquema de tres dosis23,26. El potencial protector de la vacuna, una vez introducida a larga escala, quedó evidente en el estudio llevado adelante por Tate et al27 en los EUA, con el análisis retrospectivo de los datos de una cohorte de niños vacunados con Rotashield®, de 1999 a 2000, la vacuna se mostró altamente eficaz en la prevención de la hospitalización y las visitas a los servicios de emergencia por gastroenteritis de todas las etiologías, ampliando las estimativas previas del impacto de la vacunación en larga escala.
Aunque se trate de una vacuna ya no recomendada para uso de rutina, los hallazgos oriundos de la RRV-TV, establecieron las bases para las estrategias futuras y determinantes del actual escenario satisfactorio con las vacunas ahora licenciadas30.
CONCLUSIÓN
Los resultados alcanzados confirman la expresiva protección de la RRV-TV en los episodios diarreicos revestidos de mayor gravedad y la eficacia significativa frente a los serotipos más prevalentes en la época del estudio.
Los hallazgos del presente reanálisis se suman a los originarios de los estudios con la RRV-TV realizados en América Latina y en los Estados Unidos y constituyeron la base de las nuevas directrices para los ensayos clínicos de la nueva generación de vacunas, en el esfuerzo global de acelerar la introducción de vacunas contra los rotavirus en los programas de inmunización de los países que presentan los mayores índices de mortalidad infantil por estos agentes, con destaque para India, Indonesia y China.
AGRADECIMIENTOS
Agradecimiento a la sra. Maria José Mateus (Biblioteca del Instituto Evandro Chagas) por los relevantes servicios en el acceso a los artículos científicos.
REFERENCIAS
1 Bernstein DI. Rotavirus overview. Pediatr Infect Dis J. 2009 Mar;28(3 Suppl):S50-3. [ Links ]
2 Bines J. Rotavirus vaccines and intussusception risk. Curr Opin Gastroenterol. 2005 Jan;21(1):20-5. [ Links ]
3 Bishop RF, Davidson GP, Holmes IH, Ruck BJ. Virus particles in epithelial cells of duodenal mucosa from children with acute, nonbacterial gastroenteritis. Lancet. 1973 Dec;2(7841):1281-3.
4 Centers for Disease Control and Prevention. Prevention of rotavirus gastroenteritis among infants and children recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 2009 Feb;58(2):1-26. [ Links ]
5 Centers for Disease Control and Prevention. Rotavirus vaccine for the prevention of rotavirus gastroenteritis among children: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Morb Mortal Wkly Rep. 1999 Mar;48(2):1-20. [ Links ]
6 Centers for Disease Control and Prevention. Withdrawal of rotavirus vaccine recommendation. MMWR Morb Mortal Wkly Rep. 1999 Nov;48(43):1007. [ Links ]
7 Constenla DO, Linhares AC, Rheingans RD, Antil LR, Waldman EA, Silva LJ. Economic impact of a rotavirus vaccine in Brazil. J Health Popul Nutr. 2008 Dec;26(4):388-96. [ Links ]
8 Flores J, Perez-Schael I, Gonzalez M, Garcia D, Perez M, Daoud N, et al. Protection against severe rotavirus diarrhoea by rhesus rotavirus vaccine in Venezuelan infants. Lancet. 1987 Apr;1(8538):882-4. [ Links ]
9 Glass RI, Bresee JS, Turcios R, Fischer TK, Parashar UD, Steele AD. Rotavirus vaccines: targeting the developing world. J Infect Dis. 2005 Sep;192 Suppl 1:S160-6. DOI: 10.1086/431504 [ Links ]
10 Joensuu J, Koskenniemi E, Pang XL, Vesikari T. Randomised placebo-controlled trial of rhesus-human reassortant rotavirus vaccine for prevention of severe rotavirus gastroenteritis. Lancet. 1997 Oct;350(9086):1205-9. [ Links ]
11 Kapikian AZ, Chanock RM. Rotaviruses. In: Fields BN, Knipe DM, editors. Fields virology. 3rd ed. Philadelphia: Raven Publishers; 1996. Vol. 2, p. 1657-708.
12 Leite JPG, Carvalho-Costa FA, Linhares AC. Group A rotavirus genotypes and the ongoing Brazilian experience - A Review. Mem Inst Oswaldo Cruz. 2008 Dec;103(8):745-53. DOI: 10.1590/S0074-02762008000800001 [ Links ]
13 Linhares AC, Gabbay YB, Freitas RB, Travassos da Rosa ES, Mascarenhas JD, Loureiro EC. Longitudinal study of rotavirus infection among children from Belém, Brazil. Epidemiol Infect. 1989 Feb;102(1):129-45. [ Links ]
14 Linhares AC, Gabbay YB, Mascarenhas JDP, Freitas RB, Oliveira CS, Bellesi N, et al. Immunogenicity, safety and efficacy of tetravalent rhesus-human, reassortant rotavirus vaccine in Belém, Brazil. Bull World Health Organ. 1996;74(5):491-500. [ Links ]
15 Linhares AC, Lanata CF, Hausdorff WP, Gabbay YB, Black RE. Reappraisal of the Peruvian and Brazilian lower-titer tetravalent rhesus-human reassortant rotavirus vaccine efficacy trials: analysis by severity of diarrhea. Pediatr Infect Dis J. 1999 Nov;18(11):1001-6. [ Links ]
16 Linhares AC, Monção HC, Gabbay YB, Araújo VL, Serruya AC, Loureiro ECB. Acute diarrhoea associated with rotavirus among children living in Belém, Brazil. Trans R Soc Trop Med Hyg. 1983;77(3):384-90. [ Links ]
17 Linhares AC, Moura JM, Gabbay YB, Mendes PS, Mascarenhas JD, Azevedo RC. Rotavirus serotypes and electrophoretypes among children attending three pediatric hospitals in Belém, Brazil. J Trop Pediatr. 1993 Jun;39(3):137-41. [ Links ]
18 Linhares AC, Pinheiro FP, Schmetz C, Muller G, Peters D. Duovírus (rotavírus) em Belém do Pará, Brasil (nota prévia). Rev Inst Med Trop Sao Paulo. 1977 jul-ago;19(4):278-9.
19 Linhares AC, Velázquez RR, Pérez-Schael I, Sáez-Llorens X, Abate H, Espinoza F, et al. Efficacy and safety of an oral live attenuated human rotavirus vaccine against rotavirus gastroenteritis during the first 2 years of life in Latin American infants: a randomised, doubleblind, placebo-controlled phase III study. Lancet. 2008 Apr;371(9619):1181-9. [ Links ]
20 Murphy BR, Morens DM, Simonsen L, Chanock RM, La Montagne JR, Kapikian AZ. Reappraisal of the association of intussusception with the licensed live rotavirus vaccine challenges initial conclusions. J Infect Dis. 2003 Apr;187(8):1301-8. [ Links ]
21 O'Ryan M. The ever-changing landscape of rotavirus serotypes. Pediatr Infect Dis J. 2009 Mar;28(3 Suppl):S60-2. [ Links ]
22 Pereira HG, Linhares AC, Candeias JAN, Glass RI. National laboratory surveillance of viral agents of gastroenteritis in Brazil. Bull Pan Am Health Organ. 1993;27(3):224-33. [ Links ]
23 Pérez Mato S, Perrin K, Scardino D, Bégué RE. Evaluation of rotavirus vaccine effectiveness in a pediatric group practice. Am J Epidemiol. 2002 Dec;156(11):1049-55. [ Links ]
24 Pérez-Schael I, Guntiñas MJ, Pérez M, Pagone V, Rojas AM, González R, et al. Efficacy of the rhesus rotavirus-based quadrivalent vaccine in infants and young children in Venezuela. N Engl J Med. 1997 Oct;337(17):1181-7. [ Links ]
25 Simonsen L, Viboud C, Elixhauser A, Taylor RJ, Kapikian AZ. More on RotaShield and intussusception: the role of age at the time of vaccination. J Infect Dis. 2005 Sep;192 Suppl 1:S36-43. [ Links ]
26 Staat MA, Cortese MM, Bresee JS, Bégué RE, Vitek C, Rhodes P, et al. Rhesus rotavirus vaccine effectiveness and factors associated with receipt of vaccine. Pediatr Infect Dis J. 2006 Nov;25(11):1013-8. [ Links ]
27 Tate JE, Curns AT, Cortese MM, Weintraub ES, Hambidge S, Zangwill KM, et al. Burden of acute gastroenteritis hospitalizations and emergency department visits in US children that is potentially preventable by rotavirus vaccination: a probe study using the now-withdrawn RotaShield vaccine. Pediatrics. 2009 Mar;123(3):744-9. [ Links ]
28 Vesikari T, Karvonen A, Forrest BD, Hoshino Y, Chanock RM, Kapikian AZ. Neonatal administration of rhesus rotavirus tetravalent vaccine. Pediatr Infect Dis J. 2006 Feb;25(2):118-22. [ Links ]
29 Vesikari T, Matson DO, Dennehy P, Van Damme P, Santosham M, Rodriguez Z, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine. N Engl J Med. 2006 Jan;354(1):23-33. [ Links ]
30 World Health Organization. Rotavirus vaccines. Wkly Epidemiol Rec. 2007 Aug;82(32):285-95.
 Correspondência/Correspondence/Correspondencia:
Correspondência/Correspondence/Correspondencia:
Consuelo Silva de Oliveira
Instituto Evandro Chagas, Seção de Virologia
Rodovia BR316, km 7, s/no, Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
E-mail:consuelooliveira@iec.pa.gov.br
Recebido em/Received/Recibido en: 31/07/2009
Aceito em/Accepted/Aceito en: 24/09/2009











 texto em
texto em 

