Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.2 Ananindeua June 2010
http://dx.doi.org/10.5123/S2176-62232010000200012
ARTIGO ORIGINAL
Caracterização genética parcial do hantavírus Seoul em ratazanas provenientes de Buenos Aires, Argentina, e geração de um antígeno a partir da nucleoproteína recombinante do vírus Seoul
Paula Julieta PadulaI; Valeria Paula MartínezI; Gerardo Rubén CuetoII; Regino CaviaII; Olga Virginia SuárezII
IDepartamento de Virología, Instituto Nacional de Enfermedades Infecciosas, Administración
Nacional de Laboratorios e Institutos de Salud "Dr. Carlos G. Malbrán",
Buenos Aires, Argentina
IILaboratorio de Ecología
de Roedores, Departamento de Ecología Genética y Evolución,
Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Buenos
Aires, Argentina
Endereço para
correspondência
Correspondence
Dirección para correspondencia
Título original: Partial genetic characterization of Seoul hantavirus in rats from Buenos Aires City, Argentina, and generation of a Seoul recombinant nucleoprotein antigen. Traduzido por: André Monteiro Diniz.
RESUMO
A febre hemorrágica com síndrome renal (FHSR) é uma doença grave, caracterizada por febre, hemorragia, falência renal e trombocitopenia. Pelo menos sete hantavírus causam a FHSR: Hantaan, Seoul (SEOV) (de distribuição global), Dobrava-Belgrade, Saaremaa, Amur, Thailand e Puumala. Para investigar a epidemiologia da FHRS e a transmissão viral na Argentina, criamos um plasmídio procariótico que "codifica" a nucleoproteína recombinante do vírus SEOV de 430 aminoácidos. Após a expressão, a nucleoproteína recombinante foi testada como antígeno para uso em ensaio imunoenzimático (ELISA) para diagnóstico da infecção. Para determinar o nível atual de transmissão viral em populações de ratos-marrons ou ratazanas (Rattus norvegicus) capturadas na cidade de Buenos Aires, Argentina, testamos tecidos de ratos selecionados para serem sorologicamente positivos para o vírus SEOV, e o seu genoma viral foi detectado após submetido a RT-PCR utilizando primers específicos para dois fragmentos de proteínas Gn e Gc codificadas pelo segmento M. O genoma viral foi detectado em 11 das 21 ratazanas soropositivas (52,4%), previamente capturadas em dois parques. A análise sequencial de uma região gênica (333 nt) do segmento M "codificador" da proteína Gc apresentou 97% e 96% de similaridade com as cepas de SEOV coletadas em Baltimore e no Brasil, respectivamente. Os dados genéticos levantados confirmam a informação de que há uma diversidade muito pequena entre as cepas do vírus SEOV.
Palavras-chave: Hantavirus; Vírus Seul; Ratos; Células Procarióticas; Proteínas Recombinantes; ELISA.
INTRODUÇÃO
Os hantavírus (família Bunyaviridae, gênero Hantavírus) são vírus transmitidos por roedores que causam duas graves doenças. Na Eurásia, a febre hemorrágica com síndrome renal (FHSR) é uma doença infecciosa grave causada por pelo menos quatro hantavírus antigenicamente e geneticamente distintos classificados por diferentes sorotipos: Hantaan (HTNV), Seoul (SEOV), Dobrava/Belgrado (DOBV), e Puumala (PUUV)21. Nas Américas, os hantavírus associados à sigmodontina, como o vírus Sin Nombre (SNV), na América do Norte, e o vírus Andes (ANDV), na América do Sul, causam síndrome pulmonar por hantavírus17,14. O seu genoma de RNA apresenta cadeia tripla, com segmentos de fita simples de polaridade negativa, que "codificam" a RNA polimerase dependente de RNA, duas glicoproteínas emergindo do envelope (Gn e Gc) e uma proteína de nucleocapsídeo (NP)20.
Na natureza, cada hantavírus tem como reservatório predominante roedores de diferentes espécies, e as doenças resultantes de infecções por esses vírus estão confinadas à região correspondente à distribuição de seu hospedeiro roedor22. No entanto, como as espécies do gênero Rattus são cosmopolitas, o vírus SEOV tem o potencial de causar a doença em humanos no mundo inteiro devido à distribuição dos seus hospedeiros infectados, ratos-pretos (R. rattus) e ratazanas ou ratos-marrons (R. novergicus)13, pelo transporte internacional de mercadorias. Atualmente, existem poucos relatos de casos confirmados de infecções humanas por SEOV fora do continente asiático, incluindo ocorrências nos EUA7 e no Brasil9. Até a presente data, o registro de FHSR resultantes da infecção por SEOV tem sido restrita principalmente aos países asiáticos19. Em Buenos Aires, o SEOV tem sido detectado sorologicamente em ratazanas desde 198512,23,26; entretanto, nenhum caso de FHSR causada por SEOV foi registrado23. Recentemente, um estudo acerca da soroprevalência da infecção por SEOV em ratazanas da Cidade de Buenos Aires revelou uma positividade de 11,9%2, porém o genoma viral não foi caracterizado.
Devido à natureza altamente patogênica dos hantavírus, sua replicação lenta e sua baixa e variável produtividade em cultura de células, proteínas recombinantes de hantavírus têm sido produzidas para utilização como antígenos em testes sorológicos, incluindo testes para SEOV10,27,25,5,4,18,1.
Nesta pesquisa, apresentamos a primeira evidência genética de SEOV em ratazanas na Cidade de Buenos Aires, Argentina. Criamos também um antígeno para a proteína de nucleocapsídeo recombinante de SEOV (rNP) para uso em testes sorológicos.
MATERIAIS E MÉTODOS
ANIMAIS CAPTURADOS EM AMBIENTE SELVAGEM
De 2003 a 2005, ratos selvagens foram capturados em diversas localidades na Cidade de Buenos Aires, Argentina, tais como parques urbanos com mais de 20 ha, áreas residenciais urbanas com alta densidade populacional e favelas. Durante este estudo, 151 ratazanas e 33 ratos-pretos foram capturados, em um total de 14,088 armadilhas noturnas2.
Amostras de sangue de todos os espécimes capturados foram coletadas via punção cardíaca e utilizadas para análise sorológica. Amostras de tecido do pulmão, fígado e rim foram removidas de cada roedor e armazenada em nitrogênio líquido até o momento do teste.
CLONAGEM, EXPRESSÃO E PURIFICAÇÃO DO RNP DO VÍRUS SEOV
Para a clonagem, usamos o vetor pGEM-T e a cepa de Escherichia coli DH5α cultivada em meio Luria-Bertani. O estoque viral de SEOV Sapporo de cepas de ratos (gentilmente fornecido por Jay Hooper e Connie Schmaljohn, do United States Army Medical Research Institute of Infectious Diseases, Fort Detrick, Frederick, MD) foi amplificado em células Vero, e o RNA viral foi extraído do sobrenadante de células. Para gerar um plasmídeo contendo a ORF completa da proteína N, realizamos uma RT-PCR com primers sintetizados para conter os sítios de restrição, ocorrendo o imediato anelamento para cima do códon de iniciação N e imediatamente para baixo no códon de interrupção N. O plasmídeo pGEM-T ligado com o cDNA foi transformado em E. coli DH5α.
Para a expressão da proteína recombinante, utilizamos o pRSET B (Invitrogen Life Technologies) para transformar o plasmídeo na cepa de E. coli BL21(DE3), seguindo as orientações do fabricante, e ajustamos para mutantes resistentes a ampicilina. Após a lise celular e a centrifugação, o sobrenadante foi purificado por meio de cromatografia de afinidade com Ni. As proteínas purificadas foram analisadas por eletroforese em gel de poliacrilamida 10% com dodecilsulfato de sódio (SDS-PAGE) e glicina.
ENSAIO IMUNOADSORVENTE ENZIMA-ASSOCIADO
Foi realizado um ensaio imunoadsorvente enzima-associado (ELISA) em amostras de sangue total para detectar anticorpos IgG, como descrito anteriormente para o vírus ANDV18. Logo em seguida, as placas foram cobertas durante a noite a 4o C com rNP de SEOV e antígeno recombinante controle ou células Vero E6 infectadas com SEOV e células Vero E6 não infectadas. As amostras foram diluídas a 1:200 em solução salina tamponada com fosfato com Tween 20 e adicionadas em duplicata a poços revestidos com antígeno contendo células Vero E6 infectadas ou não infectadas. As placas foram lavadas com a mesma solução tampão e incubadas a 37o C por 1 h com anticorpos anti-imunoglobulina G de rato conjugado à fosfatase alcalina (H + L; Kirkegaard and Perry Laboratories, Gaithersburg, MD). As placas foram incubadas por 1 h a 37o C, e foi adicionado o substrato para peroxidase. A densidade ótica (DO) foi de 405 nm, e a DO média para cada grupo de duplicatas de Vero E6 não infectadas ou antígeno recombinante controle foi subtraída da DO média de cada grupo de duplicatas de Vero E6 infectadas ou antígenos rNP de SEOV, respectivamente. As amostras foram consideradas positivas quando a diferença entre os valores de DO foi maior de 0,3. Devido ao fato de os hantavírus transmitidos por roedores da família Sigmodontinae terem sua circulação reportada em Buenos Aires e áreas vizinhas, também analisamos amostras de soro de ratos com valores baixos de ELISA-SEOV, utilizando antígeno recombinante de ANDV, como previamente descrito18.
O título foi definido como a recíproca da maior diluição cuja DO alcançava 0,3 ou mais.
ISOLAMENTO DO RNA, AMPLIFICAÇÃO, SEQUENCIAMENTO E ANÁLISE DE DNA
O RNA total extraído de tecidos de pulmão ou rim dos roedores com o reagente Trizol (Invitrogen Life Technologies®) foi submetido à transcrição reversa utilizando AMV (Promega Corp.®) e primers específicos, de acordo com as recomendações do fabricante. Os procedimentos de RT-PCR hemi-nested e single round visaram amplificar dois fragmentos parciais do RNA hantaviral do segmento M. Para amplificar o fragmento Gn da área gênica 437 nt (6 a 442), utilizamos os primers P0 (5'-TAGTAGTAGACTCCGC-3') com P10 (5'- GTTTGATTACAGGCCAGATCATAACA-3') para a primeira etapa e P57 (5'-GACTCCGCAAGAAGAAGC-3') com P10 para a segunda etapa. Uma sequência de 385 nt foi obtida. Para a análise do fragmento Gc (333 nt de 1984 a 2316), foram sequenciadas do ponto de vista genético24. Todas as posições do segmento genômico referiram-se à cepa do vírus SEOV Sapporo. Os produtos da PCR foram separados por meio de eletroforese em gel de agarose, corada com brometo de etídio e visualizados sob luz UV. Os produtos foram purificados e sequenciados diretamente utilizando um sequenciador automático de DNA (ABI PRISM® 3100-Avant Genetic Analyzer System, Perkin-Elmer, USA).
Os números de acesso ao Genbank das cepas de referência previamente publicadas são: AF324901 (ANDV); AF00578 vírus Laguna Negra (LNV); L25783 (SNV); M29979 (PUUV); NC005228 (TULV); L33685 (DOBV); M14627 (HTNV); SEOV cepa U00151 (Baltimore), SEOV cepa U00460 (Brasil), cepas chinesas de SEOV: DQ133505 (BjHD01), YS32 EF205404 (YS32), AF035832 (HB55), EF2053277 (HLD65), SEOV adquirido em laboratório AF458104 (IR461); SEOV cepa U00465 (Houston), SEOV cepa M34882 (Sapporo), SEOV cepa U00463 (Egito).
RESULTADOS
CARACTERIZAÇÃO E ANÁLISE EXPRESSO EM BACTÉRIAS DE RNP DO SEOV
Utilizamos um vetor pRSET B em sistema induzível BL21, no qual o rNP do vírus SEOV de 430 aminoácidos expressa e purifica muito bem. O sequenciamento nucleotídico do produto da expressão por vetor revelou a série de bases esperada. A SDS-PAGE revelou um rNP altamente purificado, com um peso molecular de cerca de 51 kDa. A produção de rNP de SEOV por 500 mL de células de E. coli variou de 3 a 4 mg de proteína.
O rNP recém-gerado foi avaliado com vistas ao seu uso como um antígeno para diagnóstico em testes IgG-ELISA. Os padrões de reatividade do rNP corresponderam aos de vírus autênticos de cultura de células Vero E6 (dados não apresentados). Para analisar a reatividade cruzada de vírus ANDV e SEOV, amostras de soro de ratos foram analisadas em ELISA utilizando-se ambos os antígenos de rNP. O padrão de reatividade do rNP do vírus ANDV se mostrou diferente do rNP do vírus SEOV (Figura 1). Os valores de DO variaram nas diferentes amostras na diluição sérica (1:200) utilizada para os valores de endpoint de titulação. As amostras de soro com DO baixa não puderam ser detectadas por rNP do ANDV, enquanto que em amostras com alta titulação de IgG, os rNPs não puderam diferenciar sorologicamente as infecções causadas pelo ANDV das causadas por SEOV. Três amostras positivas de SOEV obtidas por meio de RT-PCR, com altos valores de DO não puderam ser distinguidas para os rNPs de ANDV e SEOV.
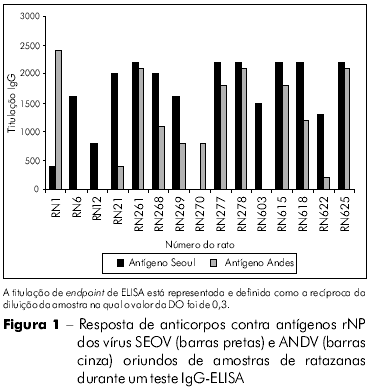
TRIAGEM DE ROEDORES PARA A PRESENÇA DE GENOMA VIRAL
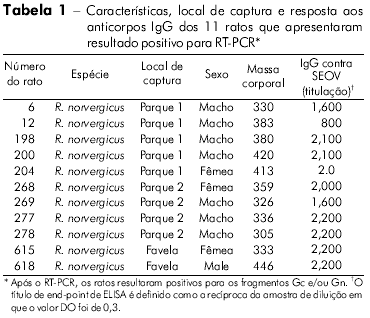
Dos 151 ratos capturados em Buenos Aires, 21 ratazanas (13,9 %) foram soropositivos para o antígeno rNP de SEOV. Os ratos sorologicamente positivos foram testados para SEOV por RT-PCR usando primers específicos de 2 fragmentos do segmento M, que codifica as proteínas Gn e Gc. O genoma viral foi detectado nos pulmões de 11 (52,4%) dos 21 ratos soropositivos capturados em dois parques (Tabela 1). Oito dos 11 ratos eram do sexo masculino (72,7%), e todos eles apresentaram resposta adequada aos anticorpos. Como esperado, nenhum produto foi amplificado dos órgãos dos seis roedores soronegativos. Em nossos testes ELISA, duas das ratazanas apresentaram alta titulação contra o antígeno de ANDV e titulação muito baixa contra o antígeno rNP de SEOV. Não sabemos se estes ratos haviam tido contato prévio com roedores Oligoryzomys spp. infectados. Infelizmente, nenhum genoma viral foi amplificado desses animais.
COMPARAÇÃO GENÉTICA E ANÁLISE FILOGENÉTICA
Dentre os 11 produtos amplificados de Gn, seis cDNAs representativos de dois locais de captura foram sequenciados. A comparação pareada de sequências de um fragmento Gn (385 nt) entre três ratazanas (RN 12, RN 198 e RN 200) de um parque, e três de um outro parque (RN204, RN277 e RN278) apresentou 100% de identidade entre os três ratos de cada grupo (Tabela 2). Ratos dos dois parques (RN12 e RN277) aprensentaram uma identidade de nucleotídeos de 96,3%. A comparação entre as sequências de aminoácidos deduzidas das seis ratazanas revelou 100% de identidade. A comparação dos fragmentos Gn dos ratos de ambos os grupos com outros infectados com SEOV apresentou a maior taxa de identidade nucleotídica com as cepas chinesas IR461 e HB55 (AF458104 e AF035832). As comparações sequenciais de um fragmento Gc 333-nt de uma ratazana proveniente da Argentina (RN12) com outras cepas de SEOV apresentaram maiores taxas de identidades nucelotídicas com as cepas provenientes de Baltimore, EUA, e do Brasil (97% e 96%, respectivamente; Tabela 3). As análises filogenéticas baseadas no fragmento Gc 333-nt gerado pelo método de análise parcimoniosa colocaram a cepa RN12 do vírus SEOV de Buenos Aires juntamente com as cepas provenientes de Baltimore e Brasil (Figura 2).
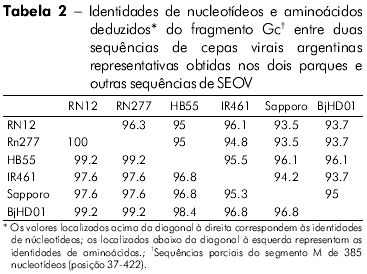
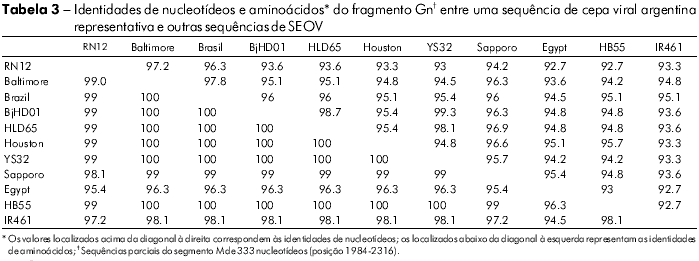
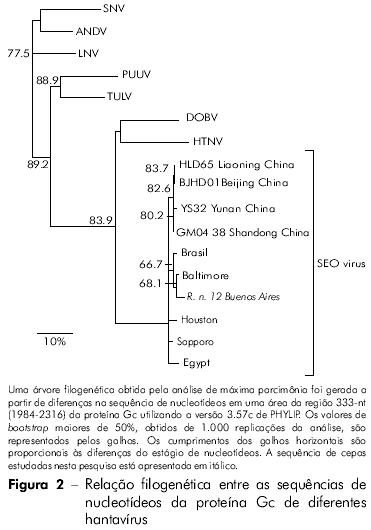
DISCUSSÃO
Neste estudo registramos pela primeira vez a detecção de material genético do vírus SEOV em ratos soropositivos capturados na Cidade de Buenos Aires, Argentina. A presença de SEOV em Buenos Aires não causou surpresa, pois estudos anteriores já haviam reportado uma soropositividade para SEOV de 31%23. Seus hospedeiros, R. norvegicus e R. rattus, são encontrados no país e a distribuição deste vírus é registrada em todo o mundo. Nenhum rato-preto soropositivo foi detectado; não foi verificada uma distribuição igual de ratos soropositivos nos 5 diferentes sítios pesquisados na Cidade de Buenos Aires, onde as taxas de soroprevalência variaram entre 0% e 26,1%2. O teste sorológico é uma medida indireta da infecção viral, e é afetada de forma variável pelo status imunológico do hospedeiro; entretanto, ele é o método mais frequentemente utilizado para avaliar a infecção por hantavírus no sangue de roedores.
Anteriormente, demonstramos que o teste ELISA baseado no rNP de ANDV apresenta bons resultados para a detecção de anticorpos vírus-específicos em pacientes e roedores com ANDV. Nesta pesquisa, o ensaio sorológico foi desenvolvido para o uso no diagnóstico de SEOV. Demonstramos que a antigenicidade do rNP completo do SEOV era forte o suficiente para ser utilizado em um ensaio imunoenzimático. O ELISA baseado no uso deste antígeno forneceu resultados que corroboraram com os resultados obtidos utilizando fluidos de cultura de células infectadas com o SEOV. O ensaio poderia detectar a reatividade dos anticorpos IgG em ratos e nas amostas de pacientes controle com SEOV de outras partes do mundo (dados não apresentados). Também analisamos as amostas de soro de ratos com valores baixos de ELISA para SEOV utilizando o antígeno rNP do ANDV, como previamente descrito18, uma vez que há registros de vírus cujos hospedeiros sejam da subfamília Sigmodontinae circulem na cidade de Buenos Aires15. Em um estudo latitudinal realizado em áreas naturais do Chile continental, de 178 ratos-pretos analisados, apenas um foi reativo em um teste sorológico ELISA baseado em ANDV16.
A detecção de anticorpos não indica necessariamente que o roedor esteja infectado ou infeccioso, mas fornece evidência indireta do atual nível de transmissão do vírus. Em áreas onde ratos dividem o habitat com animais do gênero Sigmodontinae, como nas áreas periféricas de Buenos Aires, resultados sorológicos positivos poderiam representar um spillover acidental de vírus semelhantes ao ANDV (AND-lifce). Consequentemente, o soro de roedores com anticorpos contra outros hantavírus patogênicos ou não patogênicos podem levar a resultados positivos (i.e., reação cruzada) no ensaio para o vírus SEOV. Por esta razão, a detecção direta de ácido nucleico por RT-PCR surgiu como o método de escolha para vários patógenos virais. Amplificações bem-sucedidas do genoma viral de 11 ratos soropositivos foram obtidas. Nossos resultados confirmam a hipótese de que o SEOV esteja circulando na Cidade de Buenos Aires. Este estudo constitui uma prova direta da infecção viral atual, e aponta uma taxa elevada de ratos infectados entre populações de ratazanas soropositivos na cidade, haja vista que mais da metade dos ratos soropositivos abrigavam genomas virais detectáveis. É interessante observar que a cepa do vírus SEOV recentemente descrita em Buenos Aires é muito próxima das cepas do tipo selvagem de Baltimore, EUA, e do Brasil, ambas associadas à ratazana. O porto de Buenos Aires responde por 80% das importações argentinas. Aproximadamente 50% das ratazanas do sexo masculino em Baltimore, Maryland, estão infectados com SEOV3,6. Estudos com ratazanas devidamente marcados e soltos em Baltimore demonstram que os ratos do sexo masculino feridos durante a captura são mais propensos a se infectar com SEOV durante a recaptura do que os que não se feriram entre as capturas6. Em nosso estudo, 72,7% dos ratos com genoma do SEOV eram do sexo masculino, embora as feridas tenham sido raramente observadas nos ratos capturados. Entre as populações naturais de ratazanas, os machos com ferimentos mais graves também são mais propensos a disseminar o SEOV e apresentar o RNA viral em tecidos-alvos, como os pulmões, do que os machos sem lesões ou com lesões menos severas8.
Há registros de que o SEOV tem causado enfermidades em humanos menos grave do que o HTNV e o DOBV, mas ainda é responsável por 25% dos casos de HFRS na Ásia11. Não há registros de infecções por SEOV na Argentina. A presença de ratazanas com anticorpos contra o vírus SEOV é apenas um dos vários fatores a serem considerados quando avaliarmos os riscos das FHSR. Aspectos relacionados aos agentes, reservatórios, meio ambiente e hospedeiros interagem de modo a determinar a probabilidade de uma transmissão efetiva, bem como de infecção e doença causadas pelo vírus. Os aspectos relacionados ao agente incluem a cepa viral e a dose infectante mínima do hantavírus em questão. Os fatores referentes ao reservatório incluem a infecção ativa (em oposição a evidências sorológicas de infecções anteriores), a concentração de vírus excretado, a densidade de roedores e a frequência e disseminação das excreções. Todos esses fatores devem ser levados em consideração quando se for avaliar a importância dos dados a respeito da sorologia dos roedores e quando for elaborado um planejamento preventivo apropriado. Portanto, a importância da detecção do RNA dos hantavírus em ratos enquanto agentes causadores das FHSR em Buenos Aires permanece incerta, e são necessárias novas pesquisas sorológicas com indivíduos saudáveis e, ainda, estudos ambientais. Contudo, nossos resultados indicam que são necessárias estratégias de controle para reduzir os riscos de infecção de humanos por patógenos transmitidos por ratos.
APOIO FINANCEIRO
Esta pesquisa foi parcialmente financiada pelo Governo da Cidade de Buenos Aires.
REFERÊNCIAS
1 Billecocq A, Coudrier D, Boue F, Combes B, Zeller H, Artois M, et al. Expression of the nucleoprotein of the Puumala virus from the recombinant Semliki Forest virus replicon: characterization and use as a potential diagnostic tool. Clin Diagn Lab Immunol. 2003 Jul;10(4):658-63. [ Links ]
2 Cueto GR, Cavia R, Bellomo C, Padula PJ, Suarez OV. Prevalence of hantavirus infection in wild Rattus norvegicus and R. rattus populations of Buenos Aires City, Argentina. Trop Med Int Health. 2008 Jan;13(1):46-51. [ Links ]
3 Easterbrook JD, Kaplan JB, Glass GE, Pletnikov MV, Klein SL. Elevated testosterone and reduced 5-HIAA concentrations are associated with wounding and hantavirus infection in male Norway rats. Horm Behav. 2007 Nov;52(4):474-81. [ Links ]
4 Elgh F, Lundkvist A, Alexeyev OA, Stenlund H, Avsic-Zupanc T, Hjelle B, et al. Serological diagnosis of hantavirus infections by an enzyme-linked immunosorbent assay based on detection of immunoglobulin G and M responses to recombinant nucleocapsid proteins of five viral serotypes. J Clin Microbiol. 1997 May;35(5):1122-30. [ Links ]
5 Feldmann H, Sanchez A, Morzunov S, Spiropoulou CF, Rollin PE, Ksiazek TG, et al. Utilization of autopsy RNA for the synthesis of the nucleocapsid antigen of a newly recognized virus associated with hantavirus pulmonary syndrome. Virus Res. 1993 Dec;30(3):351-67. [ Links ]
6 Glass GE, Childs JE, Korch GW, LeDuc JW. Association of intraspecific wounding with hantaviral infection in wild rats (Rattus norvegicus). Epidemiol Infect. 1988 Oct;101(2):459-72. [ Links ]
7 Glass GE, Watson AJ, LeDuc JW, Childs JE. Domestic cases of hemorrhagic fever with renal syndrome in the United States. Nephron. 1994;68(1):48-51. [ Links ]
8 Hinson ER, Shone SM, Zink MC, Glass GE, Klein SL. Wounding: the primary mode of Seoul virus transmission among male Norway rats. Am J Trop Med Hyg. 2004 Mar;70(3):310-7. [ Links ]
9 Iversson LB, Rosa APA, Travassos da Rosa MDB, Lomar AV, Sasaki MGM, LeDuc JW. Human infection by hantavirus in southern and southeastern Brazil. Rev Assoc Med Bras. 1994 Apr-Jun;40(2):85-92. [ Links ]
10 Kallio-Kokko H, Vapalahti O, Hedman K, Brummer-Korvenkontio M, Vaheri A. Puumala virus antibody and immunoglobulin G avidity assays based on a recombinant nucleocapsid antigen. J Clin Microbiol. 1993 Mar;31(3):677-80. [ Links ]
11 Kim YS, Ahn C, Han JS, Kim S, Lee JS, Lee PW. Hemorrhagic fever with renal syndrome caused by the Seoul virus. Nephron. 1995;71(4):419-27. [ Links ]
12 LeDuc JW, Smith GA, Pinheiro FP, Vasconcelos PFC, Rosa EST, Maiztegui JI. Isolation of a Hantaan-related virus from Brazilian rats and serologic evidence of its widespread distribution in South America. Am J Trop Med Hyg. 1985 Jul;34(4):810-5. [ Links ]
13 Lee HW. Hemorrhagic fever with renal syndrome (HFRS). Scand J Infect Dis Suppl. 1982;36:82-5.
14 Lopez N, Padula P, Rossi C, Lazaro ME, Franze-Fernandez MT. Genetic identification of a new hantavirus causing severe pulmonary syndrome in Argentina. Virology. 1996 Jun;220(1):223-6. [ Links ]
15 Martinez VP, Colavecchia SB, Garcia Alay M, Suzuki B, Trincheri A, Busto S, et al. Hantavirus pulmonary syndrome in Buenos Aires Province. Medicina (B Aires). 2001;61(2):147-56. [ Links ]
16 Medina RA, Torres-Perez F, Galeno H, Navarrete M, Vial PA, Palma RE, et al. Ecology, genetic diversity, and phylogeographic structure of Andes virus in humans and rodents in Chile. J Virol. 2009 Mar;83(6):2446-59. [ Links ]
17 Nichol ST, Spiropoulou CF, Morzunov S, Rollin PE, Ksiazek TG, Feldmann H, et al. Genetic identification of a hantavirus associated with an outbreak of acute respiratory illness. Science. 1993 Nov;262(5135): 914-7. [ Links ]
18 Padula P, Rossi CM, Della Valle MO, Martínez PV, Colavecchia SB, Edelstein A, et al. Development and evaluation of a solid-phase enzyme immunoassay based on Andes hantavirus recombinant nucleoprotein. J Med Microbiol. 2000 Feb;49(2):149-55. [ Links ]
19 Reynes JM, Soares JL, Hue T, Bouloy M, Sun S, Kruy SL, et al. Evidence of the presence of Seoul virus in Cambodia. Microbes Infect. 2003 Jul;5(9):769-73. [ Links ]
20 Schmaljohn CS, Hasty SE, Harrison SA, Dalrymple JM. Characterization of Hantaan virions, the prototype virus of hemorrhagic fever with renal syndrome. J Infect Dis. 1983 Dec;148(6):1005-12. [ Links ]
21 Schmaljohn CS, Hasty SE, Dalrymple JM, LeDuc JW, Lee HW, von Bonsdorff CH, et al. Antigenic and genetic properties of viruses linked to hemorrhagic fever with renal syndrome. Science. 1985 Mar;227(4690):1041-4.
22 Schmaljohn CS, Lee HW, Dalrymple JM. Detection of hantaviruses with RNA probes generated from recombinant DNA. Arch Virol. 1987;95(3-4):291-301. [ Links ]
23 Seijo A, Pini N, Levis S, Coto H, Deodato B, Cernigoi B, et al. Study of hantavirus seoul in a human and rodent population from a marginal area in Buenos Aires City. Medicina (B Aires). 2003;63(3):193-6. [ Links ]
24 Xiao SY, Leduc JW, Chu YK, Schmaljohn CS. Phylogenetic analyses of virus isolates in the genus Hantavirus, family Bunyaviridae. Virology. 1994 Jan;198(1):205-17.
25 Wang M, Rossi C, Schmaljohn CS. Expression of non-conserved regions of the S genome segments of three hantaviruses: evaluation of the expressed polypeptides for diagnosis of haemorrhagic fever with renal syndrome. J Gen Virol. 1993 Jun;74(Pt 6):1115-24. [ Links ]
26 Weissenbacher MC, Merani MS, Hodara VL, Villafane G, Gajdusek DC, Chu YK, et al. Hantavirus infection in laboratory and wild rodents in Argentina. Medicina (B Aires). 1990;50(1):43-6. [ Links ]
27 Zoller L, Yang S, Gott P, Bautz EK, Darai G. Use of recombinant nucleocapsid proteins of the Hantaan and nephropathia epidemica serotypes of hantaviruses as immunodiagnostic antigens. J Med Virol. 1993 Mar;39(3):200-7. [ Links ]
 Correspondência
/ Correspondence / Correspondencia:
Correspondência
/ Correspondence / Correspondencia:
Paula Julieta Padula Departamento de Virología,
Instituto Nacional de Enfermedades Infecciosas,
A.N.L.I.S. "Dr. Carlos G. Malbrán"
Av. Vélez Sarsfield 563 (1281)
Buenos Aires-Argentina
E-mail:ppadula@gmail.com
Phone/Fax: 5411 - 43013146
Recebido em / Received / Recibido en: 27/8/2009
Aceito em / Accepted / Aceito en: 30/3/2010










 text in
text in 

