Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.1 n.2 Ananindeua jun. 2010
http://dx.doi.org/10.5123/S2176-62232010000200017
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Coinfecção provocada pelos vírus da imunodeficiência humana e hepatite C (HIV-1/HCV): uma casuística da Amazônia brasileira*
Coinfection caused by the human immunodeficiency virus and hepatitis C virus (HIV-1/HCV): a case study in the Brazilian Amazon
Coinfección provocada por los virus de inmunodeficiencia humana y hepatitis C (VIH-1/VHC): una casuística de la Amazonía brasileña
Ivanete do Socorro Abraçado AmaralI; Rita Catarina Medeiros SousaII; Lizomar de Jesus Maués Pereira MóiaIII; Maria Silvia de Brito BarbosaIII; Esther Castello Branco Mello MirandaIII; Simone Regina Sousa da Silva CondeIV; Zilene Lameira de MedeirosV; Samia DemachkiV; Marialva Tereza AraujoV; Elisabete Maria de Figueiredo BritoVI; Manoel do Carmo Pereira SoaresVI
IFundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil. Universidade do Estado do Pará, Belém, Pará, Brasil. Núcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
IINúcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
IIIFundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil Universidade do Estado do Pará, Belém, Pará, Brasil. Universidade Federal do Pará, Belém, Pará, Brasil
IVFundação Santa Casa de Misericórdia do Pará, Belém, Pará, Brasil. Universidade Federal do Pará, Belém, Pará, Brasil
VUniversidade Federal do Pará, Belém, Pará, Brasil
VISeção de Hepatologia, Instituto Evandro Chagas/SVS/MS, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
INTRODUÇÃO: Com o advento da terapia antirretroviral de alta atividade em 1996, a doença hepática tornou-se causa importante de morbidade e mortalidade em pessoas infectadas pelo vírus da imunodeficiência humana-1 (HIV-1).
OBJETIVO: Descrever os aspectos demográficos e laboratoriais de 62 pacientes coinfectados com o vírus da imunodeficiência humana e da hepatite C (HIV-1/HCV).
MÉTODO: Estudo transversal, incluindo pacientes portadores do HIV, confirmados sorologicamente (ELISA + Imunofluorescência indireta ou Western Blot), com anti-HCV positivos pelo teste de ELISA confirmados por RT-PCR, atendidos no ambulatório de fígado da Fundação Santa Casa de Misericórdia do Pará no período de agosto de 2004 até abril de 2008.
RESULTADOS: Foram atendidos 49 (79%) indivíduos do gênero masculino e 13 indivíduos do gênero feminino, com mediana de idade de 42,6 anos, solteiros (66,1% n = 41), heterossexuais (59,7%, n = 37), bissexuais (27,4%, n = 17), homem que faz sexo com homem HSH (12,9% n = 8); contagem de linfócitos T CD4+ com mediana de 327 células/mm3, carga viral plasmática do HIV com mediana de 2,54 log10 HIV-RNA cópias/mL, carga viral do HCV (HCV-RNA) de 5,90 log10 UI/mL. O genótipo 1 do HCV foi encontrado em 60,87%. A biópsia hepática foi realizada em 41 (66,12%) pacientes, tendo sido observada a seguinte classificação METAVIR: F0 (12%), F1 (24,4%), F2 (32%), F3 (17%) e F4 (14,6%).
CONCLUSÃO: Os pacientes eram predominantemente solteiros,com carga viral do HCV elevada, apresentavam fibrose de moderada a severa em mais de 50% dos casos sem alterações laboratoriais significativas.
Palavras-chave: HIV; Hepacivirus; Hepatite C Crônica; ELISA; Estudos Transversais.
ABSTRACT
INTRODUCTION: Since highly active antiretroviral therapy was developed in 1996, liver injury has become an important cause of morbidity and mortality in individuals infected by the human immunodeficiency virus-1 (HIV-1).
OBJECTIVE: To report the demographic and laboratory findings of 62 patients coinfected with HIV-1/HCV.
METHODS: This cross-sectional study analyzed HIV patients, confirmed serologically by ELISA and indirect immunofluorescence or Western Blot, with positive anti-HCV by ELISA and confirmed by RT-PCR. These patiens were treated at the Liver Department of the Fundação Santa Casa de Misericórdia do Pará from August 2004 to April 2008.
RESULTS: A total of 49 (79%) male and 13 female patients were analyzed. Their age median was 42.6 years and they were single (66.1%, n=41), heterosexual (59.7%, n = 37), bisexual (27.4%, n = 17), man who have sex with man MSM (12.9%, n = 8); the lymphocytes T CD4+ count median was 327 cells/mm3, HIV serum viral load median was 2.54 log10 HIV RNA copies/mL, HCV viral load (RNA-HCV) was 5.9 log10 UI/mL. The HCV genotype 1 was found in 60.87% of the patients. Forty-one (66.12%) patients were submitted to liver biopsies and the histopathology results according to METAVIR were F0 (12%), F1 (24.4%), F3 (17%), F4 (14.6%).
CONCLUSION: Patients were predominantly single, with high viral load. They presented with moderate to severe fibrosis in more than 50% of cases without significant changes in their laboratory findings.
Keywords: HIV; Hepacivirus; Hepatitis C, Chronic; Enzyme-Linked Immunosorbent Assay; Cross-Sectional Studies.
RESUMEN
INTRODUCCIÓN: Con el surgimiento de la terapia antirretroviral altamente activa en 1996, la enfermedad hepática se tornó causa importante de morbilidad y mortalidad en personas infectadas por el virus de inmunodeficiencia humana-1 (VIH-1).
OBJETIVO: Describir los aspectos demográficos y de laboratorio de 62 pacientes coinfectados con el virus de inmunodeficiencia humana y de la hepatitis C (VIH-1/VHC).
MÉTODO: Estudio transversal, incluyendo pacientes portadores de VIH, serológicamente confirmados (ELISA + Inmunofluorescencia indirecta o Western Blot), con anti-VHC positivos por el test ELISA confirmados por RT-PCR, atendidos en el ambulatorio del hígado de la Fundação Santa Casa de Misericórdia do Pará, en el período de agosto de 2004 hasta abril de 2008.
RESULTADOS: Fueron atendidos 49 (79%) individuos del género masculino y 13 individuos del género femenino, con un promedio de edad de 42,6 años, solteros (66,1% n = 41), heterosexuales (59,7%, n = 37), bisexuales (27,4%, n = 17), hombre que tiene sexo con otro hombre HSH (12,9% n = 8); conteo de linfocitos T CD4+ con promedio de 327 células/mm3, carga viral plasmática de VIH con promedio de 2,54 log10 VIH-RNA copias/mL, carga viral de VHC (VHC-RNA) de 5,90 log10 UI/mL. El genotipo 1 de VHC fue encontrado en un 60,87%. La biopsia hepática fue realizada en 41 (66,12%) pacientes, habiendo sido observada la siguiente clasificación METAVIR: F0 (12%), F1 (24,4%), F2 (32%), F3 (17%) y F4 (14,6%).
CONCLUSIÓN: Los pacientes eran predominantemente solteros, con carga viral de VHC elevada, presentaban fibrosis de moderada a severa en más de 50% de los casos sin alteraciones laboratoriales significativas.
Palabras clave: VIH; Hepacivirus; Hepatitis C Crónica; Prueba ELISA; Estudios Transversales.
INTRODUÇÃO
A utilização da terapia antirretroviral de alta atividade (highly active antiretroviral therapy – HAART) para o tratamento da infecção pelo HIV-1 a partir de 1996, aumentou consideravelmente a sobrevida dos pacientes, com expressiva redução das taxas de morbimortalidade e hospitalização por doenças oportunistas associadas à aids3,30. Entretanto, outras doenças passaram a ter papel importante na morbidade e mortalidade em portadores do HIV-1, tais como neoplasias, doenças cardiovasculares e hepatites virais, especialmente a coinfecção HIV/vírus da hepatite C (HCV)18. Alguns estudos reportam evolução mais rápida da doença com o desenvolvimento de fibrose mais acentuada, falência hepática, cirrose e carcinoma hepatocelular nestes pacientes11,29,34. Assim, estudos mostraram que a progressão da doença hepática causada pelo HCV é mais rápida em indivíduos coinfectados pelo HIV-1 do que nos portadores do HCV de modo isolado, principalmente quando há avançada imunodeficiência8. Comparado com outros vírus, o HCV é transmitido principalmente através de sangue ou derivados deste, por meio, por exemplo, de compartilhamento de agulhas e seringas contaminadas29. A prevalência da infecção pelo vírus da hepatite C é variável, podendo ser baixa como observada em doadores de sangue e alta em usuários de droga injetável35. Em indivíduos portadores do HIV-1, o comportamento sexual de alto risco, com sexo desprotegido e múltiplos parceiros, é um fator para a aquisição do HCV1,2.
OBJETIVO
Descrever aspectos demográficos e laboratoriais de 62 pacientes coinfectados por HIV/HCV, atendidos no ambulatório de fígado da Fundação Santa Casa de Misericórdia do Pará (FSCMPA).
MATERIAIS E MÉTODOS
PACIENTES
Fizeram parte do estudo 62 pacientes de ambos os sexos, com idade acima de 18 anos, portadores do HIV, confirmado sorologicamente (ELISA + Imunufluorescência indireta ou Western Blot), com anti-HCV positivo pelo teste ELISA, confirmado pelo RT-PCR, encaminhados, a partir de unidades de referência para aids, para o ambulatório de fígado da FSCMPA, no período de agosto de 2004 até abril de 2008. Foram excluídos os pacientes com positividade para o HBsAg. Este estudo teve aprovação do Comitê de Ética e Pesquisa do Hospital Universitário João de Barros Barreto.
PROCEDIMENTO DE COLETA DE SANGUE
Foram colhidos 10 mL de sangue para pesquisa dos marcadores sorológicos das hepatites B (HBsAg e Anti- HBc IgG) e C (Anti-HCV) por ELISA, e para a pesquisa de ácido nucleico (HCV-RNA), além da realização de exames hematológicos e testes bioquímicos de função hepática.
PROCEDIMENTOS DE EXAME DE LABORATÓRIO
Foram realizados exames hematológicos e bioquímicos, por auto-analisador, em todos os pacientes: hemograma, tempo e atividade protrombínica, coagulograma, dosagem sérica de aminotransferases, gama glutamil transpeptidase (GGT), fosfatase alcalina, bilirrubinas, dosagem de albumina, glicemia, ureia, creatinina, alfafetoproteína, dosagens de colesterol e de triglicerídeos. A determinação de carga viral plasmática do HIV seguiu a metodologia padrão da Rede Nacional de Carga Viral do Ministério da Saúde do Brasil, que obedece a tecnologia de amplificação termoestável do RNA viral (NucliSENS/NASBA, Organon Teknica, Holanda), sendo considerado limite mínimo de detecção 80 cópias/mL. A contagem de linfócitos T CD4+ em número absoluto de células/mm3 foi realizada utilizando citômetro de fluxo FACScan (Becton Dickinson Immunocytometry Systems, San Jose, California, USA), padrão da Rede Nacional de CD4 do Ministério da Saúde. Para detecção do anti-HCV, foi utilizado o ORTHOTM HCV v. 3.0 ELISA kit, seguindo as recomendações do fabricante. A pesquisa do HCV-RNA foi feita de modo qualitativo, utilizando o AMPLICOR® HCV v. 2.0 kit. A quantificação do HCV-RNA foi realizada por meio de kit AMPLICOR HCV MONITORTM Test, v. 2.0, aferido conforme o padrão internacional da Organização Mundial de Saúde para ensaios HCV RNA NAT. A pesquisa de genótipos do HCV foi realizada por meio de hibridização reversa (VERSANT® HCV Genotype Assay LiPA), que utiliza fitas de nitrocelulose onde são imobilizadas sondas de oligonucleotídeos da região 5' NC complementares a cada tipo/subtipo (1 a 6) do HCV.
PROCEDIMENTO DE BIÓPSIA HEPÁTICA
Realizada utilizando agulha de Trucut, dirigida com o auxílio de ultrassonografia. O material colhido foi fixado em formol a 10%, não tamponado, incluído em blocos de parafina. Após os cortes histológicos de 5 µm de espessura, estes blocos foram submetidos às colorações de Hematoxilina-Eosina (HE), Cromotrope Azul de Anilina (CAB), Reticulina de Gomori, Orceína de Shikata e Perls. A avaliação histopatológica para o diagnóstico das hepatites crônicas com avaliação da atividade necroinflamatória e estadiamento de fibrose foi feita segundo a classificação METAVIR.
ANÁLISE ESTATÍSTICA
A análise, organização e tabulação dos dados da pesquisa foram feitos com auxílio dos programas Epi InfoTM, v. 6.2, e BioStat v. 3.08. Foi realizada estatística descritiva usando mediana e erro padrão. Para todos os testes estatísticos, o nível de significância adotado foi de pvalor ≤ 0.05 (5%).
RESULTADOS
No período de agosto de 2004 a dezembro de 2008, foram atendidos no ambulatório de fígado da FSCMPA 62 pacientes coinfectados com HIV-1 e HCV. Todos os pacientes foram submetidos ao exame de RT-PCR, confirmando a positividade do exame sorológico para o HCV. Dos 62 pacientes, 85,5% (53) estavam em uso de HAART em média há 3,2 anos (ep = 7 meses). Os dados demográficos, hematológicos, testes bioquímicos de função hepática, dosagens séricas de linfócitos T CD4+ e genotipagem do HCV estão sumarizados na tabela 1. Os exames bioquímicos mostraram-se dentro dos parâmetros da normalidade, com exceção dos níveis de aminotransferases (AST e ALT) que apresentaram valores duas vezes acima do limite superior da normalidade. A carga viral plasmática do HIV apresentou mediana de 2,5410 log HIV-RNA cópias/mL (ep = 0,2), com valores mínimo e máximo encontrados variando de não detecção a 6,0 log10 HIV-RNA cópias/mL, respectivamente. Quinze pacientes (39,47%) apresentaram carga viral para o HIV indetectável pelo método utilizado no teste. A mediana da carga viral do HCV (HCV-RNA) foi de 5,90 log10 UI/mL com ep = 0,2 log10 UI/mL, com valores mínimo e máximo variando de 1,8 log10 UI/mL a 6,84 log10 UI/mL, respectivamente. Um percentual de 53,3% (16/30) apresentou HCV-RNA acima de 5,90 log10 UI/mL.
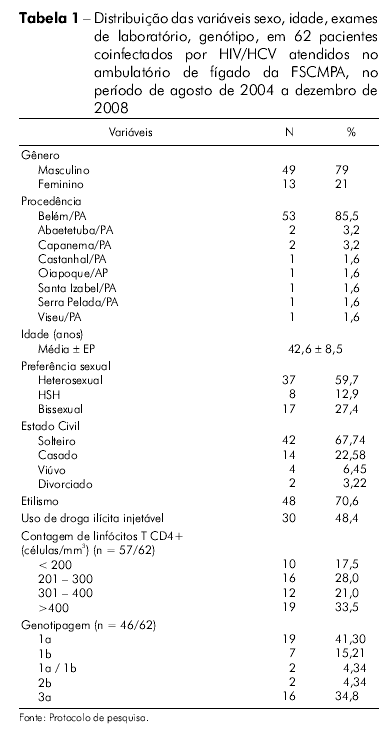
Dos 62 pacientes atendidos, 66,12% (n = 41) foram submetidos à biópsia hepática para a realização de exame histopatológico, resultados sumarizados na tabela 2.

DISCUSSÃO E CONCLUSÃO
No período pós-HAART, os pacientes com infecção pelo HIV-1 tiveram a sobrevida aumentada e a doença causada pelo HCV emergiu como doença oportunista, aumentando a morbidade e mortalidade por doenças relacionadas ao fígado nos portadores do HIV19. De fato, sabe-se que a evolução clínica para cirrose em pacientes coinfectados por HIV/HCV é mais rápida, inclusive com evolução precoce para o carcinoma hepatocelular4. A amostra estudada foi composta por indivíduos provenientes de unidades de referência para aids em Belém, Pará, procedentes, em sua maioria, de Belém e cidades do Pará. A prevalência da hepatite C em pacientes com soropositividade para HIV é variável. Em estudo realizado em Belém envolvendo 406 pacientes, a prevalência de hepatite C em indivíduos usuários de droga ilícita injetável com soropositividade para HIV foi de 83%25. Em outro estudo, envolvendo 35 pacientes coinfectados HIV/HCV de uma casuística da Amazônia, foi observada médias de idade e gênero semelhantes às encontradas neste estudo6. O percentual de indivíduos heterossexuais (61,1%) foi maior quando comparado com os bissexuais e HSH. Percentuais semelhantes foram observados em estudo conduzido por Monteiro et al25. No Brasil, com relação à infecção HIV-1, a proporção de casos de aids em adultos, de acordo com a opção sexual e categoria de exposição, no período de 1985 a 2005, aumentou entre os heterossexuais e reduziu entre os HSH24. O fato da prevalência entre heterossexuais ter aumentado pode ser explicado, em parte, pela bissexualidade não declarada ou pelo aumento dos casos em mulheres23. Os resultados dos exames bioquímicos hepáticos e dos hematológicos, não sugeriram doença hepática em estágio final na maioria dos casos. Isso talvez decorra do bom estado imunológico em que se encontrava a maioria dos pacientes. Em um estudo de coorte com 231 pacientes coinfectados por HIV-1/HCV, foi observado que a contagem de linfócitos T CD4+ abaixo de 200 células/mm3 foi forte preditor de progressão da doença hepática e morte neste grupo de pacientes31. Quando a contagem de linfócitos T CD4+ está abaixo de 100 células/mm3, os pacientes ficam mais predispostos a desenvolver insuficiência hepática13. Neste estudo, mais de 50% dos pacientes apresentou níveis de linfócitos T CD4 acima de 301 células/mm3. Os níveis de aminotransferases apresentaram-se elevados. Muitos fatores podem contribuir para esta alteração, como: o uso de cocaína; a própria infecção pelo vírus C; infecção pelo HIV; uso da terapia antirretroviral que, em pacientes coinfectados, é mais hepatotóxica; esteatose hepática; alcoolismo; e restauração imune12,32,33,7,17,27. Pacientes sem coinfecção com virus da hepatite C ou hepatite B também apresentam elevação de aminotransferases20. Os resultados de exame histopatológicos mostraram que mais de 50% dos pacientes já apresentavam fibrose de moderada a severa (F2, F3 e F4), a despeito de testes bioquímicos hepáticos. Estudos sobre fibrose hepática em pacientes coinfectados HIV/HCV mostram que a fibrose é mais pronunciada nestes indivíduos do que em pacientes monoinfectados com o HCV5,15.
Quarenta e seis amostras foram genotipadas para o HCV, sendo observada maior frequência do genótipo 1, o que reflete sua grande prevalência no Brasil26,21. Casuística brasileira demonstra distribuição genotípica semelhante28,10. Os pacientes coinfectados HIV/HCV apresentam, de um modo geral, carga viral do HCV mais elevada que em paciente monoinfectados, mesmo após a introdução do esquema antirretroviral, podendo haver, inclusive, aumento paradoxal nos títulos de HCV-RNA16,9,14, dado este observado no presente estudo. Os pacientes estudados já apresentavam grau de fibrose hepática importante, carga viral do HCV e níveis de aminotransferases elevados, fatores que podem contribuir para descompensação hepática22. Por isso é obrigatória a pesquisa do vírus da hepatite C em pacientes soropositivos para HIV, permitindo que estes pacientes tenham acesso ao tratamento anti HCV, melhorando o seu prognóstico.
REFERÊNCIAS
1 Alter MJ. Hepatitis C virus infection in the United States. J Hepatol. 1999;31 Suppl 1:88-91.
2 Ananthakrishnan AN, McGinley EL, Fangman J, Saeian K. Hepatitis C/HIV co-infection is associated with higher mortality in hospitalized patients with Hepatitis C or HIV. J Viral Hepat. In Press 2009. [ Links ]
3 Barrett L, Grant M. Brothers in harm: immunological and clinical implications of coinfection with hepatitis C virus and human immunodeficiency virus. Clin Applied Immunol Rev. 2002 Apr;2(2):93-114. [ Links ]
4 Bonacini M, Puoti M. Hepatitis C in patients with human immunodeficiency virus infection: diagnosis, natural history, meta-analysis of sexual and vertical transmission, and therapeutic issues. Arch Intern Med. 2000 Dec;160(22):3365-73. [ Links ]
5 Boyer, L. Current treatment of hepatitis C: the HIN consensus. Sociedade Brasileira de Hapatologia - Curso de Hepatologia Clínica. Pernambuco: Universitária da Federal de Pernambuco; 2003. p. 241-2.
6 Braga WSM, Castilho MC, Santos ICV, Moura MAS, Segurado AC. Low prevalence of hepatitis B virus, hepatitis D virus and hepatitis C virus among patients with human immunodeficiency virus or acquired immunodeficiency syndrome in the Brazilian Amazon basin. Rev Soc Bras Med Trop. 2006 Nov- Dez;39(6):519-22. [ Links ]
7 Braitstein P, Palepu A, Dieterich D, Benhamou Y, Montaner JS. Special considerations in the initiation and management of antiretroviral therapy in individuals coinfected with HIV and hepatitis C. AIDS. 2004 Nov;18(17):2221-34. [ Links ]
8 Bräu N, Rodriguez-Torres M, Prokupek D, Bonacini M, Giffen CA, Smith JJ, et al. Treatment of chronic hepatitis C in HIV/HCV-coinfection with interferon alpha-2b+ full-course vs. 16-week delayed ribavirin. Hepatology. 2004 Apr;39(4):989-98.
9 Chung RT, Evans SR, Yang Y, Theodore D, Valdez H, Clark R, et al. Immune recovery is associated with persistent rise in hepatitis C virus RNA, infrequent liver test flares, and is not impaired by hepatitis C virus in coinfected subjects. AIDS. 2002 Sep;16(14):1915-23. [ Links ]
10 Corvino SM, Henriques RMS, Grotto RMT, Pardini MIMC. Co-Infecção HIV/HCV em pacientes de Botucatu e região. Rev Bras Epidemiol. 2007;10(4):537-43.
11 Dieterich DT. Hepatitis C virus and human immunodeficiency virus: clinical issues in coinfection. Am J Med. 1999 Dec;107(6 Suppl 2):79-84.
12 Duarte MIS. Fígado e AIDS. In: Gayotto LCC, Alves VAF. Doenças do Fígado e Vias Biliares. São Paulo: Atheneu, 2001. p. 915-29.
13 Eyster ME, Diamondstone LS, Lien JM, Ehmann WC, Quan S, Goedert JJ. Natural history of hepatitis C virus infection in multitransfused hemophiliacs: effect of coinfection with human immunodeficiency virus. J Acquir Immune Defic Syndr. 1993 Jun;6(6):602-10. [ Links ]
14 Fishbein DA, Lo Y, Netski D, Thomas DL, Klein RS. Predictors of hepatitis C virus RNA levels in a prospective cohort study of drug users. J Acquir Immune Defic Syndr. 2006 Apr;41(4):471-6. [ Links ]
15 Fleming CA, Craven DE, Thornton D, Tumilty S, Nunes D. Hepatitis C virus and human immunodeficiency virus coinfection in an urban population: low eligibility for interferon treatment. Clin Infect Dis. 2003 Jan;36(1):97-100. [ Links ]
16 Forns X, Costa J. VHC virological assessment. J Hepatol. 2006;44 Suppl 1:S35-9.
17 Fuping G, Wei L, Yang H, Zhifeng Q, Lingyan Z, Yanling L, et al. Impact of hepatitis C virus coinfection on HAART in HIV-infected individuals: multicentric observation cohort. J Acquir Immune Defic Syndr. 2010 Jun;54(2):137-42.
18 Gonzalez SA, Talal AH. Hepatitis C virus in human immunodeficiency virus-infected individuals: an emerging comorbidity with significant implications. Semin Liver Dis. 2003 May;23(2):149-66.
19 Koike K. Co-infection of HIV with HCV and HBV. Nippon Rinsho. 2010 Mar;68(3):497-501. [ Links ]
20 Kovari H, Ledergerber B, Battegay M, Rauch A, Hirschel B, Foguena AK, et al. Incidence and risk factors for chronic elevation of alanine aminotransferase levels in HIV-infected persons without hepatitis B or C virus co-infection. Clin Infect Dis. 2010 Feb;50(4):502-11. [ Links ]
21 Lopes CL, Teles SA, Espírito-Santo MP, Lamp E, Rodrigues FP, Motta-Castro AR. Prevalence, risk factors and genotypes of hepatitis C virus infection amang drug users, Central-Western Brazil. Rev Saude Publica. 2009 Aug;43 Suppl 1:43-50. [ Links ]
22 Martin-Carbonero L, Benhamou Y, Puoti M, Berenguer J, Mallolas J, Quereda C, et al. Incidence and predictors of severe liver fibrosis in human immunodeficiency virus infected patients with chronic hepatitis C: a European collaborative study. Clin Infect Dis. 2004 Jan;38(1):128-33. [ Links ]
23 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Programa Nacional de DST e AIDS. Boletim epidemiológico - AIDS e DST. Brasília; 2004.
24 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Programa Nacional de DST e AIDS. Boletim epidemiológico - AIDS e DST. Brasília; 2005.
25 Monteiro MRCC, Nascimento MMP, Passos ADC, Figueiredo JFC. Hepatite C: prevalência e fatores de risco entre portadores do VIH/SIDA em Belém, Pará. Rev Soc Bras Med Trop. 2004;37(2):40-6.
26 Oliveira MLA, Bastos FI, Sabino RR, Paetzold U, Schreier E, Pauli G, et al. Distribution of genotypes among different exposure categories in Brazil. Braz J Med Biol Res. 1999;32(3):279-82. [ Links ]
27 Pol S. ANRS HC 02 RIBAVIC: impact of steatosis in HIVHCV co-infection. Gastroenterol Clin Biol. 2009 Mar;33 Suppl 2:S110-2. [ Links ]
28 Pontes FH, Coêlho MRCD, Vilella TAS, Silva JLA, Melo HRL. Co-infecção por HIV/HCV em hospital universitário de Recife, Brasil. Rev Saude Publica. 2009;43(1):133-9.
29 Poynard T, Yuen MF, Ratzin V, Lai CL. Viral hepatitis C. Lancet. 2003 Dez;362(9401):2095-100. [ Links ]
30 Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, Management, and Treatment of Hepatitis C. Hepatology. 2004 Apr;39(4):1147-71. [ Links ]
31 Stuver SO, Fleming C, Nunes D, Reed C, Tumilty S, Murray J, et al. Predictors of liver disease progression in a cohort of HIV/HCV-co-infected drug users. Poster presented section 165: HCV Co-Infection: Natural History. 12th Conference on Retrovirus and Opportunistic Infections; 2005 Feb 22-25; Boston, Massachuttes, 2005. [citado 2005 Dez]. Disponível em: http://www.retroconference.org/2005/cd/Abstracts/23636.htm.
32 Sulkowski MS. Thomas DL, Mehta SH, Chaisson RE, Moore RD. Hepatotoxicity associated with nevirapine or efavirenz-containing antiretroviral therapy: role of hepatitis C and B infections. Hepatology. 2002 Jan;35(1):182-9. [ Links ]
33 Vallet-Pichard A, Pol S. Natural history and predictors of ceverity of chronic hepatitis C virus (HCV) and human immunodeficiency virus (HIV) co-infection. J Hepatol. 2006;44 Suppl 1:S28-34. [ Links ]
34 Vogel M, Boesecke C, Wasmuth JC, Rockstroh JK. HIV and hepatitis C co-infection. Dtsch Med Wochenschr. 2010 Jun;135(23):1186-91.
35 Yen T, Keeffe EB, Ahmed A. The epidemiology of hepatitis C virus infection. J Clin Gastroenterol. 2003 Jan;36(1):47-53.
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Ivanete do Socorro Abraçado Amaral
E-mail: ivaneteabracado@hotmail.com
Manoel do Carmo Soares
E-mail: manoeldocarmosoares@hotmail.com
Recebido em / Received / Recibido en: 22/5/2010
Aceito em / Accepted / Aceito en: 17/6/2010
*Trabalho realizado na Fundação Santa Casa de Misericórdia do Pará.











 texto em
texto em 

