Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.3 Ananindeua Sept. 2010
http://dx.doi.org/10.5123/S2176-62232010000300015
ARTIGO DE REVISÃO
Métodos para avaliação da atividade antimalárica nas diferentes fases do ciclo de vida do Plasmodium
Fátima Nogueira; Virgílio Estólio do Rosário
Unidade de Ensino e Investigação da Malária, Centro de Malária e Outras Doenças Tropicais, Laboratório Associado, Instituto de Higiene e Medicina Tropical, Universidade Nova de Lisboa, Lisboa, Portugal
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Methods for assessment of antimalarial activity in the different phases of the Plasmodium life cycle . Traduzido por: André Monteiro Diniz.
RESUMO
A malária é uma doença transmitida por mosquitos e causada por parasitas do gênero Plasmodium. Em seres humanos, os parasitas multiplicam-se no fígado e, em seguida, infectam os eritrocitos. O ciclo de vida do Plasmodium consiste em uma fase sexuada no mosquito vetor (esporogonia) e uma fase assexuada no hospedeiro vertebrado (esquizogonia); ambas as fases podem ser detectadas por meio de testes. Em geral, a avaliação da atividade antimalárica de compostos é feita por testes in vivo e in vitro. A atividade antimalárica determinada por testes in vivo decorre de uma variedade de fatores associados tanto ao parasita quanto ao hospedeiro. Por outro lado, os testes in vitro mostram com mais precisão os efeitos "isolados" dos compostos sobre o metabolismo do parasita. A análise in vivo da atividade antiplasmódica pode ser realizada com o uso de modelos de roedores e pela avaliação da atividade bloqueadora do potencial vetor utilizando mosquitos. Há diversos testes in vitro para a avaliação da atividade antimalárica com base na observação do desenvolvimento do parasita em células sanguíneas por meio de gota espessa, ensaios isotópicos, quantificação de proteínas do parasita e testes de intercalação no DNA com o uso de corantes. Além da atividade antimalárica, um composto antimalárico promissor não deve apresentar toxicidade em relação às células hospedeiras; o grau de seletividade de um composto em relação ao parasita da malária envolve esta análise. Neste artigo, pretende-se resumir os métodos mais comumente utilizados para avaliar a atividade antimalárica de compostos durante os diferentes estágios do ciclo de vida do Plasmodium.
Palavras-chave: Malária; Resistência a Medicamentos; Antimaláricos; Testes Imunológicos de Citotoxicidade; Plasmodium.
INTRODUÇÃO
A malária atinge aproximadamente 300 milhões de pessoas no mundo inteiro, causando entre 1 e 1,5 milhão de mortes anualmente. Antes uma doença vastamente disseminada, ela hoje encontra-se confinada principalmente à África, Ásia e América Latina. As espécies predominantes de malária apresentam diferentes prevalências dependendo da região geográfica. Por exemplo, a causada por Plasmodium vivax é mais prevalente que a causada por P. falciparum na América Latina. Em geral, a falta de uma vacina e a resistência a drogas têm prejudicado muitos programas de controle da malária.
CICLO DE VIDA DO PLASMODIUM
Tanto os hospedeiros vertebrados quanto os invertebrados podem ser infectados pela malária. Os mosquitos ingerem os gametócitos do Plasmodium durante o repasto sanguíneo em um hospedeiro vertebrado infectado e os gametócitos, então, adquirem sua forma infecciosa (esporozoítos) dentro de suas glândulas salivares. A esporogonia no mosquito dura aproximadamente 10 a 20 dias e o mosquito permanece infeccioso por 1 a 2 meses. A fase esquizogônica inicia com a inoculação do parasita no sangue do hospedeiro vertebrado por meio da picada de uma fêmea do mosquito do gênero Anopheles. Em um curto intervalo de tempo, os esporozoítos invadem as células do fígado por meio de um ciclo complexo1 e iniciam a esquizogonia, que se divide em duas fases, a fase hepática (esquizogonia pré-eritrocítica) e a fase eritrocítica (esquizogonia eritrocítica). Dentro dos hepatócitos, os trofozoítos iniciam sua divisão intracelular assexuada. Ao fim desta fase, milhares de merozoítos exo-eritrocíticos são liberados de cada hepatócito infectado. O tempo gasto para que seja completada a fase tecidual varia de acordo com a espécie infecciosa: 8 a 25 dias para P. falciparum, 8 a 27 dias para P. vivax, 9 a 17 dias para P. ovale, 15 a 30 dias para P. maláriae e 9 a 12 dias para P. knowlesi2. Este período é denominado pré-patente. No caso de P. vivax e P. ovale, alguns esporozoítos podem entrar em estágio de dormência, também conhecido como criptobiótico, quando são chamados de hipnozoítos. Eles podem permanecer latentes por meses ou anos e, quando reativados, levam a novas manifestações clínicas denominadas recaídas. Os merozoítos liberados dos hepatócitos adentram nos eritrocitos e dão início à divisão assexuada, desenvolvendo, durante os estágios de anéis, trofozoítos, esquizontes precoces e maduros. Cada esquizonte maduro é composto de milhares de merozoítos eritrocíticos. Esses merozoítos são então liberados pela lise do eritrócito e imediatamente invadem eritrócitos não infectados. Esse ciclo de invasão-multiplicação-liberação-invasão repete-se continuamente; ele ocorre de forma sincrónica à medida em que os merozoítos são liberados, o que ocorre aproximadamente ao mesmo tempo. Isto resulta em manifestações clínicas características da doença. Uma pequena proporção de merozoítos no eritrócito transforma-se em macro e microgametócitos, e o seu ciclo completo é reiniciado caso outra fêmea do mosquito se alimente do hospedeiro vertebrado infectado.
AVALIAÇÃO DA ATIVIDADE ANTIMALÁRICA
Em geral, a avaliação da atividade antimalárica de compostos é feita por testes in vivo e in vitro, que podem ser complementares, pois os dados obtidos pelos testes in vitro requerem confirmação com modelos vivos.
A - Os testes in vivo são associados a modelos animais e suas questões éticas obrigatórias. Nestes testes, são medidos, principalmente, a) a depuração dos parasitas detectados por meio de microscopia ótica ou outros métodos mais sensíveis (reação em cadeia da polimerase -PCR), b) o tempo gasto entre a última dose da droga e a depuração da parasitemia e c) a dosagem da droga que depura os parasitas como resposta a sua utilização.
Após sua adaptação para testes em humanos, os estudos in vivo geralmente representam o acompanhamento de um grupo selecionado de indivíduos sintomáticos e parasitêmicos que tenham passado por tratamento cuidadosamente controlado com subsequente monitoramento das respostas parasitológicas e/ou clínicas ao longo do tempo. Um composto ou droga pode ter sua baixa eficiência terapêutica mascarada por uma depuração imunomediada dos parasitas em hospedeiros com imunidade adquirida. Quando realizados em humanos, testes in vivo refletem de forma mais precisa o real status clínico ou epidemiológico, i.e., a resposta terapêutica dos parasitas circulantes que estejam infectando a população na qual o fármaco esteja sendo ministrado.
A análise da atividade antimalárica de novos compostos segue procedimentos padronizados*. Primatas não humanos já serviram de modelos experimentais para a malária causada por P. falciparum3. No entanto, o uso desse modelo animal tem se tornado difícil devido a questões de ordem económica e ética: uma quantidade limitada de símios, a pequena quantidade de linhagens de parasitas adaptadas para causar infecção em primatas e a diferente patologia apresentada por esses modelos4,5,6. Consequentemente, a maior parte dos estudos experimentais sobre malária in vivo baseou-se em diferentes combinações de várias cepas de murinos e Plasmodium spp. de roedores7,8; entretanto, as diferenças biológicas entre as espécies de parasitas devem ser levadas em consideração9.
Fatores externos, como a imunidade, as variações na absorção da droga e no metabolismo, são reduzidos devido ao uso de animais ainda não expostos (naïve), de linhagens reconhecidas, nos experimentos. Além disso, potenciais erros de classificação de reinfecção não são levados em consideração, pois os testes utilizam inoculação direta de parasitas na fase sanguínea em áreas bem protegidas nas proximidades dos cativeiros. No entanto, a atividade antimalárica medida em um teste in vivo nem sempre leva em consideração efeitos colaterais, como o metabolismo e a genética do hospedeiro, o que pode influenciar no resultado do experimento.
B - Os testes in vitro impedem alguns dos fatores confundidores listados acima, pois retiram os parasitas do hospedeiro e os colocam em um ambiente experimental controlado. Segundo o procedimento mais utilizado, os parasitas de P. falciparum obtidos de cultura celular ou de um paciente humano são expostos a quantidades precisamente calculadas de um determinado composto ou medicamento. Em seguida, a inibição da maturação do parasita é monitorada para que se avalie o efeito dependente da dose da droga, ao impedir o desenvolvimento do parasita de anel para esquizonte. Para os testes relacionados com a infectividade do esporozoíto, são geralmente utilizados esporozítos de P. berghei em cultura de células hepáticas HepG2 para estudar o efeito da dose da droga sobre a maturação do esquizonte. A correlação dos dados das respostas dos testes in vitro com as respostas clínicas de pacientes não é consistente, uma vez que a cura clínica não é influenciada pelo sistema imunológico do indivíduo. Outro exemplo da limitação dos testes in vitro é o uso de prodrogas, como proguanil, que demanda a conversão do hospedeiro em metabólitos ativos. Apesar de se ter conseguido realizar a adaptação das formas eritrócitas de P. vivax para cultura contínua, o seu uso em testes é complexo e inviável. Em geral, esses testes são trabalhosos e relativamente caros; no entanto, há inovações sendo implementadas que podem torná-los mais fáceis de adaptar para o trabalho de campo rotineiro e mais eficientes como ferramentas de alto rendimento para as análises de atividades das drogas.
AVALIAÇÃO DA ATIVIDADE ANTIMALÁRICA DE COMPOSTOS DURANTE A FASE ERITROCÍTICA
O procedimento de análise e validação de drogas antimaláricas é relativamente demorado e complicado. A primeira fase da avaliação da droga consiste normalmente em duas subfases. A primeira abrange o uso de ensaios "whole-cell" (células totais) para a determinação do efeito do composto no crescimento do parasita humano P. falciparum in vitro. A segunda fase abrange a análise da eficiência in vivo de drogas selecionadas em pequenos modelos animais de malária, utilizando principalmente os parasitas de roedores P. berghei, P. yoelii e P. chabaudi em camundongos de laboratório.
CULTURA DE PARASITAS
A maioria das abordagens a respeito da sensibilidade in vitro à droga é baseada na cultura de parasitas de malária em eritrócitos, que foi desenvolvida na década de 197010,11. O seu desenvolvimento tornou possível a remoção do parasita da corrente sanguínea do paciente e sua transferência para o ambiente de laboratório, altamente controlado. Também permitiu a pesquisa em regiões não endêmicas onde não há uma boa quantidade de amostras novas de parasitas. A cultura em curto prazo de parasitas do P. falciparum é bem simples e requer a utilização de pouco equipamento laboratorial, podendo ser facilmente realizado sob condições de campo. Apesar de a cultura continua apresentar desafios logísticos e consideravelmente mais técnicos, ela tem se tornado uma ferramenta essencial em laboratórios que trabalham com o desenvolvimento de drogas antimaláricas e de pesquisas básicas. Com a possibilidade de criopreservação de parasitas vivos12, as culturas fornecem a base para estudos que exigem altas densidades de parasitas (proteômica) e para os procedimentos de clonagem. Embora o P. falciparum seja assíncrono durante a cultura in vitro, a sincronização artificial (Figura 1) dos estágios eritrocíticos do parasita em cultura é útil para pesquisas sobre as candidatas a vacina contra a malária no estágio eritrocítico.

TESTES IN VITRO
O principal objetivo dos testes de sensibilidade a drogas consiste em avaliar ou medir a sensibilidade do parasita (P. falciparum)a dosagens crescentes de droga in vitro; os dados são apresentados como porcentagem do crescimento parasitário comparado com culturas não tratadas. Esta abordagem permite um descarte quase total de fatores interferentes relacionados ao hospedeiro, tais como sua imunidade e seu metabolismo em relação ao composto, deste modo oferecendo uma avaliação direta do impacto da droga. Os testes in vitro são basicamente isentos de risco para o paciente, não são invasivos (com exceção da coleta de sangue para amostra) e são essenciais para o desenvolvimento da droga. Os testes in vitro para a verificação da atividade antimalárica geralmente utilize o método de cultura contínua desenvolvido por Trager e Jensen11 e a técnica de microcultura desenvolvida por Rieckmann13. A cultura in vitro em curto prazo de isolados de campo de P. vivax e P. ovale recém-coletados foi também estabelecida14,15, permitindo a avaliação da atividade antimalárica em drogas diferentes sobre estas espécies de plasmódio.
Para a seleção da droga, vários métodos in vitro são comumente utilizados para a avaliação da inibição do crescimento do P. falciparum: a) contagem de esquizontes por meio da gota espessa, método conhecido como teste padrão de maturação de esquizontes da Organização Mundial de Saúde (OMS)16; b) incorporação de precursor de ácido nucleico radiomarcado (hipoxantina radiomarcada, por exemplo), conhecido como ensaio isotópico17,18; c) a quantificação das proteínas 2 rica em histidina (HRP2) e lactato desidrogenase (LDH) do parasita pelo ensaio imunoenzimático ELISA19,20; e d) Teste de intercalação no DNA com o uso de corantes21,22,23,24.
Contagem de esquizontes por meio da gota espessa
Este teste de sensibilidade à droga é baseado em contagens do parasita após a avaliação da morfologia de seu crescimento (de anéis a esquizontes) por meio de microscopia luminosa. O microteste Mark III da OMS (Tabela 1) é uma alternativa de baixo custo padronizada pela OMS*. Ele deve ser realizado por microscopistas experientes, pois é muito trabalhoso e suscetível à variação individual. Ele é baseado na maturação do P. falciparum em microcultura de 24 a 36 h, com a contagem microscópica do número de parasitas que se desenvolvem em esquizontes (i.e., parasitas com três ou mais cromatinas) por meio de filme espesso corado com Giemsa. Apesar destes fatores, o ensaio da OMS é econômico e simples de ser realizado em campo. Diversos trabalhos publicados no Brasil utilizaram esta técnica25,26,27,28.

Testes isotópicos
O ensaio com incorporação de hipoxantina radiomarcada (Tabela 1) tem sido utilizado como padrão ouro para os testes de suscetibilidade a drogas com o P. falciparum18. Como uma alternativa ao uso de hipoxantina radiomarcada, Elabbadi29 propuseram a utilização de etanolamina, que apresenta, como maior vantagem, a possibilidade de complementação do meio de cultura com hipoxantina para melhorar o crescimento do parasita. Vários outros precursores, como o palmitato, serina, colina, inositol e isoleucina, também já foram indicados para uso em testes isotópicos29. No entanto, as normas referentes ao manuseio de materiais radiativos se tornaram bem mais restritivas, objetivando limitar a sua utilização a campos em que não há qualquer metodologia alternativa disponível. Outra limitação é o alto custo do equipamento necessário, como contadores de cintilação líquida e equipamentos de colheita. Além disso, as densidades de parasitas relativamente altas exigidas para este teste (de aproximadamente 0,5%) limitam sua aplicabilidade ao uso de cepas de parasitas adaptadas a culturas ou a amostras de campo com parasitemia alta. Estas barreiras tornam o seu uso rotineiro mais caro e difícil em contextos de pesquisa e de atendimento clínico, particularmente em ambientes com recursos limitados.
Quantificação das proteínas do parasita
O ELISA é um método fácil de implementar, altamente reproduzível, exige pouco equipamento técnico e pode ser aplicado em laboratório de campo. Alguns testes ELISA visando o LDH do P. falciparum (pLDH), a atividade do pLDH ou a HRP2 já estão disponíveis comercialmente30,19,31,32,33. O princípio por trás da produção de pLDH como uma medida para o crescimento dos parasitas decorre da diferente estrutura enzimática do pLDH, comparada às LDHs humanas34 e do rápido declínio nos níveis de pLDH quando os parasitas morrem35.
O ensaio double-site enzyme-linked LDH immunodetection (DELI) (Tabela 1) tem sido utilizado para avaliar a suscetibilidade a drogas antimaláricas do P. falciparum36,30,19. Ele é bastante sensível - mais sensível do que a detecção do P. falciparum em esfregaços sanguíneos e tão sensível quanto a PCR19. Esta técnica pode ser usada para mensurar a sensibilidade à droga in vitro do P. falciparum de forma mais fácil, rápida e com equipamentos mais simples que os exigidos para realizar os testes isotópicos. Em contraste com este último, densidades mais baixas do parasita podem ser testadas pelo DELI (até 0,005%), aumentando assim o número de isolados que podem ser investigados.
O teste de atividade enzimática do pLDH é baseado na observação de que a enzima LDH do P. falciparum tem a capacidade de usar rapidamente o 3-acetilpiridina adenina dinucleotídeo (APAD) como uma coenzima na reação, o que leva à formação de piruvato a partir do lactato. Em contraste, o LDH da hemácia humana executa esta reação lentamente na presença de APAD. O desenvolvimento da APADH é então mensurado e faz-se uma correlação entre os níveis de parasitemia e a atividade do LDH do parasita37,38.
O teste de HRP2 (Tabela 1) é baseado na avaliação do aumento das concentrações de HRP2 em amostras de cultura de P. falciparum. Há um kit comercial disponível (Malaria Ag CELISA, Cellabs Pty. Ltd., Brookvale, NSW, Austrália; http://www.cellabs.com.au), que realiza o teste em apenas 2,5 h, aproximadamente. Se o crescimento dos parasitas for inibido por drogas antimaláricas, a inibição reflete no aumento de níveis de HRP2 e pode, consequentemente, ser facilmente quantificada por meio da detecção mediada por anticorpos39. Há registros de que o HRP2 tem demonstrado uma grande diversidade de sequências de proteínas (principalmente inserções) em isolados de P. falciparum provenientes de diferentes áreas geográficas40 e alguns isolados da Amazónia peruana têm demonstrado até mesmo a falta do gene pfhrp241. Foi demosntrado que a diversidade da proteína HRP2 influencia na sensibilidade dos anticorpos de detecção do HRP2. Por estas razões, há uma crescente preocupação acerca de sua aplicação em estudos de campo. No entanto, este método é amplamente utilizado pela Rede Amazónica de Vigilância da Resistência aos Antimaláricos (RAVREDA)* para testes de suscetibilidade a drogas.
Teste de intercalação no DNA com o uso de corantes
Diversos métodos de triagem já foram publicados com drogas que apresentam potencial de alto rendimento contra o P. falciparum. A maioria deles baseia-se na quantificação automática do crescimento parasitário após sua coloração com corantes fluorescente para DNA42,21,43,44,23,24. O princípio por trás destes ensaios é o contraste entre os eritrocitos do hospedeiro, que não apresentam DNA e RNA, e os parasitas da malária, que têm tanto DNA quanto RNA; por isso, são utilizados, nos parasitas, corantes que mostram uma maior fluorescência na presença de ácidos nucleicos.
As tecnologias baseadas em coloração de DNA (Tabela 1), como as que utilizam DAPI (4, 6-diamidino-2-fenilindol), Picogreen, YOYO-1 e SYBR Green I, têm apresentado resultados comparáveis aos de testes isotópicos. Nestes últimos, a fluorescência dos corantes é medida utilizando leitores de fluorescência em microplacas ou separadores de células ativadas por fluorescência (FACS). Até o presente momento, apenas dois destes corantes apresentaram êxito nas triagens de alto rendimento dos compostos existentes: YOYO-1 e DAPI42,24. O uso destes testes tem aumentado porque sua realização é relativamente simples e barata em comparação com seus equivalentes radioativos e ELISA.
AVALIAÇÃO IN VIVO DA ATIVIDADE ANTIPLASMÓDICA
A resistência a drogas antimaláricas já foi definida como a "habilidade da cepa do parasita de sobreviver e/ou multiplicar-se, a despeito da administração e absorção de uma droga, dada em doses iguais ou maiores que aquelas normalmente recomendadas, mas dentro dos limites de tolerância do indivíduo". Outro motivo para o insucesso na eliminação do parasita do corpo dos pacientes pode ser o fato de uma quantidade insuficiente da droga ou de seu metabólito ativo alcançá-lo, um evento denominado falha terapêutica. Diferentemente da resistência a drogas, a falha terapêutica é um processo relacionado diretamente com o parasita e altamente dependente tanto do hospedeiro quanto das propriedades da droga.
Obviamente, as pesquisas tecnológicas visando à descoberta de drogas antimaláricas objetivam a eliminação da doença em humanos. Há uma grande heterogeneidade no comportamento dos pacientes e entre diferentes populações devido ao polimorfismo relacionado aos genes, à redundância de albvos, aos diferentes procedimentos regulados e aos obstáculos relacionados ao meio ambiente.
Monitoramento dos pacientes
Em humanos, a abordagem mais tradicional utilizada para determinar a suscetibilidade do P. falciparum a drogas antimaláricas é a avaliação da resposta terapêutica (in vivo), que foi originalmente definida pela OMS em termos de depuração parasitária [sensível (S) e três níveis crescentes de resistência (RI, RII, RIII)]. Como a reinfecção é difícil de ser excluída em áreas com transmissão intensa de malária, a OMS introduziu um protocolo modificado com base no desfecho clínico (resposta clínica adequada, falha terapêutica precoce e tardia) para áreas com intensa transmissão, onde a parasitemia na ausência de sinais ou sintomas clínicos é comum*. Atualmente, o sistema de classificação estende o período de monitoramento para 28 dias e inclui critérios diferentes para a definição da Falha Terapêutica Precoce, Falha Clínica Tardia e Falha Parasitológica Tardia para áreas com transmissão intensa e baixa a moderada†. O desenvolvimento de ferramentas moleculares tornou possível distinguir incidentes de recrudescência de reinfecções45. Todos os testes in vivo devem ser realizados com doses terapêuticas padronizadas e executados de acordo com as recomendações da OMS‡. Para o P. vivax,os critérios são diferentes do P. falciparum†. A proliferação de experiências com drogas antimaláricas nos últimos dez anos deu ensejo ao lançamento de um esforço conjunto global de vigilância no sentido de monitorar a eficácia de drogas antimaláricas. A Rede Mundial de Vigilância à Resistência Antimalárica (WARN)§ se propõe a estabelecer uma base de dados clínica abrangente cujas estimativas padronizadas da eficácia antimalárica podem ser obtidas e monitoradas ao longo do tempo para diversas regiões geográficas e endêmicas46. A adoção generalizada desta abordagem permitirá um reconhecimento preciso e em tempo hábil de novas tendências em eficácia de drogas, orientando assim as intervenções adequadas para lidar com as cepas de parasitas resistentes a multidrogas já estabelecidas, bem como acelerar a implementação de ações assim que novas cepas de pl asmódios multirresistentes emergirem.
Modelos de roedores para triagem in vivo da atividade antimalárica
Quatro espécies de parasitas de malária extraídos de roedores africanos foram adaptadas para o crescimento em camundongos: P. berghei, 194847; P. chabaudi, 196548; P. vinckei, 195249; e P. yoelii, 196550 (Tabela 2). Estes modelos de parasitas tornaram-se amplamente utilizados especialmente devido à facilidade de manuseio e de criação de ratos e cacmundongos em laboratório; além disso, o seu ciclo de vida pode ser mantido em laboratório por meio de transmissão cíclica, utilizando Anopheles stephensi e A. gambiae, que também são de fácil manutenção em laboratório.
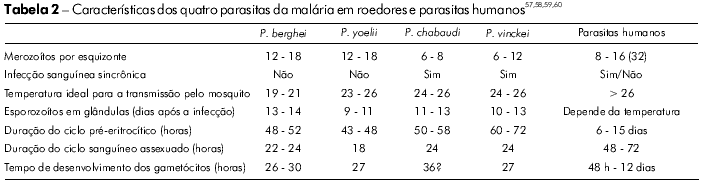
Apesar de a extrapolação direta da biologia dos modelos roedores para a biologia do P. falciparum não poder ser aplicável em todas as situações, cada uma das quatro espécies de malária de roedores tem características similares às quatro espécies de malária humana, o que as torna adequadas para o estudo paralelo (por exemplo, a variação antigênica de P. chabaudi51, os testes in vivo com drogas e P. berghei52 ou P. chabaudi53, malária cerebral com P. berghei ANKA54, vacinas em estágio pré-eritrocítico com P. yoelli55 e cronobiologia com P. vinckei56).
Um dos testes in vivo baseados na resposta a doses mais utilizados na avaliação da atividade antimalárica é o teste de supressão de quatro dias desenvolvido por Peters61. Em resumo, fêmeas de camundongos são infectadas por parasitas de roedores e as doses diferentes de tratamento são ministradas logo após a infecção, no dia 0, e são repetidas uma vez a cada um dos 3 dias subsequentes. Nos dias 4 e 7 pós-infecção, a parasitemia é avaliada. Após o dia 7, nenhuma manipulação é realizada nos camundongos, observando-se apenas sua sobrevivência.
Parasitas de primatas não humanos, roedores ou de pássaros foram utilizados como substitutos do P. falciparum62. No entanto, a despeito de seu valor, há diferenças significativas entre estas espécies e os parasitas humanos63,64. Recentemente, um modelo murino fidedigno de malária por P. falciparum foi estabelecido e se tornou uma ferramenta valiosa a ser utilizada em pesquisa, particularmente no descobrimento de novas drogas. O desenvolvimento de camundongos humanizados infectados por P. falciparum por meio da infecção de camundongos "nude" ou SCID por parasitas de P. falciparum65,66,67,68,69 facilitou a coleta de amostras nos estágios exoeritrocítico, intraeritrocítico e intraeritrocítico aderente do parasita. É possível criar novos modelos murinos de falciparum utilizando camundongos humanizados imunodeficientes expressando moléculas humanas de adesão no endotélio que também apresentam defeitos específicos nem sua atividade/ativação fagocítica. Espera-se que estas ferramentas abram novos caminhos para o estudo da biologia dos estágios eritrocíticos do P. falciparum in vivo; além disso, suas respostas moleculares às pressões seletivas impostas por drogas antimaláricas ou pelo sistema imunológico humano reconstituído em camundongos podem ser analisadas70,71,65,72. De fato, Angulo-Barturen73 conseguiram obter uma relação entre as respostas às doses de drogas antimaláricas utilizando um modelo de camundongo humanizado infectado por P. falciparum.
AVALIAÇÃO DA SEGURANÇA (CITOTOXICIDADE)
Um teste de toxicidade é uma ferramenta rápida e que apresenta uma boa relação custo-benefício no apoio à escolha de candidatas ideais, de modo a eliminar prováveis falhas antes de um composto ser submetido ao dispendioso processo de desenvolvimento da droga. A toxicidade é considerada o potencial de um composto de induzir a morte da célula. A correlação entre a citotoxicidade basal e a citotoxicidade aguda em animais e humanos tem sido considerada razoavelmente boa74. Além da atividade antimalárica, um composto antimalárico promissor não pode apresentar toxicidade às células do hospedeiro. O grau de seletividade demonstrado por um composto ante um parasita da malária pode ser expresso por seu índice de sensibilidade [IS = IC50células/IC50 parasitas (IC50, concentração que inibe 50% dos parasitas)]. Quanto maior for o IS, mais promissor será o composto, devido à sua seletividade ante o parasita da malária75. No entanto, um valor de SI abaixo de 2,0 indica que um composto pode possuir uma forte atividade antimalárica, mas pode ser uma toxina geral e não deve ser considerada uma candidata. Na prática, uma droga é considerada potencialmente interessante como um antimalárico se o seu IC50 for menor que 10 µM76.
Apesar de um grande número de organismos poderem ser utilizados, as culturas de células in vitro são geralmente aceitas como um método eficaz para a investigação da toxicidade de novos compostos. Suas vantagens sobre os métodos clássicos, tais como os estudos de longo prazo com animais experimentais como ratos, camundongos ou mesmo o menos frequente teste de letalidade para artemia salina77, são suas variáveis relativamente bem controladas, seu custo reduzido, o consumo menor de tempo e o menor número de animais necessários para a finalização dos estudos. Há seis alvos comuns de toxicidade xenobiótica: fígado, sangue, rim, nervo, pulmão e pele. Há muitos tipos de células disponíveis para cada alvo: fígado, HepG278 e BEL-7402; sangue, HL60 e K1 60; rim, Vero e HEK293; nervo, XF498 e NG1 08-15; pulmão, WI-38 e A549; e pele, SK-MEL-2 e Lox. HepG2 é uma das linhagens celulares mais utilizadas por empresas farmacêuticas (GlaxoSmithKline79) para investigar a toxicidade em uma série de compostos.
Em estudos envolvendo compostos ativos antiplasmodium, os pontos de avaliação (endpoints)de toxicidade mais frequentemente utilizados têm por base a) o colapso da barreira de permeabilidade celular (teste de LDH)80, b) a quantidade de proteína81, c) o acúmulo de vermelho neutro82 e d) função mitocondrial reduzida [teste MTT (3 - (4,5-dimetil-2-il) -2,5 dimetil-brometo de tetrazolium]83. Cada um desses métodos pode ser realizado em microculturas, utilizando múltiplas concentrações de amostras em placas de 96 ou 384 poços, levando, desta forma, a um maior rendimento de testes em grandes quantidades de compostos.
a) O teste de LDH é baseado na avaliação da atividade de lactato desidrogenase (LDH) em meio extracelular. A atividade de LDH é mensurada a partir da conversão de resazurina em resofurina fluorescente mediada pela diaforase após a conversão enzimática de lactato para piruvirato, catalizada por LDH. A perda de LDH intracelular e a sua liberação em meio de cultura é um indicador de morte irreversível de células devido aos danos causados na membrana celular. Este teste é caracterizado por sua confiabilidade, rapidez e avaliação simples80.
b) A análise de quantificação de proteína é uma medida indireta da quantidade de proteína celular em culturas em suspensão e aderentes. Ele se utiliza de coloração com sulforhodamina B (SRB) e subsequente determinação da densidade ótica (490 nm) em um leitor de microplacas. O ensaio fornece um teste colorimétrico, porém o SRB também fluoresce intensamente devido à excitação por laser a 488 nm e pode ser medido quantitativamente em nível celular por citometria por fluorescência estática81.
c) O ensaio de incorporação do vermelho neutro fundamenta-se na capacidade de células viáveis de incorporar e afixar o corante supravital vermelho neutro aos lisossomos82. O corante é então extraído e quantificado por meio de leitura de absorbância em espectrofotômetro.
d) Por último, o ensaio MTT tem sido utilizado para avaliar a viabilidade de células em diferentes linhagens celulares. Ele consiste na conversão do sal de tetrazólio MTT em formazan roxo insolúvel por meio de desidrogenases mitocondriais em células viáveis em proliferação. Os montantes de formazan são então quantificados com uso de um leitor de microplacas espectrofotométrico83.
AVALIAÇÃO DA ATIVIDADE BLOQUEADORA DO POTENCIAL VETOR POR DROGAS EXPERIMENTAIS
O rápido desenvolvimento da resistência a drogas antimaláricas de diversas classes químicas* é um fator relevante a influenciar o tratamento e controle da malária84. O uso de compostos capazes de interromper a transmissão da malária já foi defendido como um meio de evitar o desenvolvimento da resistência a drogas e limitar a disseminação de parasitas resistentes85,86,87,88. Os antimaláricos gametocitocidas, em particular as artemisininas, podem acelerar o controle da malária, pois reduzem a transmissão pós-tratamento89,90,91. No entanto, os derivados de artemisinina não evitam completamente a transmissão pós-tratamento92, e, devido à crescente resistência à terapia combinada à base de artemisinina (TCA) no sudeste da Ásia93,94,95, a necessidade de drogas eficazes contra gametócitos passou a ser urgente.
As drogas antimaláricas com atividade bloqueadora da transmissão podem afetar os estágios sexuais do parasita no hospedeiro humano (atividade gametocitocida) ou o desenvolvimento do parasita no mosquito (atividade esporontocida).
EFEITOS SOBRE A MICROGAMETOGÊNESE (TESTE DE EXFLAGELAÇÃO)
A exflagelação é o processo no qual um microgametócito ativado produz microgametas flagelares. Os microgametas rapidamente aderem aos eritrócitos ao seu redor para formar centros de exflagelação multicelulares, que podem ser observados microscopicamente96. O gametócito é acionado in vitro por meio de sua exposição simultânea a dois estímulos: uma queda de temperatura de mais de 5° C97 e uma mudança no nível de pH de 7.5 para 8.098,99,100. O método padrão para monitorar uma gametogênese efetivamente realizada é a contagem de centros de exflagelação no microscópio. No entanto, como é bastante trabalhoso, um tanto subjetivo e não pode ser automatizado, este método não é considerado adequado para aplicações com média produtividade. A replicação do DNA durante a microgametogênese tem sido investigada utilizando a coloração do DNA com vários corantes fluorescentes e a subsequente análise de células individuais por microscopia de fluorescência ou de populações de células por citometria de fluxo101,102. Entretanto, estes métodos não são facilmente adaptados a testes com maior produtividade. Recentemente foi desenvolvido um ensaio adaptado ao formato de 96 poços para monitorar a ativação de gametócitos com base na incoporação de hipoxantina radiativa em DNA recém-sintetizado de microgametas103.
AVALIAÇÃO DO IMPACTO DE ANTIMALÁRICOS NO DESENVOLVIMENTO ESPOROGÔNICO
A carga de gametócitos em humanos durante o período pós-tratamento pode ser levada em consideração104, apesar dos muitos aspectos éticos a serem observados. Como alternativa, pode ser utilizado um modelo de roedor onde os animais sejam infectados e posteriormente tratados. Camundongos experimentais são infectados via inoculação intraperitonial de hemácias infectadas. Cinco dias após a infecção, a presença de gametócitos maduros é verificada pela existência de exflagelação observada em gotas de sangue por meio de microscópio. Camundongos com gametócitos são tratados com o composto a ser testado e colocados em gaiolas com mosquitos. Dez dias após o repasto, os mosquitos são dissecados e seu intestino médio é dissecado sob microscópio ótico (400x) com vistas à avaliação da presença ou ausência de oocistos105,106. Tradicionalmente os oocistos são visualizados após corados com mercúrio-cromo a 0,5%. O desenvolvimento de parasitas de roedores transformados pela proteína fluorescente (GFP) facilitou a detecção de oocistos no intestino médio porque a fluorescência gerada pela GFP pode ser rapidamente detectada em microscópio de fluorescência (Figura 2).
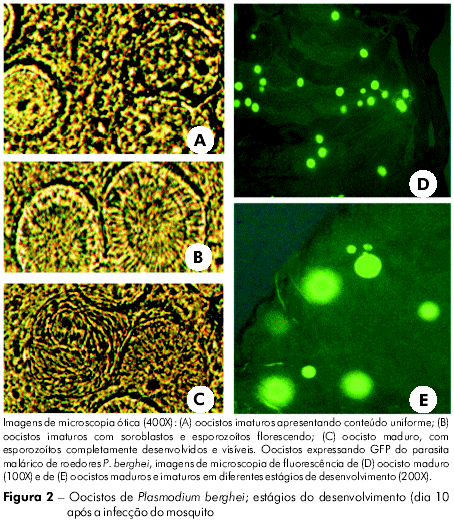
A avaliação do impacto da maturação do oocisto pode ser estabelecida por meio da observação do estágio desenvolvimental do oocisto. Como exemplos de categorias desenvolvimentais, podem ser citados: a) oocisto imaturo, anterior à formaçãod e esporoblastos; b) oocisto imaturo, com soroblastos visíveis e esporozoítos florescendo; e c) oocisto maduro, contendo esporozoítos completamente desenvolvidos. O desenvolvimento dos oocistos pode também ser quantificado medindo o diâmetro do oocisto com um micrômetro ocular.
A atividade bloqueadora do potencial vetor é finalmente avaliada com a remoção das glândulas salivares do mosquito no dia 21 pós-infecção e a verificação da presença ou ausência de esporozoítos por meio de microscopia de contraste de fase86,87,88, ou permitindo que estes mosquitos se alimentem em camundongos não infectados e depois checando sua parasitemia nos dias subsequentes.
AVALIAÇÃO DA ATIVIDADE ANTIMALÁRICA DE COMPOSTOS DURANTE A FASE HEPÁTICA
A fase hepática é uma fase de transição entre o esporozoíto extracelular, inoculado pelo mosquito vetor, e a fase sanguínea, que é responsável pela produção da doença.
ENSAIO ANTIMALÁRICO ESQUIZONTICIDA E EXOERITROCÍTICO
O desenvolvimento de produtos farmacêuticos que inibam o crescimento de formas hepáticas de Plasmodium é importante por duas razões principais: estes compostos poderiam ser utilizados como agentes profiláticos por indivíduos expostos, por um certo período, em área endêmica de malária (por exemplo, refugiados e viajantes); e o fato de a emergência de cepas resistentes a drogas ser teoricamente limitada durante a fase hepática devido à baixa carga viral em comparação com a fase sanguínea. Apesar de as fases hepáticas fornecerem alvos atraentes para a quimioterapia antimalárica, o rol de drogas eficazes e largamente disponibilizadas ainda é limitado. As únicas drogas profiláticas atualmente disponíveis são o atovaquona e as duas drogas relacionadas: primaquina e tafenoquine. O atovaquona já demonstrou ser eficaz na inibição do desenvolvimento do parasita107, porém seu uso é limitado devido ao seu custo elevado. A toxicidade hematológica restringe o uso de primaquina, particularmente na África, por causa da elevada frequência de deficiência em Glucose-6-fosfato desidrogenase (G6PD) na população humana108. Houve uma diminuição na identificação de novas drogas devido à falta de um método sensível e confiável que possa ser utilizado em triagens em larga escala.
Apesar dos avanços significativos, as fases exoeritrocíticas (EE) dos parasitas maláricos em mamíferos permanecem sendo as menos compreendidas de todas as fases do ciclo de vida do parasita. As culturas mais antigas e prolíficas das fases EE foram realizadas utilizando-se os parasitas aviários P. fallax, P. gallinaceum e P. cathemerium, cultivados em embriões de galinha ou in vitro109,110,111,112. No entanto, a disparidade biológica entre o ciclo EE em parasitas maláricos aviários e mamíferos, as diferenças entre os sistemas imunológicos dos hospedeiros e o papel do hepatócito limita de forma substancial o uso daquela cultura como modelo para a malária humana. Alguns laboratórios têm tentado utilizar hepatócitos primários de hospedeiros suscetíveis naturais e de laboratório113. Os hepatócitos primários têm a vantagem de poderem ser obtidos de animais histocompatíveis com hospedeiros imunizados experimentalmente. Além disso, eles permitem o teste de drogas que requeiram ativação metabólica, apesar de normalmente existirem diferenças qualitativas e quantitativas entre as espécies nas vias metabólicas de drogas hepáticas. Entretanto, os hepatócitos primários também apresentam algumas desvantagens relevantes: (1) o perfil metabólico do hepatócito varia durante o tempo de cultura; (2) a densidade dos parasitas obtidos utilizando essas células é relativamente baixa; (3) por razões técnicas, o preparo varia de experimento para experimento e de acordo com cada laboratório; e (4) o preparo varia de acordo com o status nutricional e outras características do hospedeiro.
Muitos avanços foram conseguidos com a introdução das linhas celulares de hepatoma HepG2-A16 e Huh7114. No entanto, em estudos sobre a sensibilidade a drogas, as linhas celulares de hepatoma podem não reproduzir fielmente o metabolismo da droga por hepatócitos primários. Por exemplo, apesar de as células de HepG2 poderem realizar oxidase de função mista dependente do citocromo P-450 e reações de conjugação, foram observadas diferenças nas atividades de algumas das enzimas que metabolizam drogas em comparação com hepatócitos humanos primários recém-isolados115,116. A primaquina, que requer a ativação pela célula do hospedeiro, apresenta uma baixa atividade contra as formas EE de P. berghei cultivadas em células de HepG2117, em comparação com o P. yoelii cultivado em hepatócitos primários de Thamnomys118. Este achado pode refletir a incapacidade de HepG2 de transformar a primaquina em seu estágio ativo. Para obter um quadro mais completo da atividade de drogas individuais, diversos sistemas de cultura diferentes podem ser utilizados.
A cultura in vitro das formas EE de P berghei (cepa ANKA) ou P. yoelii (cepa 265BY), por infecção da linha celular HepG2 com esporozoítos produzidos em mosquitos da espécie Anopheles stephensi119,78, constitui uma das técnicas mais utilizadas para avaliar a atividade antimalárica de compostos durante a fase hepática.
Os testes de sensibilidade a drogas in vitro são baseados principalmente na contagem de células hepáticas que contenham esquizontes em culturas infectadas por esporozoítos120,113,114. Apesar de terem sido propostos métodos alternativos para a detecção de esquizontes EE, incluindo o uso de métodos quantitativos de RT-PCR (1q24RT-PCR)121,122,123, o uso de sondas de RNA ribossómico124, o uso de sistemas com imagens em infravermelho juntamente com um contador de colónias125 e a detecção em culturas e em camundongos vivos utilizando imagens luminescentes em tempo real126, o número de células infectadas ainda é medido principalmente por análise de microscopia de fluorescência. Estes métodos são propensos a grandes variações entre observadores e demandam bastante tempo, dadas as baixas taxas de infecção observadas em hepatócitos provenientes de culturas (geralmente menores de 2%)125. Parasitas maláricos transgênicos de roedores (parasitas expressando GFP) que expressam a luciferase, proteína "repórter" fluorescente, já foram desenvolvidos127,128. A avaliação dos efeitos de várias drogas com base na luminescência sobre a infecção in vitro de hepatócitos usando esses parasitas demonstra que esses modelos podem ser utilizados de forma eficiente na análise in vivo e in vitro de compostos visando às fases hepáticas do Plasmodium129. Esta estratégia é um sistema reproduzível no qual um parasita clonado se desenvolve até a maturidade em uma determinada célula hospedeira na mesma velocidade e com a mesma morfologia da observada em um hospedeiro de laboratório adequado. Ademais, ela representa um ensaio de rotina reproduzível para o crescimento em todos os estágios EE, considerado objetivo e estatisticamente robusto.
A DIFÍCIL ESCOLHA
A abundância de ensaios sobre a sensitividade a drogas existentes e disponíveis faz com que o pesquisador se veja diante de uma difícil escolha. Tanto o microteste da OMS como os ensaios isotópicos já comprovaram sua confiabilidade nos campos respectivos após mais de duas décadas de utilização: o microteste da OMS em campo e os testes isotópicos em laboratórios de pesquisa altamente equipados. No entanto, ambos os testes trazem consigo importantes obstáculos. O teste da OMS é subjetivo e bastante trabalhoso, enquanto que o teste isotópico tem pouca sensibilidade e envolve o manuseio de material radiativo. Os novos ensaios colorimétricos, os testes DELI e HRP2 baseados no ELISA e os testes de intercalação no DNA com o uso de corantes superam muitas destas desvantagens e podem ser os atuais métodos de escolha. Eles são sensíveis, relativamente simples e rápidos, não demandam o uso de equipamento especializado e têm o potencial de substituir os testes tradicionais. No entanto, eles ainda estão bem distantes do uso do dipstick para a dosagem da resistência a drogas. À medida que mais conhecimento a respeito da genética da resistência a drogas é disponibilizado, e à medida que novas e melhores ferramentas são desenvolvidas (como a PCR em tempo real), técnicas moleculares podem vir a se tornar ferramentas extremamente valiosas para a vigilância e detecção precoce da resistência a drogas antimaláricas no futuro.
Os testes de drogas são fundamentais para as pesquisas sobre a malária e devem sempre ser complementados por estudos clínicos, estudos genéticos do hospedeiro relacionados ao metabolismo da droga, marcadores moleculares para uma mais rápida identificação da presença de resistência em campo e novos métodos diagnósticos aplicados principalmente na caracterização da suscetibilidade a drogas.
AGRADECIMENTOS
Os autores gostariam de agradecer as valiosas contribuições do Dr. Marcelo Silva (PhD), pesquisador do Centro de Malária e Outras Doenças Tropicais LA, Universidade Nova de Lisboa, Lisboa, Portugal.
REFERÊNCIAS
1 Mota MM, Rodriguez A. Invasion of mammalian host cells by Plasmodium sporozoites. Bioessays. 2002 Feb;24(2):149-56. [ Links ]
2 Ng OT, Ooi EE, Lee CC, Lee PJ, Ng LC, Pei SW, et al. Naturally acquired human Plasmodium knowlesi infection, Singapore. Emerg Infect Dis. 2008 May;14(5):814-6. [ Links ]
3 Carlton JM, Muller R, Yowell CA, Fluegge MR, Sturrock KA, Pritt JR, et al. Plasmodium falciparum: studies on mature exoerythrocytic forms in the liver of the chimpanzee, Pan troglodytes. Exp Parasitol. 1990 Jan;70(1):1-11. DOI:10.1016/0014-4894(90)90080-V [ Links ]
4 Evans KJ, Hansen DS, van Rooijen N, Buckingham LA, Schofield L. Severe malarial anemia of low parasite burden in rodent models results from accelerated clearance of uninfected erythrocytes. Blood. 2006 Feb;107(3):1192-9. DOI:10.1182/blood-2005-08-3460 [ Links ]
5 Sanni LA, Fonseca LF, Langhorne J. Mouse models for erythrocytic-stage malaria. Methods Mol Med. 2002;72:57-76. DOI:10.1385/1-59259-271-6:57 [ Links ]
6 Stevenson MM, Gros P, Olivier M, Fortin A, Serghides L. Cerebral malaria: human versus mouse studies. Trends Parasitol. 2010 Jun;26(6):274-5. DOI:10.1016/J.PT.2010.03.008 [ Links ]
7 Carlton JM, Muller R, Yowell CA, Fluegge MR, Sturrock KA, Pritt JR, et al. Profiling the malaria genome: a gene survey of three species of malaria parasite with comparison to other apicomplexan species. Mol Biochem Parasitol. 2001 Dec;118(2):201-10. DOI:10.1016/S0166-6851(01)00371-1 [ Links ]
8 Hernandez-Valladares M, Rihet P, ole-MoiYoi OK, Iraqi FA. Mapping of a new quantitative trait locus for resistance to malaria in mice by a comparative mapping approach with human Chromosome 5q31-q33. Immunogenetics. 2004 May;56(2):115-7. DOI 10.1007/s00251-004-0667-0 [ Links ]
9 Walliker D. Ronald Ross: malariologist and polymath. A biography. Parasitol Today. 1998 May;14(5):210. DOI:10.1016/S0169-4758(98)01230-7
10 Haynes JD, Diggs CL, Hines FA, Desjardins RE. Culture of human malaria parasites Plasmodium falciparum. Nature. 1976 Oct;263(5580):767-9. DOI:10.1038/263767a0 [ Links ]
11 Trager W, Jensen JB. Human malaria parasites in continuous culture. Science. 1976 Aug;193(4254):673-5. DOI:10.1126/science.781840 [ Links ]
12 Diggs C, Joseph K, Flemmings B, Snodgrass R, Hines F. Protein synthesis in vitro by cryopreserved Plasmodium falciparum. Am J Trop Med Hyg. 1975 Sep;24(5):760-3. [ Links ]
13 Rieckmann KH, Campbell GH, Sax LJ, Mrema JE. Drug sensitivity of Plasmodium falciparum: an in-vitro microtechnique. Lancet. 1978 Jun;1(8054):22-3.
14 Basco LK, Le Bras J. In vitro susceptibility of Cambodian isolates of Plasmodium falciparum to halofantrine, pyrona rid in e an d a rtemi sin in derivatives. Ann Trop Med Parasitol. 1994 Apr;88(2):137-44. [ Links ]
15 Russell BM, Udomsangpetch R, Rieckmann KH, Kotecka BM, Coleman RE, Sattabongkot J. Simple in vitro assay for determining the sensitivity of Plasmodium vivax isolates from fresh human blood to antimalarials in areas where P. vivax is endemic. Antimicrob Agents Chemother. 2003 Jan;47(1):170-3. DOI:10.1128/AAC.47.1.170-173.2003 [ Links ]
16 Wernsdorfer WH, Kouznetsov RL. Drug-resistant malaria: occurrence, control, and surveillance. Bull World Health Organ. 1980;58(3):341-52. [ Links ]
17 Chulay JD, Haynes JD, Diggs CL. Plasmodium falciparum: assessment of in vitro growth by [3H] hypoxanthine incorporation. Exp Parasitol. 1983 Feb;55(1):138-46. DOI:10.1016/0014-4894(83)90007-3 [ Links ]
18 Desjardins RE, Canfield CJ, Haynes JD, Chulay JD. Quantitative assessment of antimalarial activity in vitro by a semiautomated microdilution technique. Antimicrob Agents Chemother. 1979 Dec;16(6):710-8. [ Links ]
19 Druilhe P, Moreno A, Blanc C, Brasseur PH, Jacquier P. A colorimetric in vitro drug sensitivity assay for Plasmodium falciparum based on a highly sensitive double-site lactate dehydrogenase antigen-capture enzyme-linked immunosorbent assay. Am J Trop Med Hyg. 2001 May-Jun;64(5-6):233-41. [ Links ]
20 Noedl H, Wernsdorfer WH, Miller RS, Wongsrichanalai C. Histidine-rich protein II: a novel approach to malaria drug sensitivity testing. Antimicrob Agents Chemother. 2002 Jun;46(6):1658-64. [ Links ]
21 Corbett Y, Herrera L, Gonzalez J, Cubilla L, Capson TL, Coley PD, et al. A novel DNA-based microfluorimetric method to evaluate antimalarial drug activity. Am J Trop Med Hyg. 2004 Feb;70(2):119-24. [ Links ]
22 Johnson JD, Dennull RA, Gerena L, Lopez-Sanchez M, Roncal NE, Waters NC. Assessment and continued validation of the MSF assay for use in malaria drug screening. Antimicrob Agents Chemother. 2007 Jun;51(6):1926-33. DOI:10.1128/AAC.01607-06 [ Links ]
23 Smilkstein M, Sriwilaijaroen N, Kelly JX, Wilairat P, Riscoe M. Simple and inexpensive fluorescence-based technique for high-throughput antimalarial drug screening. Antimicrob Agents Chemother. 2004 May;48(5):1803-6. DOI:10.1128/AAC.48.5.1803-1806.2004 [ Links ]
24 Weisman JL, Liou AP, Shelat AA, Cohen FE, Guy RK, DeRisi JL. Searching for new antimalarial therapeutics amongst known drugs. Chem Biol Drug Des. 2006 Jun;67(6):409-16. DOI:10.1111/j.1747-0285.2006.00391.x [ Links ]
25 Best Plummer W, Pinto Pereira L. Diminished Plasmodium falciparum sensitivity to quinine exposure in vitro and in a sequential multi-drug regimen: a preliminary investigation in Guyana, South America. Int J Infect Dis. 2008 Nov;12(6):e27-31. DOI:10.1016/j.ijid.2008.03.024 [ Links ]
26 Calvosa VS, Adagu IS, Povoa MM. Plasmodium falciparum: emerging mefloquine resistance in vitro in Para State, north Brazil. Trans R Soc Trop Med Hyg. 2001 May-Jun;95(3):330-1.
27 Ferreira ID, Martinelli A, Rodrigues LA, Carmo EL, Rosário VE, Póvoa MM, et al. Plasmodium falciparum from Para State (Brazil) shows satisfactory in vitro response to artemisinin derivatives and absence of the S769N mutation in the SERCA-type PfATPase6. Trop Med Int Health. 2008 Feb;13(2):199-207. [ Links ]
28 Le Bras J, Deloron P, Hartmann JF, Coulanges P, Dourado HV, Larouze B. Application of an in vitro semi-microtest to the study of drug sensitivity of 66 Plasmodium falciparum isolates from 15 countries. Trans R Soc Trop Med Hyg. 1984;78(4):485-8. [ Links ]
29 Elabbadi N, Ancelin ML, Vial HJ. Use of radioactive ethanolamine incorporation into phospholipids to assess in vitro antimalarial activity by the semiautomated microdilution technique. Antimicrob Agents Chemother. 1992 Jan;36(1):50-5. [ Links ]
30 Brockman A, Singlam S, Phiaphun L, Looareesuwan S, White NJ, Nosten F. Field evaluation of a novel colorimetric method--double-site enzyme-linked lactate dehydrogenase immunodetection assay--to determine drug susceptibilities of Plasmodium falciparum clinical isolates from northwestern Thailand. Antimicrob Agents Chemother. 2004 Apr;48(4):1426-9. DOI:10.1128/AAC.48.4.1426-1429.2004 [ Links ]
31 Kaddouri H, Nakache S, Houze S, Mentre F, Le Bras J. Assessment of the drug susceptibility of Plasmodium falciparum clinical isolates from Africa by using a Plasmodium lactate dehydrogenase immunodetection assay and an inhibitory maximum effect model for precise measurement of the 50-percent inhibitory concentration. Antimicrob Agents Chemother. 2006 Oct;50(10):3343-9. DOI:10.1128/AAC.00367-06 [ Links ]
32 Noedl H, Attlmayr B, Wernsdorfer WH, Kollaritsch H, Miller RS. A histidine-rich protein 2-based malaria drug sensitivity assay for field use. Am J Trop Med Hyg. 2004 Dec;71(6):711-4. [ Links ]
33 Noedl H, Wernsdorfer WH, Kollaritsch H, Looareesuwan S, Miller RS, Wongsrichanalai C. Malaria drug-susceptibility testing. HRP2-based assays: current data, future perspectives. Wien Klin Wochenschr. 2003;115 Suppl 3:23-7. [ Links ]
34 Brown WM, Yowell CA, Hoard A, Vander Jagt TA, Hunsaker LA, Deck LM, et al. Comparative structural a nalysis and kin eti c properties of l actate dehydrogenases from the four species of human malarial parasites. Biochemistry. 2004 May;43(20):6219-29. DOI: 10.1021/bi049892w [ Links ]
35 Piper KP, Roberts DJ, Day KP. Plasmodium falciparum: analysis of the antibody specificity to the surface of the trophozoite-infected erythrocyte. Exp Parasitol. 1999 Feb;91(2):161-9. DOI:10.1006/EXPR.1998.4368 [ Links ]
36 Barends M, Jaidee A, Khaohirun N, Singhasivanon P, Nosten F. In vitro activity of ferroquine (SSR 97193) against Plasmodium falciparum isolates from the Thai-Burmese border. Malar J. 2007 Jun;6:81. DOI:10.1186/1475-2875-6-81 [ Links ]
37 Basco LK, Marquet F, Makler MM, Le Bras J. Plasmodium falciparum and Plasmodium vivax: lactate dehydrogenase activity and its application for in vitro drug susceptibility assay. Exp Parasitol. 1995 Mar;80(2):260-71.![]() DOI:10.1006/Expr.1995.1032 [ Links ]
DOI:10.1006/Expr.1995.1032 [ Links ]
38 Makler MT, Ries JM, Williams JA, Bancroft JE, Piper RC, Gibbins BL, et al. Parasite lactate dehydrogenase as an assay for Plasmodium falciparum drug sensitivity. Am J Trop Med Hyg. 1993 Jun;48(6):739-41. [ Links ]
39 Noedl H, Bronnert J, Yingyuen K, Attlmayr B, Kollaritsch H, Fukuda M. Simple histidine-rich protein 2 double-site sandwich enzyme-linked immunosorbent assay for use in malaria drug sensitivity testing. Antimicrob Agents Chemother. 2005 Aug;49(8):3575-7. DOI:10.1128/AAC.49.8.3575-3577.2005 [ Links ]
40 Baker J, McCarthy J, Gatton M, Kyle DE, Belizario V, Luchavez J, et al. Genetic diversity of Plasmodium falciparum histidine-rich protein 2 (PfHRP2) and its effect on the performance of PfHRP2-based rapid diagnostic tests. J Infect Dis. 2005 Sep;192(5):870-7. DOI:10.1086/432010 [ Links ]
41 Gamboa D, Ho MF, Bendezu J, Torres K, Chiodini PL, Barnwell JW, et al. A large proportion of P. falciparum isolates in the Amazon region of Peru lack pfhrp2 and pfhrp3: implications for malaria rapid diagnostic tests. PLoS One. 2010 Jan;5(1):e8091. DOI:10.1371/journal.pone.0008091 [ Links ]
42 Baniecki ML, Wirth DF, Clardy J. High-throughput Plasmodium falciparum growth assay for malaria drug discovery. Antimicrob Agents Chemother. 2007 Feb;51(2):716-23. DOI:10.1128/AAC.01144-06 [ Links ]
43 Johnson JD, Dennull RA, Gerena L, Lopez-Sanchez M, Roncal NE, Waters NC. Assessment and continued validation of the malaria SYBR green I-based fluorescence assay for use in malaria drug screening. Antimicrob Agents Chemother. 2007 Jun;51(6):1926-33. Doi:10.1128/AAC.01607-06 [ Links ]
44 Madrid PB, Wilson NT, DeRisi JL, Guy RK. Parallel synthesis and antimalarial screening of a 4-aminoquinoline library. J Comb Chem. 2004 May-Jun;6(3):437-42. DOI: 10.1021/cc0340473 [ Links ]
45 Snounou G, Beck HP. The use of PCR genotyping in the assessment of recrudescence or reinfection after antimalarial drug treatment. Parasitol Today. 1998 Nov;14(11):462-7. DOI:10.1016/S0169-4758(98)01340-4 [ Links ]
46 Price RN, Dorsey G, Ashley EA, Barnes KI, Baird JK, Guerin PJ, et al. World Antimalarial Resistance Network I: clinical efficacy of antimalarial drugs. Malar J. 2007 Sep;6:119. DOI:10.1186/1475-2875-6-119 [ Links ]
47 van den Berghe L, Vincke I, Chardome M. Tissular phase of Plasmodium berghei. Ann Soc Belg Med Trop (1920). 1950 Mar;30(1):79-82.
48 Landau I, Chabaud AG. Natural infection by 2 plasmodia of the rodent Thamnomys rutilans in the Central African Republic. C R Acad Sci Hebd Seances Acad Sci D. 1965 Jun;261(1):230-2. [ Links ]
49 Bafort JM. The biology of rodent malaria with particular reference to Plasmodium vinckei vinckei Rodhain 1952. Ann Soc Belges Med Trop Parasitol Mycol. 1971 May;51(1):5-203.
50 Landau I, Chabaud AG. Secondary hepatic schizonts in spontaneous malaria in rodents. C R Acad Sci Hebd Seances Acad Sci D. 1968 Apr;266(17):1730-3. [ Links ]
51 Phillips RS, Brannan LR, Balmer P, Neuville P. Antigenic variation during malaria infection: the contribution from the murine parasite Plasmodium chabaudi. Parasite Immunol. 1997 Sep;19(9):427-34. [ Links ]
52 van Vianen PH, van Engen A, Thaithong S, van der Keur M, Tanke HJ, van der Kaay HJ, et al. Flow cytometric screening of blood samples for malaria parasites. Cytometry. 1993;14(3):276-80. [ Links ]
53 Ancelin ML, Calas M, Bonhoure A, Herbute S, Vial HJ. In vivo antimalarial activities of mono- and bis quaternary ammonium salts interfering with Plasmodium phospholipid metabolism. Antimicrob Agents Chemother. 2003 Aug;47(8):2598-605. DOI: 10.1128/AAC.47.8.2598-2605.2003 [ Links ]
54 Bagot S, Nogueira F, Collette A, Rosario V, Lemonier F, Cazenave PA, et al. Comparative study of brain CD8+ T cells induced by sporozoites and those induced by blood-stage Plasmodium berghei ANKA involved in the development of cerebral malaria. Infect Immun. 2004 May;72(5):2817-26. DOI:10.1128/IAI.72.5.2817-2826.2004 [ Links ]
55 Becker SI, Wang R, Hedstrom RC, Aguiar JC, Jones TR, Hoffman SL, et al. Protection of mice against Plasmodium yoelii sporozoite challenge with P. yoelii merozoite surface protein 1 DNA vaccines. Infect Immun. 1998 Jul;66(7):3457-61. [ Links ]
56 Gautret P, Chabaud AG, Landau I. Plasmodium vinckei vinckei and P. yoelii nigeriensis: pattern of gametocyte production and development. Parassitologia. 1995 Apr;37(1):17-24. [ Links ]
57 Carter R, Beach RF. Gametogenesis in culture by gametocytes of Plasmodium falciparum. Nature. 1977 Nov;270(5634):240-1.
58 Landau I, Chabaud AG. Latency of Plasmodium merozoites and drug-resistance: a review. Parasite. 1994 Jun;1(2):105-14. [ Links ]
59 Killick-Kendrick R, Rajapaksa N, Peters W, Garnham PC, Cheong WH, Cadigan FC. Malaria parasites of the orang-utan. Trans R Soc Trop Med Hyg. 1973;67(1):1-2.
60 Landau I, Boulard Y, Seureau C, Peters W. Retarded schizogony of Plasmodium yoelii yoelii in rodents treated with ethionine or subjected to a methionine deficiency: histological and ultrastructural studies. Ann Parasitol Hum Comp. 1982;57(1):1-20. [ Links ]
61 Peters W. The chemotherapy of rodent malaria: XXII. The value of drug-resistant strains of P. berghei in screening for blood schizontocidal activity. Ann Trop Med Parasitol. 1975 Jun;69(2):155-71. [ Links ]
62 Fidock DA, Rosenthal PJ, Croft SL, Brun R, Nwaka S. Antimalarial drug discovery: efficacy models for compound screening. Nat Rev Drug Discov. 2004 Jun;3(6):509-20.DOI:10.1038/nrd1416 [ Links ]
63 Carlton JM, Angiuoli SV, Suh BB, Kooij TW, Pertea M, Silva JC, et al. Genome sequence and comparative analysis of the model rodent malaria parasite Plasmodium yoelii yoelii. Nature. 2002 Oct;419(6906):512-9. DOI:10.1038/nature01099 [ Links ]
64 Gautret P, Coquelin F, Mora-Silvera E, Chabaud AG, Landau I. Chronosexuality of Plasmodium species of Central African Muridae. Parassitologia. 1998 Sep;40(3):255-8. [ Links ]
65 Moore JM, Kumar N, Shultz LD, Rajan TV. Maintenance of the human malarial parasite, Plasmodium falciparum, in scid mice and transmission of gametocytes to mosquitoes. J Exp Med. 1995 Jun;181(6):2265-70.
66 Moreno A, Badell E, Van Rooijen N, Druilhe P. Human malaria in immunocompromised mice: new in vivo model for chemotherapy studies. Antimicrob Agents Chemother. 2001 Jun;45(6):1847-53. DOI:10.1128/AAC.45.6.1847-1853.2001 [ Links ]
67 Moreno A, Ferrer E, Arahuetes S, Eguiluz C, Van Rooijen N, Benito A. The course of infections and pathology in immunomodulated NOD/LtSz-SCID mice inoculated with Plasmodium falciparum laboratory lines and clinical isolates. Int J Parasitol. 2006 Mar;36(3):361-9. DOI:10.1016/J.IJPARA.2005.10.012 [ Links ]
68 Moreno Sabater A, Moreno M, Moreno FJ, Eguiluz C, van Rooijen N, Benito A. Experimental infection of immunomodulated NOD/LtSz-SCID mice as a new model for Plasmodium falciparum erythrocytic stages. Parasitol Res. 2005 Jan;95(2):97-105. DOI:10.1007/s00436-004-1249-7 [ Links ]
69 Tsuji M, Ishihara C, Arai S, Hiratai R, Azuma I. Establishment of a SCID mouse model having circulating human red blood cells and a possible growth of Plasmodium falciparum in the mouse. Vaccine. 1995;13(15):1389-92. DOI:10.1016/0264-410X(95)00081-B [ Links ]
70 Jimenez-Diaz MB, Mulet T, Viera S, Gomez V, Garuti H, Ibanez J, et al. Improved murine model of malaria using Plasmodium falciparum competent strains and non-myelodepleted NOD-scid IL2Rgammanull mice engrafted with human erythrocytes. Antimicrob Agents Chemother. 2009 Oct;53(10):4533-6. DOI:10.1128/AAC.00519-09 [ Links ]
71 Legrand N, Ploss A, Balling R, Becker PD, Borsotti C, Brezillon N, et al. Humanized mice for modeling human infectious disease: challenges, progress, and outlook. Cell Host Microbe. 2009 Jul;6(1):5-9. DOI:10.1016/J.CHOM.2009.06.006 [ Links ]
72 Moreno JE, Rubio-Palis Y, Paez E, Perez E, Sanchez V. Abundance, biting behaviour and parous rate of anopheline mosquito species in relation to malaria incidence in gold-mining areas of southern Venezuela. Med Vet Entomol. 2007 Dec;21(4):339-49.
73 Angulo-Barturen I, Jimenez-Diaz MB, Mulet T, Rullas J, Herreros E, Ferrer S, et al. A murine model of falciparum-malaria by in vivo selection of competent strains in non-myelodepleted mice engrafted with human erythrocytes. PLoS One. 2008 May;3(5):e2252. DOI:10.1371/journal.pone.0002252 [ Links ]
74 Clemedson C, Kolman A, Forsby A. The integrated acute systemic toxicity project (ACuteTox) for the optimisation and validation of alternative in vitro tests. Altern Lab Anim. 2007 Mar;35(1):33-8. [ Links ]
75 Jonville MC, Kodja H, Humeau L, Fournel J, De Mol P, Cao M, et al. Screening of medicinal plants from Reunion Island for antimalarial and cytotoxic activity. J Ethnopharmacol. 2008 Dec;120(3):382-6. [ Links ]
76 Mahmoudi N, Julian-Ortiz JV, Ciceron L, Galvez J, Mazier D, Danis M, et al. Identification of new antimalarial drugs by linear discriminant analysis and topological virtual screening. J Antimicrob Chemother. 2006 Mar;57(3):489-97. DOI:10.1093/JAC/DKI470 [ Links ]
77 Solis PN, Wright CW, Anderson MM, Gupta MP, Phillipson JD. A microwell cytotoxicity assay using Artemia salina (brine shrimp). Planta Med. 1993 Jun;59(3):250-2. DOI:10.1055/s-2006-959661 [ Links ]
78 Hollingdale MR, Leland P, Schwartz AL. In vitro cultivation of the exoerythrocytic stage of Plasmodium berghei in a hepatoma cell line. Am J Trop Med Hyg. 1983 Jul;32(4):682-4. [ Links ]
79 Gamo FJ, Sanz LM, Vidal J, Cozar C, Alvarez E, Lavandera JL, et al. Thousands of chemical starting points for antimalarial lead identification. Nature. 2010 May;465(7296):305-10. DOI:10.1038/nature09107 [ Links ]
80 Decker T, Lohmann-Matthes ML. A quick and simple method for the quantitation of lactate dehydrogenase release in measurements of cellular cytotoxicity and tumor necrosis factor (TNF) activity. J Immunol Methods. 1988 Nov;115(1):61-9. [ Links ]
81 Skehan P, Storeng R, Scudiero D, Monks A, McMahon J, Warren JT, et al. New colorimetric cytotoxicity assay for anticancer-drug screening. J Nat Cancer Inst. 1990 Jul;82(13):1107-12. [ Links ]
82 Zhang SZ, Lipsky MM, Trump BF, Hsu IC. Neutral red (NR) assay for cell viability and xenobiotic-induced cytotoxicity in primary cultures of human and rat hepatocytes. Cell Biol Toxicol. 1990 Apr;6(2):219-34. [ Links ]
83 Pieters R, Huismans DR, Leyva A, Veerman AJ. Adaptation of the rapid automated tetrazolium dye based (MTT) assay for chemosensitivity testing in childhood leukemia. Cancer Lett. 1988 Aug;41(3):323-32. [ Links ]
84 Wongsrichanalai C, Varma JK, Juliano JJ, Kimerling ME, MacArthur JR. Extensive drug resistance in malaria and tuberculosis. Emerg Infect Dis. 2010 Jul;16(7):1063-7. [ Links ]
85 Butcher GA. Antimalarial drugs and the mosquito transmission of Plasmodium. Int J Parasitol. 1997 Sep;27(9):975-87. DOI:10.1016/S0020-7519(97)00079-9 [ Links ]
86 Coleman RE . Sporontocidal activity of the antimalarial WR-238605 against Plasmodium berghei ANKA in Anopheles stephensi. Am J Trop Med Hyg. 1990 Mar;42(3):196-205. [ Links ]
87 Coleman RE, Nath AK, Schneider I, Song GH, Klein TA, Milhous WK. Prevention of sporogony of Plasmodium falciparum and P. berghei in Anopheles stephensi mosquitoes by transmission-blocking antimalarials. Am J Trop Med Hyg. 1994 May;50(5):646-53. [ Links ]
88 Coleman RE, Polsa N, Eikarat N, Kollars Jr TM, Sattabongkot J. Prevention of sporogony of Plasmodium vivax in Anopheles dirus mosquitoes by transmission-blocking antimalarials. Am J Trop Med Hyg. 2001 Sep;65(3):214-8. [ Links ]
89 Garner P, Graves PM. The benefits of artemisinin combination therapy for malaria extend beyond the individual patient. PLoS Med. 2005 Apr;2(4):e105. DOI:10.1371/journal.pmed.0020105 [ Links ]
90 Price RN, Nosten F, Luxemburger C, Paiphun L, Chongsuphajaisiddhi T, White NJ, et al. Effects of artemisinin derivatives on malaria transmissibility. Lancet. 1996 Jun;347(9016):1654-8. [ Links ]
91 Sutherland CJ, Ord R, Dunyo S, Jawara M, Drakeley CJ, Pinder M, et al. Reduction of malaria transmission to Anopheles mosquitoes with a six-dose regimen of co-artemether. PLoS Med. 2005 Apr;2(4):e92. DOI:10.1371/JOURNAL.PMED.0020092 [ Links ]
92 Targett G, Drakeley C, Jawara M, von Seidlein L, Coleman R, Deen J, et al. Artesunate reduces but does not prevent posttreatment transmission of Plasmodium falciparum to Anopheles gambiae. J Infect Dis. 2001;183(8):1254-9. DOI:10.1086/319689 [ Links ]
93 Duffy PE, Sibley CH. Are we losing artemisinin combination therapy already? Lancet. 2005 Dec;366(9501):1908-9. DOI:10.1016/S0140-6736(05)67768-9 [ Links ]
94 Jambou R, Legrand E, Niang M, Khim N, Lim P, Volney B, et al. Resistance of Plasmodium falciparum field isolates to in-vitro artemether and point mutations of the SERCA-type PfATPase6. Lancet. 2005 Dec;366(9501):1960-3. DOI:10.1016/S0140-6736(05)67787-2 [ Links ]
95 Noedl H, Krudsood S, Leowattana W, Tangpukdee N, Thanachartwet W, Looareesuwan S, et al. In vitro antimalarial activity of azithromycin, artesunate, and quinine in combination and correlation with clinical outcome. Antimicrob Agents Chemother. 2007 Feb;51(2):651-6. DOI:10.1128/AAC.01023-06 [ Links ]
96 Pradel G. Proteins of the malaria parasite sexual stages: expression, function and potential for transmission blocking strategies. Parasitology. 2007 Dec;134(Pt 14):1911-29. DOI:10.1017/S0031182007003381 [ Links ]
97 Sinden RE. The cell biology of sexual development in Plasmodium. Parasitology. 1983 Apr;86(Pt 4):7-28. [ Links ]
98 Billker O, Lindo V, Panico M, Etienne AE, Paxton T, Dell A, et al. Identification of xanthurenic acid as the putative inducer of malaria development in the mosquito. Nature. 1998 Mar;392(6673):289-92. DOI:10.1038/32667 [ Links ]
99 Garcia GE, Wirtz RA, Barr JR, Woolfitt A, Rosenberg R. Xanthurenic acid induces gametogenesis in Plasmodium, the malaria parasite. J Biol Chem. 1998 May;273(20):12003-5. [ Links ]
100 Nijhout MM, Carter R. Gamete development in malaria parasites: bicarbonate-dependent stimulation by pH in vitro. Parasitology. 1978 Feb;76(1):39-53.
101 Billker O, Dechamps S, Tewari R, Wenig G, Franke-Fayard B, Brinkmann V. Calcium and a calcium-dependent protein kinase regulate gamete formation and mosquito transmission in a malaria parasite. Cell. 2004 May;117(4):503-14. DOI:10.1016/S0092-8674(04)00449-0 [ Links ]
102 Tewari R, Ogun SA, Gunaratne RS, Crisanti A, Holder AA. Disruption of Plasmodium berghei merozoite surface protein 7 gene modulates parasite growth in vivo. Blood. 2005 Jan;105(1):394-6. DOI 10.1182/blood-2004-06-2106 [ Links ]
103 Raabe AC, Billker O, Vial HJ, Wengelnik K. Quantitative assessment of DNA replication to monitor microgametogenesis in Plasmodium berghei. Mol Biochem Parasitol. 2009 Dec;168(2):172-6.![]() DOI:10.1016/J.MOLBIOPARA.2009.08.004 [ Links ]
DOI:10.1016/J.MOLBIOPARA.2009.08.004 [ Links ]
104 Zoungrana A, Coulibaly B, Sie A, Meissner P, Mockenhaupt FP, Kouyaté B, et al. Safety and efficacy of methylene blue combined with artesunate or amodiaquine for uncomplicated falciparum malaria: a randomized controlled trial from Burkina Faso. PLoS One. 2008 Feb;3(2):e1630. doi:10.1371/journal.pone.0001630 [ Links ]
105 Lucantoni L, Yerbanga RS, Lupidi G, Pasqualini L, Esposito F, Habluetzel A. Transmission blocking activity of a standardized neem (Azadirachta indica) seed extract on the rodent malaria parasite Plasmodium berghei in its vector Anopheles stephensi. Malar J. 2010 Mar;9:66. DOI:10.1186/1475-2875-9-66 [ Links ]
106 Vale N, Prudencio M, Marques CA, Collins MS, Gut J, Nogueira F, et al. Imidazoquines as antimalarial and antipneumocystis agents. J Med Chem. 2009 Dec;52(23):7800-7. DOI: 10.1021/jm900738c [ Links ]
107 Davies CS, Pudney M, Nicholas JC, Sinden RE. The novel hydroxynaphthoquinone 566C80 inhibits the development of liver stages of Plasmodium berghei cultured in vitro. Parasitology. 1993 Jan;106(Pt 1):1-6. [ Links ]
108 Shanks GD, Biomndo K, Guyatt HL, Snow RW. Travel as a risk factor for uncomplicated Plasmodium falciparum malaria in the highlands of western Kenya. Trans R Soc Trop Med Hyg. 2005 Jan;99(1):71-4. DOI:10.1016/J.TRSTMH.2004.04.001 [ Links ]
109 Beaudoin RL, Strome CP, Clutter WG. Cultivation of avian malaria parasites in mammalian liver cells. Exp Parasitol. 1974 Dec;36(3):355-9. Doi:10.1016/0014-4894(74)90075-7
110 Dubin IN, Laird RL, Drinnon VP. Further observations on the development of sporozoites of Plasmodium gallinaceum into cryptozoites in tissue culture. J Natl Malar Soc. 1950 Jun;9(2):119-27.
111 Hawking F. Growth of Protozoa in tissue culture 1. Plasmodium gallinaceum, exoerythrocytic forms. Trans R Soc Trop Med Hyg. 1945 Dec;39(3):245-63. DOI:10.1016/0035-9203(45)90026-5 [ Links ]
112 Laird RL, Dubin IN, Drinnon VP. The infection of chicks with pre-erythrocytic stages of Plasmodium gallinaceum grown in tissue culture. J Natl Malar Soc. 1950 Jun;9(2):128-31.
113 Millet P, Landau I, Baccam D, Miltgen F, Peters W. Cultivation of exo-erythrocytic schizonts of rodent Plasmodium in hepatocytes: a new experimental model for chemotherapy of malaria. C R Acad Sci III. 1985;301(8):403-6. [ Links ]
114 Sinden RE, Suhrbier A, Davies CS, Fleck SL, Hodivala K, Nicholas JC. The development and routine application of high-density exoerythrocytic-stage cultures of Plasmodium berghei. Bull World Health Organ. 1990;68 Suppl:115-25. [ Links ]
115 Dawson JR, Adams DJ, Wolf CR. Induction of drug metabolizing enzymes in human liver cell line Hep G2. FEBS Lett. 1985 Apr;183(2):219-22. [ Links ]
116 Doostdar H, Demoz A, Burke MD, Melvin WT, Grant MH. Variation in drug-metabolizing enzyme activities during the growth of human HepG2 hepatoma cells. Xenobiotica. 1990 Apr;20(4):435-41. [ Links ]
117 Millet P, Collins WE, Aikawa M, Cochrane AH, Nguyen-Dinh P. Use of non-human primate hepatocytes for in vitro study of the pre-erythrocytic stages of malaria parasites. Bull World Health Organ. 1990;68 Suppl:60-5. [ Links ]
118 Mazier D, Landau I, Miltgen F, Druilhe P, Lambiotte M, Baccam D, et al. In vitro infection of adult Thamnomys hepatocytes by sporozoites of Plasmodium yoelii: development of schizonts and release of infective merozoites. Ann Parasitol Hum Comp. 1982;57(1):99-100.
119 Gruner AC, Hez-Deroubaix S, Snounou G, Hall N, Bouchier C, Letourneur F, et al. Insights into the P. y. yoelii hepatic stage transcriptome reveal complex transcriptional patterns. Mol Biochem Parasitol. 2005 Aug;142(2):184-92. DOI:10.1016/j.molbiopara.2005.03.019 [ Links ]
120 Mahmoudi N, Ciceron L, Franetich JF, Farhati K, Silvie O, Eling W, et al. In vitro activities of 25 quinolones and fluoroquinolones against liver and blood stage Plasmodium spp. Antimicrob Agents Chemother. 2003 Aug;47(8):2636-9. DOI:10.1128/AAC.47.8.2636-2639.2003 [ Links ]
121 Bruña-Romero O, Hafalla JCR, González-Aseguinolaza G, Sano G, Tsuji M, Zavala F. Detection of malaria liver-stages in mice infected through the bite of a single Anopheles mosquito using a highly sensitive real-time PCR. Int J Parasitol. 2001 Nov;31(13):1499-502. DOI:10.1016/S0020-7519(01)00265-X [ Links ]
122 Siau A, Silvie O, Franetich JF, Yalaoui S, Marinach C, Hannoun L, et al. Temperature shift and host cell contact up-regulate sporozoite expression of Plasmodium falciparum genes involved in hepatocyte infection. PLoS Pathog. 2008 Aug;4(8):e1000121. DOI:10.1371/JOURNAL.PPAT.1000121 [ Links ]
123 Witney AA, Doolan DL, Anthony RM, Weiss WR, Hoffman SL, Carucci DJ. Determining liver stage parasite burden by real time quantitative PCR as a method for evaluating pre-erythrocytic malaria vaccine efficacy. Mol Biochem Parasitol. 2001 Dec;118(2):233-45. DOI:10.1016/S0166-6851(01)00372-3 [ Links ]
124 Li J, Wirtz RA, Schneider I, Muratova OV, McCutchan TF, Appiah A, et al. Plasmodium falciparum: stage-specific ribosomal RNA as a potential target for monitoring parasite development in Anopheles stephensi. Exp Parasitol. 1993 Feb;76(1):32-8. DOI:10.1006/EXPR.1993.1004 [ Links ]
125 Gego A, Silvie O, Franetich JF, Farhati K, Hannoun L, Luty AJ, et al. New approach for high-throughput screening of drug activity on Plasmodium liver stages. Antimicrob Agents Chemother. 2006 Apr;50(4):1586-9. DOI:10.1128/AAC.50.4.1586-1589.2006 [ Links ]
126 Tarun AS, Baer K, Dumpit RF, Gray S, Lejarcegui N, Frevert U, et al. Quantitative isolation and in vivo imaging of malaria parasite liver stages. Int J Parasitol. 2006 Oct;36(12):1283-93. DOI:10.1016/J.IJPARA.2006.06.009 [ Links ]
127 Ono K, Okajima T, Tani M, Kuroda S, Sun D, Davidson VL, et al. Involvement of a putative. [Fe-S]-cluster-binding protein in the biogenesis of quinohemoprotein amine dehydrogenase. J Biol Chem. 2006;281(19):13672-84. [ Links ]
128 Waters AP, Thomas AW, van Dijk MR, Janse CJ. Transfection of malaria parasites. Methods. 1997 Oct;13(2):134-47. DOI:10.1006/METH.1997.0506 [ Links ]
129 Ploemen IH, Prudencio M, Douradinha BG, Ramesar J, Fonager J, van Gemert GJ, et al. Visualisation and quantitative analysis of the rodent malaria liver stage by real time imaging. PLoS One. 2009 Nov;4(11):e7881. [ Links ]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Fátima Nogueira
Instituto de Higiene e Medicina Tropical,
Universidade Nova de Lisboa
Rua da Junqueira, no 100
CEP: 1349-008 Lisboa-Portugal
Tel: 00351213652600
E-mail:fnogueira@ihmt.unl.pt
Recebido em / Received / Recibido en: 22/7/2010
Aceito em / Accepted / Aceito en: 28/9/2010
*World Health Organization. Assessment of therapeutic efficacy of antimalarial drugs for uncomplicated falciparum malaria in areas with intense transmission. Genebra: World Health Organization; 1996. Disponível em: http://www.who.int/drugresistance/malaria/en/Assessment_malaria_96.pdf.
*World Health Organization. Drug resistance: malaria. Disponível em: http://www.who.int/drugresistance/malaria/en/.
*Pan American Health Organization. RAVREDA-AMI: Amazon Network for the Surveillance of Antimalarial Drug Resistance (RAVREDA) / Amazon Malaria Initiative (AMI). Disponível em: http://www.paho.org/English/ad/dpc/cd/ravreda-ami.htm.
*World Health Organization. Assessment of therapeutic efficacy of antimalarial drugs for uncomplicated falciparum malaria in areas with intense transmission [Internet]. Genebra: World Health Organization; 1996. Disponível em: http://www.who.int/drugresistance/malaria/en/Assessment_malaria_96.pdf.
†World Health Organization. Monitoring Antimalarial Drug Resistance, Report of a WHO Consultation [Internet]. Genebra: World Health Organization; 2001. Disponível em: http://www.who.int/drugresistance/publications/WHO_CDS_CSR_EPH_2002_17/en/index.html.
‡World Health Organization. Drug resistance: malaria. Disponível em: http://www.who.int/drugresistance/malaria/en/.
§WorldWide Antimalarial Resistance Network [Internet]. 2011. Disponível em: http://www.wwarn.org/.
*World Health Organization. Emergence and Spread of Antimicrobial Resistance. Genebra: World Health Organization. Disponível em: http://www.who.int/drugresistance/AMR_Emergence_Spread/en/index.html.











 text in
text in 

