Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.4 Ananindeua Dec. 2010
http://dx.doi.org/10.5123/S2176-62232010000400003
ARTÍCULO ORIGINAL
Comparación de dos pruebas automatizadas por quimioluminiscencia para la detección de anticuerpos contra el virus de la hepatitis C
Felicidade Mota Pereira; Leonardo Assis Bertollo; Maria Alice Sant'Anna Zarife
Laboratório Central de Saúde Pública do Estado da Bahia, Salvador, Bahia, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMEN
INTRODUCIÓN: El diagnóstico correcto de la infección por el virus de la hepatitis C (VHC) es de gran importancia, una vez que su tratamiento es muy costoso y tiene serios efectos colaterales. Las pruebas para la detección de anticuerpos contra el VHC (anti-VHC) han pasado por varias modificaciones y, actualmente, las pruebas de tercera generación son ampliamente utilizadas, por tener mayor sensibilidad y especificidad.
OBJETIVO: El objetivo de este estudio fue el de comparar dos pruebas automatizadas para la detección del anti-VHC por quimioluminiscencia, de tercera generación, disponibles comercialmente.
MÉTODOS: Se utilizaron 67 muestras de la seroteca del Laboratório Central de Saúde Pública do Estado da Bahia (LACEN-BA). Los reactivos utilizados fueron las pruebas automatizadas ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Alemania), Elecsys® anti-HCV assay (Roche Diagnostics, Basilea, Suiza) y la prueba de confirmación Recombinant Immunoblot Assay (RIBA) (Chiron RIBA VHC 3.0 SIA, Chiron Corporation, Emeryville, CA, EUA).
RESULTADOS: Con la prueba Architect anti-HCV assay se obtuvieron 18 muestras positivas, 39 negativas y diez indeterminadas, mientras que con Elecsys anti-HCV assay, 47 muestras fueron negativas y 20 positivas. No hubo muestras indeterminadas con esta prueba. De las diez muestras indeterminadas por Architect anti-HCV assay, cinco fueron negativas por la prueba RIBA y cinco fueron indeterminadas. Todas las muestras indeterminadas por RIBA presentaron reactividad para la proteína c33.
CONCLUSIÓN: Cuando comparadas entre sí, las dos pruebas (62 muestras) tuvieron un 91,9% de concordancia. La prueba Elecsys anti-HCV assay parece ser menos sensible que Architect anti-VHC, en particular para la detección de la proteína c33, revelada por RIBA. Por otro lado, Architect anti-HCV assay presentó un mayor número de resultados indeterminados en muestras negativas confirmadas por RIBA, lo que sugiere una menor especificidad, cuando comparada con la otra prueba evaluada.
Palabras clave: Hepatitis C; Hepatitis C Antibodies; Laboratory Test.
INTRODUCCIÓN
El diagnóstico virológico y el monitoreo de la infección por el virus de la hepatitis C (VHC) se basa en dos tipos de pruebas: la detección serológica del anticuerpo específico contra el VHC (anti-VHC) y la detección del ARN viral o la detección del antígeno core del VHC, que confirma la infección1. Los anticuerpos anti-VHC no posibilitan la distinción entre una infección activa (viremia) y una infección resuelta. Además, se esperan resultados falso negativos a causa de la ventana inmunológica (seroconversión del anti-VHC), que dura entre 45 y 68 días2.
La reacción falso positiva para los anticuerpos anti-VHC es un problema bien conocido. Esto puede suceder debido a algunas interferencias como gamaglobulinas elevadas, síndrome nefrótica, enfermedades del hígado, enfermedades autoinmunes, infecciones virales o parasitarias y muestras de mujeres embarazadas3. El Centers for Disease Control and Prevention (CDC) estima que, en promedio, un 35% de los resultados de anti-VHC en la población inmunocompetente sean falso positivos por metodologías como ELISA imunnoassay (EIA)4.
Actualmente, la detección de los anticuerpos anti-VHC se realiza normalmente, por dos metodologías principales, que son: EIA y quimioluminescencia (CLIA)5. La prueba de EIA para detección de los anticuerpos anti-VHC pasó por varios estadios de desarrollo y las pruebas de tercera generación (EIA III) son los más utilizados, debido a su mayor sensibilidad y especificidad, resultado de mayor reactividad a la región NS3 del virus y de la incorporación de los epítopos de c100 y antígenos de la porción NS5 del genoma viral6. Sin embargo, las pruebas automatizadas por quimioluminescencia están sustituyendo a los EIA por su practicidad, precisión, especificidad superior a 98% y sensibilidad similar al EIA6.
La presencia de anticuerpos anti-VHC no siempre significa la existencia de infección actual, ya que puede representar resultado falso positivo o indicar contacto previo con resolución (cura) de la hepatitis aguda, correspondiendo a una cicatriz inmunológica6. De esta forma, a pesar de la alta especificidad de las pruebas de tercera generación, permanece la necesidad de ser realizadas pruebas confirmatorias en muestras con bajos valores de la relación sample/cut-off (S/CO), con la finalidad de evitar resultados falso positivos7.
Actualmente, las pruebas CLIA son utilizados en laboratorios de grandes rutinas y, aunque las pruebas por quimioluminescencia estén sustituyendo gradualmente el EIA, existen pocos estudios publicados sobre comparación y evaluación de estas pruebas CLIA automatizadas8.
El objetivo de este trabajo fue el de comparar dos pruebas por quimioluminescencia, totalmente automatizadas, de tercera generación, disponibles comercialmente, para detección del anti-VHC, y que son utilizados en la rutina del Laboratorio Central de Salud Pública del Estado de Bahia (LACEN-BA).
MATERIAL Y MÉTODOS
Fueron utilizadas 67 muestras seleccionadas de la seroteca del LACEN-BA. Estas muestras fueron evaluadas previamente y 18 tuvieron resultado positivo para el anti-VHC, 39 fueron negativas y diez, indeterminadas. El LACEN-BA utiliza en su rutina el kit ARCHITECT® anti-HCV assay (Abbott Diagnostics, Wiesbaden, Alemania), siendo este considerado, en este estudio, como referencia para la determinación del anti-VHC en comparación con el kit Elecsys® anti-HCV assay (Roche Diagnostics, Basilea, Suiza). Fue realizada la prueba confirmatoria Recombinant Immunoblot Assay (RIBA) (Chiron RIBA HCV 3.0 SIA, Chiron Corporation, Emeryville, CA, EUA) apenas en las muestras con resultado indeterminado.
Fueron seguidas las instrucciones del fabricante en todas las pruebas. El Architect anti-HCV assay utiliza la metodología quimioluminescencia (CLIA) y se realizó en el equipo totalmente automatizado ARCHITECT i4000 Abbott, mientras que el Elecsys anti-HCV assay utiliza la electroquimioluminescencia (ECLIA) y el equipo utilizado fue el Modular E 170 Roche, también totalmente automatizado.
RIBA es un ensayo immunoblot con tiras impregnadas con péptidos sintéticos y recombinantes (c100, c33, c22 y NS5), aplicados en líneas separadas en la fase sólida1.
Las características de las dos pruebas automatizadas pueden observarse en la tabla 1. En ambas metodologías hay liberación de señales de luz que se expresan por la proporción directa de la cantidad de anticuerpos presentes.

Las dos pruebas emiten los resultados con base en cut-off (CO) de 1,0. La prueba Architect anti-HCV assay expresa el resultado por la relación S/CO y la prueba Elecsys anti-HCV assay por valor de índice. En el LACEN-BA, se consideran como anti-VHC positivos resultados cuatro veces mayores que el cut-off (> 4,0), negativos < 0,9 e indeterminados los resultados entre 0,9 y 4,0, en las dos pruebas evaluadas. Este valor de cut-off fue elegido por tener mayor concordancia (95%) con los resultados positivos obtenidos con la prueba de immunoblot RIBA.
RESULTADOS
Con la utilización del Architect anti-HCV assay se obtuvieron 18 muestras positivas, 39 negativas y diez indeterminadas, mientras que con el Elecsys anti-HCV assay, 47 muestras fueron negativas y 20 positivas. No hubo muestras indeterminadas con esta prueba. Los datos pueden observarse en la tabla 2.

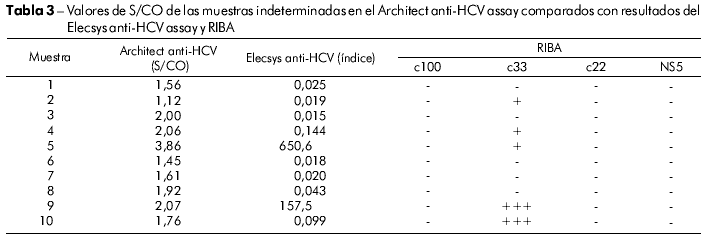
Las diez muestras, con resultados indeterminados con el Architect anti-HCV assay, tuvieron una relación S/CO entre 1,12 a 3,86. De estas, cinco fueron negativas y cinco indeterminadas por el RIBA. Cuando fueron sometidas a la prueba Elecsys anti-HCV assay, ocho fueron negativas y dos fueron positivas. Así, de las 67 muestras analizadas, 44 fueron negativas, 18 positivas y cinco indeterminadas, basadas en los resultados de la prueba RIBA. Todas las muestras con resultado indeterminado por la prueba RIBA mostraron reactividad a la proteína c33. Los resultados de laboratorio de las muestras indeterminadas por el Architect anti-HCV assay, bien como los resultados de la prueba RIBA, están sintetizados en la tabla 3.
DISCUSIÓN
El número de muestras evaluadas en este estudio fue relativamente pequeño, cuando comparado a otros estudios que evaluaron el desempeño de pruebas disponibles comercialmente para la detección del anti-VHC1,5,8.
Entre las 67 muestras analizadas, diez (14,9%) tuvieron resultados discordantes en los dos ensayos utilizados. Con el Architect anti-HCV assay, estas muestras tuvieron relación S/CO inferior a 4,0 y fueron consideradas indeterminadas, mientras que, cuando analizadas con el Elecsys anti-HCV assay, dos fueron positivas y ocho negativas. El uso de la prueba RIBA resolvió el problema en 50% de estas muestras (5/10) con el resultado negativo de la prueba immunoblot. Las muestras que tuvieron resultado indeterminado por la prueba RIBA presentaron resultado positivo tan sólo para la proteína c33.A apresentaram positividade apenas para a proteína c33.
De acuerdo a las recomendaciones del CDC, la determinación del anti-VHC requiere el uso de una prueba de selección de alta sensibilidad y las reacciones con positivad baja deben ser confirmadas con pruebas del tipo immunoblot recombinante o reacción en cadena de la polimerasa, Polimerase Chain Reaction (PCR), para pesquisa del ARN del virus8.
El RIBA puede ser utilizado como prueba confirmatoria complementaria para el anti-VHC, pero presenta algunas desventajas, siendo un de ellas, el alto índice de resultados indeterminados5.
Berger et al1 evaluaron también dos pruebas serológicas y obtuvieron un resultado diferente, con 1,9% de discordancia entre ellas, resolución por la prueba immunoblot de 63,2% de las muestras, con reactividad de hasta dos proteínas.
Las muestras indeterminadas por la prueba RIBA no fueron confirmadas por el RNA viral, ya que no había cantidad suficiente de muestras. Además, la presencia de anti-VHC no significa necesariamente la presencia del virus. Bajos títulos de anticuerpos en la muestra pueden ocurrir en la fase de seroconversión y también cuando los pacientes pierden sus anticuerpos luego de la resolución de la infección.
Normalmente, muestras de pacientes con bajo riesgo para hepatitis C, con resultado de RIBA indeterminado y baja relación S/CO, presentan virus indetectable cuando sometidas al PCR7.
Las dos pruebas, cuando comparados sus muestras positivas y negativas (62 muestras), tuvieron una concordancia de 91,9%, resultado inferior al encontrado por Kim et al8. Ellos verificaron una franja de concordancia de 94,5% a 98,1% en la evaluación de cuatro pruebas anti-VHC incluyendo el Architect anti-HCV assay y Elecsys anti-HCV assay.
Desde que el Architect anti-HCV assay fue lanzado comercialmente, se observaron algunos resultados falso negativos y falso positivos y, por este motivo, el diluente de la prueba fue modificado y nuevos estudios revelaron una mejora en la sensibilidad y especificidad1.
Echevarria et al9 demostraron que el nuevo Architect anti-HCV assay es eficiente para detectar bajos niveles del anticuerpo anti-VHC, tornándolo bastante efectivo para ser utilizado como prueba de selección en banco de sangre.
Con relación al costo/beneficio, el Elecsys anti-HCV assay presenta algunas desventajas cuando comparado con el Architect anti-HCV assay. La presentación del kit Elecsys anti-HCV assay es de 100 pruebas y el reactivo no está pronto para uso, siendo una fuente potencial de contaminación y error preanalítico. La calibración se hace por kit y no por lote y para cada Calibración se gastan cuatro pruebas además de dos controles, disminuyendo la cantidad de pruebas disponibles para las muestras, siendo un mínimo de 94 pruebas por kit. Además, la estabilidad del kit en el equipo es de tres días y el volumen de muestra requerido es mayor que la otra prueba evaluada.
CONCLUSIÓN
De acuerdo con los resultados obtenidos en este estudio, el Elecsys anti-HCV assay parece ser menos sensible que el análisis Architect anti-HCV assay, en lo que dice a la detección de la proteína c33. Por otro lado, el Architect anti-HCV assay mostró un número mayor de resultados indeterminados en muestras negativas confirmadas por el análisis RIBA, lo que sugiere una menor especificidad en relación al otro análisis evaluado.
Todas las muestras con baja relación S/CO deben ser confirmadas con pruebas suplementarias y/o confirmatorias, tales como immunoblot y PCR, con el objetivo de evitar la liberación de resultados falso positivos.
Son necesarios nuevos estudios para una mejor evaluación de las pruebas que utilizan la quimioluminescencia como metodología, incluso con un número mayor de muestras.
REFERENCIAS
1 Berger A, Rabenau H, Allwinn R, Doerr HW. Evaluation of the new Architect anti-VHC screening test under routine laboratory conditions. J Clin Virol. 2008 Oct;43(2):158-61. DOI:10.1016/J.JCV.2008.05.009 [ Links ]
2 Morota K, Fujinami R, Kinukawa H, Machida T, Ohno K, Saegusa H, et al. A new sensitive and automated chemiluminescent microparticle immunoassay for quantitative determination of hepatitis C virus core antigen. J Virol Methods. 2009 Apr;157(1):8-14. DOI:10.1016/J.JVIROMET.2008.12.009 [ Links ]
3 Zachary P, Ullmann M, Djeddi S, Meyer N, Wendling MJ, Schvoerer E, et al. Evaluation of three comercially available hepatitis C virus antibody detection assays under the conditions of a clinical virology laboratory. J Clin Virol. 2005 Nov;34(3):207-10. DOI:10.1016/J.JCV.2005.06.005 [ Links ]
4 Watterson JM, Stallcup P, Escamilla D, Chernay P, Reyes A, Trevino SC. Evaluation of the ortho-clinical diagnostics vitros ECi anti-HCVT test: comparison with three other methods. J Clin Lab Anal. 2007;21(3):162-6. [ Links ]
5 Kesli R, Ozdemir M, Kurtoglu MG, Baykan M, Baysal B. Evaluation and comparison of three different anti-hepatitis C virus antibody tests based on chemiluminescence and enzyme-linked immunosorbent assay methods used in the diagnosis of hepatitis C infections in Turkey. J Int Med Res. 2009 Sep-Oct;37(5):1420-9. [ Links ]
6 Parise E. Diagnóstico sorológico das hepatites crônicas virais. Roche Rev. 2009;8:2-6.
7 Vermeersch P, Van Ranst M, Lagrou K. Validation of a strategy for HCV antibody testing with two enzyme immunoassays in a routine clinical laboratory. J Clin Virol. 2008 Aug;42(4):394-8. DOI:10.1016/J.JCV.2008.02.015 [ Links ]
8 Kim S, Kim JH, Yoon S, Park YH, Kim HS. Clinical performance evaluation of four automated chemiluminescence immunoassays for hepatitis C virus antibody detection. J Clin Microbiol. 2008 Dec;46(12):3919-23. DOI:10.1128/JCM.01603-08 [ Links ]
9 Echevarria JM, Avellón A, Jonas G, Hausmann M, Vockel A, Kapprell HP. Sensitivity of a modified version of the ARCHITECT® anti-HCV test in detecting samples with immunoblot-confirmed, low-level antibody to hepatitis C virus. J Clin Virol. 2006 Apr;35(4):368-72. DOI:10.1016/J.JCV.2005.11.006 [ Links ]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Felicidade Mota Pereira
Rua Waldemar Falcão, 123.
Bairro: Candeal.
CEP: 40296-710
Salvador-Bahia-Brasil
Tel: +55 (71) 3276-1721
E-mail: felizmp@yahoo.com.br
Recebido em / Received / Recibido en: 9/8/2010
Aceito em / Accepted / Aceito en: 20/12/2010











 text in
text in 

