Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.4 Ananindeua Dec. 2010
http://dx.doi.org/10.5123/S2176-62232010000400008
ARTIGO ORIGINAL
Frequência de polimorfismos HLA-DRB1 em pacientes brasileiros com malária por Plasmodium vivaxe em doadores de sangue da Região Amazônica
Luciane Moreno Storti-MeloI; Daniela Reis da CostaI; Wanessa Christina Souza-NeirasI; Gustavo Capatti CassianoI; Cláudia Regina Bonini-DomingosI; Andrea Regina Baptista RossitII; Luiz Carlos de MattosIII; Ricardo Luiz Dantas MachadoIV
IUniversidade Estadual Paulista "Júlio de Mesquita Filho", São José do Rio Preto, São Paulo, Brasil
IIInstituto Biomédico, Universidade Federal Fluminense, Niterói, Rio de Janeiro, Brasil
IIILaboratório de Imunohematologia, Faculdade de Medicina de São José do Rio Preto, São José do Rio Preto, São Paulo, Brasil
IVCentro de Investigação de Microrganismos, Faculdade de Medicina de São José do Rio Preto, São José do Rio Preto, São Paulo, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Este estudo avaliou a frequência de diferentes alelos HLA-DRB1 em indivíduos infectados por Plasmodium vivax e em doadores de sangue saudáveis provenientes de áreas endêmicas de malária do Brasil. Foi realizada uma genotipagem de baixa resolução dos alelos HLA-DRB1 em 73 pacientes com malária e em 29 doadores de sangue saudáveis. Os alelos mais frequentes em indivíduos do norte do Brasil foram HLA-DRB1 *04, *08, *07 e *13. A frequência de HLA-DRB1 *07 foi maior nos indivíduos infectados com malária do que no grupo controle, o que reforça a hipótese de que esse alelo desempenha um papel importante na suscetibilidade à malária. Esta pesquisa fornece novas informações sobre um fator potencial de suscetibilidade à malária por P. vivax em uma população brasileira naturalmente exposta à doença.
Palavras-chave: Malária; Plasmodium vivax; Genes Classe II do Complexo de Histocompatibilidade (MHC).
INTRODUÇÃO
Os antígenos de leucócitos humanos HLA classe II foram originalmente descritos como genes envolvidos na resposta imune, pois diferentes alelos destes genes reconhecidamente influenciam a produção de anticorpos1. Há estudos associando estes alelos a doenças do sistema imunológico, como leucemia2 e vitiligo3. Além disso, estudos populacionais têm relatado a associação de certos alelos HLA à suscetibilidade ou resistência a doenças infecciosas, incluindo a hanseníase4, a leishmaniose mucosa5, a tuberculose6 e a hepatoesplenomegalia em casos de esquistossomose7. Poucos estudos avaliaram a influência dos alelos HLA sobre a imunidade à malária. Os autores de dois estudos (publicados em 1989) não conseguiram estabelecer uma relação entre os tipos de HLA-DR e a resposta imunológica contra a proteína circum-esporozoíta (CSP) de Plasmodium falciparum8 e aos epítopos do esporozoíto e dos gametócitos em Papua Nova Guiné9. No entanto, dois anos depois, descobriu-se que a proteção contra a malária severa causada por P. falciparum era associada à presença dos alelos HLA-Bw53, DRB1*1302 e DQB1*0501 em crianças africanas10. Até o fim do século XX, alguns alelos HLA-DR já haviam sido associados a um aumento na resposta de anticorpos contra Nt47 (porção aminoterminal p126)11, contra o antígeno 1 de membrana apical (AMA-1)12 de P. falciparum e contra a repetição da proteína CSP do P. vivax VK24713.
A maioria dos estudos que investigam a influência dos alelos HLA sobre a resposta imunológica contra a malária tem sido conduzida com antígenos de P. falciparum devido à maior mortalidade atribuída à malária causada por este parasita. No entanto, P. vivax é a espécie responsável pela maior parte dos casos de malária nas Américas do Sul e Central. No Brasil, esta espécie responde por mais de 80% dos casos clínicos registrados na Região Amazônica14. Por isso, é importante compreender os fatores que controlam a resposta imunológica aos candidatos a antígeno de vacinas, como as proteínas de fase assexuada sanguínea de P. vivax, em indivíduos naturalmente expostos ao parasita. Neste estudo, foi avaliada a frequência alélica de HLA-DRB1 em amostras de indivíduos infectados por P. vivax e de doadores de sangue saudáveis provenientes de áreas endêmicas de malária no Brasil.
MATERIAIS E MÉTODOS
SUJEITOS DO ESTUDO E LOCALIDADES
Os pacientes selecionados para este estudo preencheram os seguintes critérios: buscaram atendimento médico devido à presença de sintomas clínicos de malária, tinham mais de 18 anos de idade e apresentavam um diagnóstico positivo de malária por P. vivax pelo método da gota espessa. O termo de livre consentimento esclarecido foi assinado por cada paciente antes da coleta de amostras de sangue periférico. Os sujeitos da pesquisa foram então distribuídos em quatro áreas endêmicas de malária no Brasil: Macapá, Estado do Amapá (00o02'20'' S, 51o03'59'' W); Novo Repartimento, Estado do Pará (04o19'50'' S, 49o47'47'' W); Porto Velho, Estado de Rondônia (-08o45'43'' S, 63o54'14'' W) e Plácido de Castro, Estado do Acre (10o16'33'' S, 67o09'00'' W). Macapá é a capital do Estado do Amapá, localizada às margens do Rio Amazonas, em uma área de floresta tropical. Sua população era estimada em 366.486 habitantes e o seu índice parasitário anual (IPA) foi de 6,0 em 2009. Porto Velho é localizada no Estado de Rondônia, no alto da Bacia Amazônica. Em 2010, Porto Velho tinha cerca de 383.425 habitantes e um IPA de 53,7. Plácido de Castro localiza-se na fronteira dos Estados de Rondônia e Amazonas e tinha uma população de 18.235 habitantes. O IPA de Plácido de Castro era de 20,6 em 2009. Novo Repartimento é uma área de prospecção de ouro localizada no sudeste do Estado do Pará. Sua população era estimada em 55.759 habitantes e apresentou um IPA de 15,4 em 2010. Todos esses lugares caracterizavam-se por apresentar clima tropical sem uma estação seca, com uma precipitação média mensal de mais de 60 mm.
O grupo controle foi composto por doadores de sangue que, de acordo com as normas brasileiras que regulamentam a doação de sangue e os requisitos de inclusão deste estudo, apresentaram as seguintes características: tinham idade superior a 18 anos de idade; nasceram em alguma das cidades da área de estudo; declararam não ter histórico de malária e não apresentavam qualquer sintoma da doença durante a entrevista inicial; e deram negativo em exame pelo método da gota espessa. Foram utilizados métodos de diagnóstico molecular para a comparação das frequências de HLA-DRB. Os sujeitos dos dois grupos não apresentaram diferenças estatisticamente significantes a respeito da média de idade ou etnia, o que indica uma boa correspondência entre eles (teste exato de Fisher, p > 0.05). As amostras de DNA foram extraídas de sangue periférico congelado usando o Easy-DNATMExtraction Kit (Invitrogen, Carlsbad, CA, EUA); o diagnóstico de malária foi confirmado por meio da reação em cadeia de polimerase semi-nested (semi-nested PCR) com primers de rDNA específicos de subunidades pequenas15. O protocolo deste estudo foi analisado e aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de São José do Rio Preto, Estado de São Paulo, Brasil (N. 235/2006).
ALELOS HLA CLASSE II
As amostras de DNA dos pacientes maláricos (n = 73) e dos sujeitos do grupo controle (n = 29) foram submetidas a genotipagem dos alelos HLA-DRB1. A concentração de DNA foi medida usando um espectrofotômetro a 260 e 280 nm, e uma concentração de 100 ng/mL foi utilizada para realizar a genotipagem de baixa resolução de HLA-DRB1 por PCR com primers específicos de sequência (PCR-SSP), como descrito previamente16.
ANÁLISE ESTATÍSTICA
As frequências alélicas foram calculadas pela fórmula AF = a/N, onde a é o número de amostras positivas para um alelo específico e N é o número total de alelos na população estudada17. Foi utilizado o programa R, versão 2.8.1 (The R Foundation for Statistical Computing, Viena, Áustria, http://www.r-project.org) para realizar as análises estatísticas. O equilíbrio de Hardy-Weinberg foi testado de acordo com o preconizado por Guo e Thompson18. A heterogeneidade das frequências alélicas HLA entre os grupos controle e malárico foi avaliada pelo teste do Chi-quadrado, com o teste de correção de Yates ou teste exato de Fisher. Os valores de p abaixo de 0.05 foram considerados estatisticamente relevantes.
RESULTADOS
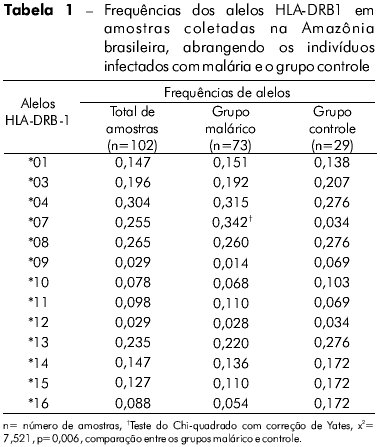
A genotipagem dos alelos HLA-DRB1 foi realizada em um total de 102 indivíduos infectados e não infectados (controle) provenientes de quatro áreas endêmicas do norte do Brasil. Como descrito na tabela 1, foram encontrados 13 alelos diferentes; as frequências observadas para cada indivíduo e para cada grupo também estão apresentadas na tabela 1. Os alelos mais frequentes em ambos os grupos foram HLA-DRB1*04, *08, *07 e *13. Nos indivíduos infectados, os alelos mais frequentes foram HLA-DRB1*04, *08 e *13, seguidos de HLA-DRB1*07. No grupo controle, HLA-DRB1*04, *08, e *13 também foram os mais frequentes, porém HLA-DRB1*07 foi um dos grupos de alelos menos frequentes. Quando comparados os dois grupos de indivíduos, a frequência de HLA-DRB1*07 foi maior no grupo infectado do que no controle; esta diferença foi considerada estatisticamente significante (p = 0.006, teste do Chi-quadrado com o índice de correção de Yates). Os loci estavam em equilíbrio de Hardy-Weinberg na população estudada (Pearson x2 = 0.5, p = 0.799).
DISCUSSÃO
As moléculas de HLA classe II são componentes essenciais da resposta imune adaptativa. Há estudos anteriores que apontam uma correlação entre alelos HLA e a suscetibilidade a diversas doenças, inclusive malária2,3,4,5,6,7,8,9,10,11,12,13. Além disso, variações étnicas e/ou geográficas aparentemente desempenham um papel importante nesta correlação. O Brasil é um país de dimensões continentais e seus habitantes apresentam uma variada composição genética. Esta diversidade resulta em uma população miscigenada composta por contribuições de três importantes grupos: caucasianos, africanos e ameríndios19. Devido ao seu distinto histórico de colonização, cada região do país apresenta diferentes níveis de prevalência para os três grupos étnicos20,21. Encontramos uma alta frequência dos alelos HLA-DRB1*04 nos sujeitos pesquisados, o que guarda semelhança com os resultados apresentados em estudos realizados anteriormente22,23. Como este alelo é característico de povos indígenas das Américas, sua prevalência reflete a contribuição dos ameríndios à composição genética da população brasileira, especialmente no norte do país24. Além disso, a alta frequência de HLA-DRB1*04, observada tanto nos indivíduos infectados quanto nos indivíduos saudáveis, indica que este alelo não está associado à suscetibilidade ou à proteção contra a malária por P. vivax. Por outro lado, a frequência bem mais alta de HLA-DRB1*07 no grupo de indivíduos infectados sugere a participação deste alelo na suscetibilidade à malária. Oliveira-Ferreira et al13 detectaram uma baixa resposta imune induzida por HLA-DRB1*07 contra a região repetitiva da CSP do P. vivax VK210. Em verdade, há estudos com vacinas virais22,25 e candidatas a vacinas com CSP de P. falciparum26 que têm demonstrado que este alelo não consegue ativar uma resposta imune consistente.
Apesar de terem sido observadas diferenças nas frequências HLA-DRB1*07 entre indivíduos infectados e não infectados, não pôde ser estabelecido um mecanismo por meio do qual este alelo deva funcionar na suscetibilidade à malária. Pode haver muitas moléculas de HLA associadas à malária humana, ainda que tenha sido possível analisar apenas os alelos HLA-DRB1 neste estudo. A análise de uma única molécula de HLA não pode refletir completamente como as múltiplas variações genéticas afetam a região MHC. Uma possibilidade é a de os alelos MHC estarem em desequilíbrio de ligação com outros genes envolvidos na suscetibilidade à malária por P. vivax. Além disso, pacientes homozigotos para o alelo HLA-DRB1*07 não poderiam ser distinguidos de portadores devido às limitações referentes às coletas neste estudo.
Na Amazônia brasileira, a malária predomina em condições mesoendêmicas com uma grande variedade de formas de transmissão14.27. Por isso, a endemicidade da malária poderia ser vista como uma pressão seletiva para a manutenção das frequências genotípicas das moléculas de HLA. É necessária uma investigação de outros alelos HLA associados à malária, fazendo uma análise sorológica, clínica e epidemiológica de uma amostra maior. Esse estudo deve avaliar, também, a influência de outras doenças infecciosas. A epidemiologia das doenças infecciosas é condicionada por uma inter-relação complexa entre o parasita, seu vetor e o ser humano. O processo coevolucionário parasita-hospedeiro pode ser visto como uma corrida armamentista, em que as mudanças visando a adaptações genéticas em um são acompanhadas por alterações no outro, neste caso em populações amazônicas geneticamente distintas28.
CONCLUSÃO
Foi descoberto que a frequência alélica HLA-DRB1*07 foi maior nos pacientes de malária do que no grupo controle, o que pode sugerir que este alelo desempenhe um papel na suscetibilidade do sistema imunológico à malária por P. vivax. Os resultados deste estudo corroboram a necessidade de pesquisas sobre os genes ligados ao complexo de histocompatibilidade. Particularmente, há uma carência de estudos com uma amostragem maior, bem como estudos que abranjam indivíduos de áreas com diferentes índices de infecção, para que seja estabelecido de forma mais exata o papel dos alelos HLA na suscetibilidade aos parasitas de P. vivax nesta região.
AGRADECIMENTOS
A todas as pessoas que participaram deste estudo; aos Drs. Carlos Eugênio Cavasini, Aline Barroso, Maria Cristina Figueredo e Mauro Tada, pela colaboração na pesquisa de campo; a Juliana Cintra, pela ajuda com a genotipagem dos alelos HLA; ao Dr Antônio José Cordeiro, por sua participação nas análises estatísticas; ao Prof. Luiz Hildebrando Pereira da Silva, por permitir o uso das instalações do Centro de Pesquisas em Medicina Tropical (CEPEM).
APOIO FINANCEIRO
Esta pesquisa foi financiada pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), São Paulo, Brasil (02/09546-1; 06/00982-4) e Conselho Nacional para o Desenvolvimento Científico e Tecnológico (CNPq), Brasília, Brasil (302353/03-8; 410405/2006-0).
REFERÊNCIAS
1 Germain RN. Antigen processing and presentation. In: Paul WE, editor. Fundamental Immunology. 4th ed. Philadelphia: Lippincott-Raven; 1999. p. 287-340.
2 Ozdilli K, Oguz FS, Anak S, Kekik C, Carin M, Gedikoglu G. The frequency of HLA class I and II alleles in Turkish childhood acute leukaemia patients. J Int Med Res. 2010 Sep-Oct;38(5):1835-44. [ Links ]
3 Hu DY, Ren YQ, Zhu KJ, Lv YM, Cheng H, Zhang Z, et al. Comparisons of clinical features of HLA-DRB1*07 positive and negative vitiligo patients in Chinese Han population. J Eur Acad Dermatol Venereol. In Press 2011. Doi:10.1111/j.1468-3083.2010.03971.x [ Links ]
4 Todd JR, West BC, McDonald JC. Human leukocyte antigen and leprosy: study in northern Louisiana and review. Rev Infect Dis. 1990 Jan-Fev;12(1):63-74. [ Links ]
5 Petzl-Erler ML, Belich MP, Queiroz-Telles F. Association of mucosal leishmaniasis with HLA. Hum Immunol. 1991 Dec;32(4):254-60. D![]() oi:10.1016/0198-8859(91)90088-Q [ Links ]
oi:10.1016/0198-8859(91)90088-Q [ Links ]
6 Duarte R, Carvalho C, Pereira C, Bettencourt A, Carvalho A, Villar M, et al. HLA class II alleles as markers of tuberculosis susceptibility and resistance. Rev Port Pneumol. 2011 Jan;17(1):15-9. [ Links ]
7 Assaad-Khalil SH, Helmy MA, Zaki A, Mikhail MM, el-Hai MA, el-Sawy M. Some genetic, clinical and immunologic interrelations in schistosomiasis mansoni. Ann Biol Clin (Paris). 1993;51(6):619-26. [ Links ]
8 Brown AE, Chandanayingyong D, Fuggle SV, Webster HK. Immune responses to the circumsporozoite protein of Plasmodium falciparum in relation to HLA-DR type. Tissue Antigens. 1989 Sep;34(3):200-4. [ Links ]
9 Graves PM, Bhatia K, Burkot TR, Prasad M, Wirtz RA, Beckers P. Association between HLA type and antibody response to malaria sporozoite and gametocyte epitopes is not evident in immune Papua New Guineans. Clin Exp Immunol. 1989 Dec;78(3):418- 23. [ Links ]
10 Hill AVS, Yates SNR, Allsopp CEM, Gupta S, Gilbert SC, Lalvani A, et al. Human leucocyte antigens and natural selection by malaria. Philos Trans R Soc Lond B Biol Sci. 1994 Nov;346(1317):379-85. [ Links ]
11 Banic DM, Goldberg AC, Pratt-Riccio LR, Oliveira-Ferreira J, Santos F, Gras-Masse H, et al. Human leukocyte antigen class II control of the immune response to p126-derived amino terminal peptide from Plasmodium falciparum. Am J Trop Med Hyg. 2002 May;66(5):509-15. [ Links ]
12 Johnson AH, Lee RG, Mendell NR, Shon D, Suh YJ, Bomba-Nkolo D, et al. Human leukocyte antigen class II alleles influence levels of antibodies to the Plasmodium falciparum asexual-stage apical membrane antigen 1 but not to merozoite surface antigen 2 and merozoite surface protein 1. Infect Immun. 2004 May;72(5):2762-71 . Doi:10.1128/IAI.72.5.2762-2771.2004. [ Links ]
13 Oliveira-Ferreira J, Pratt-Riccio LR, Arruda M, Santos F, Ribeiro CT, Goldberg AC, et al. HLA class II and antibody responses to circumsporozoite protein repeats of P. vivax (VK210, VK247 and P. vivax-like) in individuals naturally exposed to malaria. Acta Trop. 2004 Sep;92(1):63-9. Doi:10.1016/J.Acta tropica.2004.02.011 [ Links ]
14 Oliveira-Ferreira J, Lacerda MVG, Brasil P, Ladislau JLB, Tauil PL, Daniel-Ribeiro CT. Malaria in Brazil: an overview. Malar J. 2010;9:115. Doi:10.1186/1475-2875-9-115. [ Links ]
15 Kimura M, Kaneko O, Liu Q, Zhou M, Kawamoto F, Wataya Y, et al. Identification of the four species of human malaria parasites by nested PCR that targets variant sequences in the small subunit rRNA gene. Parasitol Intern. 1997 Jul;46(2):91-5. Doi:10.1016/s1383-5769(97)00013-5 [ Links ]
16 Olerup O, Zetterquist H. HLA-DR typing by PCR amplification with sequence-specific primers (PCR-SSP) in 2 hours: an alternative to serological DR typing in clinical practice including donor-recipient matching in cadaveric transplantation. Tissue Antigens. 1992 May;39(5):225-35. [ Links ]
17 Garavito EG. Asociación HLA y artritis reumatoidea juvenil: en busca de las bases moleculares dependiente del MHC [tese]. Colombia (CO): Universidad del Norte; 2003.
18 Guo SW, Thompson EA. Performing the exact test of Hardy-Weinberg proportion for multiple alleles. Biometrics.1992 Jun;48(2):361-72. [ Links ]
19 Moraes ME, Fernandez-Viña M, Salatiel I, Tsai S, Moraes JR, Stastny P HLA class II DNA typing in two Brazilian populations. Tissue Antigens. 1993 May;41(5):238-42. [ Links ]
20 Alves-Silva J, Silva SM, Guimarães PEM, Ferreira ACS, Bandelt HJ, Pena SDJ, et al. The ancestry of Brazilian mtDNA lineages. Am J Hum Genet. 2000 Aug;67(2):444-61. [ Links ]
21 Carvalho-Silva DR, Santos FR, Rocha J, Pena SDJ. The phyleogeography of Brazilian Y-chromossomes lineages. Am J Hum Genet. 2001 Jan;68(1):281-6. [ Links ]
22 Polland GA. Influenza Immunization of schoolchildren: can we interrupt community epidemics? Pediatrics. 1999 Jun;103(6 Pt1):1280-2.
23 Parolín ML, Carnese FR. HLA-DRB1 alleles in four Amerindian populations from Argentina and Paraguay. Genet Mol Biol. 2009 Apr;32(2):212-9. [ Links ]
24 Zago MA, Silva Júnior WA, Tavella MH, Santos SE, Guerreiro JF, Figueiredo MS. Interpopulational and intrapopulational genetic diversity of Amerindians as revealed by six variable number of tandem repeats. Hum Hered. 1996 Sep-Oct;46(5):274-89. [ Links ]
25 Desombere I, Willems A, Leroux-Roels G. Response to hepatitis B vaccine: multiple HLA genes are involved. Tissue Antigens. 1998 Jun;51(6):593-604. [ Links ]
26 Nardin EH, Oliveira GA, Calvo-Calle JM, Castro ZR, Nussenzweig RS, Schmeckpeper B, et al. Synthetic malaria peptide vaccine elicits high levels of antibodies in vaccinees of defined HLA genotypes. J Infect Dis. 2000 Nov;182(5):1486-96. Doi:10.1086/315871 [ Links ]
27 Lorenzetti A, Fornazari PA, Bonini-Domingos AC, Souza R, Penhalbel R, Fugikaha E, et al. Mixed Plasmodium falciparum infections and its clinical implications in four areas of the Brazilian Amazon region. Acta Trop. 2008;107(1):8-12. Doi:10.1016/j.actatropica.2008.03.012 [ Links ]
28 Nesse RM, Williams GC. Health and disease. In: Salzano FM, Bortolini MC, editors. The evolution and genetics of Latin American populations. Cambridge: Cambridge University Press; 2002. p. 165-88.
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Luciane Moreno Storti-Melo
Rua José Duran, no 112.
Bairro: Bosque da Felicidade
CEP: 67030-000
São José do Rio Preto-São Paulo-Brasil
Tel.: +55 (17) 3014-5396
E-mail: stortilu@yahoo.com.br
Received / Recebido em / Recibido en: 2/28/2011
Accepted / Aceito em / Aceito en: 5/17/2011











 text in
text in 
 Curriculum ScienTI
Curriculum ScienTI
