Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.1 no.4 Ananindeua Dec. 2010
http://dx.doi.org/10.5123/S2176-62232010000400010
ARTIGO ORIGINAL
Avaliação microbiológica do processo de manipulação de antineoplásicos em um hospital de referência no tratamento de câncer no Estado do Pará, Brasil
Jackeline Sousa CarreraI; Daisy Esther Batista do NascimentoI; Celso da Silva MascarenhasII; Lúcia Carla Vasconcelos de MendonçaIII; Marta Chagas MonteiroIII; Cristiane do Socorro Ferraz MaiaIII
IPrograma de Residência Multiprofissional em Saúde, Hospital Universitário João de Barros Barreto, Universidade Federal do Pará, Belém, Pará, Brasil
IIFarmácia Satélite da Quimioterapia, Hospital Ophir Loyola, Belém, Pará, Brasil
IIIFaculdade de Farmácia, Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Microbial evaluation of the handling of antineoplastic agents at a reference cancer treatment hospital in Pará State, Brazil. Traduzido por: André Monteiro Diniz.
RESUMO
A Resolução RDC 220/04 da Agência Nacional de Vigilância Sanitária estabelece os requisitos mínimos para o funcionamento dos serviços de terapia antineoplásica e enfatiza a importância de um sistema de garantia da qualidade que abranja as melhores práticas para a preparação da terapia antineoplásica. De acordo com os protocolos farmacêuticos, os produtos devem obedecer às especificações determinadas pelas normas da legislação oficial. A qualidade microbiológica do ambiente na preparação das drogas antineoplásicas é um fator essencial para que seja realizada com eficiência e segurança. A segurança dos pacientes depende da esterilidade do produto, pois eles são geralmente imunocomprometidos. O objetivo deste estudo foi avaliar a qualidade microbiológica do processo de manipulação de drogas antineoplásicas em um hospital de referência no tratamento de câncer no Estado do Pará, Brasil. O material foi coletado da cabine de segurança biológica (CSB), de luvas de manipuladores e do sistema de ar-condicionado, por meio de swab de superfície e sedimentação espontânea. Os espécimes de bactéria e fungo foram identificados por procedimentos bioquímicos padrões, bem como por microcultura. Foram isoladas 31 unidades formadoras de colônias: 22 de amostras da CSB, seis do sistema de ar-condicionado e três de luvas de manipuladores. A maioria dos micro-organismos identificados nas amostras da CSB era de Staphylococcus e Bacillus sp. Foram encontrados Staphylococcus e Klebsiella sp nas luvas dos manipuladores e no sistema de ar-condicionado. Os resultados apresentados demonstraram uma contaminação microbiológica nos processos envolvidos na preparação de antineoplásicos. É necessário que se faça um monitoramento contínuo da qualidade microbiológica desses processos, dos equipamentos e do ambiente, e que seja feita a validação da assepsia e a reestruturação do espaço físico, para que sejam obedecidas as Resoluções RDC 50/02 e 220/04.
Palavras-chave: Antineoplásicos; Contaminação de Medicamentos; Boas Práticas de Manipulação; Staphylococcus; Bacillus; Klebsiella.
INTRODUÇÃO
A terapia com drogas antineoplásicas, ou quimioterapia, tornou-se um dos mais importantes e promissores procedimentos antineoplásicos. Ela compreende o uso de agentes químicos individualmente ou combinados, administrados por via oral, intravenosa, intra-arterial, intracavitária ou intramuscular para o tratamento de doenças. Esta terapia é uma forma de tratamento sistêmico e difere das terapias mais antigas e de outras opções de tratamento localizado, como a cirurgia e a radioterapia1.
A preparação e manipulação de produtos estéreis, como os agentes quimioterápicos, exigem cuidados e devem ser realizadas por pessoal qualificado após treinamento específico em procedimentos assépticos, de modo a assegurar uma consistência na obtenção de produtos estéreis de qualidade aceitável2. A contaminação microbiana pode comprometer o desempenho do produto por acarretar uma quebra na estabilidade de sua formulação ou por modificar as características físicas e organolépticas, levando à inativação de seus ingredientes ativos e de seus excipientes3.
A técnica asséptica para a preparação de soluções intravenosas é de extrema importância para a sobrevivência do paciente, pois, uma vez contaminada, a terapia pode ocasionar infecções sistêmicas após sua inoculação na corrente sanguínea4. Como estes pacientes são tipicamente imunossuprimidos e a maioria das drogas quimioterápicas não apresenta atividade antimicrobiana (especialmente contra Pseudomonas aeruginosa e o multirresistente Staphylococcus aureus), a segurança do paciente depende da esterilidade do produto5.
Por esta razão, os estudos que avaliam os processos de preparação de produtos estéreis são extremamente importantes, já que permitem a análise de possíveis contaminações microbianas em todas as suas fases. O crescimento microbiano é uma evidência de que a técnica e/ou a estrutura física do ambiente não segue o Regulamento Técnico estabelecido pela RDC 220/04 da Agência Nacional de Vigilância Sanitária (Anvisa), que determina os requisitos mínimos para a realização dos serviços de terapia antineoplásicas (STA). A regulamentação oficial exige que um sistema de garantia de qualidade seja incorporado às boas práticas de preparação de terapia antineoplásica (BPPTA), além de um efetivo controle de qualidade documentado e monitorado. Portanto, o objetivo deste estudo foi avaliar a qualidade microbiológica da fase de manipulação dos STA em um hospital de referência no tratamento de câncer na Cidade de Belém, Estado do Pará, Brasil, para que sejam obedecidas as determinações previstas nas BPPTA e, consequentemente, seja assegurada a qualidade do produto e do serviço e corrigido qualquer descumprimento de procedimentos previstos pela legislação vigente6,7.
MATERIAIS E MÉTODOS
AMOSTRAS E LOCAL DO ESTUDO
As amostras foram coletadas por três dias e foram escolhidas aleatoriamente durante a preparação dos agentes quimioterápicos na sala de preparo dos STA em um hospital de referência em oncologia na Cidade de Belém.
O material de estudo foi composto por 31 colônias coletadas mediante o seguinte procedimento: uma placa foi colocada dentro da cabine de segurança biológica (CSB) por 6 h (método de sedimentação); uma placa continha uma amostra coletada por meio de swab de superfície da CSB; duas placas continham uma amostra cada, obtidas das luvas de três manipuladores denominados A, B e C, coletadas no início e no fim do período de estudo; e uma placa foi colocada em frente ao sistema de ar-condicionado por 5 min.
PRINCÍPIO DAS TÉCNICAS
Trata-se de um estudo observacional, descritivo, prospectivo no qual duas técnicas de coleta de amostras de ar foram utilizadas para controle microbiológico do ambiente: o método de placas de sedimentação8,9 e o método de placas de contato de superfície10.
O método de swab de superfície foi utilizado para coletar material de superfícies de contato e das luvas dos manipuladores. O método de placas de sedimentação foi utilizado para coletar amostras do sistema de ar-condicionado e da CSB. Este método consistiu em expor uma placa de Petri de 90 mm de diâmetro com 20 mL de um meio seletivo ou não seletivo (o ágar nutriente) ao ar daquele ambiente por 6 h. As colônias foram depositadas por gravidade e então contadas. As placas foram identificadas e guardadas em caixas de poliestireno (isopor) sob condições assépticas e posteriormente transportadas para o laboratório de microbiologia, onde foram incubadas a 37o C por 24 a 48 h; a análise foi realizada determinando-se o número de unidades formadoras de colônias (UFC's), de acordo com Pasquarella et al8.
Posteriormente, as colônias foram submetidas à coloração de Gram e identificadas com base em suas características. Em seguida, foram cultivadas a 37o C em ágar MacConkey (HIMEDIA) ou ágar manitol salgado (HIMEDIA) (em duas placas para cada meio). As colônias que apresentavam cocos Gram-positivos agrupados em clusters foram submetidas a testes de identificação bioquímica para identificação de catalase, oxidase e coagulase11. Os organismos Gram-negativos foram identificados com base em seu crescimento em ágar MacConkey e foram submetidos a testes bioquímicos, como ácido cítrico, ureia, H2S, indol, motilidade, lisina descarboxilase e fermentação de oxidase/glucose e sacarose, para identificação de enterobactérias e bacilos não fermentadores12. O crescimento fúngico em meio de Sabouraud foi analisado em uma lâmina utilizando coloração azul algodão ou clareada com KOH e microcultura.
A técnica de microcultura consiste na colocação de uma pequena amostra do meio de cultura contendo os fungos em uma lâmina para observação em microscópio. Uma lamela é posicionada sobre a amostra e a lamina é então colocada em um recinto úmido. O fungo cresce na parte inferior da lamela e desenvolve frutificações que podem ser analisadas diretamente sob o microscópio sem que sejam destruídas durante a manipulação11. Os limites recomendados para o monitoramento microbiológico de ambientes limpos são determinados pela Convenção de Inspeção Farmacêutica (PIC), que descreve a preparação asséptica de soluções em seu grau A10,13 (Tabela 1).

ÉTICA
Este projeto (protocolo 1329/10) foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Universitário João de Barros Barreto da Universidade Federal do Pará (HUJBB/UFPA) (CAAE - 3076.0.000.071-10) e os procedimentos adotados seguem a Resolução 196/96 do Conselho Nacional de Saúde.
RESULTADOS
Um total de 31 UFC's foi isolado das fontes analisadas: 22 (71%) foram obtidas da CSB, três (10%) foram obtidas das luvas de manipuladores e seis (19%) foram obtidas do sistema de ar-condicionado (Figura 1).
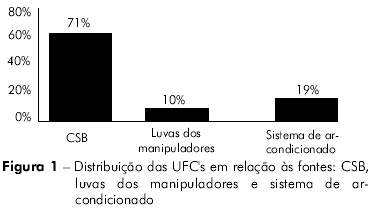
A análise qualitativa das colônias demonstrou que micro-organismos potencialmente patogênicos haviam sido isolados de todas as amostras provenientes das três fontes analisadas. As bactérias do grupo com estafilococos coagulase-negativos foram os micro-organismos mais frequentes nas amostras analisadas (23 de 31 colônias ou 74,19%).
No total, 18 (82%) das 22 UFC's isoladas provenientes da CSB foram obtidas por meio do método de sedimentação e quatro (18%) foram obtidas pelo método de swab de superfície. Os resultados mostraram uma frequência maior de bactérias Gram-positivas; o microorganismo mais frequente foi o estafilococo coagulase-negativo (73%), seguido do bacilo Gram-positivo (13,5%). Apenas uma bactéria Gram-negativa foi isolada: um bacilo Gram-negativo não fermentador (4,5%)14. Foram também encontrados fungos filamentosos do gênero Curvularia sp a uma frequência de 9% (Tabela 2).

As amostras extraídas das luvas foram coletadas em dois momentos distintos: antes e depois do processo de manipulação. Não foi observado crescimento nas amostras das luvas obtidas no início da manipulação, o que demonstrou que as luvas eram estéreis. No entanto, foi observada a contaminação em amostras obtidas no segundo dia da coleta.
Das três luvas analisadas, apenas as amostras coletadas do manipulador B apresentou contaminação microbiológica por bactérias coagulase-negativas (duas UFC's, 67%) e Klebsiella sp (uma UFC, 33%).
Nas amostras extraídas do sistema de ar-condicionado do ambiente de manipulação, foram encontradas cinco (83%) UFC's de estafilococos coagulase-negativos e uma (17%) UFC de Klebsiella sp. Além disso, foram observadas variações na temperatura do ambiente de manipulação, e ausência de filtro no sistema de ar-condicionado.
DISCUSSÃO
A quantificação de micróbios no ar é difícil de ser realizada e os quatro métodos principais são: contagem de UFC/m3 de ar, contagem de UFC's em placas, medição de componentes químicos em células microbianas/m3 no ar; e contagem com o uso de microscópio. As amostras de ar podem ser coletadas de duas formas: amostragem ativa do ar, que envolve a coleta de um volume conhecido de ar em um meio nutriente utilizando técnicas diferenciadas e específicas; e amostragem passiva, que consiste na utilização de placas de Petri contendo meio nutriente sólido expostas ao ar por um determinado período de tempo. Este último é considerado um método qualitativo8.
Neste estudo, a análise revelou uma alta taxa de contaminação nas amostras analisadas, especialmente na cabine de classe 2BII e nas luvas dos técnicos, onde não deveria ocorrer nenhum crescimento microbiano15.
Os principais micro-organismos isolados das amostras extraídas da CSB, que foram identificados como estafilococos coagulase-negativos (73%) e bacilos Gram-positivos (13,5%), são bastante distribuídos no meio ambiente e constituem parte da flora normal da pele e membranas mucosas de humanos e animais. Estudos recentes sobre o monitoramento microbiológico em ambientes não classificados utilizando a mesma metodologia detectaram a presença destes micro-organismos9.
Apesar desses micro-organismos serem considerados contaminantes ambientais, eles podem se comportar como patógenos oportunistas, causando doenças em indivíduos imunocomprometidos. Este fato é relevante, uma vez que a maior parte dos pacientes de câncer é imunocomprometida16. Estafilococos coagulase-negativos, em particular, têm sido apontados como importantes agentes de doenças em humanos, como a bacteremia, a endocardite, a osteomielite, além da em ergência da resistência a antimicrobianos frequentemente utilizados11.
Os dois métodos utilizados para a coleta de amostras da CSB apresentaram um crescimento de bacilos Gram-positivos e de fungos filamentosos do gênero Curvularia sp, considerado um contaminante ambiental comum16. As bactérias e os fungos são mais associados a biocontaminantes que comprometem a qualidade do ar interno de ambientes17.
Os achados de um estudo conduzido por Andrade Silva et al18 em um ambiente de manipulação de um hospital usando a mesma metodologia adotada nesta pesquisa também demonstraram a presença de fungos filamentosos e outros micro-organismos.
A presença desses organismos sugere que o processo de limpeza do ambiente e dos equipamentos não é adequado ou que não há controle da entrada e saída dos indivíduos desses ambientes. Estudos realizados no Brasil enfatizam a importância de restringir o acesso à área de manipulação apenas a pessoal capacitado, para, assim, minimizar a contaminação por micróbios e partículas19,20.
A contaminação das luvas de manipuladores por micro-organismos normalmente envolve a flora normal, estafilococos coagulase-negativos e Klebsiella sp e confirma o papel do técnico como um veículo de contaminação21. Nos casos em que foi detectada contaminação nas luvas de manipuladores, observou-se que as mãos foram repetidamente retiradas da cabine durante o processo de manipulação para pegar frascos de medicamentos, seringas ou outros materiais; este fato não foi observado com outros técnicos. Este procedimento deve ser evitado, pois pode resultar em contaminação, uma vez que o fluxo laminar é interrompido e microorganismos podem ser transferidos das luvas para a CSB22. De acordo com a American Society of Health-System Pharmacists, todo material necessário para a preparação asséptica deve ser manipulado na área crítica, i.e., dentro da CSB, para evitar a interrupção do fluxo de ar entre o filtro HEPA e a manipulação de frascos e outros recipientes. Este foi o cenário provável no estudo em questão, pois a ausência de crescimento microbiológico nas amostras coletadas das luvas antes do processo de manipulação confirmava sua esterilidade12. Portanto, a validação da esterilização das mãos dos manipuladores, de sua conscientização e de sua capacitação é extremamente importante para a manutenção da assepsia do ambiente.
Os principais grupos de partículas contaminantes no ar de locais com ambiente climatizado incluem fungos, bactérias, esporos e vírus que têm origem no ar externo, no sistema de ar-condicionado, na construção, no mobiliário e especialmente em seus ocupantes23. Nesta pesquisa, a contaminação das amostras extraídas das luvas dos manipuladores foi igual à encontrada nas amostras do sistema de ar-condicionado, com exceção do número de UFC's (cinco colônias de estafilococos coagulase-negativos e uma colônia de Klebsiella sp). Com base nesta metodologia, a presença de fungos contaminantes não foi observada, talvez devido ao tempo de exposição do estudo. No entanto, outros estudos já relataram a frequência de contaminação bacteriana em ambientes hospitalares limpos. Muitos estudos têm demonstrado que a avaliação do nível de contaminação em áreas consideradas de risco é muito importante para a prevenção de infecções24.
É importante observar que o espaço físico da farmácia de quimioterápicos analisada não obedecia ao disposto nas RDCs 220/04 e 50/02, o que pode contribuir para a contaminação do ar ambiente. Em 2004, a Anvisa estabeleceu os requisitos mínimos para a operação dos STA no Regulamento Técnico previsto pela RDC 220/04. Estes requisitos envolvem a exigência de que os STA tenham um sistema de garantia de qualidade que incorpore as BPPTA e um efetivo controle de qualidade documentado e monitorado. Este sistema assegura a avaliação e o registro periódico dos pontos críticos do processo, bem como a implementação de ações corretivas e a melhoria dos processos, de modo a assegurar a qualidade desses produtos6,7.
Esta pesquisa foi socializada entre os farmacêuticos do Departamento de Oncologia do hospital em questão, onde mudanças nos procedimentos operacionais padrões foram imediatamente realizadas, adotando-se principalmente a presença de um assistente no ambiente de manipulação para evitar a remoção excessiva da mão do manipulador de dentro da CSB, bem como a desinfecção de medicamentos e do ar-condicionado do ambiente limpo com álcool 70%, minimizando assim a contaminação microbiológica. Entretanto, a validação dos procedimentos para a garantia da assepsia dos produtos é de grande importância.
CONCLUSÃO
Em resumo, este estudo demonstrou a contaminação do ambiente e durante o processo de manipulação especialmente por bactérias e fungos, que são potencialmente patogênicos para indivíduos imunocomprometidos.
Esses achados, juntamente com os descritos por outros autores e pela legislação em vigor, sugerem a necessidade de um monitoramento contínuo da qualidade microbiológica dos processos, equipamentos e preparação ambiental dos agentes quimioterápicos, bem como de uma validação da assepsia e reestruturação do espaço físico, de acordo com as RDC's 50/02 e 220/04, com o objetivo de otimizar a terapia e minimizar os riscos para a saúde pública.
São necessários outros estudos para avaliar o produto final e confirmar a contaminação como resultado de processos de manipulação imprecisos e não validados.
APOIO FINANCEIRO
Projeto financiado por bolsas do Programa de Residência Multiprofissional em Saúde, vinculado ao HUJBB/UFPA, Ministério da Educação, Brasil.
REFERÊNCIAS
1 Cleton FJ. Chemotherapy: general aspects. In: Peckham M, Pinedo HM, Veronesi H, editors. Oxford textbook of oncology. New York: Oxford University Press; 1995. vol. 1, p. 445-53.
2 Schneider PJ. Process validation. In: Buchanan EC, McKinnon BT, Scheckelhoff DJ, Schneider PJ, editors. Principles of sterile product preparation. Bethesda: American Society of Health-System Pharmacists; 1995. p. 121-4.
3 Yamamoto CH, Pinto TJA, Meurer VM. Controle de qualidade microbiológico de produtos farmacêuticos, cosméticos e fototerápicos produzidos na Zona da Mata, Minas Gerais. Anais do 2o Congresso Brasileiro de Extensão Universitária; 2004 set 12-15; Belo Horizonte. Belo Horizonte: Universidade Federal de Minas Gerais; 2004. p. 1-7. [ Links ]
4 Dalgo ML. Normatização farmacêutica em terapia nutricional. In: Waitzberg DL, editor. Nutrição oral, enteral e parenteral na prática clínica. 2. ed. São Paulo: Atheneu; 2002. p. 929-45.
5 Krämer I, Wenchel HM. Viability of microorganisms in antineoplastic drug solutions. Eur J Hosp Pharm. 1991 Jun;1:14-9.
6 Agência Nacional de Vigilância Sanitária (BR). Resolução RDC no 220, de 21 de setembro de 2004. Aprova o regulamento técnico de funcionamento dos serviços de terapia antineoplásica. Diário Oficial da União. Brasília, 23 set. 2004.
7 Agência Nacional de Vigilância Sanitária (BR). Resolução RDC no 50, de 21 de fevereiro de 2002. Dispõe sobre o Regulamento Técnico para planejamento, programação, elaboração e avaliação de projetos físicos de estabelecimentos assistenciais de saúde. Diário Oficial da União, 20 mar. 2002.
8 Pasquarella C, Pitzurra O, Sarno A. The index of microbial air contamination. J Hosp Infect. 2000 Dec;46(4):241-56. [ Links ]
9 Morais GR, Silva MA, Carvalho MV, Santos JGS, Dolinger EJO, Brito DD. Qualidade do ar interno em uma instituição de ensino superior brasileira. Biosci J. 2010 mar-abr;26(2):305-10. [ Links ]
10 Pharmaceutical inspection convention. Pharmaceutical inspection co-operation scheme: guide to good manufacturing practice for medicinal products. Geneva: PIC/S; 2004. 143 p. [ Links ]
11 Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn Jr WC. Diagnóstico microbiológico: texto e atlas colorido. São Paulo: Medsi; 2001. 1465 p.
12 Koneman EW, Allen SD, Janda WM, Schreckenberger PC, Winn Jr WC. Diagnóstico microbiológico: texto e atlas colorido. 6. ed. São Paulo: Guanabara Koogan; 2008. 1468 p.
13 European good manufacturing practices. Guide to manufacture of sterile medicinal products; 1997.
14 Neder RN. Microbiologia: manual de laboratório. São Paulo: Nobel; 1992. p. 25-6.
15 ASHP guidelines on quality assurance for pharmacy-prepared sterile products. Am J Health Syst Pharm. 2000 Jun;57(12):1150-69.
16 Zanon U. Riscos infecciosos imputados ao lixo hospitalar: realidade epidemiológica ou ficção sanitária? Rev Soc Bras Med Trop. 1990 jul-set;23(3):163-70. [ Links ]
17 Gontijo Filho PP, Silva CRM, Kritski AL. Ambientes climatizados, portaria 3.523 de 28/8/98 do Ministério da Saúde e padrões de qualidade do ar de interiores do Brasil. J Bras Pneumol. 2000 set-out;26(5):254-8. Doi:10.1590/S0102-35862000000500006 [ Links ]
18 Andrade SI, Gontijo Filho PP, Melo GB. Análise microbiológica quantitativa e qualitativa do ar do centro cirúrgico durante realização de cirurgias cardíacas no hospital de clínicas da Universidade Federal de Uberlândia. Hor Ci. 2010;3(2):1-19.
19 Maravich MD, Morgan B. Alkylating Agents. In: Kirkwood JM, Lotze MT, Yasko JM, editors. Current Cancer Therapeutics. 2. ed. Churchill Livingstone; 1996. p. 1-36.
20 Polliack A. A handbook of essential drugs and regimens in hematological oncology. Chur: Harwood Academic Publishers; 1991. 180 p.
21 Pratt RJ, Pellowe CM, Wilson JA, Loveday HP, Haper PJ, Jones SRLJ, et al. Epic2: national evidence-based guidelines for preventing healthcare-associated infections in NHS hospitals in England. J Hosp Infect. 2007 Feb;65 Suppl 1:S1-64. [ Links ]
22 Flores A. Appropriate glove use in the prevention of cross-infection. Nurs Stand. 2007 May;21(35):45-8. [ Links ]
23 World Health Organization. Indoor air quality: biological contaminants, report on a WHO meeting, Rautavaara, 29 August - 2 September 1988. Copenhagen: WHO Regional Office for Europe; 1990. 67 p.
24 Wanner H-U, Verhoeff A, Colombi A, Flannigan B, Gravesen S, Mouilleseaux A, et al. European collaborative action: environment & quality of life indoor air quality and its impact on man. Luxembourg: Office for Official Publications of the European Communities; 1993. 81 p. (Environment and quality of life, Report No. 12: Biological particles in indoor).
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Cristiane do Socorro Ferraz Maia
Faculdade de Farmácia,
Universidade Federal do Pará
Av. Augusto Corrêa, no 01, Bairro: Guamá
CEP: 66075-110
Belém-Pará-Brasil
Tel.: +55 (91) 3201-7202
E-mail: crismaia@ufpa.br
Received / Recebido em / Recibido en: 3/9/2011
Accepted / Aceito em / Aceito en: 4/12/2011











 text in
text in 

