Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.2 n.1 Ananindeua mar. 2011
http://dx.doi.org/10.5123/S2176-62232011000100002
ARTIGO HISTÓRICO | HISTORICAL ARTICLE | ARTÍCULO HISTÓRICO
Evolução histórica da vigilância epidemiológica e do controle da febre amarela no Brasil
Historical development and evolution of epidemiological surveillance and control of yellow fever in Brazil
Evolución histórica de la vigilancia epidemiológica y del control de la fiebre amarilla en Brasil
Zouraide Guerra Antunes CostaI; Alessandro Pecego Martins RomanoI; Ana Nilce Maia ElkhouryI; Brendan FlanneryII
ISecretaria de Vigilância em Saúde, Ministério da Saúde, Brasília, Brasil
IIOrganização Panamericana da Saúde, Representação Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Se não honramos nosso passado, perdemos nosso futuro. Se
destruímos nossas raízes, não podemos crescer.
Hundertwasser
RESUMO
A febre amarela representou, no passado, um grande flagelo para a população brasileira, como um dos mais dramáticos problemas de saúde pública registrados no país. O Brasil investiu e alcançou um grande desenvolvimento técnico e científico que eliminou a transmissão urbana em nosso país em 1942 e influenciou a campanha de erradicação do Aedes aegypti das Américas, em 1958. A impossibilidade de erradicação da febre amarela silvestre, por se tratar de uma zoonose de animais silvestres, acrescida da ampla dispersão do Aedes aegypti no Brasil após a descontinuidade do programa continental por sua eliminação, torna presente a ameaça de sua re-emergência nos espaços urbanos. Embora os avanços da medicina não tenham impactado de maneira específica a terapêutica da doença, o advento da vacina antiamarílica permitiu controlar e levar para níveis reduzidos a transmissão da forma silvestre para humanos, o que, aliado ao combate do vetor urbano, tem impedido a circulação deste vírus nas populações humanas urbanas nas Américas. Neste trabalho, lança-se um olhar sobre as diversas formas de enfrentamento deste relevante problema de saúde pública desde o seu aparecimento no território brasileiro, sobre as bases técnicas e científicas que fundamentaram as ações em diferentes momentos do passado, sobre o momento atual e, também, sobre as perspectivas do seu controle; sobretudo, busca-se revisar a evolução do sistema de vigilância da febre amarela no Brasil.
Palavras chaves: Febre amarela; história da medicina; saúde pública; vacina contra febre amarela; vigilância epidemiológica.
ABSTRACT
In the past, yellow fever was a major scourge for the Brazilian population, one of the most dramatic public health problems in the country. Brazilian government has invested and achieved a major technical and scientific development, which finally led to the eradication of the urban transmission of the disease in Brazil, in 1 942, and influenced the campaign to eliminate Aedes aegypti in the Americas, in 1 958. The eradication of sylvaticyellow fever is impossible because it is a zoonosis of wild animals and Aedes aegypti has become widely spread in Brazil since the discontinuation of the continental elimination program; therefore its re-emergence in urban areas is a current threat. Although advances in medical sciences have not impacted on the disease's therapeutics in a specific manner, the development of the yellow fever vaccine has allowed its control, and has reduced the transmission levels of its sylvatic type to humans. This reduction and the combat against its urban vector have prevented the circulation of this virus in urban human populations in the Americas. This article casts a glance at the different ways this important public health problem has been confronted since its introduction to the Brazilian territory. It also covers the technical and scientific bases that underlie the actions at different moments of the past, the current status and the prospects for its control. Finally, it aims to analyze the evolution of the surveillance network of yellow fever in Brazil.
Keywords: Yellow Fever; History of Medicine; Public Health; Yellow Fever Vaccine; Epidemiologic Surveillance.
RESUMEN
La fiebre amarilla representó, en el pasado, un gran flagelo para la población brasileña, como uno de los más dramáticos problemas de salud pública registrados en el país. Brasil invirtió y alcanzó un gran desarrollo técnico y científico que eliminó la transmisión urbana en el país en 1942 e influyó la campaña de erradicación del Aedes aegypti de las Américas, en 1958. La imposibilidad de erradicación de la fiebre amarilla silvestre, por tratarse de una zoonosis de animales silvestres, acrecida de amplia dispersión del Aedes aegypti en Brasil después de la discontinuidad del programa continental por su eliminación, vuelve presente la amenaza de re-emergencia en los espacios urbanos. Aunque los avances de la medicina no hayan generado un impacto específico en la terapéutica de la enfermedad, el adviento de la vacuna antiamarílica permitió controlar y reducir los niveles de transmisión de la forma silvestre para humanos, lo que, aliado al combate del vector urbano, ha impedido la circulación de este virus en las poblaciones humanas urbanas en las Américas. En este trabajo, se lanza una mirada sobre las diversas formas de enfrentar este relevante problema de salud pública desde su aparecimiento en el territorio brasileño, sobre las bases técnicas y científicas que fundamentaron las acciones en diferentes momentos del pasado, sobre el momento actual y, también, sobre las perspectivas de su control; sobre todo, se busca revisar la evolución del sistema de vigilancia de la fiebre amarilla en Brasil.
Palabras claves: Fiebre amarilla; historia de la medicina; salud pública; vacuna contra fiebre amarilla; vigilancia epidemiológica.
Um breve histórico da febre amarela no Brasil
A primeira epidemia de febre amarela descrita no Brasil ocorreu em 1685, em Recife, atual capital do Estado de Pernambuco, para onde o vírus teria sido levado em barco procedente de São Tomé, na África, com escala em Santo Domingo, nas Antilhas, onde a enfermidade dizimava a população1,2. A febre amarela permaneceu no Recife por pelo menos dez anos, apresentando-se em caráter esporádico e, às vezes, recrudescendo na época do inverno. Em 1686, irrompeu em Salvador, atual capital do Estado da Bahia, havendo relatos de sua presença ali até meados de 1692, período em que cerca de 25.000 pessoas adoeceram e 900 morreram1.
Durante esse período, imperava a teoria miasmática de transmissão da doença em sua concepção ontológica, ou seja, a doença seria como algo proveniente do exterior que entra no corpo, não fazendo parte da natureza do homem3. Era considerada uma doença contagiosa e pestilencial. Com base nessa perspectiva, eram estimuladas as práticas de controle e cerceamento da liberdade dos indivíduos. Por outro lado, ao relacionar a doença ao "ar pestilencial", as práticas de saúde pública centralizavam-se fundamentalmente no controle do meio ambiente. Sustentadas por essa lógica, medidas de controle foram organizadas com a finalidade de resolver a crise das epidemias.
Assim, em 1691, visando controlar a primeira epidemia de que se tem notícia em território brasileiro, foi posta em prática a primeira campanha profilática no Novo Continente, elaborada por João Ferreira da Rosa, médico português, e executada pelo Marquês de Montebelo, Governador da então Capitania de Pernambuco. Embora utilizando bases técnicas equivocadas, a "ditadura sanitária", operacionalizada mediante ações direcionadas para a segregação dos doentes, purificação do ar, das casas, cemitérios, portos, limpeza das ruas e outras1, alcançou o resultado esperado. Essa campanha lançou as bases do modelo das estratégias de vigilância e controle que se seguiriam.
Durante mais de um século não se encontram relatos sobre a infecção amarílica no Brasil, o que sugere o seu desaparecimento, pelo menos sob a forma epidêmica. Franco refere um episódio relatado por Béranger-Féraud envolvendo a tripulação de um navio francês na Bahia, em 1823, "entretanto não se falava nesta enfermidade no país, naquela ocasião"1. Em setembro de 1849, irrompeu uma epidemia em Salvador, atribuída à chegada de um navio americano que não havia cumprido as rigorosas medidas impostas na "Carta de Saúde". A partir daí, a febre amarela alastrou-se para diversas cidades portuárias, atingindo a capital do Império, Rio de Janeiro, em 1850, quando morreram 4.160 pessoas (Figura 1). Configurava-se um grave problema de saúde pública no país (Figura 2).


Foi, então, instituído pela Secretaria de Estado de Negócios do Império o "Regulamento Sanitário", publicado em 4 de março de 1850, o qual estabelecia normas para a execução da segunda campanha contra a febre amarela organizada no Brasil. Muito semelhante à campanha de 159 anos antes, as práticas instituídas para enfrentar a epidemia constavam de desinfecção dos navios, quarentena, cuidados especiais com os enterros e velórios, medidas sanitárias coletivas que incluíam aterramento de valas e limpeza de esgotos, dentre outras1.
O êxito alcançado com a campanha motivou o governo a organizar a defesa sanitária do país. Pela Lei no 598, de 14 de setembro de 1850, foi criada uma Comissão de Engenheiros para promover melhorias sanitárias e uma Junta de Higiene Pública com o papel de propor as medidas necessárias para a conservação da saúde pública, sendo incorporados a ela os estabelecimentos da Inspeção de Saúde dos Portos do Rio de Janeiro e do Instituto Vacínico, já existentes1. Esse é o primeiro relato sobre organização governamental direcionada para as ações de controle da febre amarela no Brasil. Nesse contexto, foram criadas Comissões de Higiene Pública de Provedores de Saúde Pública em todas as Províncias, hierarquicamente subordinados à Junta que funcionava na Corte, no Rio de Janeiro, posteriormente denominada Junta Central de Higiene Pública. E, com o objetivo de controlar o obituário da epidemia, foi organizado e incorporado à Junta Central o Serviço de Estatística Demográfica, o primeiro do Brasil e da América do Sul. Em 1857, com a extinção das Comissões de Higiene, foram criadas as Inspetorias de Saúde Pública em cada Província do Império1.
Essa estrutura institucional registrava os componentes insalubres do meio ambiente e o estado sanitário dos indivíduos, especialmente nos lugares onde ocorria febre amarela, visando prevenir e impedir novas epidemias. Para isso, lançava mão do conhecimento físico-químico e social da época, bem como da clínica e das novas disciplinas experimentais que necropsiavam cadáveres para estudar as lesões de órgãos e tecidos4.
Na primeira fase desse período, a "vigilância" é expressa em seu significado clássico, cuja utilidade está vinculada aos conceitos de isolamento e quarentena surgidos no final da Idade Média e consolidados, posteriormente, nos séculos XVII e XVIII5. Essa vigilância seria entendida como a "observação sistemática e ativa de casos suspeitos ou confirmados de doenças transmissíveis e de seus contatos" e buscava vigiar e quarentenar o indivíduo, sem interferir no coletivo. Já em meados do século XIX, ainda prevaleciam rigorosas medidas de controle dos indivíduos, mas já se incorporava um componente disciplinar para os espaços urbanos em termos de salubridade pública. Indo um pouco mais além, se, por um lado, o controle dos óbitos poderia servir de instrumento político para angariar fundos destinados a combater a doença, por outro, possibilitava conhecer sua distribuição nos diferentes locais, oportunizando as ações para conter as epidemias.
Oswaldo Cruz e o modelo das campanhas sanitárias – 1903 a 1913
A era Oswaldo Cruz, nos primeiros anos do século XX, foi marcada pela ousadia e força da "polícia sanitária" (Figura 3). A transmissão da doença já havia sido profundamente estudada por Finlay em Cuba6, que formulou a hipótese da transmissão pelo mosquito Stegomyia fasciata (conhecido atualmente como Aedes aegypti). Em continuidade aos estudos de Finlay, a Comissão Reed7 comprovou a transmissão de um agente etiológico após a filtração do sangue em voluntários humanos; Emílio Ribas8 também investigou a transmissão pelo mosquito durante seus estudos de uma epidemia em Sorocaba, interior do Estado de São Paulo.

O enfrentamento da doença foi facilitado pela criação do Serviço de Profilaxia da Febre Amarela, em abril de 1903, cujo objetivo precípuo era eliminar a febre amarela da capital do país, Rio de Janeiro, em quatro anos. As "Instruções para o Serviço de Profilaxia Específica de Febre-Amarela", adotadas em maio daquele ano, regulamentaram e consolidaram a campanha empreendida por Cruz. Com bases técnicas concretas, calcadas no conhecimento sobre a transmissão da doença, e baseando-se, também, na comprovação da não contagiosidade, Oswaldo Cruz muniu-se de plenos poderes para adotar as medidas de controle da doença e direcionou as ações de vigilância e controle para o ponto focal: o mosquito transmissor. O trabalho foi organizado sob forma de campanhas inspiradas na disciplina militar, com os exércitos de "mata mosquitos" entrando nas casas à procura de focos do vetor4.
Entre as medidas de vigilância, instituiu-se a notificação imediata de caso suspeito com a adoção de medidas repressivas enérgicas para os que ocultassem doentes. A febre amarela foi a primeira doença de notificação obrigatória no Brasil. A vigilância sanitária foi aplicada no sentido literal de fiscalização, mediante a organização dos serviços de saúde com a indicação de hospital de referência para o atendimento dos doentes, elaboração de boletins estatísticos e a supervisão das atividades realizadas casa a casa. Além disso, por meio dos "Conselhos ao Povo", eram dadas orientações e esclarecimentos à população sobre como evitar a doença, contando com a participação de todos para eliminar os mosquitos1,4.
Embora não houvesse uma definição explícita de "caso suspeito de febre amarela", o que se procurava era o indivíduo febril e amarelento que apresentasse vômito negro. A instituição da obrigatoriedade da notificação desses casos foi um ponto importante para o combate da doença. A notificação de um caso ao Serviço de Profilaxia conferia oportunidade e utilidade ao sistema para demandar ações imediatas quanto ao atendimento do doente e ataque ao mosquito na residência do paciente e imediações4.
Por outro lado, havia uma preocupação de Oswaldo Cruz em lograr o objetivo proposto com menor custo possível para a implementação das ações. Assim, ainda que importando num ligeiro custo adicional para a instalação das medidas, poder-se-ia economizar em outras ações que deixariam de ser realizadas, tais como o uso de desinfetantes hospitalares, remoção dos doentes e desinfecção de roupas, uma vez que grande parte dos doentes poderia ser tratada no próprio domicílio, reservando-se o tratamento hospitalar para os que não podiam pagar. Para Oswaldo Cruz, o pequeno aumento da despesa traria economia de vidas e "... toda despesa feita em benefício da saúde pública redunda em colossal economia." (Oswaldo Cruz, Exposição no 225, de 1o de abril de 1903).
Nos anos que se seguiram à era oswaldiana, a febre amarela perdeu o seu caráter epidêmico, deixou de ser prioridade da política de saúde, escassearam os recursos para o seu controle e, em consequência, houve um relaxamento das ações propostas por Oswaldo Cruz para os períodos "extraepidêmicos". Os mosquitos voltaram a proliferar nas cidades e explodiram novas epidemias nos grandes centros, inclusive no Rio de Janeiro, que foi palco da última epidemia urbana registrada no país, entre maio de 1928 e setembro de 1929. Nessa ocasião, o modelo profilático oswaldiano repetiu-se com sucesso, agora sob o comando de Clementino Fraga, Diretor-Geral de Saúde Pública4.
A era da Fundação Rockefeller - 1923 a 1939
A Fundação Rockefeller começou sua atuação em terras brasileiras no início dos anos 20, contribuindo com novos conhecimentos sobre a febre amarela mediante uma série de pesquisas de campo. A existência do ciclo silvestre da febre amarela foi descoberta em 1932, por meio de estudos epidemiológicos realizados no Vale do Canaã, Estado do Espírito Santo9,10, derrubando o mito de "doença da cidade".
A descoberta do ciclo silvestre demandou uma série de pesquisas epidemiológicas pela Fundação Rockefeller, na busca dos possíveis vetores e hospedeiros e na tentativa de conhecer sua área geográfica de abrangência em um país de dimensões continentais. As provas de proteção passaram a ser utilizadas também com a finalidade de avaliar a imunidade em animais silvestres e puderam comprovar o importante papel dos primatas não humanos na cadeia epidemiológica. Além disso, os estudos entomológicos realizados nas localidades de ocorrência de casos de febre amarela possibilitaram a identificação de várias espécies de mosquitos silvestres com infecção natural. Os resultados mostraram que a febre amarela silvestre seria a forma de ocorrência usual e que a modalidade urbana parecia ser uma forma exótica de manifestação11.
A Fundação produziu um extenso acervo de imagens, cerca de 15 mil12, associadas a uma rica descrição epidemiológica, ambiental e social das viagens pelo interior do país, que incluía trabalho de campo, moradias dos "amarelentos", mapas aéreos, desenhos, representações cartográficas, atividades de laboratório, e outros itens, gerando, assim, ferramentas valiosas para caracterizar os cenários de manifestação da doença e estabelecer a política de intervenção técnica (Figura 4). O conhecimento científico foi então utilizado para a organização das práticas sanitárias: combate ao mosquito Aedes aegypti nas cidades e em povoados rurais, elaboração de estatísticas e gráficos para orientação das medidas profiláticas e uso da vacina, a partir do momento em que esta foi disponibilizada4.
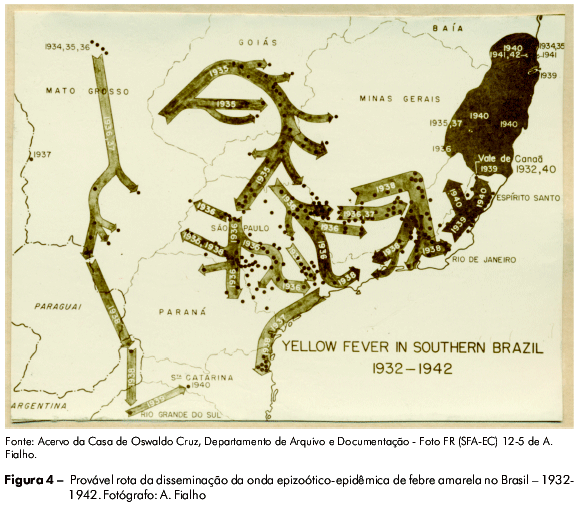
Esse modelo foi muito útil na abertura de linhas de pesquisa epidemiológica, por permitir a elucidação do comportamento da febre amarela e sua distribuição no território nacional, contribuindo para o avanço nesse campo do conhecimento. Os dados coletados por esse sistema eram de boa qualidade e de alta representatividade, possibilitando demonstrar, por exemplo, que a febre amarela silvestre era mais antiga do que se supunha. A sensibilidade e a oportunidade para detecção de casos recentes eram baixas, pois os casos eram identificados a posteriori, muitas vezes depois de decorridos meses ou anos. Entretanto, olhando por outro ângulo, a disponibilidade da informação produzida tornava oportuno o sistema, no sentido de possibilitar o planejamento das ações a longo prazo. O período rockfelleano deixou um legado indelével na organização das informações que podem ser geradas e processadas no espaço delimitado das práticas de saúde4.
Ainda prevalecia o modelo sanitário do tipo campanhista, porém, diferente do momento anterior, das campanhas sanitárias pontuais. Aqui, o modelo teórico-estrutural era apresentado em formato de campanhas verticais, permanentes, de abrangência nacional, com uma organização de trabalho rigorosamente hierarquizada e padronizada. A Fundação propôs um modelo de trabalho de "focos-chaves" para eliminação das larvas do mosquito a ser adotado nas cidades litorâneas, acreditando que, desta forma, os demais focos seriam eliminados automaticamente. Este modelo foi favorecido pela viscerotomia, necrópsia parcial do fígado, implantada oficialmente em 1932, com o propósito de descobrir os casos dissimulados da doença. Amplamente desenvolvida nos vários postos instalados no Brasil - que chegaram a 1.470 no período de 1931 a 1968 - e respaldada por Decreto Federal que determinava a notificação obrigatória e imediata de todo óbito ocorrido com menos de 11 dias de doença, essa prática orientou a descoberta de inúmeros focos em locais tidos como livres da infecção amarílica1.
O modelo rockfelleano se beneficiou ainda com a "prova de proteção", que começou a ser usada em 1928. O método possibilitou o diagnóstico retrospectivo da febre amarela mediante a realização de teste de neutralização em macacos e camundongos utilizando soro de paciente suspeito de ter sido acometido pela doença4. Os dois métodos sustentaram a realização de um grande inquérito epidemiológico no país, finalizado em 1937, que permitiu a construção de mapas para reconhecimento da extensão e peculiaridades da doença, tornando possível a estruturação do perfil do novo programa de enfrentamento da febre amarela. O Serviço de Viscerotomia foi uma das ferramentas de maior utilidade para a identificação do caminho do vírus amarílico na selva, ao lado da realização de estudos de imunidade na população humana e de animais silvestres13.
A vacina contra febre amarela
A identificação da suscetibilidade de camundongos e de macacos rhesus (Macaca mulatta) ao vírus da febre amarela foi um fator decisivo para as primeiras tentativas bem sucedidas em produzir uma vacina de vírus vivo4.
O agente etiológico da febre amarela foi isolado em 1927 por duas equipes independentes: a Fundação Rockefeller, que trabalhava na Nigéria, e o Instituto Pasteur, no Senegal, que isolou a cepa francesa. Os médicos da Fundação Rockefeller H. Bauer e A. F. Mahaffi comprovaram a suscetibilidade do macaco rhesus ao agente da febre amarela mediante a inoculação de sangue de um paciente de nome Asibi (daí o nome da cepa) na África Ocidental, que apresentara a forma moderada da doença, e em seguida, Stokes, Bauer e Hudson confirmaram que o agente era um pequeno vírus filtrável14.
Posteriormente, em 1936, nos laboratórios da mesma Fundação em Nova York, Max Theiler e Hugh H. Smith atenuaram o vírus (cepa Asibi), por meio de múltiplas passagens em macacos rhesus, com períodos intermitentes em Aedes aegypti. O vírus foi propagado em tecido embrionário de camundongos15 e, posteriormente, em cultura de embrião de galinha, onde sofreu novas passagens.
Finalmente, em 1937, foi criada e registrada a primeira vacina eficaz contra febre amarela, conhecida como a cepa 17D ou "vírus camarada". Em seguida, Theiler e Smith realizaram subculturas do vírus 17D em embrião de galinha, até obterem a atenuação do viscerotropismo e neurotropismo por meio de testes que utilizavam macacos suscetíveis16.
A necessidade de controlar tão grave problema de saúde pública acelerou as etapas do ensaio clínico e, tão logo foi constatada sua capacidade imunogênica, a nova vacina foi testada em 100 voluntários humanos da Fundação Rockefeller, em Nova York1. Em janeiro de 1937 foi trazida ao Brasil por Smith para a realização de pesquisas posteriores. Em março daquele ano, passou a ser fabricada no Instituto Oswaldo Cruz, hoje BioManguinhos e, nesse mesmo ano, foi usada pela primeira vez em larga escala no Município de Varginha, em Minas Gerais, estendendo-se posteriormente para outros municípios recém-afetados pela febre amarela silvestre. Em seis meses foram vacinadas 38.077 pessoas1,4,17. Essa campanha foi um marco em termos de logística, registro, controle e técnicas de vacinação em grande escala.
Por muitos anos a vacina antiamarílica foi utilizada como a medida profilática de maior eficácia nas regiões de matas, onde o Aedes aegypti não tem participação no ciclo de transmissão da doença, entendendo-se que assim protegeria a população residente e os trabalhadores expostos à infecção nessas áreas, além de prevenir a entrada do vírus em áreas urbanas por meio de indivíduos virêmicos. A vacina era aplicada de forma gradativa e sistemática nos municípios da área enzoótica (endêmica), a cada cinco anos, por "unidades volantes" de vacinação, visando alcançar a meta de 80%, considerando-se que esse nível conferia uma proteção satisfatória18.
Para as áreas urbanas, os maiores investimentos eram dirigidos à erradicação do vetor urbano, estratégia considerada, à época, mais barata do que a manutenção de serviços permanentes de proteção anti-aegypti. Essa premissa foi declarada em relatório da Organização Pan-Americana da Saúde no Encontro de Ministros de Saúde das Américas, realizado em Buenos Aires, em outubro de 1968, com o seguinte texto: "... não seria vantajoso tentar proteger essas áreas somente com a inoculação; além da impossibilidade de ser mantida a população inteira, adequada e permanentemente inoculada por um período indeterminado, esse tipo de proteção, a longo prazo, tornar-se-ia mais dispendioso do que a erradicação do vetor"1.
Atualmente, com a inexequibilidade da eliminação completa do Aedes aegypti, dada a sua ampla dispersão pelo país e a complexidade da vida moderna, a vacina é o único meio eficaz para prevenir e controlar a febre amarela, uma vez que interrompe o ciclo de transmissão. Nesse contexto, sua utilização visa conferir proteção individual e coletiva à população, bloquear a propagação geográfica da doença criando uma barreira de imunidade e prevenir epidemias. Entretanto, não se pode prescindir da luta anti-aegypti, visando manter sua densidade abaixo do nível crítico (5% de infestação predial) para impedir a transmissão de febre amarela urbana19,20.
Problemas com as primeiras vacinas
Desde o início do uso das vacinas de vírus atenuado, os pesquisadores enfrentaram o problema da atenuação incompleta do vírus de febre amarela. A vacina francesa (referida como a vacina neurotrópica francesa, ou French neurotropic vaccine) causou uma alta incidência de eventos neurológicos em pessoas vacinadas e foi retirada de uso21. Em ensaios clínicos para determinar a idade mínima para imunizar crianças contra febre amarela, a vacina 17D foi associada a risco elevado de eventos neurológicos em crianças com menos que seis meses de idade, e passou a ser contraindicada nessa faixa etária, por essa razão21.
O vírus também mostrou-se capaz de reverter a virulência após passagens múltiplas reagindo com mutações múltiplas, o que levou à criação, em 1940, do sistema de "lote semente" como uma segurança a mais para evitar alterações indesejadas nas propriedades biológicas da vacina durante passagens seriadas21.
Várias linhagens derivadas da cepa 17D foram testadas para alcançar um nível de atenuação com manutenção da imunogenicidade. Uma cepa derivada da cepa 17D foi atenuada demais no laboratório e deixou de ser suficientemente imunogênica21. Todas as vacinas utilizadas atualmente são derivadas da cepa 17D. Atualmente, no Brasil, está sendo utilizada a cepa 17DD, que só difere da anterior pelo número de passagens em um hospedeiro animal, mas é igualmente produzida a partir de lotes sementes derivados da cepa original 17D. A vacina é produzida em ovos embrionados de galinha e, em sua apresentação final, cada 0,5 mL contém, no mínimo, 1000 MLD50*, ou seja, dose suficiente para matar 50% dos camundongos de um determinado grupo inoculado experimentalmente com a vacina.
Após muitos anos de uso e milhões de doses da vacina administradas, um evento adverso ainda mais grave foi identificado em alguns pacientes brasileiros, que desenvolveram uma doença multissistêmica, semelhante à produzida pela infecção natural pelo vírus da febre amarela, após terem recebido uma dose da vacina. Os primeiros casos foram descritos em 1999 no Brasil22, mas, posteriormente, observou-se que pelo menos um caso anterior, na década de 1970, não teria sido detectado pela vigilância devido à semelhança com a doença causada pelo vírus selvagem23. A síndrome, conhecida como doença viscerotrópica aguda, subsequentemente foi descrita nos Estados Unidos, Austrália e outros países, em indivíduos de várias idades, vacinados com as duas cepas utilizadas no mundo. De todos os casos de doença viscerotrópica aguda foi isolado o vírus vacinal, e, no posterior sequenciamento do genoma do vírus, não se demonstrou qualquer alteração nas suas características, permitindo afirmar que esses eventos extremamente raros seriam determinados por fatores individuais, desconhecidos22,24.
Campanha de Erradicação do Aedes aegypti –1940 a 1969
A Fundação Rockefeller saiu da campanha contra a febre amarela em 1940, quando foi criado o Serviço Nacional da Febre Amarela - SNFA (Decreto-Lei no 1.975, de 23 de janeiro de 1940), sob a responsabilidade exclusiva de sanitaristas brasileiros.
A organização dos serviços e o trabalho profilático por ela realizado foram fundamentais para a operacionalidade da nova estrutura. Ademais, o método de trabalho que aquela Fundação vinha realizando contra o Anopheles gambiae no Nordeste brasileiro, desde a segunda metade do ano de 1938, que consistia da inspeção de todas as casas dos municípios infestados, vinha apresentando resultados excelentes. Isso inspirou os dirigentes do SNFA a desenharem uma nova fase na campanha anti-aegypti, agora rumo à erradicação do mosquito, oficializada, posteriormente, pelo Decreto no 8.675, de 4 de fevereiro de 1942.
A iniciativa brasileira foi elogiada na XI Conferência Sanitária Pan-Americana, realizada em 1942, no Rio de Janeiro, ocasião em que foi recomendado "aos Governos dos países em cujos territórios se encontram os vetores da enfermidade, que organizem serviços destinados à sua erradicação baseando-se nos planos adotados no Brasil" 1, o que resultou na resolução da "Erradicação Continental do Aedes aegypti", em 1947. Na prática, a erradicação do Aedes aegypti no Brasil, já sob o comando do Departamento Nacional de Endemias Rurais - DNERu, criado em 1956 (Lei no 2.743, de 6 de março de 1956), foi alcançada e declarada aceita formalmente pela OPAS, em 1958, na XV Conferência Sanitária Pan-Americana, realizada em Porto Rico1.
Como vimos, o modelo campanhista consolidou-se durante a primeira metade do século XX na luta contra a febre amarela, malária, peste e outras doenças, constituindo-se em um avanço para o modelo assistencial da época, de baixa capacidade de resolução para lidar com prevenção e controle de epidemias. O setor saúde não era organizado em uma estrutura capaz de fazer frente aos graves problemas de saúde pública que afligiam a população brasileira, mas as campanhas, com sua organização de caráter sistêmico, foram competentes para impactar esses problemas, pronta e eficazmente, apesar de terem sido originadas num contexto de autoritarismo25. As medidas anti-aegypti mostraram-se eficazes para evitar as epidemias e a propagação do vírus de uma cidade para outra. Foi assim que a febre amarela urbana foi eliminada do país, em 1942.
A Campanha contra a Febre Amarela se alicerçava em três pilares: na vigilância anti-aegypti, que consistia na inspeção vetorial de 100% dos prédios, com tratamento à base de inseticidas naqueles positivos para o mosquito; na viscerotomia, com o controle rígido dos postos e do número de amostras de fígado coletadas; e na vacinação em larga escala, como visto anteriormente no parágrafo sobre vacina.
Nesse período, considera-se o sistema de vigilância de casos baseado em laboratório altamente específico, mas de baixa sensibilidade para detectar casos e epidemias. Pode-se visualizar alguma flexibilidade na medida em que se faz uma adaptação da metodologia do trabalho de campo em resposta a uma nova demanda surgida com a observação do trabalho antianofelino, no Nordeste brasileiro.
O Instituto Evandro Chagas e a vigilância sentinela de arboviroses
O Instituto Evandro Chagas (IEC) foi criado em 1936, com o nome de Instituto de Patologia Experimental do Norte (IPEN), pelo Governo Estado do Pará e, em 1942, foi federalizado, passando a ser órgão de pesquisa científica da Fundação Serviços de Saúde Pública – FSESP. Em 1954, com o suporte da Fundação Rockefeller, foram sediados no IEC estudos sobre arboviroses na Região Amazônica, os quais trouxeram inovações nos procedimentos de campo e de laboratório que facilitaram enormemente o isolamento desses agentes em áreas próximas a Belém26.
Para efeito de enriquecimento deste trabalho e pela contribuição conferida ao conhecimento sobre a febre amarela, destacaremos o trabalho com animais sentinela realizado no período de 1954 a 1975. As investigações foram feitas nas florestas circunvizinhas à cidade de Belém, particularmente na Área de Pesquisas Ecológicas do Guamá (APEG), onde se instituiu um programa de recaptura de animais. Consistia na obtenção e uso de primatas não humanos, especialmente macacos pregos (Cebus apella) de uma ilha onde não havia floresta de grande porte, onde os animais buscavam alimento ao nível do solo, permitindo serem capturados em armadilhas com relativa facilidade27. Camundongos também foram utilizados como sentinelas no período de maio de 1954 a abril de 1959 e revelaram-se bastante efetivos para detecção da atividade dos arbovírus. Os animais comprovadamente não imunes em testes sorológicos eram usados como sentinelas e sangrados a intervalos regulares, na tentativa de isolamento viral. Entre as várias fontes produtoras de vírus, os animais sentinelas foram as mais produtivas: no período de dezembro de 1954 a maio de 1959, foram isoladas 144 amostras de 230 macacos sentinelas capturados nas florestas próximas a Belém26.
Realizaram-se estudos também nas Florestas do Utinga e do Oriboca; em áreas da rodovia Belém-Brasília, no Estado do Pará, e da Serra do Navio, no Estado do Amapá; e, posteriormente, na década de 70, em outras áreas da Amazônia, em especial ao longo das rodovias Transamazônica, Santarém-Cuiabá e Perimetral Norte. Os resultados desses estudos propiciaram o isolamento e a identificação de grande quantidade de arbovírus, muitos deles (mais de 80) desconhecidos para o mundo científico. Além disso, mostraram que as arboviroses, na Região Amazônica, são focais, com ciclos de transmissão intimamente relacionados a vetores naturais e hospedeiros vertebrados26,28.
A experiência com macacos sentinela nas florestas das cercanias de Belém mostrou-se, porém, muito cara e pouco sensível para febre amarela, sugerindo que a doença estaria "virtualmente ausente" dessas áreas (P Vasconcelos, informação pessoal). Acrescente-se a isso que o projeto sofreu descontinuidade em função de dificuldades para obtenção dos animais pelo Centro Nacional de Primatas, de onde eram frequentemente furtados ou roubados, tendo que ser abandonado, apesar dos resultados alcançados em relação a outros arbovírus.
Vigilância em tempos da SUCAM – 1969 a 1991
A Superintendência de Campanhas de Saúde Pública – SUCAM, criada pelo Decreto no 65.253, de 1o de outubro de 1969, adotou a mesma racionalidade da prática do SNFA e do DNERu. Os programas de erradicação e controle de endemias, entre eles o da febre amarela, que se seguiram às campanhas sanitárias na conjuntura sucaneira, foram originalmente estruturados segundo o modelo campanhista, com suas características sistêmicas.
O desaparecimento da febre amarela urbana não fez desaparecer o risco de seu retorno, o qual reacendia sempre que era notificado um foco de Aedes aegypti em qualquer ponto do país, ainda que distante das áreas endêmicas. Por esta razão, o objetivo maior do Programa de Controle da Febre Amarela passou a ser a manutenção dos espaços urbanos livres da doença. Para atingi-lo, era necessário detectar precoce e oportunamente a atividade viral no homem ou nos macacos, além de se obter informações atualizadas sobre os vetores urbanos e os diversos fatores que determinam o comportamento da doença. Recomendava-se também a investigação sobre a morte de macacos e a captura de mosquitos silvestres nos locais de epizootias29.
Apesar de todas essas recomendações, a vigilância e o controle da febre amarela baseavam-se fundamentalmente na alta cobertura vacinal, no controle de vetores urbanos e na viscerotomia de humanos30. Cabe ressaltar que o objetivo da viscerotomia não era a descoberta de todos os casos de febre amarela, mas um indicador das áreas onde ocorriam casos da doença, para que fossem aplicadas as medidas profiláticas. Esta atividade começou a decair ao longo dos anos 80 e os esforços para restauração da rede de postos foi inútil. A investigação de epizootias requeria recursos humanos especializados e as equipes existentes (do IEC, apenas) não eram suficientes para fazer a cobertura dos eventos que ocorriam na grande área endêmica do país; ainda assim, continuou sendo executada na medida do possível.
Contribuições dos avanços laboratoriais e das melhorias no diagnóstico
A essas dificuldades para operacionalizar a vigilância da febre amarela deve-se acrescentar que a confirmação dos casos era apenas laboratorial, sendo o isolamento de vírus o exame padrão. Eram realizadas também provas sorológicas, como a inibição da hemaglutinação, o teste de neutralização e a fixação de complemento, com a utilização de duas amostras pareadas de soro, coletadas na fase aguda da doença e na convalescença, para dosagem e comparação do nível de anticorpos, o que só valia para os casos que se restabeleciam. Os que evoluíam para o óbito eram viscerotomizados e os fragmentos hepáticos retirados eram testados pela histopatologia.
No final dos anos 80, o Centro de Controle de Doenças de Porto Rico desenvolveu o teste de MAC-ELISA, ensaio imunoenzimático para captura de anticorpos IgM, que permite o diagnóstico presuntivo de infecção recente ou ativa de dengue com uma única amostra de soro do paciente colhida na fase aguda da doença31. A nova técnica foi logo adotada pelos três Laboratórios de Referência Nacional (LRN): Instituto Evandro Chagas, Instituto Adolfo Lutz e Fundação Oswaldo Cruz, não apenas para diagnóstico de dengue, mas adaptada para febre amarela e outras arboviroses32, o que facilitou a atuação da vigilância epidemiológica, uma vez que o exame é de execução simples, rápida e de baixo custo33. Atribui-se a esse sistema uma alta especificidade em função da confirmação de todos os casos por meio de exames laboratoriais.
A vigilância nos anos 90
A Lei Orgânica de Saúde (Lei no 8080), promulgada em 1990, estabeleceu uma nova política de saúde para o Brasil. Até então, o modelo de organização e operação dos programas de controle de endemias sempre foi centralista e vertical, em que o conhecimento era mantido em domínio restrito. O novo Sistema Único de Saúde, o SUS, não abria espaços para programas de saúde formulados e executados nos limites de uma única esfera de governo.
A criação da Fundação Nacional de Saúde (FUNASA) por medida provisória, em 1991, reuniu instituições com a marca do centralismo (SUCAM e FSESP) ao lado de outras com um passado histórico de operacionalização de programas descentralizados (Secretarias Nacionais de Ações Básicas de Saúde – SNABS e de Programas Especiais de Saúde – SNPES). Esperava-se que esse novo modelo facilitasse o aperfeiçoamento da instituição e a construção do SUS. Contudo, não foi exatamente o que ocorreu no primeiro momento e foi preciso percorrer um longo caminho para preparar os estados e municípios para a transferência de responsabilidades das ações de vigilância e controle. Esse processo envolveu repasse de conhecimento e tecnologia e só se efetivou no final da década em questão, em 1998, com a transferência de recursos financeiros e o fortalecimento dos sistemas municipais quanto à autonomia técnico-gerencial, tendo a vigilância epidemiológica como uma das ferramentas mais importantes de atuação.
O Sistema de Vigilância da Febre Amarela (SVFA) foi reestruturado em 1998, com o estabelecimento de diretrizes e normas para o controle da doença no país. A partir daí, foram definidos os seguintes objetivos básicos do SVFA, conforme o Manual de Vigilância Epidemiológica de Febre Amarela33:
"- manter zero a incidência de febre amarela urbana;
- reduzir a incidência de febre amarela silvestre;
- detectar precoce e oportunamente a circulação viral;
- conhecer o estado imunológico para estimar a população sob risco de adoecer;
- conhecer o comportamento epidemiológico da febre amarela."
Para atingir os objetivos propostos, estabeleceu-se uma definição de caso suspeito baseada em recomendações da OMS34 para os países pan-americanos: "Paciente com quadro febril agudo (há menos de 7 dias), de início súbito, acompanhado de icterícia e que apresente pelo menos um dos seguintes achados clínicos e/ou laboratoriais: sinal de Faget, manifestações hemorrágicas (epistaxe, gengivorragia, hematêmese, melena e hematúria), dor abdominal alta, albuminúria, oligúria" 34. Essa definição foi posta em prática em todo o país, mas era específica demais para captar os casos frustros ou assintomáticos situados na base da pirâmide da febre amarela e que representam cerca de 70% de todos os casos ocorridos durante um surto35.
Assim, na virada do ano de 1999 para 2000, na vigência de uma epidemia de febre amarela silvestre na Região Centro-Oeste do Brasil, foi estabelecida uma segunda definição de caso suspeito, mais sensível, com a finalidade de aumentar a capacidade de detecção pelo SVFA, uma vez que as formas menos exuberantes representam a maior parte dos casos durante as epidemias. Foi proposta e imediatamente adotada a seguinte definição: "Paciente com quadro febril agudo (até sete dias), residente ou que esteve em área com transmissão viral (ocorrência de casos humanos, epizootias ou de isolamento viral em mosquitos) nos últimos 15 dias, não vacinado contra febre amarela ou com estado vacinal ignorado"36. Com isso, esperava-se um aumento da sensibilidade do SVFA e um consequente aumento na detecção precoce de casos para intervir de forma rápida e oportuna, de modo a reduzir a letalidade. Contrariamente às expectativas, as taxas de letalidade aumentaram nos dois anos subsequentes (47,1% em 2000 e 53,7% em 2001).
Não resta dúvida de que o sistema tornou-se mais sensível na detecção de casos e atuou com mais oportunidade nos anos seguintes, realizando investigação de 100% dos casos suspeitos concomitantemente com busca ativa em torno deles. Porém constatou-se, na epidemia de 2000,37 que grande parte dos casos (N=20, que representa 23,5% do total de casos) era de turistas de outros estados que se infectaram em municípios de área endêmica, onde as coberturas vacinais eram elevadas e, por esta razão, praticamente não se observavam casos na população residente. Embora mais sensível, o sistema não foi capaz de identificar e orientar os viajantes. Já na epidemia de 200138, grande parte dos casos ocorreu além dos limites da área até então considerada de risco (centro-oeste do Estado de Minas Gerais), onde não havia a recomendação de vacinar toda a população residente. Apesar de ter sido adotada uma definição de caso altamente sensível e instituída uma vigilância ativa em torno de todos os casos suspeitos, desencadeou-se uma investigação epidemiológica rigorosa, com mais de uma centena de soros coletados de indivíduos suspeitos.
Avanços obtidos a partir de 1998
Com a reestruturação, a vigilância da febre amarela começa a caminhar em direção aos conceitos estabelecidos desde 1963, preocupando-se em estudar a distribuição da incidência da doença e suas tendências, valorizando a qualidade da coleta de dados, sua consolidação e divulgação, sem perder de vista o preconizado na Lei Orgânica de Saúde, de que a informação é o subsídio da ação.
A reorganização da vigilância foi acompanhada da capacitação de profissionais das secretarias estaduais de saúde de todas as unidades federadas que, por sua vez, multiplicaram o treinamento para os municípios, o que propiciou a formação de equipes locais organizadas na vigilância epidemiológica (VE). A motivação dos profissionais resultou no fortalecimento do sistema, na medida em que melhorou a notificação, favoreceu a oportunidade da investigação e, consequentemente, a obtenção de amostras para diagnóstico.
Um dos principais avanços obtidos foi a descentralização do diagnóstico laboratorial para a realização de sorologia por meio da técnica de MAC-ELISA, eleita pela VE como principal exame de rotina para fechamento de caso suspeito. Até então realizado apenas no Instituto Evandro Chagas, no Instituto Adolfo Lutz e na Fiocruz, foi gradativamente descentralizado para os Laboratórios Centrais de Saúde Pública (LACENs), sendo realizado atualmente nos 27 Estados brasileiros. De igual modo, foi descentralizada também a realização do isolamento viral dos três principais laboratórios para os LACENs de quatro Estados (Pernambuco, Bahia, Minas Gerais e Goiás), para o do Distrito Federal e para o Instituto de Medicina Tropical de Manaus, no Amazonas. Isso possibilitou maior rapidez na detecção e confirmação de caso de febre amarela.
Outro avanço importante foi a adoção do vínculo causal pelo critério clínico-epidemiológico para confirmação de caso, após discussão com representantes dos países sul-americanos e da OPAS. A nova orientação para a rede de serviços foi pautada nos guias e manuais do Ministério da Saúde com a seguinte definição: "todo caso suspeito que evoluiu para óbito em menos de 10 dias sem confirmação laboratorial, no início ou curso de surto ou epidemia em que outros casos já tenham sido comprovados laboratorialmente"39 Isso deu maior sensibilidade ao sistema e representou um passo no futuro, pois derrubou um paradigma estabelecido desde a década de 1930, em que só eram considerados positivos os casos confirmados por laboratório. Ao considerar a dificuldade de se firmar o diagnóstico de febre amarela pela sua semelhança com várias outras doenças comuns nas áreas endêmicas, é fácil perceber que alguns casos deixariam de ser considerados, especialmente no início de um surto, quando óbitos de causa desconhecida poderiam não ter sido relacionados com a suspeita correta.
Todos esses pontos foram vitais para a melhoria da vigilância, mas aquele que consideramos um dos maiores saltos de qualidade foi a implantação da vigilância de epizootias em primatas, a partir de 1999, que se fortaleceu em 2005, com a elaboração do primeiro manual produzido no mundo sobre o tema e se estabeleceu definitivamente no SUS com a inserção da notificação compulsória, conforme a Portaria no 5, de 21 de fevereiro de 2006 e, posteriormente, a Portaria no 2.472, de 31 de agosto de 2010.
Eventos adversos graves associados com a vacina de febre amarela
Com a expansão da área de circulação viral no Brasil, fora da Região Amazônica a partir de 2001, foi grande a procura pela vacina em todo o território nacional. A demanda foi maior nas Regiões Centro-Oeste, Sudeste e Sul, onde passou a ser recomendada para a população residente e visitante não vacinada, em uma extensa área geográfica até então considerada sem risco da doença. Assim, ocorreram casos de reação adversa grave pós-vacinação antiamarílica com expressão viscerotrópica. Dois casos foram notificados no Brasil, que representaram a primeira descrição de morte causada pela vacina da febre amarela22.
Entre 2008 e 2009, houve transmissão de febre amarela silvestre nos Estados de São Paulo40 e Rio Grande do Sul41, caracterizada por ocorrência em ampla área geográfica habitada por população sem histórico vacinal. No período, foram distribuídas mais de 22 milhões de doses da vacina. Alertados para a possibilidade de ocorrência de eventos adversos, os serviços de saúde conseguiram detectar e notificar 112 eventos adversos graves, 56 dos quais tiveram associação causal com a vacina. A maioria dos eventos confirmados, 47 casos (84%), foi de doença neurotrópica aguda e todos se recuperaram; os outros nove foram classificados como doença viscerotrópica aguda e evoluíram para o óbito42.
Esses resultados levaram o Ministério da Saúde a rever o sistema de vigilância, investigação, análise e classificação dos casos, passando a revisá-los sempre em conjunto com um comitê de especialistas formado em 2009, visando apoiar o desenvolvimento do sistema, minimizar o risco de especulação da qualidade e segurança do imunobiológico e aprimorar o monitoramento.
Recentes propostas de vigilância da febre amarela no Brasil
Com o propósito de promover as mudanças necessárias, a coordenação do Programa de Vigilância e Controle de Febre Amarela vem se preocupando em encontrar soluções, nem sempre fáceis, para melhorar e aperfeiçoar a vigilância.
Em 2001, alunos do curso do Programa de Treinamento em Epidemiologia Aplicada aos Serviços de Saúde do SUS (EPISUS) realizaram uma avaliação do Sistema de Vigilância da Febre Amarela (SVE-FA) e de outros agravos de notificação compulsória, com a finalidade de identificar os pontos frágeis e recomendar alternativas para a sua melhoria43-44. Entre as recomendações propostas pelas avaliadoras do SVE-FA, destacaram-se:
- adotar uma definição de caso mais ampla do que aquela recomendada pela OPAS, preferentemente introduzindo uma abordagem sindrômica, a fim de aumentar a sensibilidade e oportunidade do sistema;
- melhorar a qualidade da informação para aumentar a utilidade do sistema em detectar tendências históricas;
- desenvolver o sistema de vigilância de epizootias e entomológica como principais eixos da detecção precoce da circulação viral no Brasil, sobretudo em área onde a população residente não é vacinada;
- incorporar conhecimentos, novas técnicas e tecnologias para o alcance dos objetivos do programa, como a utilização de informações geográficas para detectar tendências da distribuição e dispersão viral e verificar associação com dados ambientais, entomológicos e demográficos, visando desenvolver um modelo capaz de determinar áreas de risco para febre amarela.
Paralelamente aos resultados apontados pela avaliação, ressalta-se a dispersão do Aedes aegypti em milhares de municípios, o que traz para a agenda de discussões da saúde pública outras questões de ordem sanitária. Entre elas, reacende a velha discussão da possibilidade do reaparecimento da febre amarela nos centros urbanos, que teve sua última manifestação no Brasil há mais de 60 anos. Por outro lado, a manutenção da transmissão da febre amarela silvestre constitui-se em uma ameaça à saúde da população brasileira, em função do potencial epidêmico que pode assumir em populações urbanas que estejam com menos de 50% de cobertura vacinal, nível considerado incapaz de formar uma barreira de imunidade para impedir a circulação viral com elevadas taxas de transmissão. Autores têm mostrado que a prevalência da imunidade em humanos necessária para se prevenir uma epidemia é estimada entre 60% e 90%, dependendo da taxa de picada e da competência do vetor34.
Em resumo, a reunião dessas ideias indica que a vigilância de febre amarela deve incorporar a vigilância de casos humanos, vigilância de epizootias em primatas não humanos e vigilância entomológica, com vistas a aumentar a sensibilidade para a detecção mais precoce da circulação viral.
Vigilância de casos humanos
Todo caso suspeito de febre amarela deve ser notificado, imediatamente, aos níveis hierárquicos superiores, seguido de investigação imediata (até 24 horas após a notificação) com sua conclusão o mais breve possível, não excedendo o prazo máximo de 60 dias. As ações da VE frente a casos humanos suspeitos consistem basicamente em: 1) detectar o maior número possível de casos suspeitos (sintomáticos e assintomáticos) e notificá-los para ampliar a avaliação da população sob risco; 2) identificar ocorrências de epizootias na região, a fim de identificar a área de risco; 3) orientar as ações de controle (vacinação e combate ao vetor urbano); 4) informar os resultados.
Nos últimos cinco anos, a letalidade por febre amarela variou entre 25% e 47% no Brasil, enquanto a literatura refere uma variação entre 5% e 10% ao considerar as diversas formas de manifestação clínica. Por um lado, isso pode significar que a vigilância não está reconhecendo grande parcela dos casos oligossintomáticos. Por outro lado, deve-se enfatizar que a febre amarela de transmissão silvestre identificada no Brasil tem sido registrada de forma esporádica em grande parte do território nacional, o que pode levar à baixa suspeição deste agravo como causa. Por vezes, o número de casos identificados refere-se aos pacientes com apresentação clínica mais grave, sem que tenham sido considerados os casos moderados e/ou leves. Além disso, a febre amarela alcança destaque em momentos epidêmicos e geralmente passa despercebida quando se manifesta em caráter endêmico45.
A doença integra um amplo leque de diagnósticos diferenciais com agravos como a leptospirose, malária, hepatite e outras doenças ictéricas e/ou hemorrágicas, resultando em alto percentual de casos descartados nos respectivos sistemas de vigilância e, o que é mais grave, casos de febre amarela que podem não ser detectados oportunamente, aumentando o risco de ocorrência de novos casos, dispersão do vírus e ocorrência de epidemias35. Entre as inovações recentes do SVFA ressalta-se a recomendação da abordagem sindrômica na vigilância, com a utilização de uma ficha de investigação única e a realização de exames laboratoriais, como uma forma de melhorar a oportunidade e aumentar a sensibilidade, a aceitabilidade e a representatividade do sistema de vigilância43,44,46. Desse modo, pretende-se ainda implantar a vigilância sistemática e continuada de síndrome febril ictérica e/ou hemorrágica em unidades de serviço sentinela, , visando a detecção ampliada e precoce de casos suspeitos.
Vigilância de primatas não humanos (vigilância de epizootias)
A ocorrência de casos de febre amarela em humanos geralmente é precedida da transmissão entre macacos e vetores silvestres, e, sendo assim, a informação sobre morte desses animais constitui-se em um sinal de alerta precoce para desencadeamento de medidas de controle. A vigilância de epizootias é vista como um componente importantíssimo a ser desenvolvido em todo o território nacional, incluindo áreas sem registros de febre amarela, onde há presença do vetor silvestre47. Diversas localidades podem apresentar coberturas vacinais baixas, além de falta de informação para a população e profissionais de saúde, podendo resultar no reconhecimento tardio de casos da doença com potencial de disseminação epidêmica. O modelo de vigilância utilizado é do tipo passivo, em que a investigação é iniciada a partir da notificação de morte ou adoecimento de primatas não humanos.
Durante o período de expansão da circulação viral no Brasil, entre 2007 e 2009, foi observado que grande parte dos profissionais envolvidos na investigação de epizootias de primatas não apresentava formação adequada e nem detinha o conhecimento necessário para condução da investigação epidemiológica, sobretudo na coleta de amostras biológicas de primatas e vetores que pudessem apoiar a análise da investigação em diferentes áreas geográficas onde existisse a possibilidade de circulação do vírus da febre amarela. Diante dessa percepção, o sistema passou a adotar a metodologia de formação de pontos focais para atuar como multiplicadores da capacidade de investigação em suas regiões de origem, visando a ampliação da rede de investigação e a obtenção de amostras biológicas adequadas em situação de suspeita de febre amarela. Ainda nesse sentido, o Ministério da Saúde passou a envolver instituições relacionadas ao meio ambiente e à proteção animal como parceiras importantes na captação oportuna de primatas doentes ou mortos com suspeita de febre amarela, com vistas a aumentar a sensibilidade da ação e, paralelamente, constituir uma rede de vigilância com amplitude de setores, além daqueles restritos ao setor saúde.
Vigilância entomológicaA circulação viral deve ser também investigada rotineiramente por meio da vigilância entomológica, com realização de captura de vetores silvestres em locais onde há ocorrência de epizootias e/ou de casos humanos. A execução dessa atividade requer equipes de técnicos bem preparados para captura e identificação dos espécimes, acondicionamento e encaminhamento de amostras para pesquisa viral e biossegurança, temas que têm sido abordados durante capacitações específicas desde 2001.
Na mesma proposta de desenvolvimento do eixo da vigilância veterinária em epizootias de primatas, também se observou a necessidade de desenvolver este segmento, cuja finalidade principal deve ser a detecção precoce da circulação viral. Ademais, é importante ferramenta de apoio à investigação, sobretudo quando não é possível obter amostras oportunas e adequadas de primatas humanos e não humanos, possibilitando a atribuição de causa pelo vínculo epidemiológico. A metodologia de desenvolvimento e ampliação da atividade foi baseada no mesmo formato utilizado para a vigilância de epizootia de primatas, por meio da formação de pontos focais regionais com características de multiplicadores, com perfil para formação de novos técnicos e consequente ampliação da rede.
Reforço da capacidade laboratorial
O objetivo deste subcomponente é o aprimoramento da capacidade laboratorial para a detecção precoce do vírus da febre amarela em primatas não humanos e humanos. Adicionalmente, ressalta-se a importância da estruturação para o diagnóstico voltado para a pesquisa de vírus em vetores potenciais, acompanhada da formação para a identificação das espécies de culicídeos capturados em áreas de investigação. Atualmente, a rede laboratorial é composta pelos LACENs, com destaque para o Instituto Adolfo Lutz , como referência regional, e o Instituto Evandro Chagas como o laboratório de referência nacional.Predição de novas áreas de risco
Durante uma epidemia de febre amarela silvestre ocorrida nos Estados de Tocantins e Goiás, entre o final de 1999 e os primeiros meses de 2000, estabeleceu-se uma relação de causa e efeito entre elevada pluviosidade (a mais alta entre todas as regiões geográficas verificadas naquele verão, especialmente nas áreas onde foram notificados casos humanos) e o aumento das populações de mosquitos silvestres transmissores37. Durante essa epidemia, curiosamente observou-se uma explosão de múltiplos focos de atividade do vírus da febre amarela em vários pontos do país, em lugares que se encontravam silenciosos há mais de quatro décadas; surgiu no Centro-Oeste, passando pelo sudoeste da Bahia, norte de Minas Gerais, noroeste de São Paulo, despontando também, em 2001, em Estados da Região Sul (Paraná e Rio Grande do Sul)47,48, repetindo o caminho percorrido pelo vírus na década de 193049 (Figura 4).
Têm sido levantados vários fatores ecológicos que afetam a transmissão da febre amarela34. Alguns estão relacionados ao vírus, como a quantidade de vírus no início da amplificação do ciclo e a virulência; outros dizem respeito ao vetor, citando-se a abundância, longevidade, trofismo, número de repastos sanguíneos/dia, tempo de incubação do vírus no vetor, e sua competência vetorial; há também fatores próprios do hospedeiro vertebrado: abundância, taxas de imunidade e suscetibilidade (duração e dimensão da viremia).
Como já citado acima, fatores climáticos, como temperatura, umidade e duração da estação chuvosa, têm comprovadamente implicações na produção de infecções por febre amarela37,49. Além disso, aspectos comportamentais do ser humano também poderiam afetar a transmissão da doença, como é o caso de práticas de caça de macacos, quer seja com a finalidade de aquisição de animal de estimação, quer seja por hábitos de consumo, o que implicaria na redução do número de hospedeiros e ainda possibilitaria a entrada do homem no ciclo natural de transmissão da doença. Há que se considerar, ainda, a diversidade de ecossistemas existentes no Brasil, que refletem padrões de chuvas diversos e determinam a abundância e distribuição dos mosquitos vetores e dos hospedeiros vertebrados. A análise espacial dos casos humanos de febre amarela silvestre ocorridos no Brasil nos últimos 10 anos mostra um padrão de ocorrência em áreas com vegetação do tipo savana e de florestas ombrófilas47.
Em resumo, semelhantemente a outras doenças transmitidas por vetores, a dinâmica de transmissão da febre amarela depende de interações complexas entre os elementos bióticos da cadeia epidemiológica (hospedeiros, vetores/reservatórios e patógeno) e os abióticos, próprios do meio ambiente que afetam a atividade humana50. Com este olhar, sua vigilância e controle requerem estudos que envolvem outras áreas do conhecimento que extrapolam a da saúde, como a geografia médica51. A literatura vem mostrando que análises espaciais têm contribuído no estudo de fatores ambientais que podem estar associados a habitats de vetores de doenças infecciosas e o risco de transmissão para o homem51.
Uma ferramenta que pode ser usada como marcador epidemiológico de risco é o Normalized Difference Vegetetion Index (NDVI), uma medida de biomassa de vegetação. A literatura relata várias aplicações desse índice como indicador de risco de aumento da população de determinados vetores52,53,54,55,56,57,58. Se for possível estabelecer uma relação entre fatores ambientais e o risco de epidemias, poder-se-ia mapear as áreas de risco de forma mais acurada, para orientar as medidas de prevenção e controle.
Desse modo, a implantação de um sistema de geoprocessamento visa estabelecer parâmetros entre a febre amarela e o ambiente e desenvolver algoritmos preditores no espaço e no tempo que possibilitem a adoção de ações de prevenção e controle. Sua utilização como instrumento de vigilância epidemiológica certamente será de grande utilidade para a avaliação de indicadores preditivos de áreas vulneráveis e/ou receptivas que podem se configurar como locais de risco para a circulação do vírus da febre amarela.
Sazonalidade da febre amarela
Uma revisão dos casos de febre amarela notificados/identificados pelo sistema nacional de vigilância entre 1999 e 2009 demonstrou uma forte tendência de sazonalidade, com 93% dos casos identificados entre novembro e maio (Figura 5). Essa tendência foi observada tanto na Região Amazônica como fora da Bacia Amazônica, a partir de casos esporádicos e durante epidemias. Embora a razão da sazonalidade não esteja totalmente esclarecida, fatores climáticos, como a elevação da temperatura ambiente e o aumento da pluviosidade, podem influenciar no ciclo reprodutivo dos insetos vetores, aumentando sua densidade e, consequentemente, o potencial de transmissão. Como atividades que expõem indivíduos à infecção não demonstram uma estacionalidade tão acentuada, uma hipótese é que o próprio ciclo silvestre teria alguma particularidade que a determine. Isso pode ser devido à própria vida reprodutiva dos vetores ou mesmo pela dinâmica de vida e comportamento dos hospedeiros silvestres.
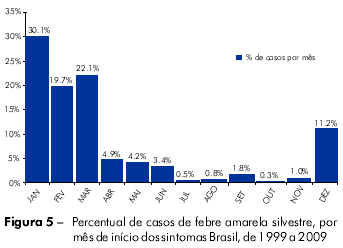
A observação da sazonalidade permitiu o planejamento de algumas atividades de prevenção no período anterior àquele de maior circulação viral e ocorrência de casos, alertando os serviços de saúde para a importância de intensificar a vigilância de possíveis casos e de estimular campanhas regionais de comunicação à população, visando divulgar a importância da vacina para viajantes de áreas de risco, trabalhadores rurais migrantes de áreas sem recomendação de vacina, assim como turistas, principalmente, praticantes do ecoturismo, turismo rural ou turismo de aventura.
Atualmente, a estratégia de vigilância baseada na sazonalidade considera três períodos epidemiológicos distintos, definidos a partir de um estudo onde se analisou a série histórica de casos e óbitos por febre amarela do período de 1980 a 2008. As recomendações são diferenciadas em cada período e foram divulgadas recentemente em Nota Técnica59 para orientações aos serviços:
a) "Período de baixa ocorrência: entre as semanas epidemiológicas (SE) 20a e 37a":
Nesse período, é recomendado priorizar atualização e capacitação dos profissionais de vigilância epidemiológica, ambiental, laboratórios de saúde pública, imunização, zoonoses e entomologia. Deve-se, ainda, analisar a situação epidemiológica visando avaliar e readequar o sistema para o próximo período sazonal59.
b) "Período pré-sazonal: entre as SE 38a e 51a":
Aqui se recomenda a preparação da rede de saúde para o período sazonal e de monitoramento das notificações. O processo de notificação e acompanhamento dos casos suspeitos da doença deve ser articulado entre as três instâncias da saúde, com as equipes de vigilância epidemiológica e ambiental, controle vetorial (Programa Nacional da Dengue) e imunização, integradas com a rede de atenção e de laboratórios. Essa comunicação integrada será um estímulo para os serviços no sentido de aumentar a sensibilidade e favorecer a detecção precoce da circulação viral para que medidas de prevenção e controle sejam desencadeadas oportunamente59.
c) "Período sazonal: entre as SE 52a e 19a do ano seguinte"
Neste período, espera-se que a rede de saúde esteja devidamente sensibilizada e preparada para qualquer surpresa. Todos os casos suspeitos devem ser notificados e investigados oportunamente (em menos de 24 h), bem como os rumores e notificações de mortes de primatas não humanos. É importante obedecer aos fluxos estabelecidos para a notificação imediata com vistas à mobilização rápida de todas as equipes técnicas envolvidas59.
Educação em saúde
Como último ponto, é necessário apreender que a educação em saúde, sempre mantida à margem do Programa de Vigilância e Controle da Febre Amarela, constitui em um mecanismo importante do mesmo, onde deve ocupar uma posição central. Ela deve ser vista como uma necessidade da população de compreender a base científica do programa com vistas a mudar sua conduta em relação à prevenção.
Perspectivas para a vigilância da febre amarela
Compreendendo que uma das funções da vigilância epidemiológica é monitorar o estado de saúde das populações para subsidiar as políticas públicas no sentido de promover ambientes seguros e saudáveis60, pretende-se estruturar a vigilância da febre amarela de uma forma criativa, de modo a contemplar os diversos espaços de receptividade para a doença, os quais, uma vez reconhecidos e mapeados, poderão vir a ser locais de intervenção60. Assim, deve ser direcionada para a melhor compreensão dos fatores de risco ambientais e ecológicos que modulam a circulação do vírus. Para isso, há a necessidade de se estabelecer parcerias com outros órgãos e instituições relacionadas com o meio ambiente e afins, tais como o Instituto Brasileiro do Meio Ambiente (IBAMA), Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), Instituto Nacional de Pesquisas Espaciais (INPE), Instituto Nacional de Meteorologia (INMET) e outros.
Nesse sentido, a partir de 2007, iniciativas operacionais e de gestão têm buscado aproximar a rotina de vigilância com outras ações e instituições, visando interligar vigilância e comunidade científica, desenvolvimento tecnológico e pesquisas, de forma a gerar informações indispensáveis para o constante conhecimento do comportamento da febre amarela e para a detecção e previsão de modificações que possam ocorrer devido a alterações nos fatores condicionantes. A perspectiva é a de que os dados obtidos a partir da introdução de novas ferramentas e novos olhares possam fornecer a informação adicional necessária para estabelecer as diretrizes de ação oportuna por meio de bases firmes e precisas de análise e interpretação para que novas recomendações de medidas de prevenção e controle61 venham a contribuir para o aperfeiçoamento da vigilância, prevenção e controle da febre amarela no Brasil.
Essas iniciativas visam ainda fomentar a produção do conhecimento para aperfeiçoar a gestão e operacionalização do sistema de vigilância, de modo a ampliar o entendimento do processo de dispersão do vírus da febre amarela fora da Região Amazônica, em especial focando nos fatores que favorecem o risco de exposição, mecanismos de captação e percepção precoce da circulação viral a partir de primatas e vetores, e ainda modelos que possam classificar e diferenciar o risco entre as áreas receptivas e vulneráveis, sobretudo onde a população não é vacinada. Adicionalmente e visando recomendação segura e monitorada quando da sua inserção em áreas de população vacinada, deve-se considerar o risco de eventos adversos graves associados à vacina da febre amarela, de modo a contribuir para a melhor compreensão dos fatores de risco a eles relacionados.
Vários pontos ainda devem ser considerados na vigilância e controle da febre amarela no Brasil. Além da prática disseminada da vacinação em áreas recomendadas, uma estratégia promissora é a avaliação das coberturas vacinais, de modo a garanti-las altas e homogêneas por localidades municipais, como um instrumento de vigilância precoce do risco de transmissão da doença. Entretanto, reconhece-se que o atual modelo de registros em algumas salas de vacina e, especialmente, em momentos de intensificação dessa atividade, apresenta limitações que comprometem a fidedignidade das estatísticas, como é o caso da ausência de registro nominal, da contagem de doses aplicadas e não de pessoas vacinadas, da revacinação antes de completado o prazo de 10 anos da última dose, da aplicação da vacina em migrantes, dentre outras. Apesar disso, é uma recomendação que deve ser perseguida pelo trabalho conjunto das equipes de vigilância e imunização.
Lacunas no conhecimento na epidemiologia da febre amarela acabam por ensejar o desenvolvimento de novas ações na vigilância epidemiológica. Por exemplo, permanece ainda no desconhecido a possibilidade da existência de outros hospedeiros e reservatórios, além dos já estudados, que poderiam contribuir para a manutenção do vírus na natureza e que pudessem explicar a transmissão em áreas sem registro de primatas não humanos e mosquitos transmissores habituais. Presume-se que outros mamíferos, como os marsupiais, já encontrados com anticorpos amarílicos62, possam representar algum papel em ciclos atípicos, mas a importância epidemiológica desses achados ainda não foi demonstrada. Neste sentido, as parcerias com instituições ligadas ao meio ambiente podem ser também uma oportunidade para estimular o desenvolvimento de pesquisas que respondam a essas questões.
Ainda existem sérias dificuldades nos municípios para garantir o pleno desenvolvimento de um SVE sensível e efetivo, incluindo a insuficiência de recursos humanos, problemas de capacidade laboratorial diante das necessidades e ações de VE, inadequada utilização dos recursos devido a um mau gerenciamento por políticos locais, além dos recursos financeiros sempre insuficientes para o setor saúde. Entretanto, espera-se que as ferramentas legais já existentes possam dar conta da capacitação e ampliação do quadro de profissionais de saúde para enfrentar os desafios da reestruturação e operacionalização da vigilância epidemiológica da febre amarela dentro do SUS, fornecendo instrumental para um melhor desempenho de sua função enquanto agente de mudança, de intervenção e de promoção à saúde.
REFERÊNCIAS
1 Franco O. A história da febre amarela no Brasil. Rio de Janeiro: Ministério da Saúde; 1969. 200 p.
2 Teixeira L. Da transmissão hídrica a culicidiana: a febre amarela na sociedade de medicina e cirurgia de São Paulo. Rev Bras Hist. 2001;21(41):217-42. Doi:http://dx.doi.org/10.1590/S0102-01882001000200012 [Link]
3 Czeresnia DM. Do contágio à transmissão: ciência e cultura na gênese do conhecimento epidemiológico. [dissertação]. Rio de Janeiro (RJ): Fundação Oswaldo Cruz; 1997. [Link]
4 Benchimol J, editor. Febre amarela: a doença e a vacina, uma história inacabada. Rio de Janeiro: FIOCRUZ; 2001. 469 p.
5 Romero A, Troncoso MC. La vigilancia epidemiológica: significado e implicaciones en la práctica y en la docencia. Cuad Med Soc. 1981;17:17-28. [Link]
6 Finlay C. El mosquito hipoteticamente considerado como agente de transmisión de la fiebre amarilla. An Acad Cien Med La Habana. 1881;18:147-69.
7 Reed W, Carrol J, Agramonte A, Lazear J. A etiologia da febre amarela. Nota adicional 2. Rev Med Sao Paulo. 1901:123-30.
8 Ribas E. O mosquito como agente de propagação da febre amarela. Bras Med. 1901;15(34):331-34.
9 Soper F. Jungle yellow fever. A new epidemiological entity in South America. Rev Hyg Saude Publica. 1936;10(4):107-44.
10 Soper F, Penna E, Serafim J, Frobisher M, Pinheiro J. Yellow fever whithout Aedes aegypti. Study of a rural epidemic in the Valle do Chanaan, Espirito Santo, Brazil, 1932. Am J Hyg. 1933;18(3):555-87.
11 Soper F. Recent extensions of knowledge of yellow fever. Quart Bull Health Organ League Nations. 1935;5:1-50.
12 Lacerda A. Em busca de um tempo perdido: fontes visuais para a história da vacina contra a febre amarela. In: Benchimol J, editor. Febre amarela: a doença e a vacina, uma história inacabada. Rio de Janeiro: FIOCRUZ; 2001. 470 p.
13 Soper F, Wilson D. Species eradication: a practical goal of species reduction in the control of mosquito borne-disease. J Natl Malar Soc. 1942;1:5-24.
14 Stokes A, Bauer J, Hudson N. Transmission of yellow fever to Macacus rhesus. Preliminary note. JAMA. 1928;90(4):253-4.
15 Lloyd W, Theiler M, Ricci N. Modification of virulence of yellow fever virus by cultivation in tissues in vitro. Trans R Soc Trop Med Hyg. 1936 Fev;29(5):481-529. [Link]
16 Theiler M, Smith HH. The use of yellow fever virus modified by in vitro cultivation for human immunization. The Journal of experimental medicine. 1937 May;65(6):787-800.
17 Soper F, Smith H. Vaccination with virus 17D in control of jungle yellow fever in Brazil. In: Acta Conventus Tertii de Tropicis atque Malariae Morbis. Amsterdam; 1938. p. 295.
18 Calheiros L. A febre amarela no Brasil. In: Homma A, Cunha J, editores. Simpósio Internacional sobre Febre Amarela e Dengue Cinqüentenário da introdução da cepa 17D no Brasil. Rio de Janeiro: Fundação Oswaldo Cruz. 1988. p. 74-85.
19 Soper FL. Aedes aegypti and yellow fever. Bull World Health Organ.1967;36(4):521-7.
20 Soper FL. El Aedes aegypti y la fiebre amarilla [Aedes aegypti and yellow fever]. Rev Panam Salud. 1968;64(3):187-96.
21 Monath TP, Cetron MS, Teuwen DE. Yellow fever vaccine. In: Plotkin SA, Orenstein WA, Offit PA, editors. Vaccines, 5th ed. Philadelphia: Elsevier; 2008. p. 959-1055.
22 Vasconcelos PF, Luna EJ, Galler R, Silva LJ, Coimbra TL, Barros VL, et al. Serious adverse events associated with yellow fever 17DD vaccine in Brazil: a report of two cases. Lancet. 2001 Jul;358(9276):91-7.
23 Engel AR, Vasconcelos PF, McArthur MA, Barrett AD. Characterization of a viscerotropic yellow fever vaccine variant from a patient in Brazil. Vaccine. 2006 Apr ;24(15):2803-9.
24 Galler R, Pugachev KV, Santos CL, Ocran SW, Jabor AV, Rodrigues SG, et al. Phenotypic and molecular analyses of yellow fever 17DD vaccine viruses associated with serious adverse events in Brazil. Virology. 2001 Nov;290(2):309-19.
25 Porto M. Marcos técnicos e legais para a descentralização do controle de endemias. In: Saúde MdSFNd, editor. Descentralização do controle de endemias. Brasília: Ministério da Saúde; 1994. p. 35-9.
26 Causey C. Implantação dos estudos sobre arbovírus na região amazônica. In: Pública FSdS, editor. Instituto Evandro Chagas; 50 anos de contribuição às ciências biológicas e à medicina tropical. Belém: Fundação Serviços de Saúde Pública; 1986. p. 361-3.
27 Ministério da Saúde (BR). Instituto Evandro Chagas: 50 anos de contribuição às ciências biológicas e à medicina tropical. Belém: Fundação Serviços de Saúde Pública; 1986. p. 69-79. [Link]
28 Travassos da Rosa A, Shope R, Travassos da Rosa J, Nakauth C, Vasconcelos P. Aspectos virológicos. In: Pública FSdS, editor. Instituto Evandro Chagas: 50 anos de contribuição às ciências biológicas e à medicina tropical. Belém: Fundação Serviços de Saúde Pública; 1986. p. 365-73.
29 Branco J. Vigilância da febre amarela no Brasil. In: Homma A, Cunha J, editores. Simpósio Internacional sobre Febre Amarela e Dengue Cinqüentenário da introdução da cepa 17D no Brasil. Rio de Janeiro: Fundação Oswaldo Cruz; 1988. p. 197-214.
30 Faria GS. Endemias Rurais: métodos de trabalho adotados pelo DNERu. Rio de Janeiro: Ministério da Saúde; 1968. 278 p.
31 Kuno G, Gomez I, Gubler DJ. Detecting artificial anti-dengue IgM immune complexes using an enzyme-linked immunosorbent assay. Am J Trop Med Hyg. 1987 Jan;36(1):153-9.
32 Vasconcelos PF, Rodrigues SG, Degallier N, Moraes MA, Rosa JF, Rosa ES, et al. An epidemic of sylvatic yellow fever in the southeast region of Maranhão State, Brazil, 1993-1994: epidemiologic and entomologic findings. Am J Trop Med Hyg. 1997 Aug;57(2):132-7.
33 Ministério da Saúde (BR). Manual de Vigilância Epidemiológica de Febre Amarela. Brasilia: Fundação Nacional de Saúde, Ministério da Saúde; 1999. 60 p. [Link]
34 World Health Organization. District guidelines for yellow fever surveillance. WHO/EPI/GEN/98.09. Geneva: WHO; 1998. 60 p.
35 Vasconcelos PF. [Yellow Fever]. Rev Soc Bras Med Trop. 2003 Mar-Apr;36(2):275-93. [Link]
36 Ministério da Saúde (BR). Guia de vigilância epidemiológica. 5. ed. Brasília: Fundação Nacional de Saúde; 2002. 842 p. [Link]
37 Vasconcelos PF, Costa ZG, Travassos da Rosa ES, Luna E, Rodrigues SG, Barros VL, et al. Epidemic of jungle yellow fever in Brazil, 2000: implications of climatic alterations in disease spread. J Med Virol. 2001 Nov;65(3):598-604.
38 Carmo E, Martins E, Pelucci H, Maia M, Duzzi R, Tuboi S, et al. Brote de fiebre amarilla selvática en Minas Gerais. Bol Inf PAI. 2002 abr;24(2):5-6.
39 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Doenças infecciosas e parasitárias: guia de bolso. 3. ed. Brasília: Ministério da Saúde; 2004. 320 p.
40 Souza RP, Foster PG, Sallum MA, Coimbra TL, Maeda AY, Silveira VR, et al. Detection of a new yellow fever virus lineage within the South American genotype I in Brazil. J Med Virol. 2010 Jan;82(1):175-85.
41 Cardoso JC, Almeida MA, Santos E, Fonseca DF, Sallum MA, Noll CA, et al. Yellow fever virus in Haemagogus leucocelaenus and Aedes serratus mosquitoes, southern Brazil, 2008. Emerg Infect Dis. 2010 Dec;16(12):1918-24.
42 Ministério da Saúde (BR). Emergências em Saúde Pública de Importância Nacional de Febre Amarela Silvestre em São Paulo e no Rio Grande do Sul e a Situação Epidemiológica Atual no Brasil (2008/2009) [Internet]. 2010 [citado 2010] Disponível em http://portal.saude.gov.br/portal/arquivos/pdf/boletim_febre_amarela_09_12_09.pdf
43 Ministério da Saúde (BR). Avaliação do Sistema de Vigilância de Febre Amarela. Brasilia: FUNASA; 2001. p. 6-7
44 Tuboi SH, Costa ZG, Costa VPF, Hatch D. Clinical and epidemiological characteristics of yellow fever in Brazil: analysis of reported cases 1998-2002. Trans R Soc Trop Med Hyg. 2007 Feb;101(2):169-75. [Link]
45 Barrett AD, Monath TP. Epidemiology and ecology of yellow fever virus. Adv Virus Res. 2003;61:291-315.
46 Ministério da Saúde (BR). Plano de Intensificação das Ações de Prevenção e Controle da Febre Amarela no Brasil. In: Saúde FNd, editor. Brasília: Ministério da Saúde; 2001.
47 Costa Z. Estudo das características epidemiológicas da febre amarela no Brasil, nas áreas fora da Amazônia Legal, período de 1999-2003 [dissertação]. Brasília (DF): Escola Nacional de Saúde Pública Sergio Arouca; 2005.
48 Vasconcelos PF, Sperb AF, Monteiro HA, Torres MA, Sousa MR, Vasconcelos HB, et al. Isolations of yellow fever virus from Haemagogus leucocelaenus in Rio Grande do Sul State, Brazil. Trans R Soc Trop Med Hyg. 2003 Jan-Feb;97(1):60-2. [Link]
49 Vasconcelos PF. Yellow fever in Brazil: thoughts and hypotheses on the emergence in previously free areas. Rev Saude Publica. 2010 Dec;44(6):1144-9. [Link]
50 Bejarano JFR. Complejos patógenos de los virus transmitidos por atrópodos. Rev Sanit Milit Argent. 1971 jan-jun;70(1):51-81
51 Pignatti MG. Saúde e ambiente: as doenças emergentes no Brasil. Ambient Soc. 2004 jan-jun;7(1):133-47. [Link]
52 Beck LR, Lobitz BM, Wood BL. Remote sensing and human health: new sensors and new opportunities. Emerg Infect Dis. 2000 May-Jun;6(3):217-27. [Link]
53 Cross ER, Newcomb WW, Tucker CJ. Use of weather data and remote sensing to predict the geographic and seasonal distribution of Phlebotomus papatasi in southwest Asia. Am J Trop Med Hyg. 1996 May;54(5):530-6. [Link]
54 Davies FG, Kilelu E, Linthicum KJ, Pegram RG. Patterns of Rift Valley fever activity in Zambia. Epidemiol Infect. 1992 Feb;108(1):185-91. [Link]
55 Elnaiem DA, Connor SJ, Thomson MC, Hassan MM, Hassan HK, Aboud MA, et al. Environmental determinants of the distribution of Phlebotomus orientalis in Sudan. Ann Trop Med Parasitol. 1998 Dec;92(8):877-87. [Link]
56 Fuentes MV, Malone JB, Mas-Coma S. Validation of a mapping and prediction model for human fasciolosis transmission in Andean very high altitude endemic areas using remote sensing data. Acta Trop. 2001 Apr;79(1):87-95. [Link]
57 Linthicum KJ, Bailey CL, Davies FG, Tucker CJ. Detection of Rift Valley fever viral activity in Kenya by satellite remote sensing imagery. Science. 1987 Mar ;235(4796):1656-9.[Link]
58 Rogers DJ, Randolph SE. Mortality rates and population density of tsetse flies correlated with satellite imagery. Nature. 1991 Jun;351(6329):739-41. [Link]
59 Romano APM, Ramos DG, Araújo FAA, Siqueira GAM, Ribeiro MPD, Leal SG, et al. Febre amarela no Brasil: recomendações para a vigilância, prevenção e controle. Epidemiol Serv Saude. 2011;20(1):101-6. [Link]
60 Hammann E, Laguardia J. Reflexões sobre a vigilância epidemiológica: mais além da notificação compulsória. Inf Epidemiol SUS. 2000 jul-set;9(3):211-19. [Link]
61 Fossaert H, Llopis A, Tigre CH. [System of epidemiologic surveillance]. Bol Oficina Sanit Panam. 1974 Jun;76(6):512-28.
62 Monath TP. Yellow fever. In: Monath TP, editor. Arboviruses: ecology and epidemiology. Boca Raton: CRC Press; 1988, p. 139-241.
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Zouraide Guerra Antunes Costa
Secretaria de Vigilância em Saúde/MS
SCS, Quadra 4, Bloco A, Edifício Principal, 5o Andar
CEP:70.304.000 Brasília - Distrito Federal- Brasil
Tel.: + 55 (61) 3213-8422 / (61) 3213-8404
E-mail:zouraide.guerra@saude.gov.br
Recebido em / Received / Recibido en: 3/3/2011
Aceito em / Accepted / Aceito en: 8/5/11
*MLD: Mice Lethal Dose













