Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.2 n.1 Ananindeua mar. 2011
http://dx.doi.org/10.5123/S2176-62232011000100003
ARTIGO ORIGINAL
Estudo descritivo sobre a leishmaniose tegumentar americana na área urbana do Município de Governador Valadares, Estado de Minas Gerais, Brasil
Thiago Mourão de MirandaI; Luiz Cosme Cotta MalaquiasII; Patrícia Maria Fonseca EscaldaI; Katiuscia Cardoso RamalhoIII; Wendel Coura-VitalIV; Alexandre Rotondo da SilvaIV; Rodrigo Corrêa-OliveiraV; Alexandre Barbosa ReisVI
ILaboratório de Imunologia, Universidade Vale do Rio Doce, Governador Valadares, Minas Gerais, Brasil
IIDepartamento de Ciências Biomédicas, Universidade Federal de Alfenas, Alfenas, Minas Gerais, Brasil
IIIDepartamento de Atenção à Saúde, Secretaria Municipal de Saúde, Governador Valadares, Minas Gerais, Brasil
IVLaboratório de Imunopatologia, Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto, Ouro Preto, Minas Gerais, Brasil
VLaboratório de Imunologia Celular e Molecular, Instituto René Rachou, Fundação Oswaldo Cruz, Belo Horizonte, Minas Gerais, Brasil
VIDepartamento de Análises Clínicas, Escola de Farmácia, Universidade Federal de Ouro Preto, Ouro Preto, Minas Gerais, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Descriptive study of American tegumentary leishmaniasis in the urban area of the Municipality of Governador Valadares, Minas Gerais State, Brazil. Traduzido por: André Monteiro Diniz.
RESUMO
Para entender os padrões de emergência e re-emergência da leishmaniose tegumentar americana (LTA), foram avaliados os perfis clínico e epidemiológico e a distribuição espacial da doença entre 2001 e 2006 em uma área endêmica situada no vale do Rio Doce, no nordeste do Estado de Minas Gerais, Brasil. O número de casos notificados aumentou de seis, no primeiro ano, para 111 no último ano do período estudado. Os casos da doença predominaram na área urbana (75,9%) e atingiram igualmente homens e mulheres em todas as faixas etárias. A transmissão de LTA ocorreu dentro de residências e em áreas vizinhas, com o maior número de casos registrados oriundo de áreas pobres, sobretudo as localizadas às margens do Rio Doce, sem uma infraestrutura sanitária adequada. O diagnóstico baseou-se em critérios clínicos e no teste de Montenegro. A maioria dos pacientes apresentou a forma cutânea da LTA. O tratamento de primeira linha abrangeu a utilização de drogas antimoniais pentavalentes (99,1%), que foram responsáveis pela cura de > 75% dos pacientes. A incidência da LTA variou entre 11,38 e 15,99 casos por 100.000 habitantes, valor alto em comparação com a média nacional. Medidas urgentes, incluindo a melhoria de técnicas de diagnóstico nas unidades de saúde locais, a conscientização de crianças em idade escolar e a motivação da população em geral, são necessárias para reduzir a transmissão da doença e controlá-la.
Palavras-chave: Leishmaniose; Estudos Transversais; Notificação de Doenças; Saúde da População Urbana; Leishmaniose Tegumentar Americana.
INTRODUÇÃO
A leishmaniose é causada por vários protozoários pertencentes ao gênero Leishmania (Kinetoplastida: Trypanosomatidae), o qual abrange muitas espécies unicelulares digenéticas (heteroxenos)1. Na América Latina, o parasita é transmitido pela picada de fêmeas de insetos hematófagos pertencentes à família Phlebotominae2.
Estima-se que os casos desta doença atinjam um total de 1,6 milhão de pessoas a cada ano. Destes, 500 mil são de leishmaniose visceral e 1,1 milhão são da forma cutânea ou mucocutânea3. A prevalência total indica que 12 milhões de pessoas em 88 países sofram de leishmaniose e 350 milhões de pessoas vivam em áreas de risco4. A leishmaniose tegumentar americana (LTA) é amplamente distribuída no continente americano, do sul dos Estados Unidos ao norte da Argentina5,6. No Brasil, a doença representa um grave problema de saúde pública, pois tem sido diagnosticada na maioria de seus estados7,8.
As manifestações clínicas da doença dependem de diversos fatores, incluindo o status nutricional do indivíduo e sua resposta imune à infecção, bem como a diversidade de espécies de vetores e parasitas envolvidas9. A LTA pode emergir em três diferentes formas: (i) leishmaniose cutânea, caracterizada por lesões simples ou múltiplas, geralmente ulceradas, próximas ao local da picada; (ii) leishmaniose mucosa, caracterizada pela destruição das mucosas nasal e oral e consequente desfiguração do paciente, que pode ocorrer separadamente ou concomitantemente com a leishmaniose cutânea; e (iii) leishmaniose cutânea difusa, caracterizada por múltiplas lesões nodulares não ulceradas, as quais podem ser localizadas longe da região da picada10. A LTA é considerada uma doença ocupacional, pois a exposição é tipicamente relacionada às atividades laborais e a consequente angústia psicológica induzida pela doença reflete no desempenho social e econômico dos indivíduos11,6.
Estudos epidemiológicos revelaram que a LTA é uma zoonose que afeta inicialmente animais e posteriormente humanos. Em humanos, o período médio de incubação é de dois meses, embora em alguns casos possa durar menos (cerca de duas semanas) ou, menos frequentemente, mais de dois meses (até dois anos)6. Um diagnóstico definitivo de LTA depende da avaliação clínica e epidemiológica do paciente, bem como dos resultados de testes parasitológicos, imunológicos e moleculares11. O tratamento de primeira linha consiste na administração de drogas anitmoniais pentavalentes, enquanto que a terapia secundária inclui o tratamento com anfotericina B e pentamidina, ambos relativamente tóxicos e caros12,13,14. Devido à complexidade da doença, o planejamento de estratégias profiláticas apropriadas deve levar em consideração todos os componentes do ciclo da Leishmania, inclusive os insetos vetores, seus reservatórios domésticos e selvagens e os humanos suscetíveis e infectados10.
Os perfis clínico e epidemiológico da LTA são complexos por causa dos vários fatores ambientais, sociais, humanos e biológicos envolvidos. Registros históricos mostram claramente que o perfil epidemiológico da doença no Brasil é cíclico15,16,17,18. Durante a década de 1950, o número de casos de LTA reduziu, porém mais recentemente a incidência de novos casos confirmados aumentou para 30 mil por ano19,17. De acordo com a Secretaria de Vigilância em Saúde6, a Região Norte possui o maior coeficiente de detecção da doença (100 casos por 100 mil habitantes), seguida das Regiões Centro-Oeste e Nordeste; a Região Sudeste é responsável por apenas 10% de todos os casos registrados.
No Estado de Minas Gerais, o maior estado da Região Sudeste do Brasil, foi reportada uma média anual de 10,5 novos casos de LTA por 100 mil habitantes entre 1990 e 2006. O número de indivíduos infectados aumentou durante este período e a doença se alastrou por diversos municípios. Na Região Metropolitana de Belo Horizonte, capital do Estado, casos autóctones de LTA têm sido registrados por instituições de saúde desde 198719, com ciclos de infecção que variam de acordo com fatores climáticos e sociais, tais como o desmatamento, a seca e a ocupação desordenada de terras. Em termos gerais, a incidência da LTA tem sido positivamente correlacionada com as estações, pois o aumento na temperatura ou na umidade favorece a multiplicação de flebotomíneos20. Por esta razão, cada região geográfica apresenta características específicas que determinam o padrão e a complexidade da transmissão de LTA.
A LTA foi inicialmente diagnosticada na década de 1960, no Vale do Rio Doce, uma das mais importantes áreas de mineração de Minas Gerais. Mayrink e colaboradores16 observaram que as características da LTA no Vale do Rio Doce eram diferentes das de outras áreas endêmicas no Brasil, pois os indivíduos infectados tinham pouco ou nenhum contato com ambientes de floresta. Embora haja algumas evidências da ocorrência da doença em Governador Valadares desde a década de 194021,22, não foi possível determinar o número de casos registrados antes de 2001 por meio de análises dos registros mantidos por entes administrativos da esfera municipal, estadual ou federal, ou de outras publicações. Espera-se que os resultados destes estudos contribuam para a compreensão dos fatores associados à emergência e re-emergência da doença.
MATERIAIS E MÉTODOS
ÁREA DE ESTUDO
Os 260.396 habitantes de Governador Valadares (latitude: 18o51'01" S; longitude: 41o56'18" W; altitude: 170 m) estão distribuídos por 100 distritos urbanos e 10 distritos rurais. O clima tropical semiúmido é caracterizado por uma temperatura média de 24,5o C, com apenas leves variações ao longo do ano. A precipitação máxima ocorre no verão e no outono (dezembro a maio), enquanto que o inverno é tipicamente seco. A umidade relativa é, em média, de 76% no inverno e de 84% no verão. Governador Valadares é um dos mais importantes centros econômicos do Vale do Rio Doce e exerce influência sobre a atividade humana em todas as áreas de seu entorno. A economia local é baseada em atividades de mineração, em indústria pesada, comercialização de pedras preciosas, agricultura, pecuária e turismo.
DESENHO DO ESTUDO E COLETA DE DADOS
Este estudo descritivo baseou-se em dados fornecidos pelo Sistema de Informação de Agravos de Notificação (SINAN) do Ministério da Saúde referentes ao período de 2001 a 2006. Os perfis de indivíduos infectados com LTA foram descritos; os protocolos registraram o status demográfico (idade, gênero, escolaridade e local de origem), a epidemiologia clínica (número de casos registrados por ano, formas clínicas, presença de lesões e histórico da doença), o diagnóstico (testes clínicos e laboratoriais) e a terapia (droga inicial ministrada, evolução da doença). Os valores médios das variáveis associadas à população-base foram determinados por meio da média aritmética das variáveis respectivas nos anos de 2003 e 2004, calculadas com base nas estimativas de crescimento do Instituto Brasileiro de Geografia e Estatística (IBGE) disponíveis na base DATASUS23. A média anual dos casos de LTA registrados foi determinada somando-se o número de casos para cada variável e dividindo pelo número de anos do estudo (i.e., seis anos). A prevalência média anual foi expressa como o número de casos de LTA registrados por 100 mil habitantes.
ANÁLISE DA DISTRIBUIÇÃO ESPECIAL DA LTA
Foi preparado um mapa da zona urbana de Governador Valadares apresentando os limites dos setores censitários, de acordo com as informações fornecidas pelo IBGE. Cada caso de LTA registrado foi identificado em seu respectivo setor censitário, e cada setor recebeu uma gradação diferente de cinza de acordo com o número total de casos. A população foi dividida em grupos de acordo com a semelhança de variáveis socioeconómicas e sanitárias estabelecida pela análise de agrupamentos de dados extraídos da base de dados do Censo Demográfico de 2000. Os setores censitários foram então classificados em três grupos de acordo com suas características comuns e a prevalência de cada grupo foi estabelecida segundo os dados populacionais do IBGE. Todas as análises estatísticas foram realizadas utilizando o programa SPSS Data Editor para Windows (versão 13.0).
RESULTADOS
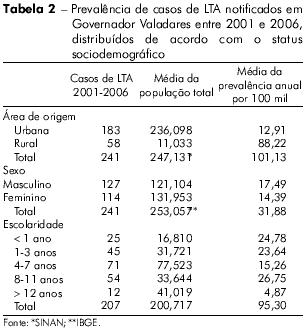
De acordo com o SINAN, foram registrados 241 casos de LTA em Governador Valadares no período de 2001 a 2006; destes, 46,10% foram registrados apenas em 2006. As taxas de frequência de casos de LTA distribuídos segundo parâmetros clínico-epidemiológicos, diagnósticos e terapêuticos são apresentadas na tabela 1 e segundo seus parâmetros sociodemográficos, na tabela 2. A maioria dos indivíduos infectados vivia na zona urbana (75,93%) e era do sexo masculino (52,70%). A prevalência média de infecção foi de 17,49 por 100 mil homens e 14,39 por 100 mil mulheres. A maioria (aproximadamente 68%) da população infectada apresentava escolaridade de até 11 anos, apenas.
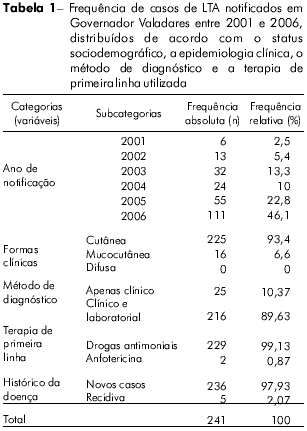
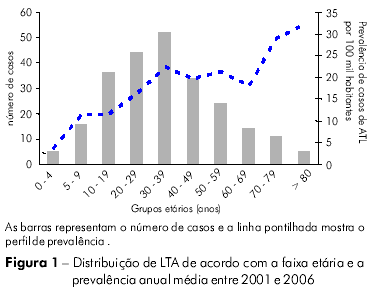
A figura 1 mostra as frequências dos casos de LTA distribuídos de acordo com a faixa etária. O maior número de infecções ocorreu em indivíduos com idade entre 30 e 39 anos (n = 52; 21,58%); na verdade, a maioria (aproximadamente 55%) dos indivíduos afetados (n = 132) era de adolescentes e adultos jovens, com idade entre 10 e 39 anos. Em contraste, o número de casos de LTA entre crianças (≤ 4 anos) e idosos (≥ 80 anos) foi muito pequeno. Os dois indivíduos doentes mais novos tinham < 1 ano de idade, e o mais velho tinha 86. No entanto, a prevalência de LTA nas faixas etárias de 0 a 4 e > 80 anos foi bem diferente (3,58 e 32,05 por 100 mil habitantes, respectivamente) por causa do pequeno número de indivíduos idosos na população pesquisada.
O diagnóstico da doença foi baseado em evidências clínicas complementadas por testes laboratoriais. O teste de Montenegro foi realizado em 191 indivíduos (79,25% da população afetada), sendo que 177 deles foram positivos (92,67%). Foram realizados exames histopatológicos de amostras de epitélio usando hematoxilina eosina em 76 indivíduos (31,53% da população afetada), 30 (39,47%) dos quais deram positivo para a presença do parasita, 41 (53,95%) apresentaram uma reação compatível com a LTA e 5 (6,58%) apresentaram uma reação não compatível. Testes parasitológicos diretos foram realizados em apenas 10 indivíduos (4,15%), dos quais 6 (60%) deram positivo para a presença do parasita e 4 (40%) deram negativo. Vinte e cinco indivíduos (10,37%) foram diagnosticados com LTA exclusivamente com base em evidências clínicas, pois 17 (7,05%) pacientes não foram submetidos a testes laboratoriais e 8 (3,32%), embora tenham sido submetidos aos testes, deram resultado negativo para a presença do parasita ou apresentaram reação não compatível.
A forma cutânea de LTA foi de longe a mais comum (> 90%). A terapia de primeira linha foi baseada principalmente em drogas antimoniais pentavalentes (aproximadamente 99%) e a maioria dos casos de LTA foi precocemente diagnosticada.
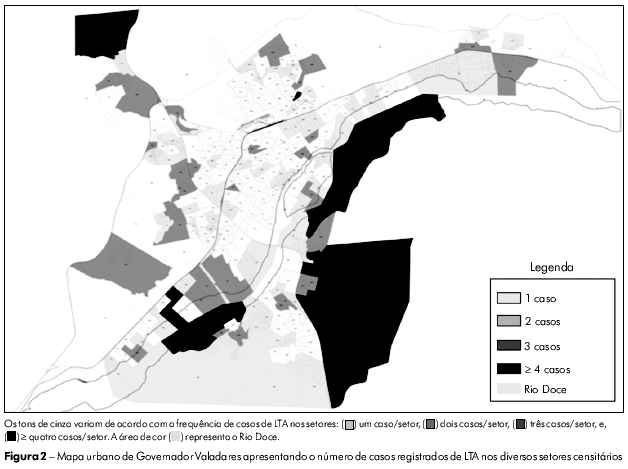
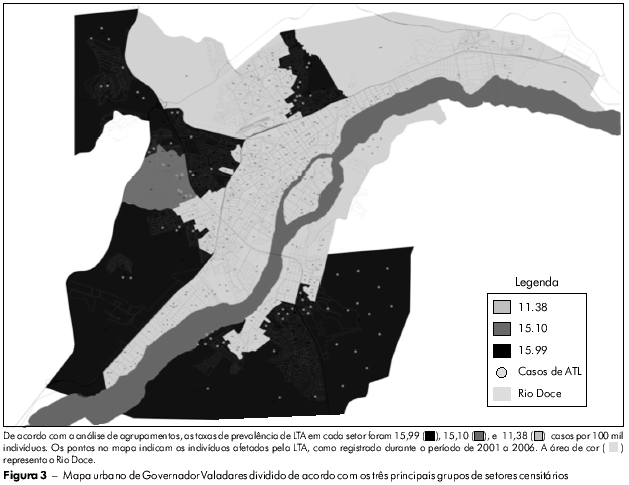
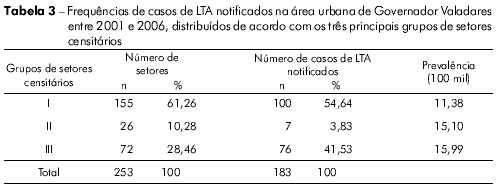
A figura 2 mostra os setores censitários (n = 253) da área urbana de Governador Valadares em tons de cinza de acordo com o número de casos, permitindo assim a identificação de áreas onde as ocorrências de LTA se concentraram. A análise de agrupamentos dos resultados permitiu a classificação destes setores censitários em três grupos, como apresentado na figura 3. A maior prevalência da LTA foi verificada no grupo III (15,99 por 100 mil habitantes), seguido do grupo II (15,10 por 100 mil habitantes), enquanto que o grupo I apresentou a menor prevalência (11,38 por 100 mil habitantes). As frequências absoluta e relativa de LTA nestes locais são apresentadas na tabela 3.
DISCUSSÃO
A crescente prevalência de LTA no Brasil tem causado uma preocupação especial nas autoridades em saúde pública locais devido às altas taxas de morbidade nas populações residentes em áreas endêmicas e por causa do processo de urbanização da doença nos últimos anos, com surtos ocorrendo em várias capitais24. Além disso, enquanto a incidência de LTA tem crescido substancialmente, a reconhecida subnotificação de casos ainda obscurece a real dimensão do problema25. De acordo com fontes oficiais, o número total de casos notificados de LTA no território brasileiro aumentou de 3 mil, em 1980, para 22.264, em 2006, com picos de transmissão a cada 5 anos6. Entre 2001 e 2006, o número de casos registrados da doença em Governador Valadares aumentou 18,5 vezes (de 6 para 111), enquanto que o número de casos em Minas Gerais apresentou um pequeno aumento (de 1.116 para 1.851); no país, esse número diminuiu de 26.636 para 22.264 durante o mesmo período.
Com base nas evidências coletadas no período de 2001 a 2006, a prevalência de LTA na área estudada parece não estar associada ao fator gênero porque o número de homens e mulheres acometidos pela doença foi comparável. Este achado corrobora os resultados de estudos anteriores conduzidos no Vale do Rio Doce16 e em outras áreas endêmicas26,27,28. Indivíduos de todas as faixas etárias foram expostos ao vetor da LTA independentemente do local em que desenvolviam suas atividades de trabalho ou de lazer, o que demonstra que o vetor da doença representa um problema comum e amplamente disseminado29. Ademais, os perfis de distribuição da doença em relação ao gênero e à idade sugerem um lugar comum de exposição que teria sido, provavelmente, o domicílio ou o seu entorno.
Embora as médias da prevalência em áreas rurais sejam mais altas em Governador Valadares, a ocorrência de LTA foi predominantemente urbana, provavelmente devido à domesticação dos componentes de seu ciclo de transmissão, como já observado nas Cidades de Belo Horizonte e Manaus20,19,29. Mudanças nos hábitos e estilo de vida de uma população podem resultar em modificações em seu meio ambiente, especialmente no que diz respeito à temperatura e umidade, e esse fato pode levar a variações nos padrões de transmissão de LTA e outras doenças. No caso do parasita responsável pela Leishmania, a domesticação é causada principalmente pela disseminação dos insetos vetores e mamíferos hospedeiros para áreas habitadas por humanos30,8.
Os diagnósticos de casos de LTA registrados durante o período compreendido entre 2001 e 2006 na área estudada foram baseados principalmente em critérios clínicos e em testes de Montenegro. Os testes histopatológicos e parasitológicos foram realizados em apenas um terço dos pacientes, o que indica uma falta de infraestrutura laboratorial nas unidades de saúde municipais de Governador Valadares. Como observado por Luz e colaboradores19, instalações mal equipadas são uma realidade comum em áreas endêmicas para Leishmania, mesmo em capitais de estados. Como ocorre em muitas outras doenças, o diagnóstico precoce e a utilização de técnicas mais refinadas são importantes para o controle da LTA.
Neste estudo, a forma cutânea de LTA predominou sobre as outras formas de leishmaniose, como já registrado em outras áreas endêmicas7,31,28,16,24, embora 6,6% dos indivíduos afetados tenham apresentado a forma mucosa. A incidência desta forma mais severa da doença durante o período estudado foi mais alta do que a média nacional (3 a 5%)6 e pode ser associada a diversos fatores, tais como diagnóstico tardio, virulência do parasita, status nutricional e/ou condições de comorbidade que tenham alterado a resposta imunológica dos pacientes32,33.
Embora a maioria dos casos registrados se refira a novos pacientes, houve aproximadamente 2,1% de recidivas, o que pode ser consequência de uma série de fatores relacionados aos hospedeiros e parasitas ou à medicação utilizada. Em Governador Valadares, assim como em outras partes do mundo34,24,35, o tratamento de primeira linha contra a LTA consistiu na utilização de antimoniais, e 95% dos pacientes receberam esta classe de medicamento. Entretanto, a eficácia do tratamento depende de vários fatores, incluindo a cepa de Leishmania, o uso prévio e inadequado do medicamento (e a resistência ao parasita, como consequência), o número de lesões cutâneas e a expansão da doença para as mucosas36.
Após a classificação dos setores censitários da área urbana de Governador Valadares em três grupos, de acordo com suas características comuns, foi possível verificar que a LTA foi menos prevalente no grupo socioeconómico I, de classe social mais elevada, que goza dos benefícios de boas condições sanitárias (Tabela 3). As taxas de prevalência dos grupos II e III foram semelhantes, porém maiores que as do grupo I por causa das piores condições socioeconómicas e sanitárias, que favorecem a transmissão da LTA. No entanto, de acordo com Secretaria de Vigilância em Saúde, um coeficiente médio de detecção de LTA entre ≥ 10 e < 71 por 100 mil habitantes é considerado alto6. Neste contexto, todos os três grupos de Governador Valadares apresentaram um alto coeficiente de detecção e, portanto, demandam a aplicação de medidas urgentes (i.e., melhoria na infraestrutura para a realização de diagnósticos e tratamento apropriado de pacientes infectados) para a eliminação ou diminuição da transmissão de LTA na região.
Por meio de análise da distribuição espacial da leishmaniose no Rio de Janeiro, Kawa e Sabroza28 afirmaram que as taxas médias de incidência da doença eram maiores em zonas de intenso crescimento populacional. A dinâmica endêmico-epidêmica da LTA é associada à ocupação humana e transformação da paisagem nativa porque a adaptação de flebotomíneos aos domicílios e às áreas em seu entorno é favorecida pela presença de humanos e cachorros, ambos representando fontes acessíveis de repasto3. Além disso, a presença de vegetação em áreas próximas às residências favorece o surgimento de roedores e animais selvagens, que não são apenas potenciais fontes de repasto, mas também hospedeiros de Leishmania spp30.
Como demonstrado na figura 2, os maiores números de casos de LTA concentraram-se em áreas ao longo das margens do Rio Doce, que atravessa o Município de Governador Valadares, o que sugere a sua participação no ciclo de transmissão da Leishmania. Estas áreas demandam claramente a atenção urgente e especial das autoridades da saúde e a mobilização de líderes comunitários para enfrentar o problema. Muitos estudos já demonstraram a correlação positiva entre a ocorrência de LTA e indivíduos que residem ou trabalham próximo a rios37,38. Os aquíferos (rios e lagos), portanto, constituem fatores de risco para a transmissão de LTA porque a migração de animais infectados para áreas habitadas é facilitada. Por outro lado, a presença de gatos em áreas habitadas por humanos é considerada um fator de proteção contra a LTA, pois estes animais domésticos são predadores naturais de roedores, que são reservatórios potenciais de Leishmania5.
O aspecto mais importante a respeito da preocupante situação relativa à disseminação de LTA em Governador Valadares se deve ao fato de o nível educacional da maioria dos indivíduos ser básico. No entanto, apenas o conhecimento acerca da epidemiologia da LTA pode não ser suficiente para motivar a população a adotar práticas preventivas, como observado por Moreira e colaboradores39 no Estado do Maranhão. Como já sugerido anteriormente, a implementação de um esforço conjunto das autoridades de saúde e dos jovens e adultos da comunidade é essencial40,41.
CONCLUSÃO
Em resumo, foi realizado o primeiro estudo descritivo retrospectivo sobre a LTA em Governador Valadares, no qual os casos registrados durante o período de 2001 a 2006 foram analisados e distribuídos espacialmente de acordo com as zonas urbanas. A dificuldade em se obter dados a respeito da incidência da doença nos anos anteriores ao estudo demonstra que não havia vigilância epidemiológica prévia no município. Além disso, os resultados demonstraram a necessidade de aprimoramento das técnicas de diagnóstico e de que se mantenha um rígido controle da transmissão da LTA. Finalmente, este estudo sobrepós dados demográficos e socioeconómicos relacionados a pequenos setores censitários, como realizado pelo IBGE, a mapas do município fornecido pela Prefeitura Municipal, fazendo com que as áreas de risco fossem prontamente identificadas. Este tipo de avaliação diagramática pode ser útil no planejamento de estratégias (programas sociais e educacionais, bem como políticas de saúde e investimentos) necessárias para a erradicação da LTA, uma doença debilitante e desfigurante.
AGRADECIMENTOS
Os autores gostariam de agradecer à Prefeitura Municipal de Governador Valadares, Estado de Minas Gerais, Brasil, pelo fornecimento de dados e pelo gentil apoio durante o desenvolvimento deste projeto.
APOIO FINANCEIRO
Esta pesquisa foi financiada pela Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG: bolsa PRONEX 2007). ABR e RCO agradecem as bolsas fornecidas pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
APROVAÇÃO POR COMITÊ DE ÉTICA
Os detalhes deste projeto foram submetidos e aprovados pelo Comitê de Ética em Pesquisa da Universidade do Vale do Rio Doce (N. CEP/UNIVALE 08/2007).
REFERÊNCIAS
1 Lainson R, Shaw JJ. Evolution, classification and geographical distribution. In: Peters W, Killinck-Kendrick R, editors. The leishmaniases in biology and medicine: biology and epidemiology. London: Academic Press; 1987. p. 1-120.
2 Cupolillo E, Grimaldi Jr G, Momen H. A general classification of new world Leishmania using numerican zymotaxonomy. Am J Trop Med Hyg. 1994 Mar;50(3):296-311. [ Links ]
3 World Health Organization. First WHO report on neglected tropical diseases: working to overcome the global impact of neglected tropical diseases. Geneva: WHO; 2010.
4 Desjeux P. Leishmaniasis: current situation and new perspectives. Comp Immunol Microbiol Infect Dis. 2004 Sep;27(5):305-18. Doi:10.1016/J.Cimid.2004.03.004 [Link]
5 Salomón OD, Sosa-Estani S, Ramos K, Orellano PW, Sanguesa G, Fernández G, et al. Tegumentary leishmaniasis outbreak in Bella Vista City, Corrientes, Argentina during 2003. Mem Inst Oswaldo Cruz. 2006 Nov;101(7):767-74. DOI:10.1590/S0074-02762006000700010 [Link]
6 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Manual de Vigilância da Leishmaniose Tegumentar Americana. 2. ed. Brasília: Ministério da Saúde; 2007. 180 p.
7 Ampuero J, Macêdo V, Marsden P. Clinical findings of tegumentary leishmaniasis in children under five years of age in an endemic area of Leishmania (Viannia) braziliensis. Rev Soc Bras Med Trop. 2006 Jan-Feb;39(1):22-6. DOI:10.1590/S0037-86822006000100004 [Link]
8 Costa SM, Cechinel M, Bandeira V, Zannuncio JC, Lainson R, Rangel EF. Lutzomyia (Nyssomyia) whitmani s.l. (Antunes & Coutinho, 1939) (Diptera: Psychodidae: Phlebotominae): geographical distribution and the epidemiology of American cutaneous leishmaniasis in Brazil - Mini-review. Mem Inst Oswaldo Cruz. 2007 May;102(2):149-53. DOI:10.1590/S0074-02762007005000016 [Link]
9 Neuber H. Leishmaniasis. J Dtsch Dermatol Ges. 2008 Sep;6(9):754-65. DOI:10.1111/j.1610-0387.2008.06809.x [Link]
10 Marzochi MCA, Marzochi KB. Tegumentary and visceral leishmaniases in Brazil: emerging anthropozoonosis and possibilities for their control. Cad Saude Publica. 1994 Jan;10 Suppl 2:S359-75. DOI:10.1590/S0102-311X1994000800014 [Link]
11 Gontijo B, Carvalho MLR. American cutaneous leishmaniasis. Rev Soc Bras Med Trop. 2003 Jan- Feb;36(1):71-80. DOI:10.1590/S0037-86822003000100011 [Link ]
12 Croft SL, Seifert K, Yardley V. Current scenario of drug development for leishmaniasis. Indian J Med Res. 2006 Mar;123:399-410. [Link]
13 Machado-Pinto J, Pinto J, Costa CA, Genaro O, Marques MJ, Modabber F, et al. Immunochemotherapy for cutaneous leishmaniasis: a controlled trial using killed Leishmania (Leishmania) amazonensis vaccine plus antimonial. Int Soc Dermatol. 2002 Feb;41(2):73-8. DOI:10.1046/j.1365-4362.2002.01336.x [Link]
14 Ouellette M, Drummelsmith J, Papadopoulou B. Leishmaniasis: drugs in the clinic, resistance and new developments. Drug Resist Updat. 2004 Aug-Oct;7(4):257-66. DOI:10.1016/j.drup.2004.07.002 [Link]
15 Machado-Coelho GLL, Assunção R, Mayrink W, Caiaffa WT. American cutaneous leishmaniasis in southeast Brazil: space-time clustering. Int J Epidemiol. 1999 Oct;28(5):982-9. [Link]
16 Mayrink W, Williams P, Coelho MV, Dias M, Martins AV, Magalhães PA, et al. Epidemiology of dermal leishmaniasis in the Rio Doce valley, State of Minas Gerais, Brazil. Ann Trop Med Parasitol. 1979 Apr;73(2):123-37. [Link]
17 Ferreira P. Epidemiologia das leishmanioses. In: Sabroza P, organizador. Glossário de doenças [Internet]. Rio de Janeiro: FIOCRUZ; 2008 [citado 2008 nov 1]. Disponível em: http://www.fiocruz.br/ccs/cgi/cgilua.exe/sys/start.htm?infoid=355&sid=6.
18 Zare S, Baghestani S. Cutaneous leishmaniasis in Hormozgan, Iran. Int J Dermatol. 2001 Oct;40(10):629-31. DOI:10.1046/j.1365-4362.2001.01279.x [Link]
19 Luz ZMP, Pimenta DN, Cabral ALLV, Fiúza VOP, Rabello A. Leishmaniasis: urbanization and low diagnosis capacity in the metropolitan region of Belo Horizonte. Rev Soc Bras Med Trop. 2001 May-Jun;34(3):249-54. DOI:10.1590/S0037-86822001000300004 [Link]
20 Guerra JAO, Ribeiro JAS, Coelho LIARC, Barbosa MGV, Paes MG. Epidemiology of tegumentary leishmaniasis in São João, Manaus, Brazil. Cad Saude Publica. 2006 Nov;22(11):2319-27. DOI:10.1590/S0102-311X2006001100006 [Link]
21 Aleixo J. Leishmaniose com localização genital. An Bras Dermatol Sifilogr. 1945;20:89-91.
22 Furtado TA, Viegas AC. Ensaios terapêuticos na leishmaniose tegumentar americana. An Bras Dermatol. 1967;42(1):47-55.
23 Ministério da Saúde (BR). Departamento de Informática do SUS [Internet]. Brasília [citado 2008 mar 11]. Disponível em: http://www.datasus.gov.br.
24 Oliveira-Neto MP, Mattos MS, Perez MA, Da-Cruz AM, Fernandes O, Moreira J, et al. American tegumentary leishmaniasis (ATL) in Rio de Janeiro State, Brazil: main clinical and epidemiologic characteristics. Int J Dermatol. 2000 Jul;39(7):506-14. DOI: 10.1046/j.1365-4362.2000.00969.x [Link]
25 Nunes AG, Paula EV, Teodoro R, Prata A, Silva-Vergara ML. Epidemiological aspects of American tegumentary leishmaniasis in Varzelândia, Minas Gerais, Brazil. Cad Saude Publica. 2006;22(6):1343-7. DOI:10.1590/S0102-311X2006000600023 [Link]
26 Cunha JCL, Lima JWO, Pompeu MML. Domestic transmission of cutaneous leishmaniasis, during an epidemic in Serra de Baturité, State of Ceará, Brazil. Rev Bras Epidemiol. 2006 Dec;9(4):425-35. DOI:10.1590/S1415-790X2006000400003 [Link]
27 Gontijo CMF, Silva ES, Fuccio MB, Sousa MCA, Pacheco RS, Dias ES, et al. Epidemiological studies of an outbreak of cutaneous leishmaniasis in the Rio Jequitinhonha valley, Minas Gerais, Brazil. Acta Trop. 2002 Feb;81(2):143-50. DOI:10.1016/S0001-706x(01)00205-4 [Link]
28 Kawa H, Sabroza PC. Spatial distribution of tegumentary leishmaniasis in the city of Rio de Janeiro. Cad Saude Publica. 2002 May-Jun;18(3):853-65. DOI:10.1590/S0102-311X2002000300034 [Link]
29 Passos VM, Barreto SM, Romanha AJ, Krettli AU, Volpini AC, Gontijo CM, et al. Cutaneous leishmaniasis in the metropolitan region of Belo Horizonte: clinical, laboratorial, therapeutic and prognosis features (1989-1995). Rev Soc Bras Med Trop. 2001 Jan-Feb;34(1):5-12. DOI:10.1590/S0037-86822001000100002 [Link]
30 Chaves LF, Cohen LM, Pascual M, Wilson ML. Social exclusion modifies climate and deforestation impacts on a vector-borne disease. PLoS Negl Trop Dis. 2008 Feb;2(2):e176. DOI:10.1371/journal.pntd.0000176. [Link]
31 Castro EA, Soccol VT, Membrive N, Luz E. Epidemiological and clinical study of 332 cases of cutaneous leishmaniasis in the north of Paraná State from 1993 to 1998. Rev Soc Bras Med Trop. 2002 Sep-Oct;35(5):445-52. [Link]
32 Machado-Coelho GLL, Caiaffa WT, Genaro O, Magalhães PA, Mayrink W. Risk factors for mucosal manifestation of American cutaneous leishmaniasis. Trans R Soc Trop Med Hyg. 2005 Jan;99(1):55-61. DOI:10.1016/j.trstmh.2003.08.001 [Link]
33 Passos VMA, Falcão AL, Marzochi MCA, Gontijo CMF, Dias ES, Barbosa-Santos EGO, et al. Epidemiological aspects of American cutaneous leishmaniasis in a periurban area of the metropolitan region of Belo Horizonte, Minas Gerais, Brazil. Mem Inst Oswaldo Cruz. 1993 Jan-Mar;88(1):103-10. DOI:10.1590/S0074-02761993000100016 [Link]
34 Brochu C, Wang J, Roy G, Messier N, Wang XY, Saravia NG, et al. Antimony uptake systems in the protozoan parasite Leishmania and accumulation differences in antimony-resistant parasites. Antimicrob Agents Chemother. 2003 Oct;47(10):3073-9. DOI:10.1128/AAC.47.10.3073-3079.2003. [Link]
35 Rastogi V, Nirwan PS. Cutaneous leishmaniasis: an emerging infection in a non-endemic area and a brief update. Indian J Med Microbiol. 2007 Jul;25(3): 272-5. DOI: 10.4103/0255-0857.34774 [Link]
36 Rodrigues AM, Hueb M, Santos TARR, Fontes CJF. [Factors associated with treatment failure of cutaneous leishmaniasis with meglumine antimoniate]. Rev Soc Bras Med Trop. 2006 Mar-Apr;39(2):139-45. DOI:10.1590/S0037-86822006000200001 [Link]
37 Ryan JR, Mbui J, Rashid JR, Wasunna MK, Kirigi G, Magiri C, et al. Spatial clustering and epidemiological aspects of visceral leishmaniasis in two endemic villages, Baringo district, Kenya. Am J Trop Hyg. 2006 Feb;74(2):308-17. [Link]
38 Salomón OD, Orellano PW, Lamfri M, Scavuzzo M, Dri L, Farace MI, et al. Phlebotominae spatial distribution associated with a focus of tegumentary leishmaniasis in Las Lomitas, Formosa, Argentina, 2002. Mem Inst Oswaldo Cruz. 2006 May;101(3):295-9. DOI:10.1590/S0074-02762006000300013 [Link]
39 Moreira RCR, Rebêlo JMM, Gama MEA, Costa JML. Nível de conhecimento sobre leishmaniose tegumentar americana (LTA) e uso de terapias alternativas por populações de uma área endêmica da Amazônia do Maranhão, Brasil. Cad Saude Publica. 2002 jan-fev;18(1):187-95. DOI:10.1590/S0102-311X2002000100019 [Link]
40 Costa JML, Vale KC, França F, Coatá MAF, Silva JO, Lago EL, et al. A leishmaniose tegumentar americana em uma região endêmica como fator de mobilização comunitária. Rev Soc Bras Med Trop. 1994 out-dez;27(4):255-7. [Link]
41 Freitas JS, Santana RG, Melo SR. A survey on cases of leishmaniosis recorded at the municipal district of Jussara, Paraná, Brazil. Arq Ciencias Saude UNIPAR. 2006 Jan-Apr;10(1):23-7.
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Alexandre Barbosa Reis
Laboratório de Imunopatologia,
Instituto de Ciências Exatas e Biológicas,
Universidade Federal de Ouro Preto.
Morro do Cruzeiro CEP: 35400-000
Ouro Preto-Minas Gerais-Brasil
Tel.: 55 (21) 31 3559-1694 | Fax: 55 (21) 31 3559-1680
E-mail: alexreis@nupeb.ufop.br
Received / Recebido em / Recibido en: 21/7/2010
Accepted / Aceito em / Aceito en: 16/2/2011











 texto en
texto en 

