Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.2 n.1 Ananindeua mar. 2011
http://dx.doi.org/10.5123/S2176-62232011000100012
Doença de Chagas congênita por infecção aguda maternal por Trypanosoma cruzi transmitida via oral
Ana Yecê das Neves PintoI; Vera da Costa ValenteI; Sebastião Aldo da Silva ValenteI; Amira Consuelo de Melo FigueirasII
ISeção de Epidemiologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIUniversidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Congenital Chagas disease due to acute maternal Trypanosoma cruzi infection transmitted by the oral route. Traduzido por: André Monteiro Diniz.
RESUMO
Uma família de quatro pessoas, incluindo uma mulher de 24 anos de idade, apresentou-se em nosso laboratório em dezembro de 2006 com uma síndrome febril prolongada de etiologia desconhecida. Após uma triagem laboratorial extensa, foi confirmada, por meio de hemocultura positiva para T. cruzi, combinada com achados clínicos, epidemiológicos e sorológicos, a ocorrência de doença de Chagas aguda. A paciente, seus pais e marido receberam uma dose diária de Benzonidazol, porém ela desenvolveu intolerância severa à droga e amenorreia. Seu tratamento foi interrompido devido à confirmação de gravidez de cerca de 12 semanas de idade gestacional. A criança nasceu prematuramente em 18 de abril de 2007 com baixo peso e sinais de síndrome do desconforto respiratório. Testes de triagem diagnóstica para infecções congênitas, incluindo a doença de Chagas, resultaram negativos durante o período perinatal. Aproximadamente quatro meses após o nascimento, os achados clínicos forneceram os seguintes indicadores clínicos de doença congênita: esotropia, microcefalia e atraso no desenvolvimento psicomotor. Testes sorológicos confirmaram a soroconversão e a ressonância magnética apresentou lesões císticas e calcificações intracranianas. Os autores discutem a natureza crítica deste grave problema de saúde pública na região e sugerem revisões necessárias ao tratamento recomendado para pacientes grávidas com a doença de Chagas aguda.
Palavras-chaves: Doença de Chagas; Transmissão Vertical de Doença Infecciosa; Tripanossomicidas.
INTRODUÇÃO
O Brasil já foi certificado pela erradicação de Triatoma infestans, o principal vetor da doença de Chagas. O último levantamento de soroprevalência da doença de Chagas realizado em áreas rurais do Brasil demonstrou uma baixa taxa de infecção entre crianças de até cinco anos de idade e uma transmissão congênita de 0,025%1.
Apesar desses bons resultados, a vigilância entomológica contínua não deve ser interrompida. Na verdade, este estudo de caso apresenta evidências de que a transmissão direta e indireta por outros vetores não domiciliares podem ter sido aprimorados especialmente na Região Amazônica, que tem ciclos enzoóticos de T. cruzi bem estabelecidos e tem sido palco de desequilíbrio ecológico resultante de grandes mudanças antropogênicas ocorridas na década de 1990. Essas influências multifatoriais aumentam o risco focal de ocorrência da doença de Chagas na região, como já descrito em estudos anteriores2,3,4.
Este é o primeiro relato de doença de Chagas congênita autóctone na Amazônia, resultante de infecção materna aguda durante um surto familiar de transmissão oral.
APRESENTAÇÃO DO CASO
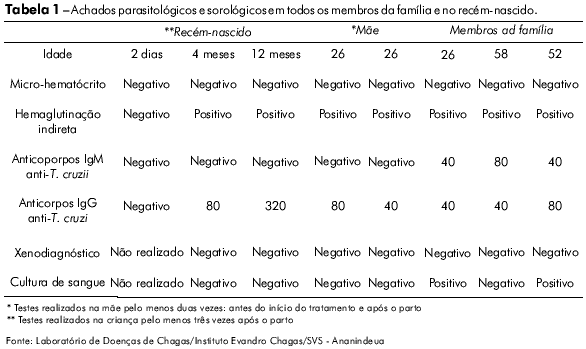
Uma família composta por quatro pessoas, sendo elas um casal (homem com 26 e mulher com 24 anos de idade) e os pais da jovem (com 52 e 56 anos de idade), apresentou-se no Instituto Evandro Chagas (IEC) para atendimento em virtude de uma síndrome febril prolongada. Os quatro membros da família foram acometidos pela doença simultaneamente e sua duração foi de 18 dias. As análises de diagnóstico foram realizadas mediante dois testes sorológicos e três exames parasitológicos. Os achados parasitológicos (cultura de sangue positiva para T. cruzi em dois pacientes), clínicos e sorológicos confirmaram um surto de doença de Chagas aguda (DCA) na família (Tabela 1).
A investigação epidemiológica não encontrou vetores associados à transmissão entre os membros da família em questão. Além disso, a sua ocorrência em uma área urbana e o aparecimento quase simultâneo dos sintomas nos quatro pacientes sugerem uma associação entre a doença e um alimento (açaí) ingerido por todos eles, porém esse dado não é discutido em detalhes neste estudo.
Todos os pacientes receberam doses diárias de Benzonidazol em janeiro de 2007. A jovem apresentou uma séria intolerância à droga, sofrendo de náuseas, vômitos, dores abdominais e tontura. Consequentemente, devido a uma suspeita de gravidez (amenorreia), o tratamento foi interrompido e a paciente experimentou uma melhora espontânea dos sintomas. Confirmada a gravidez de 12 semanas de idade gestacional, foi feito acompanhamento clínico da paciente durante toda a sua gestação. Os testes sorológicos de hemaglutinação indireta (HAI) e ensaio de imunofluorescência indireta (IFI) realizados na paciente deram positivo para os anticorpos da classe IgG anti-T. cruzi. Seus três testes parasitológicos seriados deram resultado negativo. Durante toda a gestação, a paciente não apresentou nenhum sintoma de doença de Chagas. Uma ultrassonografia morfológica da 29a semana de gravidez não apontou nenhuma anormalidade.
O recém-nascido era do sexo feminino, nasceu prematuramente (34 semanas) no dia 18 de abril de 2007, após cirurgia de cesariana, e apresentou baixo peso (1.850 g), icterícia e sintomas de síndrome do desconforto respiratório (SDR), demandando internação em unidade de terapia intensiva. Durante a internação, a criança foi diagnosticada com pneumonia bacteriana. Dois dias após o nascimento, foi submetida a exames parasitológicos e sorológicos visando à detecção de infecção por T. cruzi pelo método da gota espessa, IFI e HAI. Todos esses testes resultaram negativos (Tabela 1).
Após três semanas, o recém-nascido recuperou-se e não apresentou nenhuma alteração até o quarto mês de vida. Durante uma visita de rotina ao laboratório, aos quatro meses de idade, foram observados esotropia e atraso em seu desenvolvimento psicomotor (não sustentava a cabeça). O exame clínico apontou microcefalia e o fechamento da sutura bregmática. Os parâmetros hematológicos apresentaram um nível de hemoglobina de 9,7 g%.
Durante este período, os resultados da pesquisa por T. cruzi em sangue periférico pelo método de micro-hematócrito, por cultura de sangue para T. cruzi e por xenodiagnóstico indireto permaneceram negativos; no entanto, foi observada uma conversão sorológica positiva por HAI e IFI (IgG anti-T. cruzi: 80). A tabela 1 mostra todos os resultados da mãe e da criança em diferentes momentos e os resultados referentes a todos os indivíduos analisados durante o surto, na fase aguda da doença de Chagas. Para avaliar outros possíveis agentes de infecção congênita, foi realizado um estudo sorológico para detectar toxoplasmose (IFI); citomegalovírus por ELISA; sífilis pelos métodos de VDRL e FTA-Abs; e rubéola por ELISA. Todos os resultados foram negativos tanto na mãe quanto na criança, com exceção do teste para detecção de anticorpos IgG contra o citomegalovírus, que foi positivo na mãe.
As imagens de ressonância magnética apontaram anormalidades no cérebro da criança, tais como lesões atróficas caracterizadas por ventrículos dilatados e áreas com encefalomalácia, o que sugere a existência de calcificações intracranianas e lesões císticas (Figura 1).
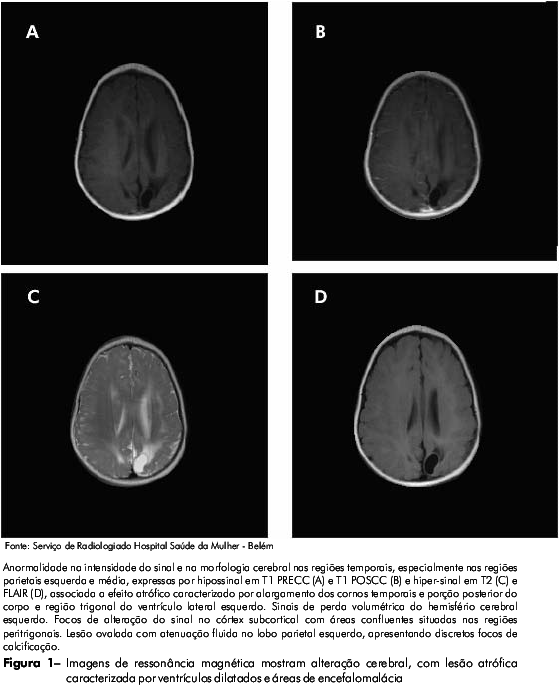
A criança foi tratada com Benzonidazol por 45 dias e o caso foi notificado à Secretaria Municipal de Saúde de Ananindeua. Aos 12 meses de idade, ela permanece sob monitoramento clínico. A mãe foi submetida ao tratamento e os efeitos colaterais foram rigorosamente controlados. Os testes sorológicos da mãe e da criança permaneceram positivos.
DISCUSSÃO
Pesquisas anteriores realizadas em áreas endêmicas para T. cruzi encontraram um índice de prevalência de doença de Chagas de cerca de 1% em mulheres grávidas no Brasil, 4% a 6% em gestantes na Argentina, 2% a 3% no Chile e 12% na Bolívia5. Esses índices são relacionados à infecção maternal crônica, em que os níveis de parasitas no sangue são baixos (1 a 10%)6. Em contraste, durante a fase aguda, os níveis de parasita no sangue são altos e induzem a resposta imunológica do hospedeiro, o que aumenta o risco de infecção congênita7. Entretanto, a Amazônia Brasileira é uma área que se caracteriza pela transmissão ativa de DCA e por índices subestimados de infecção chagásica8. A ocorrência de surtos de DCA em áreas urbanas provavelmente livres de vetores e a transmissão por forma não usual sugerem a adoção de novas abordagens metodológicas em estratégias de controle desta antiga doença.
Moretti et al9 descreveram três gestantes com DCA na Argentina. Duas delas foram infectadas durante o terceiro trimestre e deram à luz crianças não infectadas. A terceira foi infectada durante o segundo trimestre e deu à luz uma criança com hepatoesplenomegalia. Como em todos os casos em que há a possibilidade de transmissão vertical, o início da gravidez é associado a um alto risco de infecção. Assim, a infecção da mãe durante o primeiro trimestre pode ter sido determinante para a infecção da criança, bem como para o seu envolvimento neurológico severo.
Estudos realizados na Argentina, Bolívia, Paraguai e Brasil descrevem os espectros clínicos da infecção congênita e suas formas sintomáticas e assintomáticas. Os sintomas clínicos das formas sintomáticas variam de leves a graves: são normalmente descritos nascimentos prematuros, baixo peso, hepatomegalia, esplenomegalia, sinais neurológicos, icterícia, anemia, anasarca e SDR 10,11,12,13. Na criança ora estudada, os principais sinais clínicos observados foram icterícia, anemia e SDR; no entanto, há raras descrições de baixo desenvolvimento neurológico com calcificação intracraniana em casos de doença de Chagas congênita. Há apenas um registro, de La Paz, Bolívia, semelhante ao descrito neste estudo14. Por outro lado, uma série de casos observados na Argentina demonstra que 64,8% das crianças não apresentam sintomas clínicos e que, em crianças sintomáticas, a hepatomegalia foi o principal sintoma observado12.
Não foram encontrados parasitas no sangue periférico da criança em nenhum momento durante o período de monitoramento. O diagnóstico foi realizado por meio de testes de conversão sorológica, dados epidemiológicos (dados relacionados à transmissão vertical de uma mãe com DCA) e achados clínicos. A sensibilidade de testes parasitológicos é reduzida em casos congênitos devido à baixa parasitemia e o diagnóstico é frequentemente realizado por meio de sorologia. Por isso, o acompanhamento clínico de uma criança desempenha um papel importante no diagnóstico e, posteriormente, na resposta potencial (sorologia negativa) ao tratamento.
O rigoroso controle da DCA em gestantes e em recém-nascidos de áreas de alto risco na Região Amazônica durante os períodos pré-natal e perinatal é um desafio importante para os sistemas de vigilância em saúde pública. Mães com reações sorológicas positivas devem, juntamente com seus recém-nascidos, passar por exames parasitológicos diretos pelo método do micro-hematócrito imediatamente após o parto. Além disso, essas crianças devem ser monitoradas até alcançarem pelo menos noves meses de idade. No Brasil, o Consenso Brasileiro em Doença de Chagas reforça a necessidade de análise sorológica de gestantes e o monitoramento de crianças nascidas de mães acometidas com a doença de Chagas15,16. Contudo, esta importante recomendação é frequentemente negligenciada no país e na maioria das nações em que a doença de Chagas é endêmica.
O segundo desafio no controle da doença de Chagas é a revisão dos protocolos de tratamento com o uso de Benzonidazol em gestantes com DCA. Mulheres grávidas necessitam de cuidados individualizados para que se possa fazer uso seguro desta droga17. Sugere-se que a indicação de Benzonidazol seja discutida com a mãe especialmente após a vigésima quarta semana de gravidez (quando há uma redução do potencial lesivo da droga para o feto). O desenvolvimento de drogas eficazes, com o mínimo possível de efeitos colaterais, deve ser uma prioridade para os sistemas de saúde pública em áreas que apresentem focos ativos de transmissão de doença de Chagas.
Além disso, todos os esforços são válidos para fortalecer os sistemas de vigilância em doença de Chagas no Brasil. Para isso, a capacitação de recursos humanos configura uma estratégia de controle essencial tanto para aprimorar a qualidade dos diagnósticos laboratoriais, como para melhorar a sensibilidade de suspeição clínica no nível da atenção primária individual e ainda formar pessoal habilitado, com desempenho sustentável, para, assim, compreender os vários componentes da cadeia de transmissão deste agravo que é antigo no Brasil, porém emergente na Região Amazônica.
CONCLUSÃO
Mulheres com DCA apresentam um maior risco de transmissão de doenças para o feto do que mães com infecção crônica. O potencial de ocorrência de lesões irreversíveis em recém-nascidos, como resultado desta transmissão vertical (como encontrado neste relato), indica a necessidade da revisão das recomendações acerca do uso de drogas tripanossomicidas nesses casos.
AGRADECIMENTOS
A Francelino de Almeida Araújo Júnior, do Hospital Saúde da Mulher, Belém, pelas imagens de resssonância magnética.
APOIO FINANCEIRO
Instituto Evandro Chagas e UNESCO
REFERÊNCIAS
1 Ostermayer AL, Passos ADC, Silveira AC, Ferreria AW, Macedo V, Prata A. O inquérito nacional de soroprevalência de avaliação do controle da doença de Chagas no Brasil (2001-2008). Rev Soc Bras Med Trop. 2011;44 Suppl 2:S108-21. [Link]
2 Coura JR, Junqueira AC, Fernandes O, Valente SA, Miles MA. Emerging Chagas disease in Amazonian Brazil. Trends Parasitol. 2002 Apr;18(4):171-6. Doi:doi:10.1016/S1471-4922(01)02200-0 [Link]
3 Pinto AYN, Ferreira Jr AG, Valente VC, Harada GS, Valente SAS. Urban Outbreak of Emerging acute Trypanosomiasis in Brazilian Amazon: 4-year follow-up post treatment with benznidazol. Rev Panam Salud Publica. 2009 Jan;25(1):77-83.
4 Valente SA, Valente VC, Pinto AYN. Epidemiologia e transmissão oral da doença de Chagas na Amazônia brasileira. In: Organización Panamericana de la Salud. Organización Mundial de la Salud. Unidad. Informe de la consulta técnica en Epidemiología, Prevención y Manejo de la Transmisión de la Enfermedad de Chagas como Enfermedad Transmitida por Alimentos. Rio de Janeiro: OPS/OMS; 2006. p. 21-6. [Link]
5 Schmunis GA. A Tripanosomíase Americana e seu impacto na Saúde Pública das Américas. In: Brener Z, Andrade ZA, Barral-Neto M, editors. Trypanosoma cruzi e Doença de Chagas. 2. ed. Rio de Janeiro: Guanabara Koogan; 2000. p. 1-15.
6 Bittencourt AL. Transmissão vertical da doença de Chagas. In: Brener Z, Andrade ZA, Barral-Neto M, editors. Trypanosoma cruzi e doença de Chagas. 2. ed. Rio de Janeiro: Guanabara Koogan; 2000. p. 16-20.
7 Hermann E, Truyens C, Alonso-Vega C, Rodriguez P, Berthe A, Torrico F, et al. Congenital transmission of Trypanosoma cruzi is associated with maternal enhanced parasitemia and decreased production of interferon- gamma in response to parasite antigens. J Infect Dis. 2004 Apr;189(7):1274-81. [Link]
8 Organização Pan Americana da Saúde. Guia para vigilância, prevenção, controle e manejo clínico da doença de Chagas aguda transmitida por alimentos. Rio de Janeiro: PANAFTOSA-VP/OPAS/OMS; 2009. p. 92. (Serie de Manuais Técnicos, 12). [Link]
9 Moretti E, Basso B, Castro I, Carrizo Paez M, Chaul M, Barbieri G, et al. Chagas disease: study of congenital transmission in cases of acute maternal infection. Rev Soc Bras Med Trop. 2005 Jan-Feb;38(1):53-5. [Link]
10 Torrico F, Alonso-Vega C, Suarez E, Rodríguez P, Torrico MC, Dramaix M, et al. [Endemic level of congenital Trypanosoma cruzi infection in the areas of maternal residence and the development of congenital Chagas disease in Bolivia]. Rev Soc Bras Med Trop. 2005;38 Suppl 2:17-20. [Link]
11 Negrette OS, Mora MC, Basombrio MA. High prevalence of Congenital Trypanosoma cruzi infection and family clustering in Salta, Argentina. Pediatrics 2005 Jun; 115(6):668-72. [Link]
12 Freilij H, Altched J. Congenital Chagas' disease: diagnostic and clinical aspects. Clin Infect Dis. 1995 Sep;21(3):551-5. [Link]
13 Gürtler ER, Segura E, Cohen J. Congenital transmission of Trypanosoma cruzi infection in Argentina. Emerg Inf dis. 2003 Jan;9(1):29-32. [Link]
14 Pehrson P, Walgren M, Bengstsson E. Intracranial calcifications probably due to congenital chagas disease. Am J Trop Med Hyg. 1982 May;31(3):449-51.
15 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Consenso Brasileiro em Doença de Chagas. Rev Soc Bras Med Trop. 2005;38 Suppl 3:S30.[Link]
16 Gontijo ED, Andrade GMQ, Santos SE, Galvã LMC, Moreira EF, Pinto FS, et al. Triagem neonatal da infecção pelo Trypanosoma cruzi em Minas Gerais, Brasil: transmissão congênita e mapeamento das áreas endêmicas. Epidemiol Serv Saúde. 2009 jul-set;18(3):243-54. [Link]
17 Bittencourt AL. Actual aspects and epidemiological significance of congenital transmission of Chagas' disease. Mem Inst Oswaldo Cruz. 1984;79 Suppl:133-7. [Link]
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Ana Yecê das Neves Pinto,
Setor Médico Unificado (SOAMU)/Epidemiologia,
Instituto Evandro Chagas/SVS/MS
BR 316 Km 7 s/n,
ZIP code: 67030-070, Ananindeua/PA
Phone – FAX number: 91 32142189
E.mail:ayece@iec.pa.gov.br
Recebido em / Received / Recibido en: 10/5/2011
Aceito em / Accepted / Aceito en: 18/7/2011










 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI