Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.2 no.2 Ananindeua June 2011
http://dx.doi.org/10.5123/S2176-62232011000200005
ARTÍCULO ORIGINAL
Producción de hemocitos de caracoles de la especie Biomphalaria glabrata luego de la exposición a diferentes protocolos de infección por Schistosoma mansoni
Daniel Valle Vasconcelos SantosI; Marco Antonio Vasconcelos SantosII; Izabel Raimunda de Carvalho RodriguesII
ILaboratório de Biofísica Celular, Instituto de Ciências Biológicas, Universidade Federal do Pará, Belém, Pará, Brasil
IILaboratório de Parasitoses Intestinais e Malacologia, Seção de Parasitologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Hemocyte production in Biomphalaria glabrata snails after exposure to different Schistosoma mansoni infection protocols. Traducido por: Lota Moncada
RESUMEN
El objetivo de este artículo fue el de determinar el perfil del sistema de defensa celular durante la infección mansónica. Específicamente, este estudio evaluó el número de hemocitos producidos y liberados en la hemolinfa como respuesta a la infección por el parásito. La cuantificación de los hemocitos de Biomphalaria glabrata se realizó en grupos de caracoles previamente infectados con 5, 10, 15 o 30 miracideos de Schistosoma mansoni en los días 1, 5, 10, 15, 20 y 30 pos infección. Los resultados revelaron que B. glabrata posee un mecanismo de defensa celular caracterizado por la liberación de hemocitos en la hemolinfa. El mayor registro de producción celular ocurrió 24 h luego de la infección y hubo una reducción significante en la concentración de hemocitos durante los 10 días siguientes. Sin embargo, al 15o día pos infección, hubo un segundo aumento en la producción de hemocitos, aunque no tan acentuado como el primer pico. Al 30o día pos infección, se verificó otro aumento moderado de la producción de hemocitos. Con base en este perfil de respuesta celular, el sistema de defensa del caracol aparenta ser eficiente en los momentos inmediatamente posteriores a la infección, pero esa respuesta no asegura la destrucción de todos los parásitos en el curso de la infección.
Palabras clave: Biomphalaria; Schistosoma mansoni; hemocitos.
INTRODUCCIÓN
La resistencia de caracoles del género Biomphalaria a la infección por el parásito Schistosoma mansoni está directamente relacionada a la capacidad de los hemocitos del vector para realizar la fagocitosis y destruir parásitos recién introducidos1,2,3,4. Los hemocitos son la principal línea de defensa de los moluscos contra parásitos y bacterias5. Se cree que esas células se originen en el órgano productor de amebocitos6, aunque algunos autores han sugerido que esas células especializadas pueden tener un origen multicéntrico7,8.
El encapsulado de los miracidios sucede inmediatamente después de la penetración del parásito y es determinante para la supervivencia o muerte del parásito en su huésped9,10. Basch11 demostró que este proceso puede alterarse por diversos factores, como el estatus nutricional del vector, la virulencia de la cepa del parásito, la cantidad de hemocitos en la hemolinfa, algunos aspectos ambientales directos e indirectos y el número de miracidios que consiguen penetrar en el huésped.
El objetivo de este estudio fue el de evaluar el perfil de producción de hemocitos de especímenes de caracoles de la especie Biomphalaria glabrata mantenidos en cautiverio luego de la infección experimental por diferentes cantidades de miracidios de S. mansoni. La caracterización de la variabilidad de la producción de hemocitos es fundamental para la comprensión de los mecanismos de resistencia de diferentes especies de Biomphalaria a la infección por S. mansoni.
MATERIAL Y MÉTODOS
Cepas brasileñas albinas (no pigmentadas) y pigmentadas (salvajes) de B. glabrata difieren en su susceptibilidad a la infección por S. mansoni12. Los especímenes de B. glabrata utilizados en este estudio eran descendientes de caracoles capturados en la Región Bragantina del Estado de Pará, Brasil. Esta colonia de caracoles fue mantenida en cautiverio en tanques especiales en el Laboratorio de Parasitosis Intestinales y Malacología del Instituto Evandro Chagas, Estado de Pará. La cepa de S. mansoni utilizada se extrajo de ratones infectados en el propio laboratorio, previamente aisladas de caracoles capturados en reservorios de agua dulce en la Ciudad de Belém, Estado de Pará.
El hígado de los caracoles infectados fue macerado, filtrado con gasa y sometido a sedimentación espontánea. El sedimento fue expuesto a la luz por 45 min y los miracidios fueron colectados con el uso de micropipetas y un estereomicroscopio (Zeiss, Stemi SV 11).
Un total de 752 caracoles de aproximadamente ocho meses de edad y 1,5 cm. de diámetro de concha fueron infectados individualmente en frascos de vidrio con 2 mL de agua potable sin cloro con 5, 10, 15 o 30 miracidios. La infección fue considerada exitosa en los casos en que ningún miracidio fue visualizado en el recipiente luego de 90 min de exposición a la luz. Después de este procedimiento, los moluscos fueron transferidos para acuarios especiales debidamente etiquetados con su protocolo de infección. El grupo control estaba compuesto por 52 caracoles no infectados de la misma colonia inicial.
Las muestras de hemolinfa (20 µL) fueron recolectadas por medio de punción directa en cada caracol en los días 1o, 5o, 10o, 15o, 20o y 30o post-infección para evaluar la cantidad de hemocitos circulantes. Las muestras fueron diluidas en solución de Turk (0,1% violeta cristal en 1% de ácido acético glacial) a una proporción de 1:1; se colocaron 5 µL de la solución resultante en cada una de las laterales de una cámara de Neubauer. Por fin, cada muestra de hemolinfa fue analizada en duplicado utilizando un microscopio óptico (Leitz, Dialux 20 EB) 100X y 400X.
Los resultados se presentan como valores medios y desvíos estándar. Las diferencias entre los valores de cada grupo fueron evaluadas por un análisis de la varianza (ANOVA) y prueba † de Student (α = 0,05). Todos los análisis estadísticos fueron realizados con el programa BioEstat® 5.0 (IDSM/MCT/CNPq).
RESULTADOS
De los 752 caracoles infectados, 8% murió en el curso de la infección y no hubo cualquier correlación entre la tasa de mortalidad y el número de miracidios utilizados. Por lo tanto, fueron utilizados 710 caracoles en la cuantificación de los hemocitos circulantes. Esos caracoles fueron divididos en 24 grupos de aproximadamente 30 individuos; el grupo control estaba compuesto por 52 especímenes. Un resumen de estos resultados puede ser observado en la Tabla 1.
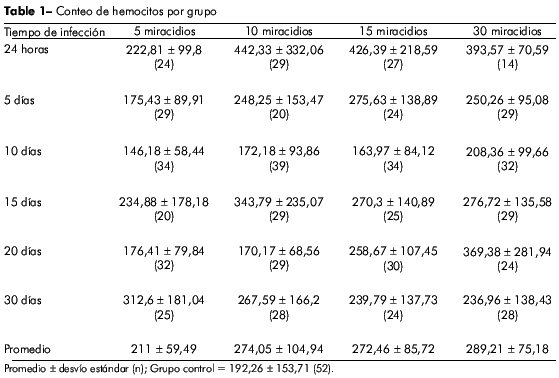
Hubo un pequeño aumento (9,7%) en el conteo de hemocitos circulantes en el grupo infectado por cinco miracidios, pero estos valores no fueron considerados significativos cuando comparados con el grupo control. Sin embargo, hubo un fuerte aumento en la producción de hemocitos 24 h luego de la infección en los grupos infectados con los números más altos de miracidios. La producción de hemocitos aumentó en un 130,07%, 121,78% y 104,71 % en los grupos que recibieron 10, 15 y 30 miracidios, respectivamente. Después de cinco días de infección, hubo una significativa reducción en el número de hemocitos en cada uno de los grupos de caracoles, a pesar de que el grupo que había sido infectado con cinco miracidios había presentado una producción menor que los otros grupos experimentales (p < 0.05).
En todos los grupos, la menor cantidad de hemocitos circulantes se observó al décimo día post-infección y el grupo que había sido infectado con 30 miracidios experimentó la menor reducción.
Al 15o día post-infección, el conteo de hemocitos circulantes au mentó proporcionalmente a la carga inicial de parásitos y esta tendencia permaneció hasta el 20o día post-infección. Al 30o día post-infección, la producción celular se estabilizó y no se observaron diferencias significantes entre los grupos experimentales. Estos resultados pueden ser vistos en la figura 1.
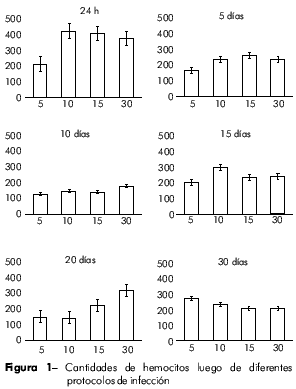
Luego de 24 h de la infección, hubo una fuerte correlación inversa entre el conteo de hemocitos circulantes y el número de miracidios utilizados para causar la infección (r = 0.99; p < 0.01). Esta relación se invirtió al 10o día postinfección (r = 0.91; p < 0.05) y se mantuvo hasta la última fase de la infección (r = 0.97; p < 0.05) (Figura 2).
DISCUSIÓN
Los hemocitos, que son células ameboides móviles, son importantes constitutivos del sistema de defensa de los caracoles del género Biomphalaria contra la infección por miracidios de S. mansoni3,13. Estas células forman la barrera primaria contra parásitos y bacterias invasoras13,14; la motilidad de su citoesqueleto y las adaptaciones de sus membranas plasmáticas encapsulan organismos externos15 y esas células también colaboran con diversos factores humorales de defensa. Muchos estudios han buscado elucidar la interacción compleja entre parásito y huésped existente en este modelo16,17,18,19.
En este artículo, fueron evaluadas las variaciones en los conteos de hemocitos circulantes de caracoles de la especie B. glabrata luego de exposición a diferentes cantidades de miracidios de S. mansoni. El principal hallazgo de este estudio fue el aumento significativo en la producción de hemocitos solamente cuando más de cinco miracidios penetraron en el caracol. Este agregado fue seguido de una disminución considerable en el conteo de hemocitos 24 h luego de la infección, aumento este que persistió durante los primeros 10 días post-infección. Al 15o día post-infección, se inició una retomada en la producción de hemocitos en las células y el nivel de hemocitos se tornó estable al 30o día post-infección. Además, este comportamiento se mostró independiente de la carga parasitaria inicial. Hubo una fuerte correlación negativa entre el conteo de hemocitos y el número de miracidios utilizados para la infección luego de 24 h, aunque esta correlación fue invertida en los días 10o y 20o post-infección.
Luego de 24 h de la infección, el aumento medio en el número de hemocitos circulantes fue de 93,11%. Stumpf y Gilbertson19 relataron una duplicación en el conteo de hemocitos de B. glabrata 2 h luego de la exposición a los miracidios. Resultados semejantes fueron obtenidos por Joky et al20 and Jeong et al13; hubo un aumento en el número de hemocitos de B. glabrata seguido inmediatamente a la exposición a un número menor de miracidios, reducción que fue seguida de un pico en la producción celular en los 3o y 4o días y una disminución acentuada en el número de hemocitos en los 6o y 7o días. Martins-Souza et al21 caracterizaron los hemocitos vivos presentes luego de la infección por esquistosoma por medio de análisis citométrico e identificaron el pico en la producción de hemocitos 24 h post-infección.
Esos datos dan base a los resultados en lo referente al aumento en el conteo de hemocitos durante las primeras horas luego de la penetración de miracidios y a la posterior disminución en los números de hemocitos circulantes22,23,24.
Este estudio también demostró que, luego de la exposición al S. mansoni, el nivel de hemocitos en la hemolinfa se mantuvo más alto que en el grupo control y por más tiempo que el relatado en investigaciones anteriores25. Este hallazgo corrobora la potencial existencia de un efecto duradero sobre los hemocitos, que probablemente consiste en factores humorales, luego de la reacción del caracol a los organismos invasores.
Este estudio también demostró que el número de miracidios infecciosos es un factor determinante para la magnitud de la respuesta celular a la infección por esquistosoma. Por ejemplo, el número de hemocitos producidos en las primeras 24 h post-infección fue bastante mayor en moluscos infectados con 10, 15 o 30 miracidios que en los infectados con 5 de esas larvas.
En relación a la dinámica de la respuesta celular hemocítica de los moluscos a los miracidios invasores, estudios anteriores9,10 registraron la interacción o adhesión de los hemocitos a la superficie del parásito 3 h después de la penetración de las larvas. Siete horas y media después de este contacto, los hemocitos fagocitaron las microvellosidades en la superficie del parásito. Veinticuatro horas después, se observó una gran actividad hemocítica, procesos de encapsulación y la formación de grandes fagosomas. Cuarenta y ocho horas más tarde, fueron encontradas cápsulas con muchos hemocitos conteniendo un gran número de fagosomas. Al cuarto día, sin embargo, esas cápsulas aparecían en número bastante menor.
Los resultados obtenidos por Cheng y Garrabrant12 luego del estudio de dos diferentes cepas de B. glabrata (PR-albino y 10-R2) infectadas por S. mansoni demostraron que los niveles de fosfatasa ácida en la hemolinfa aumentaron ocho veces después de 24 h de infección por la cepa 10-R2, en comparación con el grupo control no infectado. Sin embargo, hubo apenas un aumento discreto de esos niveles durante el mismo período para el grupo infectado por la cepa PR-albino. En relación al número de hemocitos, los resultados fueron completamente inversos. La cepa PR-albino indujo un pico en la producción de hemocitos durante las primeras 12 h de infección, lo que fue seguido de una acentuada reducción en la cantidad de hemocitos circulantes, mientras que la cepa 10-R2 no alteró de forma significativa el conteo de hemocitos durante el proceso infeccioso, lo que indicó que la fosfatasa ácida puede tener un papel importante en la regulación de la producción de hemocitos luego de la exposición al parásito.
CONCLUSIÓN
La dinámica del proceso de fagocitosis, que fue observada hasta el cuarto día post-infección, sugiere que la movilización de esas células defensivas solamente es eficiente durante la primera fase del proceso infeccioso después que un gran número de parásitos hubiera penetrado en el caracol. Además, esa movilización no garantiza la eliminación de las larvas en el curso de la infección. La reacción de defensa del molusco contra las larvas del parásito podría ser más eficaz si no fuera regulada apenas por un proceso celular, sino también por mecanismos bioquímicos que estimularían directamente a los órganos hematopoiéticos a producir más hemocitos.
AGRADECIMIENTOS
Los autores desean agradecer a Rosângela Barros do Nascimento, Carlos da Silva Faria y Bruno Silva de Lima, por el apoyo técnico durante toda la investigación, y a Kauê Machado Costa, por la revisión crítica y sus valiosas sugestiones.
APOYO FINANCIERO
Instituto Evandro Chagas / Fundação Nacional de Saúde.
REFERENCIAS
1 Newton W. The comparative tissue reaction of two strains of Australorbis glabratus to infection with Schistosomia mansoni. J Parasitol. 1952 Aug;38(4 Sec. A. 1):362-6.
2 Barbosa F, Coelho M, Dobbin J. Qualidade de vetor dos hospedeiros de Schistosoma mansoni no Nordeste do Brasil. II. Duração da infestação e eliminação de cercarias em Australorbis glabratus. Publ Av Inst Aggeu Magalhães. 1954;7:79-92.
3 Lie J, Heyneman D, Jeong K. Studies on resistance in snails. 4. Induction of ventricular capsules and changes in the amebocyte-producing organ during sensitization of Biomphalaria glabrata snails. J Parasitol. 1976 Apr;62(2):286-91. [Link]
4 Negrão-Corrêa D, Pereira C, Rosa F, Martins R, Martins-Souza RL, Andrade ZA, et al. Molluscan response to parasite: Biomphalaria and Schistosoma mansoni interaction. ISJ. 2007;4:101-11. [Link]
5 Granath Jr WO, Yoshino TP. Lysosomal enzyme activities in susceptible and refractory strains of Biomphalaria glabrata during the course of infection with Schistosoma mansoni. J Parasitol. 1983 Dec;69(6):1018-26. [Link]
6 Cheng TC, Auld KR. Hemocytes of the pulmonate gastropod Biomphalaria glabrata. J Invertebr Pathol. 1977 Jul;30(1):119-22.
7 Connors VA, Buron I, Granath Jr WO. Schistosoma mansoni: interleukin-1 increases phagocytosis and superoxide production by hemocytes and decreases output of cercariae in schistosome-susceptible Biomphalaria glabrata. Exp Parasitol. 1995 Feb;80:139-48. [Link]
8 Souza S, Andrade Z. On the origin of the Biomphalaria glabrata hemocytes. Mem Inst Oswaldo Cruz. 2006 Sep;101 Suppl 1:S213-8. [Link]
9 Loker ES, Bayne CJ, Buckley PM, Kruse KT. Ultrastructure of encapsulation of Schistosoma mansoni mother sporocysts by hemocytes of juveniles of the 10-R2 strain of Biomphalaria glabrata. J Parasitol. 1982 Feb;68(1):84-94.
10 Van der Knaap WP, Loker E. Immune mechanisms in trematod-snail interactions. Parasitol Today. 1990 Jun;6(6):175-82. Doi:10.1016/0169-4758(90)90349-9 [Link]
11 Basch PF. Intermediate host specificity in Schistosoma mansoni. Exp Parasitol. 1976 Feb;39(1):150-69.
12 Cheng T, Garrabrant T. Acid phosphatase in granulocytic capsules formed in strains of Biomphalaria glabrata totally and partially resistant to Schistosoma mansoni. Int J Parasitol. 1977 Dec;7(6):467-72.
13 Jeong KH, Lie KJ, Heyneman D. Leucocytosis in Biomphalaria glabrata sensitized and resensitized to Echinostoma lindoense. J Invertebr Pathol. 1980 Jan;35(1):9-13.
14 Matricon-Gondran M, Letocart M. Internal defenses of the snail Biomphalaria glabrata II. Defense cells have different phagocytic responses to various injected foreign materials. J Invertebr Pathol. 1999 Nov;74(3):235-47. Doi:10.1006/Jipa.1999.4877 [Link]
15 Loker ES, Bayne CJ, Yui MA. Echinostoma paraensei: hemocytes of Biomphalaria glabrata as targets of echinostome mediated interference with host snail resistance to Schistosoma mansoni. Exp Parasitol. 1986 Aug;62(1):149-54. [Link]
16 Barracco MA, Steil AA, Gargioni R. Morphological characterization of the hemocytes of the pulmonate snail Biomphalaria tenagophila. Mem Inst Oswaldo Cruz. 1993 Jan-Mar;88(1):73-83. http://dx.doi.org/10.1590/S0074-02761993000100012 [Link]
17 Bayne CJ, Buckley PM, DeWan PC. Schistosoma mansoni: cytotoxicity of hemocytes from susceptible snail hosts for sporocysts in plasma from resistant Biomphalaria glabrata. Exp Parasitol. 1980 Dec;50(3):409-16.
18 Bayne CJ, Loker ES, Yui MA, Stephens J. Immune-recognition of Schistosoma mansoni primary sporocysts may require specific receptors on Biomphalaria glabrata hemocytes. Parasite Immunol. 1984 Dec;6(6):519-28. DOI:10.1111/j.1365-3024.1984.tb00822.x [Link]
19 Stumpf JL, Gilbertson DE. Hemocytes of Biomphalaria glabrata: factors affecting variability. J Invertebr Pathol. 1978 Sep;32(2):177-81. Doi:10.1016/0022-2011(78)90027-7 [Link]
20 Joky A, Matricon-Gondran M, Benex J. Response to the amoebocyte-producing organ of sensitized Biomphalaria glabrata after exposure to Echinostoma caproni miracidia. J Invertebr Pathol. 1985 Jan;45(1):28-33. Doi:10.1016/0022-2011(85)90045-X [Link]
21 Martins-Souza RL, Pereira CA, Coelho PM, Martins-Filho O, Negrão-Corrêa D. Flow cytometry analysis of the circulating haemocytes from Biomphalaria glabrata and Biomphalaria tenagophila following Schistosoma mansoni infection. Parasitology. 2009 Jan;136(1):67-76. DOI:10.1017/S0031182008005155 [Link]
22 Matricon-Gondran M. The site of ultrafiltration in the kidney sac of the pulmonate gastropod Biomphalaria glabrata. Tissue & cell. 1990;22:911-23. Doi:10.1016/0040-8166(90)90052-B [Link]
23 Bayne CJ, Hahn UK, Bender RC. Mechanisms of molluscan host resistance and of parasite strategies for survival. Parasitology. 2001;123 Suppl:S159-67. [Link]
24 Martins-Souza RL, Pereira CA, Coelho PM, Negrão-Corrêa D. Silica treatment increases the susceptibility of the Cabo Frio strain of Biomphalaria tenagophila to Schistosoma mansoni infection but does not alter the natural resistance of the Taim strain. Parasitol Res. 2003 Dec;91(6):500-7. DOI: 10.1007/s00436-003-0985-4 [Link]
25 Oliveira AL, Silva D, Manzano BC, Abdel-Hamid AZ, Marcelino MY, Zanotti-Magalhaes EM, et al. Genetic differences between strains of Biomphalaria glabrata (Planorbidae) that are susceptible and unsusceptible to schistosomiasis. Genet Mol Res. 2010 Jul;9(3):1450-9. DOI 10.4238/vol9-3gmr821 [Link]
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Daniel Valle Vasconcelos Santos
Rua Arciprestes Manoel Teodoro, no 265 Bairro: Batista Campos
CEP: 66023700 Belém - Pará – Brasil
Tel.: 55 (91) 81299664
E-mail: danielsantos@ufpa.br
Received / Recebido em / Recibido en: 27/5/2011
Accepted / Aceito em / Aceito en: 1/9/2011











 text in
text in 

