Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.2 no.2 Ananindeua June 2011
http://dx.doi.org/10.5123/S2176-62232011000200005
ARTIGO ORIGINAL
Produção de hemócitos de caramujos da espécie Biomphalaria glabrata após a exposição a diferentes protocolos de infecção por Schistosoma mansoni
Daniel Valle Vasconcelos SantosI; Marco Antonio Vasconcelos SantosII; Izabel Raimunda de Carvalho RodriguesII
ILaboratório de Biofísica Celular, Instituto de Ciências Biológicas, Universidade Federal do Pará, Belém, Pará, Brasil
IILaboratório de Parasitoses Intestinais e Malacologia, Seção de Parasitologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
Título original: Hemocyte production in Biomphalaria glabrata snails after exposure to different Schistosoma mansoni infection protocols. Traduzido por: André Monteiro Diniz.
RESUMO
O objetivo deste artigo foi determinar o perfil do sistema de defesa celular durante a infecção mansônica. Especificamente, este estudo avaliou o número de hemócitos produzidos e liberados na hemolinfa em resposta à infecção pelo parasita. A quantificação dos hemócitos de Biomphalaria glabrata foi realizada em grupos de caramujos previamente infectados com 5, 10, 15 ou 30 miracídios de Schistosoma mansoni nos dias 1, 5, 10, 15, 20 e 30 pós-infecção. Os resultados revelaram que B. glabrata possui um mecanismo de defesa celular caracterizado pela liberação de hemócitos na hemolinfa. O maior registro de produção celular ocorreu 24 h após a infecção e houve uma redução significante na concentração de hemócitos durante os 10 dias seguintes. No entanto, no dia 15 pós-infecção, houve um segundo aumento na produção de hemócitos, porém não tão acentuado como o primeiro pico. No dia 30 pós-infecção, foi observado outro aumento moderado da produção de hemócitos. Com base neste perfil de resposta celular, o sistema de defesa do caramujo aparenta ser eficiente nos momentos imediatamente posteriores à infecção, mas essa resposta não assegura a destruição de todos os parasitas no curso da infecção.
Palavras-chave: Biomphalaria; Schistosoma mansoni; hemócitos.
INTRODUÇÃO
A resistência de caramujos do gênero Biomphalaria à infecção pelo parasita Schistosoma mansoni é diretamente relacionada à capacidade dos hemócitos do vetor de realizar a fagocitose e destruir parasitas recém-introduzidos1,2,3,4. Os hemócitos são a principal linha de defesa dos moluscos contra parasitas e bactérias5. Acredita-se que essas células se originem do órgão produtor de amebócitos6, apesar de alguns autores terem sugerido que essas células especializadas podem ter uma origem multicêntrica7,8.
A encapsulação dos miracídios ocorre imediatamente após a penetração do parasita e é determinante para a sobrevivência ou morte do parasita em seu hospedeiro9,10. Basch11 demonstrou que este processo pode ser alterado por diversos fatores, como o status nutricional do vetor, a virulência da cepa do parasita, a quantidade de hemócitos hemolinfa, alguns aspectos ambientais diretos e na indiretos e o número de miracídios que conseguem penetrar no hospedeiro.
O objetivo deste estudo foi avaliar o perfil de produção de hemócitos de espécimes de caramujos da espécie Biomphalaria glabrata mantidos em cativeiro após a infecção experimental por diferentes quantidades de miracídios de S. mansoni. A caracterização da variabilidade da produção de hemócitos é fundamental para a compreensão dos mecanismos de resistência de diferentes espécies de Biomphalaria à infecção por S. mansoni.
MATERIAL E MÉTODOS
Cepas brasileiras albinas (não pigmentadas) e pigmentadas (selvagens) de B. glabrata diferem em sua suscetibilidade à infecção por S. mansoni12. Os espécimes de B. glabrata utilizados neste estudo eram descendentes de caramujos capturados na região Bragantina do Estado do Pará, Brasil. Esta colônia de caramujos foi mantida em cativeiro em tanques especiais no Laboratório de Parasitoses Intestinais e Malacologia do Instituto Evandro Chagas, Estado do Pará. A cepa de S. mansoni utilizada foi extraída de camundongos infectados no próprio laboratório, previamente isoladas de caramujos capturados em reservatórios de água doce na Cidade de Belém, Estado do Pará.
O fígado dos camundongos infectados foi macerado, filtrado com gaze e submetido a sedimentação espontânea. O sedimento foi exposto à luz por 45 min e os miracídios foram coletados com o uso de micropipetas e um estereomicroscópio (Zeiss, Stemi SV 11).
Um total de 752 caramujos de aproximadamente oito meses de idade e 1,5 cm de diâmetro de concha foram individualmente infectados em frascos de vidro com 2 mL de água potável sem cloro com 5, 10, 15 ou 30 miracídios. A infecção foi considerada de sucesso nos casos em que nenhum miracídio foi visualizado no recipiente após 90 min de exposição à luz. Após este procedimento, os moluscos foram transferidos para aquários especiais devidamente etiquetados com o seu protocolo de infecção. O grupo controle era composto por 52 caramujos não infectados da mesma colônia inicial.
As amostras de hemolinfa (20 µL) foram coletadas por meio de punção direta em cada caramujo nos dias 1, 5, 10, 15, 20 e 30 pós-infecção para avaliar a quantidade de hemócitos circulantes. As amostras foram diluídas em solução de Turk (0,1% violeta cristal em 1% de ácido acético glacial) a uma proporção de 1:1; foram colocados 5 µL da solução resultante em cada uma das laterais de uma câmara de Neubauer. Por fim, cada amostra de hemolinfa foi analisada em duplicata utilizando-se um microscópio ótico (Leitz, Dialux 20 EB) 100X e 400X .
Os resultados são apresentados como os valores médios e os desvios padrões. As diferenças entre os valores de cada grupo foram avaliadas por meio de uma análise de variância (ANOVA) e teste † de Student (α = 0,05). Todas as análises estatísticas foram realizadas com o programa BioEstat® 5.0 (IDSM/MCT/CNPq).
RESULTADOS
Dos 752 caramujos infectados, 8% morreram no curso da infecção e não houve qualquer correlação entre a taxa de mortalidade e o número de miracídios utilizados. Portanto, foram utilizados 710 caramujos na quantificação dos hemócitos circulantes. Esses caramujos foram divididos em 24 grupos de aproximadamente 30 indivíduos; o grupo controle era composto por 52 espécimes. Um resumo desses resultados pode ser observado na tabela 1.
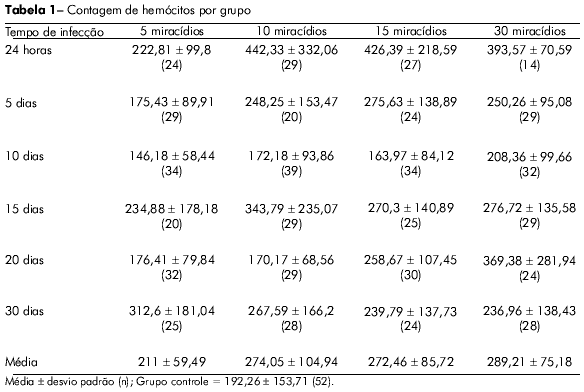
Houve um pequeno aumento (9,7%) na contagem de hemócitos circulantes no grupo infectado por cinco miracídios, porém estes valores não foram considerados significantes se comparados com o grupo controle. No entanto, houve um forte aumento na produção de hemócitos 24 h após a infecção nos grupos que foram infectados com os números mais altos de miracídios. A produção de hemócitos aumentou em 130,07%, 121,78% e 104,71% nos grupos que receberam 10, 15 e 30 miracídios, respectivamente. Após cinco dias de infecção, houve uma redução significante no número de hemócitos em cada um dos grupos de caramujos, apesar de o grupo que havia sido infectado com cinco miracídios ter apresentado uma produção menor do que os outros grupos experimentais (p < 0.05).
Em todos os grupos, a menor quantidade de hemócitos circulantes foi observada no dia 10 pós-infecção e o grupo que havia sido infectado com 30 miracídios experimentou a menor redução.
No dia 15 pós-infecção, a contagem de hemócitos circulantes aumentou proporcionalmente à carga inicial de parasitas e esta tendência permaneceu até o dia 20 pós-infecção. No dia 30 pós-infecção, a produção celular estabilizou-se e não foram observadas diferenças significantes entre os grupos experimentais. Estes resultados podem ser visualizados na figura 1.
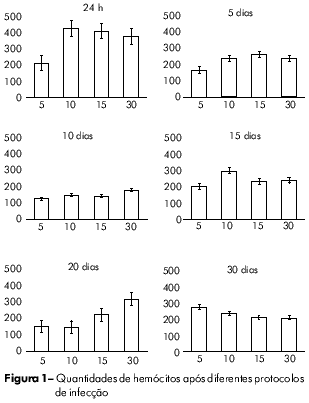
Após 24 h da infecção, houve uma forte correlação inversa entre a contagem de hemócitos circulantes e o número de miracídios utilizados para causar a infecção (r = 0.99; p < 0.01). Esta relação foi invertida no dia 10 pós-infecção (r = 0.91; p < 0.05) e manteve-se até a última fase da infecção (r = 0.97; p < 0.05) (Figura 2).
DISCUSSÃO
Os hemócitos, que são células ameboides móveis, são constituintes importantes do sistema de defesa dos caramujos do gênero Biomphalaria contra a infecção por miracídios de S. mansoni3,13. Estas células formam a barreira primária contra parasitas e bactérias invasoras13,14; a mobilidade de seu citoesqueleto e as adaptações de suas membranas plasmáticas encapsulam organismos externos15 e essas células também colaboram com diversos fatores humorais de defesa. Muitos estudos têm procurado elucidar a interação complexa entre parasita e hospedeiro existente neste modelo16,17,18,19.
Neste artigo, foram avaliadas as variações nas contagens de hemócitos circulantes de caramujos da espécie B. glabrata após a exposição a diferentes quantidades de miracídios de S. mansoni. O principal achado deste estudo foi o aumento significativo na produção de hemócitos apenas quando mais de cinco miracídios penetraram no caramujo. Este acréscimo foi seguido de uma diminuição considerável na contagem de hemócitos 24 h após a infecção, aumento este que persistiu durante os primeiros 10 dias pós-infecção. No dia 15 pós-infecção, iniciou-se uma retomada na produção de hemócitos nas células e o nível de hemócitos tornou-se estável no dia 30 pós-infecção. Além disso, este comportamento mostrou-se independente da carga parasitária inicial. Houve uma forte correlação negativa entre a contagem de hemócitos e o número de miracídios utilizados para a infecção após 24 h, porém esta correlação foi invertida nos dias 10 e 20 pós-infecção.
Após 24 h da infecção, o aumento médio no número de hemócitos circulantes foi de 93,11%. Stumpf e Gilbertson19 relataram uma duplicação na contagem de hemócitos de B. glabrata 2 h após a exposição aos miracídios. Resultados semelhantes foram obtidos Joky et al20 and Jeong et al13; houve um aumento no número de hemócitos de B. glabrata imediatamente após a exposição a um número menor de miracídios, redução esta que foi seguida de um pico na produção celular nos dias 3 e 4 e uma diminuição acentuada no número de hemócitos nos dias 6 e 7. Martins-Souza et al21 caracterizaram os hemócitos vivos presentes após a infecção por esquistossoma por meio de análise citométrica e identificaram o pico na produção de hemócitos 24 h pós-infecção.
Esses dados embasam os resultados no que diz respeito ao aumento na contagem de hemócitos durante as primeiras horas após a penetração de miracídios e ao posterior declínio nos números de hemócitos circulantes22,23,24.
Este estudo também demonstrou que, após a exposição ao S. mansoni, o nível de hemócitos na hemolinfa manteve-se mais alto do que no grupo controle e por mais tempo do que o relatado em pesquisas anteriores25. Este achado corrobora a potencial existência de um efeito duradouro sobre os hemócitos, que provavelmente consiste em fatores humorais, após a reação do caramujo aos organismos invasores.
Este estudo também demonstrou que o número de miracídios infecciosos é um fator determinante para a magnitude da resposta celular à infecção por esquistossoma. Por exemplo, o número de hemócitos produzidos nas primeiras 24 h pós-infecção foi bem maior em moluscos infectados com 10, 15 ou 30 miracídios do que nos infectados com cinco dessas larvas.
Em relação à dinâmica da resposta celular hemocítica dos moluscos aos miracídios invasores, estudos anteriores9,10 registraram a interação ou adesão dos hemócitos à superfície do parasita 3 h após a penetração das larvas. Sete horas e meia depois deste contato, os hemócitos fagocitaram as microvilosidades na superfície do parasita. Vinte e quatro horas depois, foram observados uma grande atividade hemocítica, processos de encapsulação e a formação de grandes fagossomos. 48 h mais tarde, foram encontradas cápsulas com muitos hemócitos contendo um grande número de fagossomos. No quarto dia, entretanto, essas cápsulas apresentavam-se em número bem menor.
Os resultados obtidos por Cheng e Garrabrant12 após o estudo de duas diferentes cepas de B. glabrata (PR-albino e 10-R2) infectadas por S. mansoni demonstraram que os níveis de fosfatase ácida na hemolinfa aumentaram oito vezes após 24 h de infecção pela cepa 10-R2, em comparação com o grupo controle não infectado. No entanto, houve apenas um aumento discreto desses níveis no mesmo período para o grupo infectado pela cepa PR-albino. Em relação ao número de hemócitos, os resultados foram completamente inversos. A cepa PR-albino induziu um pico na produção de hemócitos durante as primeiras 12 h de infecção, o qual foi seguido de uma acentuada redução na quantidade de hemócitos circulantes, enquanto que a cepa 10-R2 não alterou de forma significativa a contagem de hemócitos durante o processo infeccioso, o que indicou que a fosfatase ácida pode ter um papel importante na regulação da produção de hemócitos após a exposição ao parasita.
CONCLUSÃO
A dinâmica do processo de fagocitose, que foi observada até o quarto dia pós-infecção, sugere que a mobilização dessas células defensivas só é eficiente durante a primeira fase do processo infeccioso após um grande número de parasitas ter penetrado no caramujo. Além disso, essa mobilização não garante a eliminação das larvas no curso da infecção. A reação de defesa do molusco contra as larvas do parasita poderia ser mais eficaz se não fosse regulada apenas por um processo celular, mas também por mecanismos bioquímicos que estimulariam diretamente os órgãos hematopoiéticos a produzirem mais hemócitos.
AGRADECIMENTOS
Os autores gostariam de agradecer a Rosângela Barros do Nascimento, Carlos da Silva Faria e Bruno Silva de Lima, pelo apoio técnico durante toda a pesquisa, e a Kauê Machado Costa, pela revisão crítica e suas valiosas sugestões.
APOIO FINANCEIRO
Instituto Evandro Chagas / Fundação Nacional de Saúde.
REFERÊNCIAS
1 Newton W. The comparative tissue reaction of two strains of Australorbis glabratus to infection with Schistosomia mansoni. J Parasitol. 1952 Aug;38(4 Sec. A. 1):362-6.
2 Barbosa F, Coelho M, Dobbin J. Qualidade de vetor dos hospedeiros de Schistosoma mansoni no Nordeste do Brasil. II. Duração da infestação e eliminação de cercarias em Australorbis glabratus. Publ Av Inst Aggeu Magalhães. 1954;7:79-92.
3 Lie J, Heyneman D, Jeong K. Studies on resistance in snails. 4. Induction of ventricular capsules and changes in the amebocyte-producing organ during sensitization of Biomphalaria glabrata snails. J Parasitol. 1976 Apr;62(2):286-91. [Link]
4 Negrão-Corrêa D, Pereira C, Rosa F, Martins R, Martins-Souza RL, Andrade ZA, et al. Molluscan response to parasite: Biomphalaria and Schistosoma mansoni interaction. ISJ. 2007;4:101-11. [Link]
5 Granath Jr WO, Yoshino TP. Lysosomal enzyme activities in susceptible and refractory strains of Biomphalaria glabrata during the course of infection with Schistosoma mansoni. J Parasitol. 1983 Dec;69(6):1018-26. [Link]
6 Cheng TC, Auld KR. Hemocytes of the pulmonate gastropod Biomphalaria glabrata. J Invertebr Pathol. 1977 Jul;30(1):119-22.
7 Connors VA, Buron I, Granath Jr WO. Schistosoma mansoni: interleukin-1 increases phagocytosis and superoxide production by hemocytes and decreases output of cercariae in schistosome-susceptible Biomphalaria glabrata. Exp Parasitol. 1995 Feb;80:139-48. [Link]
8 Souza S, Andrade Z. On the origin of the Biomphalaria glabrata hemocytes. Mem Inst Oswaldo Cruz. 2006 Sep;101 Suppl 1:S213-8. [Link]
9 Loker ES, Bayne CJ, Buckley PM, Kruse KT. Ultrastructure of encapsulation of Schistosoma mansoni mother sporocysts by hemocytes of juveniles of the 10-R2 strain of Biomphalaria glabrata. J Parasitol. 1982 Feb;68(1):84-94.
10 Van der Knaap WP, Loker E. Immune mechanisms in trematod-snail interactions. Parasitol Today. 1990 Jun;6(6):175-82. Doi:10.1016/0169-4758(90)90349-9 [Link]
11 Basch PF. Intermediate host specificity in Schistosoma mansoni. Exp Parasitol. 1976 Feb;39(1):150-69.
12 Cheng T, Garrabrant T. Acid phosphatase in granulocytic capsules formed in strains of Biomphalaria glabrata totally and partially resistant to Schistosoma mansoni. Int J Parasitol. 1977 Dec;7(6):467-72.
13 Jeong KH, Lie KJ, Heyneman D. Leucocytosis in Biomphalaria glabrata sensitized and resensitized to Echinostoma lindoense. J Invertebr Pathol. 1980 Jan;35(1):9-13.
14 Matricon-Gondran M, Letocart M. Internal defenses of the snail Biomphalaria glabrata II. Defense cells have different phagocytic responses to various injected foreign materials. J Invertebr Pathol. 1999 Nov;74(3):235-47. Doi:10.1006/Jipa.1999.4877 [Link]
15 Loker ES, Bayne CJ, Yui MA. Echinostoma paraensei: hemocytes of Biomphalaria glabrata as targets of echinostome mediated interference with host snail resistance to Schistosoma mansoni. Exp Parasitol. 1986 Aug;62(1):149-54. [Link]
16 Barracco MA, Steil AA, Gargioni R. Morphological characterization of the hemocytes of the pulmonate snail Biomphalaria tenagophila. Mem Inst Oswaldo Cruz. 1993 Jan-Mar;88(1):73-83. http://dx.doi.org/10.1590/S0074-02761993000100012 [Link]
17 Bayne CJ, Buckley PM, DeWan PC. Schistosoma mansoni: cytotoxicity of hemocytes from susceptible snail hosts for sporocysts in plasma from resistant Biomphalaria glabrata. Exp Parasitol. 1980 Dec;50(3):409-16.
18 Bayne CJ, Loker ES, Yui MA, Stephens J. Immune-recognition of Schistosoma mansoni primary sporocysts may require specific receptors on Biomphalaria glabrata hemocytes. Parasite Immunol. 1984 Dec;6(6):519-28. DOI:10.1111/j.1365-3024.1984.tb00822.x [Link]
19 Stumpf JL, Gilbertson DE. Hemocytes of Biomphalaria glabrata: factors affecting variability. J Invertebr Pathol. 1978 Sep;32(2):177-81. Doi:10.1016/0022-2011(78)90027-7 [Link]
20 Joky A, Matricon-Gondran M, Benex J. Response to the amoebocyte-producing organ of sensitized Biomphalaria glabrata after exposure to Echinostoma caproni miracidia. J Invertebr Pathol. 1985 Jan;45(1):28-33. Doi:10.1016/0022-2011(85)90045-X [Link]
21 Martins-Souza RL, Pereira CA, Coelho PM, Martins-Filho O, Negrão-Corrêa D. Flow cytometry analysis of the circulating haemocytes from Biomphalaria glabrata and Biomphalaria tenagophila following Schistosoma mansoni infection. Parasitology. 2009 Jan;136(1):67-76. DOI:10.1017/S0031182008005155 [Link]
22 Matricon-Gondran M. The site of ultrafiltration in the kidney sac of the pulmonate gastropod Biomphalaria glabrata. Tissue & cell. 1990;22:911-23. Doi:10.1016/0040-8166(90)90052-B [Link]
23 Bayne CJ, Hahn UK, Bender RC. Mechanisms of molluscan host resistance and of parasite strategies for survival. Parasitology. 2001;123 Suppl:S159-67. [Link]
24 Martins-Souza RL, Pereira CA, Coelho PM, Negrão-Corrêa D. Silica treatment increases the susceptibility of the Cabo Frio strain of Biomphalaria tenagophila to Schistosoma mansoni infection but does not alter the natural resistance of the Taim strain. Parasitol Res. 2003 Dec;91(6):500-7. DOI: 10.1007/s00436-003-0985-4 [Link]
25 Oliveira AL, Silva D, Manzano BC, Abdel-Hamid AZ, Marcelino MY, Zanotti-Magalhaes EM, et al. Genetic differences between strains of Biomphalaria glabrata (Planorbidae) that are susceptible and unsusceptible to schistosomiasis. Genet Mol Res. 2010 Jul;9(3):1450-9. DOI 10.4238/vol9-3gmr821 [Link]
 Correspondence / Correspondência / Correspondencia:
Correspondence / Correspondência / Correspondencia:
Daniel Valle Vasconcelos Santos
Rua Arciprestes Manoel Teodoro, no 265 Bairro: Batista Campos
CEP: 66023700 Belém - Pará – Brasil
Tel.: 55 (91) 81299664
E-mail: danielsantos@ufpa.br
Received / Recebido em / Recibido en: 27/5/2011
Accepted / Aceito em / Aceito en: 1/9/2011











 text in
text in 

