Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.2 n.3 Ananindeua sep. 2011
http://dx.doi.org/10.5123/S2176-62232011000300004
ARTÍCULO ORIGINAL
Genotipado de la resistencia genotípica secundaria a los antirretrovirales en pacientes con aids en los Estados de Pará y Amazonas, Brasil: 2002 a 2006*
Olinda MacêdoI; Luciana Macedo FerreiraI; Pedro Fernando da Costa VasconcelosII; Rita Catarina Medeiros de SousaIII; Carmen Andrea FreitasIV; José Ricardo Mourão AraújoV
ISeção de Virologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IISeção de Arbovirologia e Febres Hemorrágicas, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIINúcleo de Medicina Tropical, Universidade Federal do Pará, Belém, Pará, Brasil
IVHospital Universitário João de Barros Barreto, Universidade Federal do Pará, Belém, Pará, Brasil
VCasa Dia, Secretária Municipal de Saúde, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMEN
La resistencia a las drogas antirretrovirales resulta de la supresión incompleta de la replicación del VIH-1. El presente estudio caracterizó el perfil de resistencia genotípica a los antirretrovirales (ARV) en muestras serológicas de 127 pacientes VIH positivos, originarias de los Estados de Amazonas y Pará, Región Norte de Brasil, en el período de 2002 a 2006. Las muestras fueron sometidas a la prueba de resistencia por el kit ViroSeqTM Genotyping System. Considerando las informaciones genéticas obtenidas de las regiones de la proteasa y/o transcriptasa inversa del VIH-1, la mutación M184V (81,1%) fue la más asociada a los inhibidores nucleósidos de la transcriptasa inversa (INTR), en individuos usando ARV en el Estado de Pará, y la mutación T215F/Y (56,3%) en individuos del Estado de Amazonas. La mutación K103N fue la más prevalente (33,5%) para los inhibidores no nucleósidos de la transcriptasa inversa (INTR) en ambos Estados. Para el gen de la proteasa la mutación minor L63P (65,3%) se presentó como la más frecuente en ambos Estados. El estudio reveló la importancia de la identificación de mutaciones asociadas a la resistencia a las drogas antirretrovirales para el uso racional en esquemas terapéuticos y sus resultados se mostraron semejantes a los obtenidos en otras regiones de Brasil.
Palabras clave: Terapia Antirretroviral; VIH-1; Mutación; Genotipado.
INTRODUCCIÓN
La resistencia del virus de la inmunodeficiencia humana tipo 1 (VIH-1) a los fármacos antirretrovirales es consecuencia de la alta tasa de replicación y mutación de este virus combinada con su capacidad de integración con el genoma del huésped. El VIH-1 presenta una notable diversidad genética con implicaciones en la patogénesis, desarrollo de vacuna, diagnóstico y susceptibilidad a los antirretrovirales (ARV)1,2,3.
El virus posee distintos mecanismos que le permiten escapar tanto de la presión del sistema inmunológico como de la presión farmacológica. El surgimiento de las quasiespecies es favorecido por los siguientes factores: escasa fidelidad de la transcriptasa reversa (TR) en su trabajo de replicación del ARN viral lo que genera una elevada población de cepas de virus diversificadas - cerca de 1012 y extraordinaria cinética de replicación viral con una vida plasmática promedio inferior a seis horas4,5. La continua producción de esas variantes proporciona al virus una gran capacidad de adaptación al huésped. La resistencia antirretroviral es un de los motivos primarios para que la terapia antirretroviral (TARV) fracase con el uso prolongado del esquema6,7.
La finalidad de la TARV para individuos con infección por el VIH incluye impedir o retardar la progresión de la inmunodeficiencia; mejorar la sobrevida de los pacientes, disminuyendo la ocurrencia de infecciones oportunistas; y mejorar la calidad de vida de los infectados8,9,10. La reducción de la carga viral en sangre periférica y la reversión de la inmunodeficiencia característica traen beneficios al paciente, aumentando la supervivencia del individuo en, al menos, 13 a 14 años11. El esquema terapéutico está compuesto por una asociación de drogas para obtener la disminución da carga viral plasmática y, así, alcanzar niveles virales indetectables en la circulación periférica12.
Las cepas resistentes del virus VIH-1 pueden ser transmitidas entre los individuos. La transmisión de variantes del VIH-1, con resistencia a los inhibidores de la TR y la proteasa (PR), ha sido ampliamente caracterizada en países desarrollados. Con efecto, los niveles de transmisión del VIH-1 estudiados en pacientes con infección reciente documentada y con otros crónicamente infectados mostraron que de 10 a 20% de los nuevos pacientes diagnosticados en Europa y EUA corresponde a infecciones con cepas de VIH-1 resistentes a, al menos, una droga13,14,15,16.
Algunos autores17,18 estimaron que alrededor de 70% de los individuos, aunque correctamente tratados, presentaban una carga viral detectable y tenían resistencia como mínimo, a un medicamento. La transmisión del VIH-1 resistente a drogas también fue documentada entre todos los grupos con comportamiento de riesgo19.
Se sabe que la supresión de la infección por VIH-1 por las drogas antirretrovirales es notable. Sin embargo, si la infección es ocasionada por un virus resistente, puede haber una reducción de la eficacia de los medicamentos empleados en el régimen de primera línea20.
La transmisión del VIH resistente a los ARV impacta negativamente en la respuesta terapéutica de individuos vírgenes de tratamiento. Como la estrategia de la terapia y utilización de drogas ARV evolucionó, los estándares de mutación transmitida pueden cambiar. En investigaciones que abarcaron 40 ciudades de los EUA quedó demostrado que hubo una alta prevalencia de resistencia a los ARV, sugiriendo que el genotipado y/o el fenotipado debería ser considerado en la investigación de esos individuos, especialmente si la terapia incluye un inhibidor no nucleósido de la TR (IRTNN)21.
En Brasil, la distribución gratuita y universal de los medicamentos ARV por el Ministerio de Salud se inició en 1996 con la introducción del esquema TARV, el que cambió radicalmente la sobrevida de los portadores de Sida22,23. No obstante, Clavel y Hance24, describieron que, con el uso en masa de esos medicamentos, hubo un aumento del riesgo de resistencia a los ARV, surgiendo la necesidad de adoptar un monitoreo intenso y continuo de esa resistencia.
El presente estudio evaluó el perfil de resistencia en muestras de sangre de individuos con Sida para mejorar las estrategias de terapia en pacientes con fracaso en los regímenes terapéuticos previos en los Estados de Pará y Amazonas, Región Norte del Brasil, en el período de 2002 a 2006.
MATERIAL Y MÉTODOS
La detección de la resistencia primaria y secundaria a los ARV fue evaluada utilizando la lista propuesta por Johnson y colaboradores25 para la clasificación de las mutaciones. En el presente estudio se observó, durante el proceso de análisis realizado en muestras de pacientes usuarios de ARV, un largo espectro de codones mutacionales asociados a la mayor o menor resistencia a los ARV.
CRITERIO DE INCLUSIÓN
Se emplearon protocolos propios de la Red Nacional de Laboratorios de Genotipado (Renageno) los cuales contenían informaciones personales, clínicas, de laboratorio y epidemiológicas, para, enseguida, elegir el grupo considerando los criterios de la red. Los pacientes estuvieron de acuerdo y firmaron un documento conteniendo el término de consentimiento informado, o consentimiento libre y esclarecido, de la Coordinación Nacional de DST y Sida del Ministerio de Salud (CN de DST/Sida del MS), concordando en tomar parte del estudio de la Renageno.
DESCRIPCIÓN DE LAS MUESTRAS
Para poder efectuar el estudio se colectaron muestras de plasma (1 mL) de los individuos que cumplieron con los criterios de inclusión.
POBLACIÓN ESTUDIADA
Considerando que se trata de un estudio retrospectivo realizado en el período de 2002 a 2006, el material se procesó adoptando los procedimientos de la Renageno, utilizando muestras de 127 pacientes, siendo 95 del Estado de Pará y 32 del Estado de Amazonas.
Las medidas de frecuencia fueron analizadas usando el Programa BioEstat 5.026. El análisis de las variables por la prueba del chi-cuadrado que presentaron valores de p menores a 5% (p < 0,05) proporcionaron adherencia a nivel de significación estadístico.
RESULTADOS
CARACTERÍSTICAS DE LA POBLACIÓN ESTUDIADA
El estudio incluyó a 32 (25,2%) pacientes procedentes de Amazonas, 19 (59,4%) de los cuales pertenecían al sexo masculino y 95 (74,8%) de Pará, 75 (78,9%) de los cuales del sexo masculino.
La edad varió de 19 a 72 años (promedio de 39 años) siendo que la mayoría, 84,3% estaba en la franja etaria entre 20 y 49 años.
Por ocasión del genotipado, 84 (66,1%) individuos de ambos Estados no presentaban ningún síntoma o señal clínica de Sida. El diagnóstico de la infección por el VIH-1 fue realizado en 63,8% en el período entre 1991 y 1999.
La detección de carga viral entre 10 mil y 100 mil copias de ARN/ml. fue positiva en 58,3% de los pacientes, con mediana de conteo en 39 copias de ARN/ml. El conteo de linfocitos TCD4+ en 57,5% de los pacientes al momento de su inclusión en el estudio estaba por debajo de 200 células/mm3 (mediana 97 células/mm3).
ANÁLISIS MOLECULAR
La extracción de ARN se realizó a partir de 1.000 microlitros (µL) de plasma por el método ViroSeqTM HIV-1 Genotyping System, siguiendo las instrucciones del fabricante (Celera Dignostic, 2004). La secuenciación de las muestras se hizo empleando un secuenciados automatizado modelo ABI PRISM® 3100 DNA Analyzer, (Applied Biosystems, EUA) al cual estaba acoplado el Software - VIH-1 Genotyping System, versión 2.6, para la detección automática y análisis de todas las secuencias.
ANÁLISIS ESTADÍSTICO
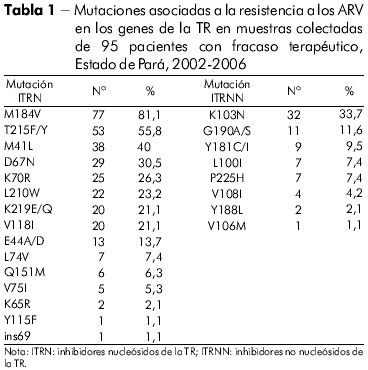
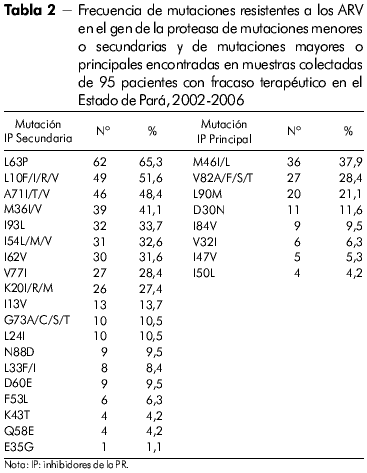
El perfil de las mutaciones de resistencia asociado al gen de la TR de todos los individuos con fracaso terapéutico en el Estado de Pará en las clases de los inhibidores nucleósidos de la TR (ITRN), no nucleósidos de la TR (ITRNN) y de los inhibidores de la proteasa (IP), se puede ver en las tablas 1 y 2.
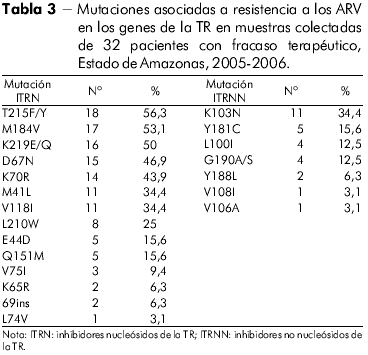
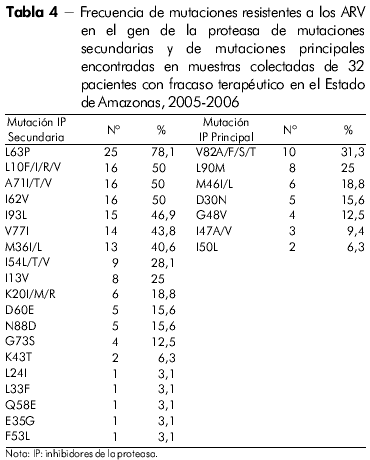
El perfil de las mutaciones de resistencia asociado al gen de la TR de todos los individuos con fracaso terapéutico en el Estado de Amazonas en la clase de los ITRN, ITRNN e IP puede verse en las tablas 3 y 4.
Considerando la presencia de mutaciones principales relacionadas a las tres clases de ARV (Tabla 5), se observó mayor ocurrencia en la clase de los ITRN (96,9 %), seguida de IP (62,5%) e ITRNN (56,3%) en Amazonas. En Pará, los porcentajes observados en las mismas clases fueron: ITRN (91,6%), IP (61,1%) e ITRNN (50,5%). No se observó significación estadística para los ARV con (p = 0,1188) en Amazonas, mientras en Pará hubo significación (p = 0,0017).
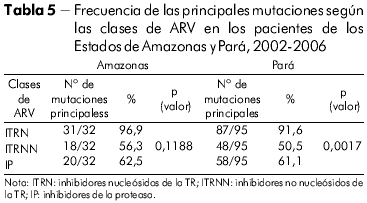
Se infirió el nivel de resistencia y de sensibilidad del VIH-1 de las muestras de Pará a los medicamentos con meta en el gen de la TR (Tabla 6). En orden decreciente, relacionamos los fármacos más comprometidos para utilizar en un próximo esquema por los pacientes de este análisis: (Lamivudina, Zidovudina, Zidovudina + Lamivudina, Didanosina (en la clase de los ITRN) y Efavirenz y Nevirapina (en la clase de los ITRNN). Se observó significación estadística para la resistencia (*R), resistencia intermedia (**RI) y (***S) sensible S con p (valor) 0,0001 en Pará por la prueba de chi-cuadrado de adherencia con nivel de significación 5% (0,05).
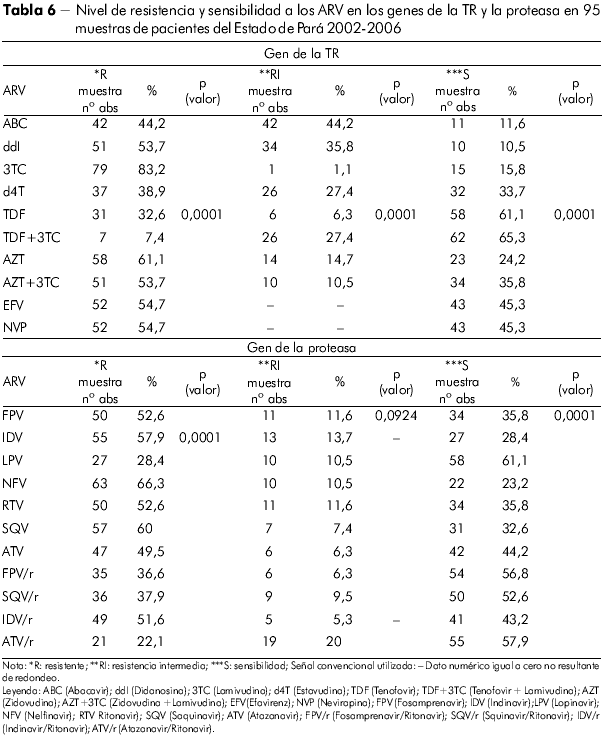
Se hizo la misma evaluación (Tabla 6) con los medicamentos utilizados en el gen de la PR y observamos los siguientes fármacos más comprometidos: Nelfinavir, Saquinavir, Indinavir, Ritonavir, Fosamprenavir e Indinavir/Ritonavir. Se observó elevada significación estadística para la *R y ***S con p (valor) 0,0001 en el Estado de Pará por la prueba de chi-cuadrado de adherencia, pero no fue significante para la variable **RI (p = 0,092).
Se infirió el nivel de resistencia y sensibilidad del VIH-1 de las muestras del Estado de Amazonas a los medicamentos con meta en el gen de la TR (Tabla 7). En orden decreciente, relacionamos los fármacos más comprometidos a utilizar en un próximo esquema por los pacientes de este análisis: Zidovudina, Zidovudina + Lamivudina, Lamivudina, Estavudina, Didanosina y Abacavir en la clase de los ITRN y Nevirapina y Efavirenz en la clase de los ITRNN. Se observó significación estadística para la RI y S con p = 0, 0042 y p = 0, 0001 respectivamente en Amazonas por la prueba chi-cuadrado de adherencia a nivel de significación 5% (p < 0,05). No hubo significación para la variable R (p = 0, 2029).
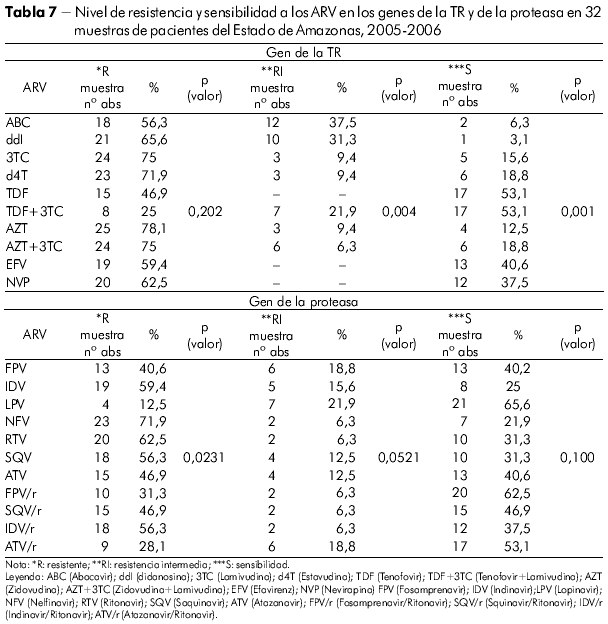
Lo mismo sucede (Tabla 7) con los medicamentos utilizados en el gen de la proteasa. Observamos los siguientes fármacos más comprometidos en el Estado de Amazonas: Nelfinavir, Saquinavir, Indinavir, Ritonavir, Fosamprenavir e Indinavir/Ritonavir. Se observó significación estadística para la R p = 0,0231 en Amazonas por la prueba chi-cuadrado de adherencia a nivel de significación 5% (0,05), no siendo significante para las variables RI y S p = 0,0521 y p = 0,100 respectivamente.
DISCUSIÓN
La mutación encontrada con más frecuencia en el Estado de Pará, involucrando a los ITRN, fue la M184V, seguida de los codones 215, 41, 67, 70, 210 y 219, perfil este presentado por el VIH-1. Por otro lado, la mutación más frecuente en los pacientes del Estado de Amazonas fue la T215F/Y. En orden decreciente, los otros codones encontrados fueron los siguientes: 184, 70, 219, 67, 41 y 210. El estándar de mutaciones observado en el Estado de Pará recuerda al encontrado en el Sudeste y el Nordeste brasileños27,28, mientras que el encontrado en el Estado de Amazonas fue similar al observado en Chile29, lo que sugiere que el origen de las cepas entre esos dos Estados amazónicos sea, probablemente, distinto.
El discreto aumento de la prevalencia en el codón 215, observado en las muestras del Estado de Amazonas, comparado al codón 184, antes observado, se debió, posiblemente, al hecho de que el estándar de la mutación sola M184V fue hallado en muestras de apenas dos de los 32 pacientes del Estado de Amazonas. Medeiros y colaboradores30 observaron que pacientes de la Región Nordeste de Brasil, presentaron un aumento significativo de mutaciones TAM, cuando comparados a grupos de pacientes enfrentando fracaso terapéutico primario y secundario con aquellos pacientes con fracasos terapéuticos múltiples y, asociaron ese hecho al mayor número de terapias empleadas en estos últimos pacientes ocasionando, como consecuencia, el aumento de las referidas mutaciones.
Aún en la clase de los ITRN, en otro estudio se identificó que, más de un quinto de las muestras de pacientes del Estado de Pará presentaba la frecuencia de cuatro mutaciones en las posiciones 184, 41, 210 y 215, mientras que en el Estado de Amazonas la frecuencia de esos codones fue menor. El estándar de mutación de esos codones en los dos Estados de la Región Norte brasileña recuerda lo que fue anteriormente observado en pacientes del Estado de Rio de Janeiro27.
Además de las mutaciones mencionadas para la clase de los ITRN, también fueron observadas otras mutaciones importantes, aunque en menor proporción, en los codones 74, 151, 75, 115, 65, e ins69, en el Estado de Pará. Las muestras del Estado de Amazonas presentaron resistencia para los mismos codones con excepción del 115, presente solamente en las muestras del Estado de Pará, lo que está de acuerdo con la literatura para otras regiones de Brasil28.
En este estudio se detectó la presencia de mutación principal para los ITRN en 96,9% de las muestras virales del Estado de Amazonas y en 91,6% de los VIH-1 procedentes de muestras del Estado de Pará. Aunque menos potente contra el VIH que los ITRNN y los IP, los ITRN tienen un papel central en la TARV y permanecen como parte del tratamiento estándar actual31,32.
Por otro lado, el VIH-1 de las muestras del Estado de Amazonas mostró un nivel de resistencia superior a 50% a los siguientes ARV: Zidovudina, Zidovudina + Lamivudina, Lamivudina, Didanosina y Abacavir, y el VIH-1 de las muestras del Estado de Pará presentaba el mismo nivel de resistencia a los fármacos Lamivudina, Zidovudina, Zidovudina + Lamivudina y Didanosina. La mayor sensibilidad fue al medicamento Tenofovir - superior a 50%, en ambos Estados. Estos datos son similares también a los descritos para VIH-1 en pacientes procedentes del Nordeste de Brasil30.
En este estudio se detectó la mutación K103N en la clase ITRNN como la más prevalente en las muestras de los pacientes de los dos Estados y los valores hallados son similares a los de otros relatos en Brasil27,28. Es de destacar que esa mutación ocurrió en más de 50% de los pacientes que desarrollaron fallo virológico con el uso de Efavirenz, reduciendo su susceptibilidad en aproximadamente 25 veces33.
En el presente estudio detectamos la presencia de mutación principal para los ITRNN en 56,3% de las muestras del Estado de Amazonas y en 50,5% de las muestras de Pará, reflejándose en el nivel de resistencia del VIH-1 en 59,4% muestras de Amazonas y 57,4% del Estado de Pará, tanto al Efavirenz como a la Nevirapina, las únicas drogas pertenecientes a esa clase de ARV evaluadas. Cualquier tipo de mutación detectada en ese grupo de drogas, ocasiona significativa resistencia cruzada a todas las drogas, por tratarse de medicamentos que presentan una baja barrera genética24 Ese hecho también fue observado anteriormente en diversos otros estudios brasileños27,28.
Entre los IP, la barrera genética para resistencia es generalmente mayor. Podemos citar, como ejemplo, el régimen ARV conteniendo Ritonavir, que requiere múltiples mutaciones que varían entre los IP, y su grado de resistencia depende tanto del número como del tipo de mutación presente34,35.
Las mutaciones secundarias (minar) normalmente emergen antes de las principales (majar), y por sí mismas no presentan un efecto significativo en el fenotipo25. En algunos casos, su efecto puede ser para compensar el fitness replicativo del virus conteniendo mutaciones principales y en otros que contribuyen a la resistencia36,37,25.
En el presente estudio, mutaciones específicas asociadas a resistencia a los IP se hallaron en muestras de pacientes con fallo para eses inhibidores. La mutación secundaria L63P fue hallada con más frecuencia en las muestras del Estado de Amazonas - 78,1%, para 65,1% en el Estado de Pará. En seguida, los codones secundarios más encontrados en las muestras de los dos Estados fueron 10 y 71, lo que está de acuerdo a los resultados obtenidos en el estudio realizado por Couto-Fernandez y colaboradores27.
CONCLUSIONES
La mutación más frecuente en la clase de los ITRN fue M184V para las muestras del Estado de Pará mientras que para las del Estado de Amazonas fue T215F/Y. La mutación más frecuente para las muestras de los Estados de Amazonas y Pará fue K103N, en la clase de los ITRNN, y, entre los IP, la mutación L63P para ambos Estados. En la clase de los ITRN, se encontró un porcentaje significativo de muestras de pacientes del Estado de Pará presentando cuatro mutaciones en las posiciones 184, 41, 210 y 215, siendo que esa frecuencia era un poco menor en las muestras del Estado de Amazonas. El VIH-1 se mostró más resistente a los ARV de la clase de los ITRN, seguido de la clase de los IP y, posteriormente, a los ITRNN para las muestras de ambos Estados. Se infirió el nivel de resistencia del VIH-1 a los ARV en el gen de la TR y las muestras analizadas del Estado de Amazonas presentaron resistencia superior a 50% para ocho drogas, siendo sensibles a solamente dos. En el gen de la proteasa, se presentaron resistentes a cinco y sensibles a tres de las drogas evaluadas. Se infirió el nivel de resistencia del VIH-1 a los ARV en el gen de la TR y las muestras analizadas del Estado de Pará presentaron resistencia superior a 50% para seis drogas y sensibles a dos. En el gen de la proteasa, se mostraron resistentes a seis y sensibles a cuatro. Las muestras del Estado de Amazonas sugieren mayor resistencia a todas las clases de ARV analizados en comparación con las muestras del Estado de Pará.
AGRADECIMIENTOS
A los profesionales del Instituto Evandro Chagas: Raimundo Macêdo dos Reis, Celina Serra de Freitas por todo el apoyo técnico durante la realización de las pruebas.
REFERENCIAS
1 Kanki PJ, Hamel DJ, Sankalé JL, Hsieh C, Thior I, Barin F, et al. Human immunodeficiency virus type 1 subtypes differ in disease progression. J Infect Dis. 1999 Jan;179(1):68-73. [Link]
2 Caride E, Brindeiro R, Hertogs K, Larder B, Dehertogh P, Machado E, et al. Drug-resistant reverse transcriptase genotyping and phenotyping of B and non-B subtypes (F and A) of human immunodeficiency virus type I found in Brazilian patients failing HAART. Virology. 2000 Sep;275(1):107-15. [Link]
3 Kaleebu P, French N, Mahe C, Yirrell D, Watera C, Lyagoba F, et al. Effect of human immunodeficiency virus (HIV) type 1 envelope subtypes A and D on disease progression in a large cohort of HIV-1-positive persons in Uganda. J Infect Dis. 2002 May;185(9):1244-50. [Link]
4 Eigen M. Viral quasispecies. Sci Am. 1993 Jul;269(1):42-9.
5 Hellerstein MK, McCune JM. T cell turnover in HIV-1 disease. Immunity. 1997 Nov;7(5):583-9.
6 Shafer RW, Winters MA, Palmer S, Merigan TC. Multiple concurrent reverse transcriptase and protease mutations and multidrug resistance of HIV-1 isolates from heavily treated patients. Ann Intern Med. 1998 Jun;128(11):906-11. [Link]
7 Vella S, Palmisano L. Antiretroviral therapy: state of the HAART. Antiviral Res. 2000 Jan;45(1):1-7.
8 Coffin JM. HIV population dynamics in vivo: implications for genetic variation, pathogenesis, and therapy. Science. 1996 Jan;267(5197):483-9.
9 Little SJ, Daar ES, D'Aquila RT, Keiser PH, Connick E, Whitcomb JM, et al. Reduced antiretroviral drug susceptibility among patients with primary HIV infection. JAMA. 1999 Sep;282(12):1142-9. Doi:10.1001/jama.282.12.1142 [Link]
10 Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Recomendações para a terapia anti-retroviral em adultos e adolescentes infectados pelo HIV. Brasília: Ministério da Saúde; 2006.
11 Vermund SH. Millions of life-years saved with potent antiretroviral drugs in the United States: a celebration, with challenges. J Infect Dis. 2006 Jul;194(1):1-5. Doi:10.1086/505154 [Link]
12 Perno CF, Cozzi-Lepri A, Balotta C, Forbici F, Violin M, Bertoli A, et al. Impact of mutations conferring reduced susceptibility to lamivudine on the response to anti retroviral th erapy. Antivir Ther. 2001 Sep;6(3):195-8.
13 Balotta C, Berlusconi A, Pan A, Violin M, Riva C, Colombo MC, et al. Prevalence of transmitted nucleoside analogue-resistant HIV-1 strains and preexisting mutations in pol reverse transcriptase and protease region: outcome after treatment in recently infected individuals. Antivir Ther. 2000 Mar;5(1):7-14. [Link]
14 Little SJ. Transmission and prevalence of HIV resistance among treatment-naive subjects. Antivir Ther. 2000 Mar;5(1):33-40. [Link]
15 Briones C, Pérez-Olmeda M, Rodríguez C, del Romero J, Hertogs K, Soriano V. Primary genotypic and phenotypic HIV-1 drug resistance in recent seroconverters in Madrid. J Acquir Immune Defic Syndr. 2001 Feb;26(2):145-50. [Link]
16 Duwe S, Brunn M, Altmann D, Hamouda O, Schmidt B, Walter H, et al. Frequency of genotypic and phenotypic drug-resistant HIV-1 among therapy-naive patients of the German Seroconverter Study. J Acquir Immune Defic Syndr. 2001 Mar;26(3):266-73. [Link]
17 Tamalet C, Fantini J, Tourres C, Yahi N. Resistance of HIV-1 to multiple antiretroviral drugs in France: a 6-year survey (1997-2002) based on an analysis of over 7000 genotypes. AIDS. 2003 Nov;17(16):2383-8. [Link]
18 Scott P, Arnold E, Evans B, Pozniak A, Moyle G, Shahmenesh M, et al. Surveillance of HIV antiretroviral drug resistance in treated individuals in England: 1998-2000. J Antimicrob Chemother. 2004 Mar;53(3):469-73. Doi:10.1093/jac/dkh102 [Link]
19 Tang JW, Pillay D. Transmission of HIV-1 drug resistance. J Clin Virol. 2004 May;30(1):1-10. [Link]
20 Johnson JA, Li JF, Wei X, Lipscomb J, Irlbeck D, Craig C, et al. Minority HIV-1 drug resistance mutations are present in antiretroviral treatment-naïve populations and associate with reduced treatment efficacy. PLoS Med. 2008 Jul;5(7):e158. Doi:10.1371/journal.pmed.0050158.g002 [Link]
21 Ross L, Lim ML, Liao Q, Wine B, Rodriguez AE, Weinberg W, et al. Prevalence of antiretroviral drug resistance and resistance-associated mutations in antiretroviral therapy-naïve HIV-infected individuals from 40 United States cities. HIV Clin Trials. 2007 Jan-Feb;8(1):1-8. Doi:10.1310/hct0801-1 [Link]
22 Brasil. Decreto no 9.313, de 13 nov. 1996. Dispõe sobre a distribuição gratuita de medicamentos aos portadores do HIV e Doentes de AIDS. Diário Oficial da União, Brasília, p. 1, 14 nov. 1996.
23 Marins JR, Jamal LF, Chen SY, Barros MB, Hudes ES, Barbosa AA, et al. Dramatic improvement in survival among adult Brazilian AIDS patients. AIDS. 2003 Jul;17(11):1675-82. [Link]
24 Clavel F, Hance AJ. HIV drug resistance. N Engl J Med. 2004 Mar;350(10):1023-35.
25 Johnson VA, Brun-Vezinet F, Clotet B, Conway B, Kuritzkes DR, Pillay D, et al. Update of the drug resistance mutations in HIV-1: Fall 2005. Top HIV Med. 2005 Oct-Nov;13(4):125-31. [Link]
26 Ayres M, Ayres Jr M, Ayres DL, Santos AS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá. 2007. 364 p.
27 Couto-Fernandez JC, Silva-de-Jesus C, Veloso VG, Rachid M, Gracie RS, Chequer-Fernandez SL, et al. Human immunodeficiency virus type 1 (HIV-1) genotyping in Rio de Janeiro, Brazil: assessing subtype and drug-resistance associated mutations in HIV-1 infected individuals failing highly active antiretroviral th era py. Mem Inst Oswaldo Cruz. 2005 Feb;100(1):73-8. [Link]
28 Cavalcanti AM, Lacerda HR, Brito AM, Pereira S, Medeiros D, Oliveira S. Antiretroviral resistance in individuals presenting therapeutic failure and subtypes of the human immunodeficiency virus type 1 in the Northeast Region of Brazil. Mem Inst Oswaldo Cruz. 2007 Nov;102(7):785-92. [Link]
29 Afani SA, Orellana RL, Duarte JP, Acevedo MW, Morales BO, Wolff RM, et al. Resistance to antiretroviral therapy in Chilean patients with HIV-1 from 2002 to 200 5. Rev Med Chil. 2007 Oct;135(10):1237-44. Doi:10.4067/S0034-98872007001000002 [Link]
30 Medeiros MS, Arruda EA, Guerrant RL, Brown C, Hammarskjold ML, Rekosh D, Lima AA, et al. Genotype testing and antiretroviral resistance profiles from HIV-1 patients experiencing therapeutic failure in northeast Brazil. Braz J Infect Dis. 2007 Aug;11(4):390-4.
31 Shen L, Peterson S, Sedaghat AR, McMahon MA, Callender M, Zhang H, et al. Dose-response curve slope sets class-specific limits on inhibitory potential of anti-HIV drugs. Nat Med. 2008 Jul;14(7):762-6.
32 Department of Health and Human Services Panel on antiretroviral guidelines for adults and adolescents: guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. [Internet]. USA, 2009. [Cited 2010 Apr 30]. Available from: http://www.antimicrobe.org/h04c.files/history/Guideline-NIH-AdultandAdolescentGL-2009.pdf.
33 Ceccherini-Silberstein F, Svicher V, Sing T, Artese A, Santoro MM, Forbici F, et al. Characterization and structural analysis of novel mutations in human immunodeficiency virus type 1 reverse transcriptase involved in the regulation of resistance to nonnucleoside inhibitors. J Virol. 2007 Oct;81(20):11507-19. Doi:10.1128/JVI.00303-07 [Link]
34 Shafer RW, Schapiro JM. Drug resistance and antiretroviral drug development. J Antimicrob Chemother. 2005 Jun;55(6):817-20. Doi:10.1093/jac/dki127 [Link]
35 Von Wyl V, Yerly S, Böni J, Bürgisser P, Klimkait T, Battegay M, et al. Emergence of HIV-1 drug resistance in previously untreated patients initiating combination antiretroviral treatment: a comparison of different regimen types. Arch Intern Med. 2007 Sep;167(16):1782-90. [Link]
36 Condra JH, Schleif WA, Blahy OM, Gabryelski LJ, Graham DJ, Quintero JC, et al. In vivo emergence of HIV-1 variants resistant to multiple protease inhibitors. Nature. 1995 Apr;374(6522):569-71. Doi:10.1038/374569a0 [Link]
37 Mammano F, Trouplin V, Zennou V, Clavel F. Retracing the evolutionary pathways of human immunodeficiency virus type 1 resistance to protease inhibitors: virus fitness in the absence and in the presence of drug. J Virol. 2000 Sep;74(18):8524-31. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Olinda Macêdo
Instituto Evandro Chagas, Seção de Virologia
Rodovia BR 316, km 7, s/no Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
Tel:. +55 (91) 3214 2009
E-mail: olindamacedo@iec.pa.gov.br
Recebido em / Received / Recibido en: 18/04/2011
Aceito em / Accepted / Aceito en: 19/8/2011
*Artículo resultado de disertación presentada al Programa de Posgrado en Biología de los Agentes Infecciosos y Parasitarios del Instituto de Ciencias Biológicas de la Universidad Federal de Pará, como requisito para obtener el grado de Magíster en Biología de Agentes Infecciosos y Parasitarios.











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI
