Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.2 no.3 Ananindeua Sept. 2011
http://dx.doi.org/10.5123/S2176-62232011000300005
ARTIGO ORIGINAL |ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Capillaria hepatica (Bancroft, 1893) (Nematoda) entre populações indígenas e mamíferos silvestres no noroeste do Estado do Mato Grosso, Brasil, 2000
Capillaria hepatica (Bancroft, 1893) (Nematoda) among indigenous populations and wild mammals in the northwest of Mato Grosso State, Brazil, 2000
Capillaria hepatica (Bancroft, 1893) (Nematodo) entre poblaciones indígenas y mamíferos silvestres en el noroeste del Estado de Mato Grosso, Brasil, 2000
Manoel do Carmo Pereira SoaresI; Heloisa Marceliano NunesI; Fernando Antonio Alves da SilveiraI; Max Moreira AlvesI; Alex Junior Souza de SouzaII
ISeção de Hepatologia, Instituto Evandro Chagas (IEC/SVS/MS), Belém, Pará, Brasil
IISeção de Hepatologia, Instituto Evandro Chagas (IEC/SVS/MS), Belém, Pará, Brasil. Centro de Ciências Biológicas e da Saúde, Faculdades Integradas do Tapajós, Santarém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Capillaria hepatica é um nematoide hepatotrópico capaz de infectar roedores e outros mamíferos. Em virtude da identificação de ovos deste helminto em amostras de fezes de indígenas do noroeste do Mato Grosso, no ano 2000, foi realizado inquérito coproparasitológico nas fezes de 477 (76,6%) dos 622 indígenas de seis aldeias (Mamaindé, Kithãulu, Camararé, Negatoré, Nambiquara e Wassussu) situadas nos vales dos rios Guaporé e Nambiquara, noroeste do Estado do Mato Grosso. Amostras de fígado de animais silvestres utilizados como fonte alimentar por estes indígenas também foram coletadas para avaliação histopatológica e parasitológica. Os resultados indicaram a presença de ovos de C. hepatica nas fezes de 8,6% (41/477) dos indígenas e de protozoários e outros helmintos enteroparasitas entre as amostras testadas. Ovos de C. hepatica também foram identificados no fígado de Tayassu pecari (queixada) e Ateies paniscus (macaco-aranha). A eliminação fecal de ovos de C. hepatica entre os indígenas representou infecções espúrias e foi associada ao consumo de vísceras de animais silvestres, considerados como reservatórios do helminto na área. Estudos clínico-epidemiológicos complementares devem ser desenvolvidos na região em virtude do potencial zoonótico do parasita em causar infecções genuínas de capilaríase hepática.
Palavras-chave: Capillaria hepatica; Nematoda; helmintos; protozoários; população indígena.
ABSTRACT
Capillaria hepatica is a hepatotropic nematode that infects rodents and other mammals. In 2000, eggs of this helminth were identified in stool samples from the indigenous population in Northwestern Mato Grosso, Brazil. A parasitological survey was conducted in stool samples from 477 (76.6%) out of 622 Indians from six villages (Mamaindé, Kithaulu, Camararé, Negatoré, Nambiquara and Wassussu) located in the valleys of the Guaporé and Nambiquara rivers. Liver samples from wild animals were used by these Indians as a food source and were collected for histopathological and parasitological assessment. The results revealed the presence of C. hepatica eggs in the stool samples from 8.6% (41/477) of the individuals and revealed enteric parasitic protozoa and other helminths. Eggs of C. hepatica were also found in the livers of Tayassu pecari (white-lipped peccary) and Ateles paniscus (black spider monkey). The fecal elimination of C. hepatica eggs that was found among the Indians represented a spurious infection and was associated with the consumption of the viscera of wild animals that are considered to be reservoirs of C. hepatica in the investigated area. Additional clinical and epidemiological studies must be performed in this area because of the zoonotic potential of C. hepatica to cause hepatic capillariasis.
Keyword: Capillaria hepatica; Nematoda; Helminths; protozoan; Indigenous Population.
RESUMEN
Capillaria hepatica es un nematodo hepatotrópico capaz de infectar roedores y otros mamíferos. En virtud de la identificación de huevos de este helminto en muestras de heces de indígenas del noroeste de Mato Grosso, el año 2000, se realizó una investigación coproparasitaria en las heces de 477 (76,6%) de los 622 indígenas de seis aldeas (Mamaindé, Kithaulu, Camararé, Negatoré, Nambiquara y Wassussu) situadas en los valles de los ríos Guaporé y Nambiquara, noroeste del Estado de Mato Grosso. También se colectaron muestras, para evaluación histopatológica y parasitaria, de hígados de animales silvestres utilizados como fuente alimentar por estos indígenas. Los resultados indicaron la presencia de huevos de C. hepatica en las heces de 8,6% (41/477) de los indígenas y de protozoarios y otros helmintos enteroparásitos entre las muestras analizadas. Huevos de C. hepatica también fueron identificados en el hígado de Tayassu pecari (pecarí barbiblanco) y Ateles paniscus (mono araña). La eliminación fecal de huevos de C. hepatica entre los indígenas representó infecciones espurias y fue asociada al consumo de vísceras de animales silvestres, considerados como reservorios del helminto en el área. Estudios clínico-epidemiológicos complementarios deben ser desarrollados en la región, en virtud del potencial zoonótico del parásito en causar infecciones genuinas de capilariasis hepática.
Palabras clave: Capillaria hepatica; Nematodo; helmintos; protozoarios; población indígena.
INTRODUÇÃO
Capillaria hepatica (syn. Calodium hepaticum; Hepaticola hepatica) é um helminto hepatotrópico da família Trichinellidae que comumente infecta roedores, lagomorfos e outros vertebrados como canídeos, felinos, pecaris e primatas não humanos1,2,3,4. Este parasita, potencialmente zoonótico, também é associado a casos esporádicos de infecção em humanos5,6,7,8.
A infecção genuína ocorre a partir da ingestão de material contaminado com ovos embrionados que, ao chegarem ao ceco do hospedeiro, eclodem, liberando larvas que migram para o fígado via circulação portal, onde permanecem até a fase adulta. No parênquima hepático, as fêmeas adultas depositam ovos não embrionados que permanecem encapsulados e não são excretados por via fecal3,6. Após a deposição dos ovos no fígado, os vermes adultos morrem e são desintegrados pelo sistema imune do hospedeiro, enquanto os ovos imaturos conservam-se no parênquima hepático4,7.
A liberação dos ovos no meio ambiente pode ocorrer a quando da morte do hospedeiro, em virtude da desintegração da carcaça, ou a partir de infecções espúrias ou pseudoparasitárias, quando o fígado de um animal infectado é ingerido por outro vertebrado, determinando que os ovos não embrionados de C. hepatica transitem de modo inócuo pelo tubo digestivo do indivíduo e sejam eliminados pelas fezes3,6,9. Neste sentido, a predação e canibalismo também são importantes para manutenção do ciclo da C. hepatica em populações de roedores10.
Uma vez no ambiente, os ovos não embrionados necessitam de cerca de 28 dias, sob condições adequadas de temperatura e umidade, para se tornarem infectantes (embrionados)11,12.
A identificação prévia de ovos compatíveis com C. hepatica nas fezes de dois indígenas na aldeia de Camararé, Estado do Mato Grosso, motivou a realização deste estudo, que objetivou elucidar os fatores implicados na ocorrência de ovos deste nematoide nas fezes de indígenas do noroeste mato-grossense.
MATERIAIS E MÉTODOS
A presente investigação foi desenvolvida durante o período de 3 a 23 de outubro de 2000 nas aldeias indígenas de Mamaindé, Kithãulu, Camararé, Negatoré, Nambiquara e Wassussu, situadas nos vales do Guaporé e Nambiquara, noroeste do Estado do Mato Grosso, na Amazônia brasileira. Estas aldeias estão sob responsabilidade legal do Distrito Sanitário Especial Indígena Vilhena/Estado de Roraima.
Dos 622 indígenas das seis aldeias estudadas, foram realizados exames coproparasitológico (método qualitativo direto) nas fezes de 477 indivíduos (76,6%). Adicionalmente, foram coletadas amostras de fígado de cinco animais silvestres das espécies Tayassu pecari (Link, 1795) (queixada), Ateles paniscus (Linnaeus, 1758) (macaco-aranha), Lagothrix lagotricha (Humboldt, 1812) (macaco-barrigudo), Chelonoidis sp. (Linnaeus, 1766) (jabuti) e de um peixe de espécie não informada, já caçados por estes indígenas, na tentativa de correlacionar a presença dos ovos de C. hepatica nas fezes dos indígenas com os hábitos alimentares destas populações, que comumente consomem vísceras de animais como alimento, na área indígena de Nambiquara. As amostras de fígado foram acondicionadas em formol a 10% para posterior avaliação histopatológica e parasitológica.
Em relação aos aspectos éticos: este estudo de campo ocorreu após a identificação de ovos de C. hepatica nas fezes de dois indígenas da aldeia de Camararé, motivando o deslocamento de uma equipe da Seção de Hepatologia do Instituto Evandro Chagas (SAHEP/IEC), Belém, Pará, até o noroeste do Estado do Mato Grosso a partir de solicitação oficial do Distrito Sanitário Especial Indígena (DSEI) Vilhena, Rondônia, então a unidade federal sanitária legalmente responsável pelas populações indígenas das áreas em questão. Por este motivo, não foram incluídas autorizações prévias de um comitê de ética de pesquisa com seres humanos para o estudo com os índios.
RESULTADOS
O resultado total indicou a presença de ovos de C. hepatica (Figura 1) nas fezes de 8,6% (41/477) dos indígenas das seis aldeias estudadas. A prevalência dentro de cada aldeia foi de 11,2%, 19,6%, 15,5% e 13,9% nas aldeias Mamaindé, Kithãulu, Negatoré e Wassussu, respectivamente. Não foram identificados casos positivos nas aldeias Camararé e Nambiquara.
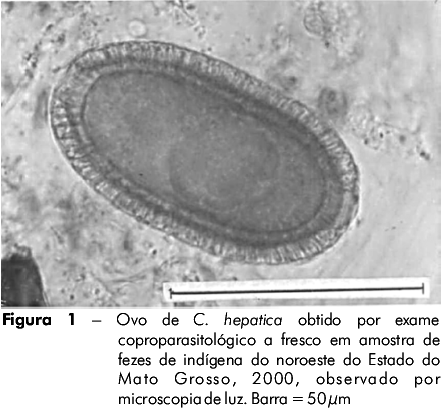
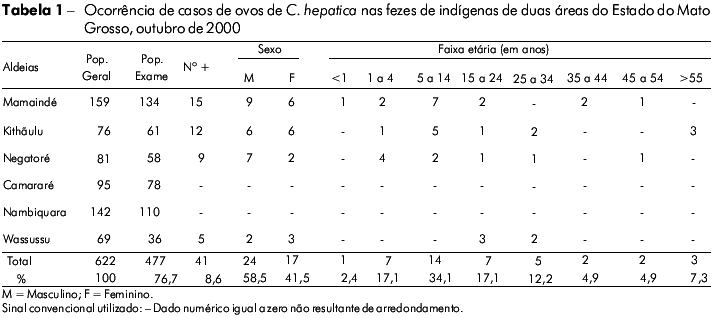
Em relação ao número total de casos positivos (41/477), a maior prevalência foi observada na aldeia Mamaindé, que correspondeu a 36,5% (15/41) do total. A amplitude de idade variou de 2 meses a 64 anos (média de 30,2 anos) sendo predominante a faixa etária entre 5-14 anos. Em relação ao sexo, a maior prevalência foi identificada em indivíduos do sexo masculino (58,5%). Os dados sobre a prevalência de ovos de C. hepatica em amostras de fezes em populações indígenas de duas áreas do noroeste do Estado do Mato Grosso encontram-se sumarizados na tabela 1.
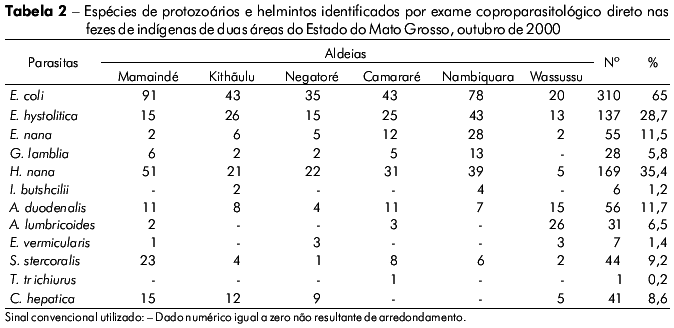
O exame coproparasitológico também identificou outras espécies de protozoários e helmintos enteroparasitas nas 477 amostras de fezes analisadas (Tabela 2). As maiores prevalências de protozoários foram Entamoeba coli (65%) e Hymenolepis nana (35,4%). Já os helmintos mais prevalentes foram Ascaris duodenalis (11,7%) e Ascaris lumbricoides (6,4%).
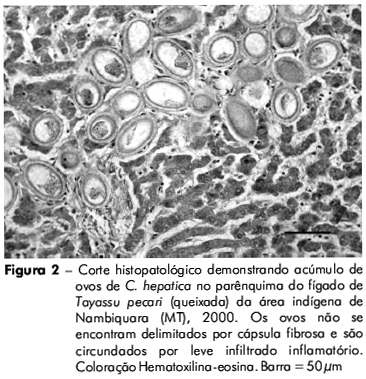
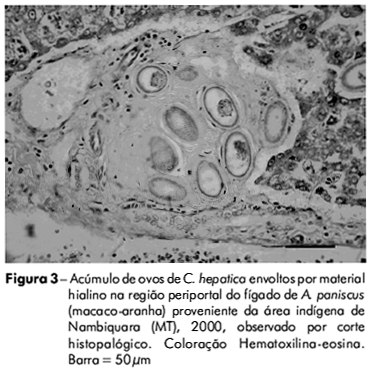
Macroscopicamente, não foram identificadas lesões nas vísceras dos animais. Entretanto, o exame histopatológico indicou a presença de ovos de C. hepatica em amostras de fígado das espécies Tayassu pecari (queixada) (Figura 2) e Ateles paniscus (macaco-aranha) (Figura 3). A estrutura do tecido hepático apresentou arquitetura acinar preservada, com tratos portais exibindo discreta expansão fibrosa, bem como representação de ovos de parasitas, os quais foram igualmente encontrados ao longo do parênquima hepático. Tais estruturas parasitárias, compatíveis com ovos de C. hepatica, apresentavam formato ovalar, cápsula estriada e opérculo bipolar não protuso, sendo circundados por discreta reação inflamatória predominantemente composta por infiltrado de linfócitos e eosinófilos. Vermes adultos não foram identificados e os hepatócitos encontravam-se distribuídos em traves regul ares, sem outras particularidades.
Os dados de morfometria dos ovos de C. hepatica obtidos durante o exame parasitoscópico de amostras de indígenas e animais silvestres indicaram similaridade entre eles e encontram-se descritos na tabela 3.

DISCUSSÃO
A grande prevalência de enteroparasitoses nos indígenas das aldeias Mamaindé, Kithãulu, Camararé, Negatoré, Nambiquara e Wassussu foi relacionada ao baixo status sanitário dessas populações. O exame dessas condições sanitárias das comunidades revelou que muitas moradias apresentavam grande número de habitantes e a água de consumo era proveniente de fontes naturais ou poços artesianos sem nenhuma espécie de tratamento sanitário. Outro fator associado à alta prevalência de parasitos nas fezes dos indígenas foi o contato direto com animais domésticos e silvestres "domesticados".
O processo de limitação da extensão das terras indígenas em virtude da pressão antrópica contribuiu para que algumas populações alterassem hábitos semi-nômades de outrora. E esta reduzida mobilidade espacial implicou, também, na mudança de alguns hábitos de destino de dejetos e resíduos alimentares nas aldeias, fator que parece estar relacionado à alta prevalência de enteroparasitoses dentro de algumas populações9.
Apesar de haver privadas de fossa seca nas aldeias, em virtude dos hábitos culturais destes povos os dejetos ainda eram lançados a céu aberto, no espaço peridomiciliar, determinando a existência de contaminação ambiental por formas infectantes de parasitos.
A contaminação peridomiciliar com restos alimentares e material fecal desempenha papel importante na contaminação do solo e, consequentemente, na disseminação de formas infectantes de enteroparasitas9. A prevalência de enteroparasitoses também está associada à contaminação das fontes de água em virtude deste destino inadequado de dejetos13 e o consumo de água sem tratamento favorece a transmissão de enteroparasitoses entre os indígenas13,14,15. Adicionalmente, o clima úmido e solo arenoso de algumas áreas da Região Amazônica também favorecem a manutenção de estágios infectantes de parasitas em determinados ambientes9,14.
Algumas populações rurais nativas da Região Amazônica conservam o hábito de consumo de animais silvestres na alimentação e a presença de ovos C. hepatica nas fezes das populações indígenas estudadas indicou infecções pseudoparasitárias associadas à ingestão de vísceras de animais silvestres infectados.
Relatos prévios da ocorrência de ovos de C. hepatica nas fezes de indígenas na região também foram relacionados à ingestão de fígado de animais silvestres9,16,17. De modo similar, um relato de infecção espúria associada ao consumo de fígado de anta (Tapirus terrestris Linnaeus, 1758) foi descrito em uma moradora não indígena de uma comunidade ribeirinha no rio Negro, Amazonas3.
A prevalência de 34,1% de anticorpos anti-C. hepatica entre seis populações ribeirinhas do Estado de Rondônia foi relacionada ao consumo de carne de animais silvestres, relatado por 91,7% dos indivíduos entrevistados, indicando q ue a ingestão de ovos não embrionados pode sensibilizar o sistema imune destas pessoas4.
No Brasil, ovos de C. hepatica foram anteriormente descritos em fígados de outras espécies silvestres como o graxaim do campo Lycalopex gymnocercus G. Fischer, 1814), cachorro-do-mato (Cerdocyon thous Linnaeus 1766)2 e suçuarana (Puma concolor Linnaeus 1771 )18.
Dentre as amostras de animais silvestres estudadas na área indígena de Nambiquara, ovos de C. hepatica foram identificados em fígados de Tayassu pecari e Ateles panicus, duas espécies previamente relatadas como hospedeiras naturais de C hepatica 1.A presença de ovos deste triquinelídeo nas fezes de humanos de áreas rurais do Panamá foi, inclusive, associada ao consumo de vísceras dessas mesmas espécies1.
As lesões histopatológicas por infecções genuínas em mamíferos são caracterizadas por fibrose hepática de grau variável e inflamação granulomatosa contendo ovos parasitários, necrose e infiltrado eosinofílico5,8,19. Durante o curso da infecção, podem ser observados múltiplos macrogranulomas contendo ovos circundados por severo infiltrado de linfócitos, eosinófilos, fibroblastos e macrófagos (células epitelioides e células gigantes multinucleadas, do tipo corpo estranho)7,20. Os microgranulomas são compostos por debris de restos parasitários e ovos calcificados circundados por reação inflamatória6,20.
Em estágios iniciais, a lesão pode apresentar-se como inflamação granulomatosa necrosante circundada por pouca fibrose, com a identificação de parasitas imaturos, vermes adultos com ovos no interior do útero ou de vermes degenerados sem a presença de ovos, sendo possível identificação do parasita por estruturas características, como o esticossomo que reveste o esôfago parasitário7,21,22.
A presença de vermes adultos e de ovos de C. hepatica no fígado de macacos cynomolgus naturalmente infectados induziu à leve reação de fibrose e infiltrado mononuclear, achados associados aos estágios iniciais da infecção23. Similar aos resultados do presente estudo, leve infiltrado inflamatório circunjacente aos ovos de C. hepatica foi detectado em fígados de gorilas naturalmente infectados24.
A presença de ovos de C. hepatica no fígado de queixada e macaco-aranha estava associada à discreta fibrose e leve reação inflamatória, sugerindo que essas espécies podem funcionar como reservatório silvestre do parasita na área indígena de Nambiquara, no noroeste do Estado do Mato Grosso.
CONCLUSÃO
Os ovos de C. hepatica nas fezes das populações indígenas estudadas representaram infecções espúrias e foram associados ao hábito de consumo de vísceras de animais silvestres, justificando o achado inicial. As repercussões dessas circunstâncias para as questões clínico-epidemiológicas junto às populações indígenas e a presença de reservatórios silvestres do parasita merecem abordagem complementar, já que estas populações apresentam estreito contato ambiental com o parasita e podem estar potencialmente expostas a infecções genuínas.
AGRADECIMENTOS
Agradecemos pela colaboração de Antônio Augusto Monteiro Lobato, Domingos Macedo de Souza (in memorian) e Bernardo Farias da Conceição pelo auxílio técnico durante os trabalhos de campo.
APOIO FINANCEIRO
Instituto Evandro Chagas/MS/SVS; PACA.
REFERÊNCIAS
1 Foster AO, Johnson CM. An explanation for the occurrence of Capillaria hepatica ova in human faeces suggested by the finding of three new hosts used as food. Trans Roy Soc Trop Med Hyg. 1939;32(5):639-44.
2 Ruas JL, Soares MP, Farias NAR, Brum JGW. Infecção por Capillaria hepatica em carnívoros silvestres (Lycalopexgymnocercus e Cerdocyon thous) na região sul do Rio Grande do Sul. Arq Inst Biol. 2003;70(2):127-30.
3 Carvalho-Costa FA, Silva AG, Souza AH, Moreira CJ, Souza DL, Valverde JG, et al. Pseudoparasitism by Calodium hepaticum (syn. Capillaria hepatica; Hepaticola hepatica) in the Negro River, Brazilian Amazon. Trans Roy Soc Trop Med Hyg. 2009 Oct;103(10):1071-3.
4 Camargo LMA, Camargo JSAA, Vera LJ, Barreto PTC, Tourinho EK, Souza MM. Capillariaisis (Trichurida, Trichinellidae, Capillaria hepatica) in the Brazilian Amazon: low pathogenicity, low infectivity and a novel mode of transmission. Parasit Vectors. 2010;3:11. Doi:10.1186/1756-3305-3-11 [Link]
5 Piazza R, Correa MA, Fleury RN. Sobre um caso de infestação humana por Capillaria hepatica. Rev Inst Med Trop Sao Paulo. 1963;5:37-41.
6 Galvão VA. Capillaria hepatica: an evaluation of its pathogenic role in man. Mem Inst Oswaldo Cruz. 1981 Oct-Dec;76(4):415-33. Doi:http://dx.doi.org/10.1590/S0074-02761981000400010 [Link]
7 Choe G, Lee HS, Seo JK, Chai JY, Lee SH, Eom KS, et al. Hepatic capillariasis: first case reported in the Republic of Korea. Am J Trop Med Hyg. 1993 May;48(5):610-25. [Link]
8 Sawamura R, Fernandes MIM, Peres LC, Galvão LC, Goldano HAS, Jorge SM, et al. Hepatic capillariasis in children: report of 3 cases in Brazil. Am J Trop Med Hyg. 1999 Oct;61(4):642-7.
9 Coimbra CEA Jr, Mello DA. Enteroparasitas e Capillaria SP. entre o grupo Suruí, parque indígena Aripuanã, Rondônia. Mem Inst Oswaldo Cruz. 1981 jul-set;76(3):299-302. Doi:http://dx.doi.org/10.1590/S0074-02761981000300008 [Link]
10 Sinniah B, Singh M, Anuar K. Preliminary survey of Capillaria hepatica (Bancroft, 1893) in Malaysia. J Helminthol. 1979 Jun;53:147-52. [Link]
11 Oliveira RF, Andrade ZA. Worm load and septal fibrosis of the liver in Capillaria hepatica-infected rats. Mem Inst Oswaldo Cruz. 2001 Oct;96(7):1001-3.
12 Oliveira L, Souza MM, Andrade ZA. Capillaria hepatica-induced hepatic fibrosis in rats: paradoxical effect of repeated infections. Rev Soc Bras Med Trop. 2004;37(2):123-7. Doi:http://dx.doi.org/10.1590/S0074-02762001000700020 [Link]
13 Santos FSS, Gama ASM, Fernandes AB, Reis JDD Jr, Guimarães J. Prevalência de enteroparasitismo em crianças de comunidades ribeirinhas do Município de Coari, no médio Solimões, Amazonas, Brasil. Rev Pan-Amaz Saude. 2010 dez;1(4):23-8. Doi:http://dx.doi.org/10.5123/S2176-62232010000400004 [Link]
14 Miranda RA, Xavier FB, Menezes RC. Parasitismo intestinal em uma aldeia indígena Parakanã no sudoeste do Estado do Pará, Brasil. Cad Saude Publica. 1998;14(3):507-11. [Link]
15 Miranda RA, Xavier FB, Nascimento JRL, Menezes RC. Prevalência de parasitismo intestinal nas aldeias indígenas da tribo Tembé, Amazônia Oriental Brasileira. Rev Soc Bras Med Trop. 1999 jul-ago;32(4):389-93. [Link]
16 Santos RV, Coimbra CEA Jr, Ott AMT. Estudo epidemiológico entre grupos indígenas de Rondônia. III. Parasitoses intestinais nas populações dos vales dos rios Guaporé e Mamoré. Cad Saude Publica. 1985 out-dez;1(4):467-77.
17 Santos RV, Coimbra CEA Jr, Flowers NM, Silva JP. Intestinal parasitism in the xavante indians, central Brazil. Rev Inst Med Trop Sao Paulo. 1995 Mar-Apr;37(2):145-8. [Link]
18 Quadros RM, Pilati C, Marques SMT, Mazzolli M, Benedet RC. Capillaria hepatica in Puma concolor: first report in Brazil. J Zoo Wildl Med. 2009 Sep;40(3):586-7. [Link]
19 Gomes AT, Cunha LM, Bastos CG, Medrado BF, Assis BCA, Andrade ZA. Capillaria hepatica in rats: focal parasitic hepatic lesions and septal fibrosis run independent courses. Mem Inst Oswaldo Cruz. 2006 Dec;101(8):895-8. Doi:http://dx.doi.org/10.1590/S0074-02762006000800012 [Link]
20 Mowat V, Turton J, Stewart J, Lui KC, Pilling AM. Histopathological features of Capillaria hepatica infection in laboratory rabbits. Toxicol Pathol. 2009 Aug;37(5):661-6.
21 Klenzak J, Mattia A, Valenti A, Goldberg J. Hepatic capillariasis in Maine presenting as a hepatic mass. Am J Trop Med Hyg. 2005 May;72(5):651-3.
22 Redrobe SP, Patterson-Kane JC. Calodium hepaticum (syn. Capillaria hepatica) in captive rodents in a zoological Garden. J Comp Pathol. 2005 Jul;133(1):73-6. [Link]
23 Abbot DP, Majeed SK. A survey of parasitic lesions in wild-caught, laboratory-mantained primates: (rhesus, cynomolgus, and badoon). Vet Path. 1984 Mar;21(2):198-207. [Link]
24 Graczyk TK, Lowenstine LJ, Cranfield MR. Capillaria hepatica (Nematoda) infections in human-habituated mountain gorillas (Gorilla gorilla beringei) of the Parc National de Volcans, Rwanda. J Parasitol. 1999 Dec;85(6):1168-70.
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Manoel do Carmo Pereira Soares
Instituto Evandro Chagas, Seção de Hepatologia
Av. Almirante Barroso, 492
CEP: 66093-020 Belém-Pará-Brasil
E-mail: msoares@iec.pa.gov.br
Recebido em / Received / Recibido en: 3/9/201 1
Aceito em / Accepted / Aceito en: 4/12/2011













