Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.2 n.4 Ananindeua dez. 2011
http://dx.doi.org/10.5123/S2176-62232011000400004
ARTIGO ORIGINAL| ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Perfil de sensibilidade do gênero Candida a antifúngicos em um hospital de referência da Região Norte do Brasil
Antifungal sensitivity profile for the Candida genus in a reference hospital in Northern Brazil
Perfil de sensibilidad del género Candida a antifúngicos en un hospital de referencia de la Región Norte de Brasil
Emmanuel Borges NunesI; Natália Borges NunesII; Julius Caesar Mendes Soares MonteiroII; Andrea Luzia Vaz PaesIII
IHospital Universitário João de Barros Barreto, Belém, Pará, Brasil
IIUniversidade Federal do Pará, Belém, Pará, Brasil
IIIUniversidade do Estado do Pará, Belém, Pará, Brasil. Hospital Universitário João de Barros Barreto, Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
INTRODUÇÃO: Nos últimos anos tem-se observado, principalmente no ambiente hospitalar, um aumento de infecções por Candida spp resistentes a antifúngicos. Esta resistência tem elevado a taxa de insucesso na terapêutica contra esses agentes, causando, consequentemente, aumentos de morbidade e mortalidade.
OBJETIVO: Descrever o perfil de sensibilidade de isolados de espécies do gênero Candida a antifúngicos em um hospital de referência.
MATERIAIS E MÉTODOS: Estudo transversal-analítico, realizado em hospital universitário da rede pública de Belém, Estado do Pará, Brasil, no período de julho de 2008 a junho de 2010. Foram selecionados, a partir de espécimes clínicos, isolados onde houve crescimento de Candida spp na cultura para fungos. Para a identificação das espécies utilizou-se o sistema automatizado Mini API® da bioMérieux® e para o teste de sensibilidade, o ATB® Fungus 2 bioMérieux® segundo o protocolo de interpretação do Clinical and Laboratory Standards Institute (NCCLS/CLSI; M27-A2). Os dados foram consolidados em tabelas e submetidos à análise estatística descritiva e inferencial.
RESULTADOS: Todos os 81 isolados de Candida foram sensíveis à anfotericina B e à flucitosina. Resistências ao fluconazol e ao voriconazol foram de 3,7% e 4,9%, respectivamente. Das Candida spp, 16% foram resistentes ao itraconazol. Nenhum isolado de C. albicans foi resistente ao itraconazol; três (9%) foram sensíveis dose-dependente. Os isolados de C. tropicalis apresentaram resistência a pelo menos um antifúngico testado (42,9%) e apenas 23,8%, sensibilidade ao itraconazol.
CONCLUSÃO: As altas frequências de isolados de C. tropicalis resistente e de Candida spp resistente ao itraconazol indicam haver fatores predisponentes e sugerem a adoção de medidas para se evitar uso indiscriminado de antifúngicos e para a vigilância epidemiológica da candidemia nosocomial.
Palavras-chave: Candida; Antifúngicos; Resistência a Medicamentos.
ABSTRACT
INTRODUCTION: An increased number of antifungal-resistant Candida infections have been observed in the last few years, primarily in hospital environments. This resistance has increased the failure rate for treating these infections and, consequently, caused greater morbidity and mortality.
OBJECTIVE: To determine the antifungal sensitivity profile of species from the Candida genus in a reference hospital.
MATERIAL AND METHODS: A cross-sectional study was performed in a university hospital that is part of the public hospital network in the City of Belém, Para State, Brazil, between July 2008 and June 2010. Isolates were selected from Candida spp that grew in fungal cultures of clinical specimens. The species were identified using the automated Mini API® system from bioMérieux®, and their sensitivity was tested using the ATB® Fungus 2 bioMérieux® system following the Clinical and Laboratory Standards Institute (NCCLS/CLSI; M27-A2) interpretation protocol. The data were gathered into tables and then were subjected to descriptive and inferential statistical analyses.
RESULTS: All 81 Candida isolates were sensitive to amphotericin B and flucytosine, while 3.7% and 4.9% were resistant to fluconazole and voriconazole, respectively. Additionally, 16% of the Candida spp isolates were resistant to itraconazole. None of the C. albicans isolates were resistant to itraconazole, while three (9%) were sensitive in a dose-dependent manner. The C. tropicalis isolates were resistant to at least one of the tested antifungals (42.9%), while only 23.8% were sensitive to itraconazole.
CONCLUSION: The high resistance rates for C. tropicalis and Candida spp to itraconazole indicate that there are risk factors, and these rates support the adoption of measures to avoid the indiscriminant use of antifungals in the epidemiological surveillance of nosocomial candidemia.
Keywords: Candida; Antifungal Agents; Drug Resistance.
RESUMEN
INTRODUCCIÓN: En los últimos años se ha observado, especialmente en el ambiente hospitalario, un aumento de infecciones por Candida spp resistentes a antifúngicos. Esta resistencia ha aumentado la tasa de fracaso en la terapéutica contra esos agentes, causando, consecuentemente, aumentos de morbilidad y mortalidad.
OBJETIVO: Describir el perfil de sensibilidad de aislados de especies del género Candida a antifúngicos en un hospital de referencia.
MATERIALES Y MÉTODOS: Estudio transversal-analítico, realizado en hospital universitario de la red pública de Belém, Estado de Pará, Brasil, en el período de julio de 2008 a junio de 2010. Fueron seleccionados, a partir de especimenes clínicos, aislados en donde hubo crecimiento de Candida spp en el cultivo para hongos. Para la identificación de las especies se utilizó el sistema automatizado Mini API® de bioMérieux® y para la prueba de sensibilidad, el ATB® Fungus 2 bioMérieux® según el protocolo de interpretación de Clinical and Laboratory Standards Institute (NCCLS/CLSI; M27-A2). Los datos fueron consolidados en tablas y sometidos a análisis estadístico descriptivo e de inferencia.
RESULTADOS: Todos los 81 aislados de Candida fueron sensibles a la anfotericina B y a la flucitosina. Las resistencias al fluconazol y al voriconazol fueron de 3,7% e 4,9%, respectivamente. De las Candida spp, un 16% fue resistente al itraconazol. Ningún aislado de C. albicans fue resistente al itraconazol; tres (9%) fueron sensibles dosis-dependiente. Los aislados de C. tropicalis presentaron resistencia a, al menos, un antifúngico probado (42,9%) y apenas 23,8%, sensibilidad al itraconazol.
CONCLUSIÓN: Las altas frecuencias de aislados de C. tropicalis resistente y de Candida spp resistente al itraconazol indican que hay factores de predisposición y sugieren la adopción de medidas para evitar el uso indiscriminado de antifúngicos y para la vigilancia epidemiológica de la candidemia nosocomial.
Palabras clave: Candida; Antifúngicos; Resistencia a Medicamentos.
INTRODUÇÃO
Tem-se observado, principalmente no ambiente hospitalar, aumento de infecções por Candida spp resistentes a antifúngicos1,2. Esta resistência tem elevado a taxa de insucesso na terapêutica contra esses agentes, a morbidade e a mortalidade1,2,3,4.
Infecções por esta levedura, especialmente as do trato urinário e as hematogênicas, vêm aumentando consideravelmente, principalmente em centros de terapia intensiva e/ou de assistência a pacientes críticos5,6,7,8,9.
Diversas espécies, com destaque para a C. albicans, têm sido apontadas como relevantes patógenos nosocomiais, principalmente nas infecções fúngicas hospitalares e fungemias6,7,8,9. A candidemia ainda se apresenta como uma das causas relevantes de infecção sanguínea em hospitais de atenção terciária e quaternária, estando diretamente associada a longos períodos de institucionalização (três a 30 dias), à alta mortalidade (10% a 49%) e ao elevado custo hospitalar10,11,12,13. Estimativas descrevem gastos em torno de 1 bilhão de dólares para o manejo da candidemia nos Estados Unidos14.
É importante a identificação do agente etiológico nessas infecções, pois a patogenicidade e o padrão de sensibilidade a cada antifúngico apresentam variações de acordo com cada fungo4,15,16. Estudos apontam que, apesar da C. albicans ser o principal agente identificado nas infecções superficiais ou nas invasivas, tem aumentado a incidência de isolamentos de Candida não albicans, nessas infecções, diretamente relacionadas a altos percentuais de mortalidade17,18,19.
No Brasil, infecções por Candida spp tem sido dois a 15 vezes mais frequente que em países do Hemisfério Norte, tendo sido ela o quarto principal germe isolado em hemoculturas. A resistência desta tem ocorrido principalmente aos azólicos; porém, em índices menos alarmantes que nos USA20,21.
Indubitavelmente, só o conhecimento do perfil de sensibilidade permite uma conduta segura frente a uma infecção causada por Candida spp15. Na Região Norte do Brasil, porém, há uma grande carência de trabalhos científicos sobre o assunto, principalmente relacionada a esta levedura. Assim, conhecendo os melhores antimicóticos para o caso, é possível alcançar uma mais eficaz abordagem terapêutica contra estas infecções.
MATERIAIS E MÉTODOS
Desenvolveu-se um estudo do tipo transversal-analítico, em que a população de interesse foi constituída por pacientes que apresentavam cultura com crescimento de leveduras do gênero Candida e que foram internados no Hospital Universitário João de Barros Barreto (HUJBB) em Belém, no período de julho de 2008 a junho de 2010.
A amostra foi selecionada a partir do banco de dados da Comissão de Controle de Infecção Hospitalar (CCIH) do HUJBB, o qual possui cópia de todos os resultados de culturas de espécimes clínicos (sangue, urina e secreções) testados no laboratório de microbiologia da instituição.
Após a visualização de todos estes dados, selecionaram-se aqueles classificados pela CCIH como agravos causados por Candida e provenientes de colonização hospitalar ou infecção hospitalar no HUJBB.
As culturas com crescimento de fungos do gênero em questão foram submetidas à identificação das espécies pelo sistema automatizado Mini API® ID 32 C da bioMérieux®. Para determinar a sensibilidade in vitro dos isolados, foi utilizado o ATB® Fungus 2 (API® bioMérieux®), com leituras após 24/48 h de incubação, seguindo as recomendações técnicas e de interpretação clínica do protocolo M27-A2 do Clinical and Laboratory Standards Institute (NCCLS/CLSI)22.
Foram incluídos no trabalho apenas os dados dos pacientes classificados segundo os critérios do National Nosocomial Infections Surveillance System23 recomendado pelo Sistema Nacional de Informação para o Controle de Infecções em Serviços de Saúde (SINAIS) do Ministério da Saúde, que a CCIH do HUJBB utilizou para corretamente classificar as culturas em "oriundas de infecção hospitalar" e "oriundas de colonização hospitalar".
Foram excluídos dados dos pacientes com infecções consideradas de natureza nosocomial mas que haviam sido transferidos de outra instituição para o HUJBB; daqueles em que as culturas foram provenientes de coletas em até 48 h de internação, caracterizando colonização comunitária; daqueles em que as culturas foram consideradas como contaminação; e dos paciente cujo material não foi submetido a teste de susceptibilidade a antifúngicos, conforme citado.
Os resultados obtidos foram organizados em planilhas do Microsoft Excel 2007® e foram analisadas nos programas Epi Info® versão 3.5.2 e BioEstat® versão 5.3. Realizou-se estudo descritivo dos dados, demonstrando a frequência absoluta e relativa.
Para análise de associação entre as variáveis estudadas, optou-se pelos testes do qui-quadrado de partição e exato de Fisher na análise estatística inferencial. Determinou-se como nível alfa ≤ 0,05 (5%) para rejeição da hipótese nula.
Este projeto foi submetido ao Comitê de Ética em Pesquisa do HUJBB tendo sido aprovado em 15 de setembro de 2010 sob o protocolo 1314/2010 (CAE: 0062.0.071.000-10).
RESULTADOS
No período estudado foram analisados 81 isolados para leveduras do gênero Candida, sendo C. albicans (40,7%) e C. tropicalis (25,9%). Em 18/81 amostras não foi possível identificar a espécie, apenas descartar a possibilidade de pertencer à espécie C. albicans (Tabela 1).
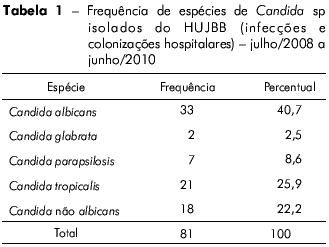
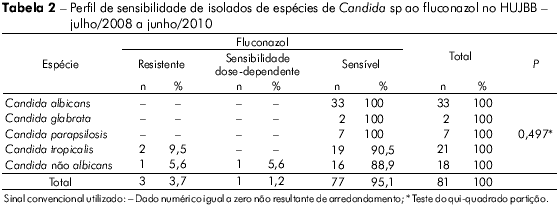
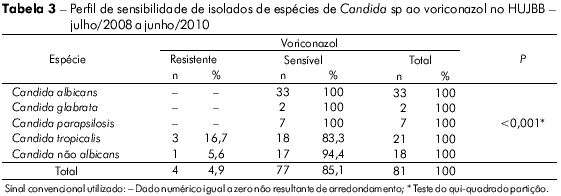
Dentre os 78 isolados testados à anfotericina B, todos foram sensíveis. O mesmo ocorreu nos 81 testados à flucitosina. Não houve diferença significativa na sensibilidade ao fluconazol e ao voriconazol em relação aos grupos de Candida (Tabelas 2 e 3).
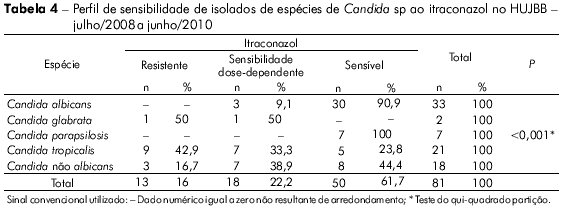
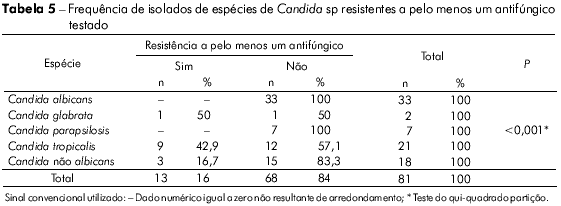
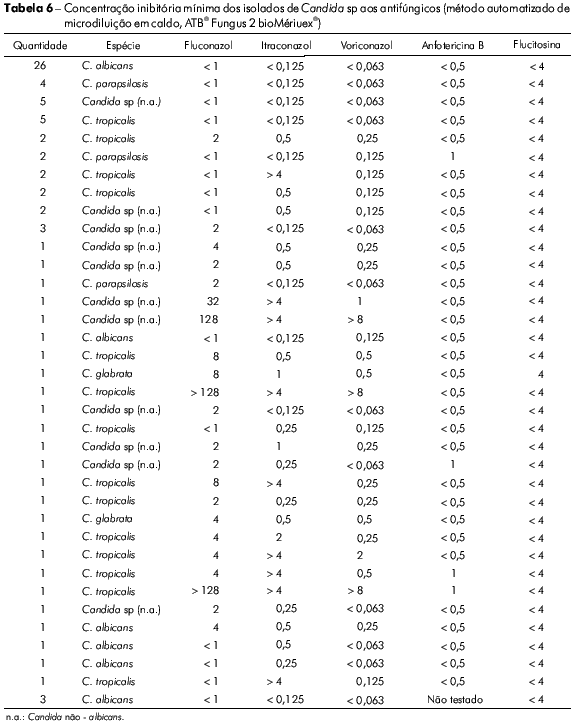
Os isolados de C. tropicalis foram significativamente resistentes/sensíveis dose-dependente ao itraconazol (Tabelas 4 e 5). Na tabela 6 observa-se a análise de cada amostra e o seu perfil de sensibilidade e de resistência, destacando-se as resistências a mais de um antifúngico, principalmente da mesma classe.
DISCUSSÃO
Nos últimos anos, em todo o mundo, tem-se observado um crescente aumento de infecções por Candida resistentes a antifúngicos comumente usados na prática clínica1,2,3.
Ao redor do mundo, resistência de Candida não albicans, a antifúngicos azólicos tem sido pouco prevalente24,25,26,27,28. No Brasil não foi diferente5,7,11,29.
C. tropicalis, a Candida não albicans mais frequente no Brasil, foi descrita no Ceará como altamente sensível aos antifúngicos30. Em contraste, no presente trabalho, 42,8% dos isolados desta espécie foram resistentes a pelo menos um azólico (Tabela 5).
O alto número de isolados resistentes, como também o encontrado neste trabalho tem sido raro no mundo, com exceção de Taiwan, onde, em estudo multicêntrico, 46,5% dos isolados de C. tropicalis eram resistentes ao fluconazol no centro participante deste país31.
A tabela 5 mostra que o tratamento empírico pode levar insucesso, principalmente se utilizado contra C. tropicalis (p < 0,001). Há probabilidade de falha especialmente se a droga escolhida for o itraconazol (Tabela 4, p < 0,001).
Esta levedura vem se tornando cada vez mais prevalente no mundo e já é a segunda mais frequentemente isolada no Brasil30,32. No presente estudo, correspondeu a 25,6% de todos os isolados, sendo a primeira mais encontrada entre as Candida não albicans (Tabela 1).
Há evidências de que a resistência aos azólicos ocorre por uso prévio destes últimos31,33,34,35. Vandeputte et al2 afirmaram que, no caso da C. tropicalis, há um aumento da expressão do gene ERG11, associada com uma mutação missense nesse gene.
C. albicans é a principal levedura isolada, principalmente em infecções nosocomiais, e o principal agente de fungemia no mundo6,9,16. A sensibilidade desse agente aos mesmos antifúngicos testados tem sido observada igualmente no mundo16,24,25,26,27,36 e no restante do Brasil7,11,15,21. Nos isolados pesquisados, a sensibilidade foi de 100% (p < 0,001).
Alguns isolados de C. albicans, porém, demonstraram sensibilidade dose-dependente ao itraconazol (9%) (Tabela 4 ). Tal fato é importante, pois em outros centros já se detecta importante resistência de isolados dessa espécie a esse antifúngico16.
Índices de resistência crescentes de Candida sp tem sido descritos, porém tal fato ainda carece de comparação satisfatória com dados anteriores à publicação M27A de 1997 do CLSI, momento em que os pontos corte de sensibilidade e resistência foram finalmente estabelecidos para os antifúngicos e a literatura científica começou a usá-los como padrão de referência para comparação1,2,22.
De uma forma geral, Candida sp tem se mostrado sensível a anfotericina B (anfB) no antifungigrama. Porém, cinco amostras (6% do total / 10% das Candida não albicans) possuíram concentração inibitória mínima (CIM) = 1 mcg/mL (Tabela 6). O CLSI recomenda cuidado especial ao se usar a CIM de anfotericina B para se tomar decisão terapêutica na prática clínica, afirmando que é provável que o fungo seja resistente quando a CIM é maior que 1 mcg/mL in vitro22. Afirmação importante para espécies como C. lusitaniae e C. guilliermondii, naturalmente resistentes a esse antimicótico37.
A sensibilidade in vitro da Candida ao fluconazol (96%) tem sido semelhante ao de outras regiões do Brasil (95%-100%)11,15,21,38 e de outros países4. Entretanto, em outros centros esta sensibilidade vem diminuindo gradativamente (90%)39.
Com relação ao voriconazol, o resultado tem sido diferente. Enquanto que no presente estudo verificou-se 95% de sensibilidade, em outros lugares do país a sensibilidade foi de 100%5,11,15,27, e, no mundo (estudo multicêntrico), 95%39.
Colombo et al11 observaram que cepas resistentes ao fluconazol frequentemente também eram resistentes ao voriconazol. Menezes et al30 verificaram que todas as três C. tropicalis resistentes ao fluconazol de seu trabalho eram resistentes ao itraconazol. No presente estudo, todas as três leveduras resistentes ao fluconazol (duas C. tropicalis e uma C. albicans) foram resistentes ao voriconazol e também ao itraconazol (Tabela 6).
Segundo Magill et al40 resistência cruzada entre azóis pode acontecer rapidamente e é causada pelo uso prévio dos mesmos. Para Barchiesi et al41, ao se induzir resistência ao fluconazol é possível observar o desenvolvimento de resistência cruzada ao itraconazol.
Coassociação entre perda de suscetibilidade ao fluconazol e anfotericina B também foi encontrada, achado corroborado por Yang et al31. Segundo Kelly et al42, esta resistência cruzada entre fluconazol e à anfotericina B ocorre por defeito na dessaturação do esterol delta5,6 do fungo que o deixa sem ergosterol. Assim, a anfotericina B, que se liga ao ergosterol presente na membrana celular da levedura, fica impedida de agir42.
A recente sugestão da literatura de se usar o itraconazol como opção terapêutica em caso de falha no uso do fluconazol pareceu extremamente desfavorável no cenário avaliado31,34. Já que o itraconazol mostrou-se sensível in vitro em apenas 61,7% das amostras (16% resistentes e 22% sensíveis dose-dependente).
Conhecer a espécie do fungo é essencial para a correta conduta terapêutica frente a uma infecção grave por Candida. Porém, 22,2% das culturas com Candida (37% das Candida não albicans) não puderam ser identificadas pelo aparelho usado (Mini API® da bioMérieux®) (Tabela 1). É uma limitação muito frequente também nos outros equipamentos automatizados.
CONCLUSÃO
As altas frequências de C. tropicalis resistente a fluconazol, itraconazol e voriconazol, e de Candida spp resistentes ao itraconazol sugerem haver fatores predisponentes no hospital avaliado, os quais devem ser investigados e devidamente evitados.
Uma medida inicial indicada para isto seria o desenvolvimento de estratégias que se foquem no combate ao uso indiscriminado de antifúngicos, principal causa conhecida da resistência fúngica na literatura; porém, novos trabalhos são necessários para confirmar quais são os fatores causais na região deste estudo.
REFERÊNCIAS
1 Canuto MM, Rodero FG. Antifungal drug resistance to azoles and polyenes. Lancet Infect Dis. 2002 Sep;2(9):550-63. [Link]
2 Vandeputte P, Larcher G, Bergès T, Renier G, Chabasse D, Bouchara JP. Mechanisms of azole resistance in a clinical isolate of Candida tropicalis. Antimicrob Agents Chemother. 2005 Nov;49(11):4608-15. Doi:10.1128/AAC.49.11.4608-4615.2005 [Link]
3 Passos XS, Costa CR, Araujo CR, Nascimento ES, Souza LKH, Fernandes OFL, et al. Species distribution and antifungal susceptibility patterns of Candida spp. bloodstream isolates from a Brazilian tertiary care hospital. Mycopathologia. 2007 Mar;163(3):145-51. Doi:10.1007/s11046-007-0094-5 [Link]
4 Zomorodian K, Rahimi MJ, Pakshir K, Motamedi M, Ghiasi MR, Rezashah H. Determination of antifungal susceptibility patterns among the clinical isolates of Candida species. J Global Infect Dis. 2011 Oct;3(4):357-60. Doi:10.4103/0974-777X.91059 [Link]
5 Antunes AGV, Pasqualotto AC, Diaz MC, d'Azevedo PA, Severo LC. Candidemia in a Brazilian tertiary care hospital: species distribution and antifungal susceptibility patterns. Rev Inst Med Trop Sao Paulo. 2004 Sep-Oct;46(5):239-41. [Link]
6 Almirante B, Rodríguez D, Park BJ, Cuenca-Estrella M, Planes AM, Almela M, et al. Epidemiology and predictors of mortality in cases of Candida bloodstream infection: results from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol. 2005 Apr;43(4):1829-35. Doi:10.1128/JCM.43.4.1829-1835.2005 [Link]
7 Aquino VR, Lunardi LW, Goldani LZ, Barth AL. Prevalence, susceptibility profile for fluconazole and risk factors for candidemia in a tertiary care hospital in southern Brazil. Braz J Infect Dis. 2005 Oct;9(5):411-8. Doi.org/10.1590/S1413-86702005000500009 [Link]
8 Pasqualotto AC, Nedel WL, Machado TS, Severo LC. A 9-year study comparing risk factors and the outcome of paediatric and adults with nosocomial candidaemia. Mycopathologia. 2005 Sep;160(2):111-6. Doi:10.1007/s11046-005-3452-1 [Link]
9 Ostrosky-Zeichner L, Pappas PG. Invasive candidiasis in the intensive care unit. Crit Care Med. 2006 Mar;34(3):857-63. [Link]
10 Barberino MG, Silva N, Rebouças C, Barreiro K, Alcântara AP, Netto EM, et al. Evaluation of blood stream infections by Candida in three tertiary hospitals in Salvador, Brazil: a case-control study. Brazilian J Infect Dis. 2006 Feb;10(1):36-40. Doi.org/10.1590/S1413-86702006000100008 [Link]
11 Colombo AL, Nucci M, Park BJ, Nouér SA, Arthington-Skaggs B, Matta DA, et al. Epidemiology of candidemia in Brazil: a nationwide sentinel surveillance of candidemia in eleven medical centers. J Clin Microbiol. 2006 Aug;44(8):2816-23. Doi:10.1128/JCM.00773-06 [Link]
12 Gudlaugsson O, Gillespie S, Lee K, Vande Berg J, Hu J, Messer S, et al. Attributable mortality of nosocomial candidemia, revisited. Clin Infect Dis. 2003 Nov;37(9):1172-7. Doi:10.1086/378745 [Link]
13 Morgan J, Meltzer MI, Plikaytis BD, Sofair AN, Huie-White S, Wilcox S, et al. Excess mortality, hospital stay, and cost due to candidemia: a case-control study using data from population-based candidemia surveillance. Infect Control Hosp Epidemiol. 2005 Jun;26(6):540-7. Doi:10.1086/502581 [Link]
14 Miller LG, Hajjeh RA, Edwards JE Jr. Estimating the cost of nosocomial candidemia in the United States. Clin Infect Dis. 2001 Apr;32(7):1110. Doi:10.1086/319613 [Link]
15 Mímica LMJ, Ueda SMY, Martino MDV, Navarini A, Martini IJ. Diagnóstico de infecção por Candida: avaliação de testes de identificação de espécies e caracterização do perfil de suscetibilidade. J Bras Patol Med Lab. 2009 fev;45(1):17-23. [Link]
16 Badiee P, Alborzi A. Susceptibility of clinical Candida species isolates to antifungal agents by E-test, Southern Iran: a five year study. Iran J Microbiol. 2011 Dec;3(4):183-8. [Link]
17 Colombo AL, Guimarães T. Epidemiologia das infecções hematogênicas por Candida spp. Rev Soc Bras Med Trop. 2003 set-out;36(5):599-607. Doi.org/10.1590/S0037-86822003000500010 [Link]
18 Matta DA, Almeida LP, Machado AM, Azevedo AC, Kusano EJU, Travassos NF, et al. Antifungal susceptibility of 1000 Candida bloodstream isolates to 5 antifungal drugs: results of a multicenter study conducted in São Paulo, Brazil, 1995-2003. Diagn Microbiol Infect Dis. 2007 Apr;57(4):399-404. Doi:10.1016/j.diagmicrobio.2006.10.011 [Link]
19 Godoy P, Tiraboschi IN, Severo LC, Bustamante B, Calvo B, Almeida LP, et al. Species distribution and antifungal susceptibility profile of Candida spp. bloodstream isolates from Latin American hospitals. Mem Inst Oswaldo Cruz. 2003 Apr;98(3):401-5. Doi.org/10.1590/S0074-02762003000300020 [Link]
20 Weinstein RA, Rex JH, Sobel JD. Prophylactic antifungal therapy in the intensive care unit. Clin Infect Dis. 2001 Apr;32(8):1191-200. Doi:10.1086/319763 [Link]
21 Furlaneto MC, Rota JF, Quesada RM, Furlaneto-Maia L, Rodrigues R, Oda S, et al. Species distribution and in vitro fluconazole susceptibility of clinical Candida isolates in a Brazilian tertiary-care hospital over a 3-year period. Rev Soc Bras Med Trop. 2011 Oct;44(5):595-9. Doi.org/10.1590/S0037-86822011000500013 [Link]
22 National Committee for Clinical Laboratory Standards. Reference method for broth dilution antifungal susceptibility testing of yeasts. 2nd ed. Wayne: National Committee for Clinical Laboratory Standards; 2002.
23 Gaynes RP, Horan TC. Surveillance of nosocomialinfections. In: Mayhall CG. Hospital epidemiology and infection control. 3rd ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p. 1659-702.
24 Pfaller MA, Diekema DJ. Role of sentinel surveillance of candidemia: trends in species distribution and antifungal susceptibility. J Clin Microbiol. 2002 Oct;40(10):3551-7. Doi: 10.1128/JCM.40.10.3551-3557.2002 [Link]
25 Pfaller M, Diekema DJ, Jones RN, Messer SA, Hollis RJ. Trends in antifungal susceptibility of Candida spp. Isolated from pediatric and adult patients with bloodstream infections: SENTRY Antimicrobial Surveillance Program, 1997 to 2000. J Clin Microbiol. 2002 Mar;40(3):852-6. Doi:10.1128/JCM.40.3.852-856.2002 [Link]
26 St-Germain G, Laverdiere M, Pelletier R, Bourgault AM, Libman M, Lemieux C, et al. Prevalence and antifungal susceptibility of 442 Candida isolates from Blood and other normally sterile sites: results of a 2-Year (1996 to 1998) multicenter surveillance study in Quebec, Canada. J Clin Microbiol. 2001 Mar;39(3):949-53. Doi:10.1128/JCM.39.3.949-953.2001 [Link]
27 Diekema D, Messer S, Brueggemann A, Coffman S, Doern G, Herwaldt L, et al. Epidemiology of candidemia: 3-year results from the emerging infections and the epidemiology of Iowa organisms study. J Clin Microbiol. 2002 Apr;40(4):1298-302. Doi:10.1128/JCM.40.4.1298-1302.2002 [Link]
28 Kao AS, Brandt ME, Pruitt WR, Conn LA, Perkins BA, Stephens DS, et al. The epidemiology of candidemia in two United States cities: results of a population-based active surveillance. Clin Infect Dis. 1999 Nov;29(5):1164-70. [Link]
29 Sugar AM, Liu XP, Chen RJ. Effectiveness of quinolone antibiotics in modulating the effects of antifungal drugs. Antimicrob Agents Chemother. 1997 Nov;41(11):2518-21. [Link]
30 Menezes EA, Mendes LG, Cunha FA. Resistência a antifúngicos de Candida tropicalis isoladas no Estado Ceará. Rev Soc Bras Med Trop. 2009 maio-jun;42(3):354-5. Doi.org/10.1590/S0037-86822009000300024 [Link]
31 Yang YL, Cheng MF, Chang YW, Young TG, Chi H, Lee SC, et al. Host factors do not influence the colonization or infection by fluconazole resistant Candida species in hospitalized patients. J Negat Results Biomed. 2008 Dec;7:12. Doi:10.1186/1477-5751-7-12 [Link]
32 Nucci M, Colombo AL. Candidemia due to Candida tropicalis: clinical, epidemiologic, and microbiologic characteristics of 188 episodes occurring in tertiary care hospitals. Diagn Micr Infec Dis. 2007 May;58(1):77-82. Doi:10.1016/j.diagmicrobio.2006.11.009 [Link]
33 Myoken Y, Kyo T, Fujihara M, Sugata T, Mikami Y. Clinical significance of breakthrough fungemia caused by azole-resistant Candida tropicalis in patients with hematologic malignancies. Haematologica. 2004 Mar;89(3):378-80. DOI 10.1099/jmm.0.013227-0 [Link]
34 Tortorano AM, Rigoni AL, Biraghi E, Prigitano A, Viviani MA. The European Confederation of Medical Mycology ECMM) survey of candidaemia in Italy: antifungal susceptibility patterns of 261 non-albicans Candida isolates from blood. J Antimicrob Chemother. 2003 Oct;52(4):679-82. [Link]
35 Pappas PG, Kauffman CA, Andes D, Benjamin DK Jr, Calandra TF, Edwards JE Jr, et al. Clinical practice guidelines for the management candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis. 2009 Mar;48(5):503-35. Doi:10.1086/596757 [Link]
36 Córdoba S, Vivot W, Bosco-Borgeat ME, Taverna C, Szusz W, Murisengo O, et al. Species distribution and susceptibility profile of yeasts isolated from blood cultures: results of a multicenter active laboratory-based surveillance study in Argentina. Rev Argent Microbiol. 2011 Jul-Sep;43(3):176-85. [Link]
37 Barbedo LS, Sgarbi DBG. Candidíase. J Bras Doenças Sex Transm. 2010;22(1):22-38. [Link]
38 França JCB, Ribeiro CEL, Queiroz-Telles F. Candidemia in a Brazilian tertiary care hospital: incidence, frequency of different species, risk factors and antifungal susceptibility. Rev Soc Bras Med Trop. 2008 Jan-Feb;41(1):23-8. [Link]
39 Pfaller MA, Diekema D, Gibbs D, Newell V, Ellis D, Tullio V, et al. Results from the ARTEMIS DISK Global Antifungal Surveillance Study, 1997 to 2007: a 10.5-year analysis of susceptibilities of Candida species to fluconazole and voriconazole as determined by CLSI standardized disk diffusion. J Clin Microbiol. 2010 Apr;48(4):1366-77. Doi: 10.1128/JCM.02117-09 [Link]
40 Magill SS, Shields C, Sears CL, Choti M, Merz WG. Triazole cross-resistance among Candida spp.: case report, occurrence among bloodstream isolates, and implications for antifungal therapy. J Clin Microbiol. 2006 Feb;44(2):529-35. [Link]
41 Barchiesi F, Calabrese D, Sanglard D, Di Francesco LF, Caselli F, Giannini D, et al. Experimental induction of fluconazole resistance in Candida tropicalis ATCC 750. Antimicrob Agents chemother. 2000 Jun;44(6):1578-84. [Link]
42 Kelly S, Lamb D, Kelly D, Manning N, Loeffler J, Hebart H, et al. Resistance to fluconazole and cross-resistance to amphotericin B in Candida albicans from AIDS patients caused by defective sterol Delta 5,6-desaturation. FEBS Lett. 1997 Jan;400(1):80-2. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Emmanuel Borges Nunes
Rua dos Mundurucus, 4487, Bairro: Guamá,
Belém - Pará - Brasil
CEP: 66073-005
Email: emmanuelbnunes@yahoo.com.br
Recebido em / Received / Recibido en: 5/3/2012
Aceito em / Accepted / Aceito en: 17/7/2012













