Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.3 n.2 Ananindeua jun. 2012
http://dx.doi.org/10.5123/S2176-62232012000200004
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Interação hospedeiro-parasita entre a sardinha Cetengraulis edentulus (Cuvier, 1829) e o isópode parasita Livoneca desterroensis (Isopoda, Cymothoidae) em um estuário do norte do Brasil
Host-parasite interaction between sardines Cetengraulis edentulus (Cuvier, 1829) and the isopod parasite Livoneca desterroensis (Isopoda, Cymothoidae) in an estuary in Northern Brazil
Interacción huésped-parásito entre la sardina cola amarilla Cefengraulis edenfulus (Cuvier, 1829) y el isópodo parásito Livoneca desferroensis (Isopoda, Cymothoidae) en un estuario del norte de Brasil
Sarita Nunes LoureiroI; Marcela Nunes VideiraII; Tommaso GiarrizzoI
ILaboratório de Biologia Pesqueira, Manejo dos Recursos Aquáticos, Universidade Federal do Pará, Belém, Pará, Brasil
IIPrograma de Pós-Graduação em Biologia de Agentes Infecciosos e Parasitários, Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
O isópode Livoneca desterroensis (Thatcher, Souza-Conceição, Jost, 2003) foi encontrado parasitando o peixe Cetengraulis edentulus em um ambiente de entremaré lamoso não vegetado do estuário do rio Curuçá, norte do Brasil. As amostragens foram realizadas com o auxílio de uma rede de arrasto-de-praia no período de maré de quadratura ao longo de um ciclo de maré. Um total de 1.134 peixes da espécie C. edentulus foi coletado. Na observação parasitológica foi verificado que 80 (7%) dos peixes estavam parasitados por 83 indivíduos de L. desterroensis. Do número total de parasitas encontrados foi observada uma maior frequência para fêmeas 86% (71) em relação aos machos 14% (12). O local no corpo dos hospedeiros onde se verificou a maior frequência de parasitas foi a brânquia 97,6% (n = 81), já a boca apresentou apenas 2,4% (n = 2). A prevalência de parasitismo foi de 7,05%, a intensidade média foi de 1,04 e a abundância de 0,07. Uma forte correlação positiva (r = 0,72; p < 0,05) em relação ao comprimento total (cm) do hospedeiro e dos parasitas por sexos agrupados e em relação ao comprimento total (cm) das parasitas fêmeas (r = 0,78; p < 0,05). Em todas as classes de tamanho dos hospedeiros infestados verificou-se a predominância de parasitas fêmeas e um aumento na frequência de fêmeas conforme o aumento na classe de tamanho do hospedeiro. Esse é o primeiro registro de L. desterroensis parasitando o C. edentulus no estuário do rio Curuçá, nordeste do Estado do Pará.
Palavras-chave: Doenças dos Peixes; Interações Hospedeiro-Parasita; Boca; Brânquias.
ABSTRACT
The isopod Livoneca desterroensis (Thatcher, Souza-Conceicao, Jost, 2003) was found in specimens of Cetengraulis edentulus in a non-vegetated intertidal mangrove in the estuary of the Curuca river, North of Brazil. The samples were collected with a beach seine net at neap tide during an entire tidal cycle. A total of 1,134 specimens of C. edentulus were captured. The parasitological survey showed that 80 (7%) of the fish hosted 83 parasites of the species L. desterroensis: 71 (86%) females and 12 (14%) males. They were found in the branchiae (81; 97.6%) and in the mouth (2; 2.4%). Their prevalence rate was 7.05%, mean intensity was 1.04, and abundance rate was 0.07. There was a strong positive correlation (r = 0.72; p < 0.05) between the hosts' and the parasites' total length (grouped according to their gender), and between the hosts' and the female parasites' total length (r = 0.78; p < 0.05). Female parasites were more common in infested hosts regardless of their size groups, and their frequency rates increased as the size group of the host increased. This is the first report of L. desterroensis parasiting C. edentulus in the estuary of the Curuçá river, Northeastern Pará State.
Keywords: Fish Diseases; Host-Parasite Interactions; Mouth; Gills.
RESUMEN
El isópodo Livoneca desterroensis (Thatcher, Souza-Conceição, Jost, 2003) fue hallado parasitando el pez Cetengraulis edentulus en un ambiente intermareal lodoso no vegetado del estuario del río Curuçá, norte de Brasil. Los muestreos se realizaron con el auxilio de una red de arrastre de playa en el período de marea de cuadratura durante un ciclo de marea. Se colectó un total de 1.134 peces de la especie C. edentulus. A la observación parasitaria se verificó que 80 (7%) de lo peces estaban parasitados por 83 individuos de L. desterroensis. Del número total de parásitos encontrados fue observada una frecuencia mayor para hembras, un 86% (71) en relación a los machos 14% (12). El local del cuerpo de los huéspedes en donde se verificó la mayor frecuencia de parásitos fue la branquia 97,6% (n = 81), ya la boca presentó apenas un 2,4% (n = 2). La prevalencia de parasitismo fue de 7,05%, la intensidad promedio de 1,04 y la abundancia de 0,07. Una fuerte correlación positiva (r = 0,72; p < 0,05) en relación al largo total (cm.) del huésped y de los parásitos por sexos agrupados y en relación al largo total (cm) de los parásitos hembras (r = 0,78; p < 0,05). En todos los tamaños de huéspedes infectados se verificó la predominancia de parásitos hembras y un aumento en la frecuencia de hembras conforme el aumento en la clase de tamaño del huésped. Este es el primer registro de L. desterroensis parasitando a C. edentulus en el estuario del río Curuçá, nordeste del Estado de Pará.
Palabras clave: Enfermedades de los Peces; Interacciones Huésped-Parásitos; Boca; Branquias.
INTRODUÇÃO
O parasitismo tem sido reportado como um dos fatores que pode regular populações de peixes e influenciar na estrutura da ictiofauna1,2. Consequentemente, pode levar a perdas econômicas para a pesca, pois o parasitismo causa a morte, diminuição do crescimento ou outros danos para espécies de peixes comercialmente importantes3,4.
Muitas espécies de peixes são infestadas por crustáceos ectoparasitas da ordem Isopoda5. Os isópodes são parasitas visíveis na superfície do corpo, nas câmaras branquiais ou na cavidade bucal e são considerados deletérios para os peixes6,7.
Na ordem Isopoda enquadra-se a família Cymothoidae, que é representada por parasitas obrigatórios3, que podem ser encontrados tanto nas formas imatura quanto na adulta em regiões branquiais, bucais e na pele dos peixes5,8,9.
Estes parasitas possuem fertilização interna, sendo descritos pela maioria dos autores como hermafroditas protândricos4,10,11. Morfologicamente, possuem o corpo segmentado e achatado dorsoventralmente, apresentando de quatro a sete pares de patas locomotoras modificadas, sendo que cada uma possui garras adaptadas para fixação no hospedeiro12.
Este mecanismo de fixação permite que os isópodes se alimentem do sangue de seu hospedeiro e do líquido tissular, causando grandes alterações teciduais, além de tornar os peixes suscetíveis a infecções secundárias por fungos e bactérias13,14. Além disso, podem afetar a eficiência respiratória e o crescimento normal dos peixes, e a infestação causar a morte imediata dos seus hospedeiros3,5,7.
Uma das espécies de peixes mais abundantes nos manguezais do norte do Brasil é a sardinha Cetengraulis edentulus (Clupeiformes: Engraulidae)15. Esta espécie distribui-se no Caribe e no litoral atlântico, do Panamá até a costa de Santa Catarina16. Ocupa uma posição fundamental na cadeia alimentar de muitos ecossistemas de mangue neotropicais ao longo da costa atlântica17,18. Os indivíduos dessa espécie são consumidores primários e alimentam-se principalmente de diatomáceas pelágicas e bentônicas em águas rasas e turvas estuarinas, servindo como fonte de alimento para indivíduos das espécies de botos Sotalia fluviatilis e Sotalia guianensis assim como para espécies de peixes e aves marinhas17,19,20,21,22. Na Região Norte do Brasil, C. edentulus é usada como isca na pesca de outras espécies de peixes, além de ser fonte de alimento e renda para as comunidades locais16.
Estudos em relação ao parasitismo por isópode Lironeca desterroensis em peixes da espécie C. edentulus já foram realizados23,24. No entanto, concentraram-se apenas em uma análise taxonômica da espécie L. desterroensis23. Já quando as interações entre parasita e hospedeiro foram investigadas, o destaque foi maior em relação aos índices parasitários24.
Nesse contexto, o presente trabalho pretende fornecer informações sobre os índices parasitológicos e as interações entre hospedeiro e parasita, verificando se o comprimento do hospedeiro C. edentulus pode influenciar no número e comprimento total do isópode parasita L. desterroensis capturados em um ambiente de entremaré lamoso não vegetado de um estuário no norte do Brasil.
MATERIAL E MÉTODOS
ÁREA DE ESTUDO E DESENHO AMOSTRAL
O estudo foi realizado na zona de entremaré lamosa não vegetada da praia de Paxicu, estuário de Curuçá, localizada no nordeste do Estado do Pará (0°37'04,76"S e 47°49'46,2"W) (Figura 1). O clima da região é do tipo equatorial superúmido, com uma precipitação média anual de 2.500 mm distinguindo um período chuvoso de janeiro a junho e um período seco de julho a dezembro25. O estuário é dominado por marés semidiurnas, com amplitude de maré de 3-4 m na maré de quadratura e de 4-5 m na maré de sizígia26.
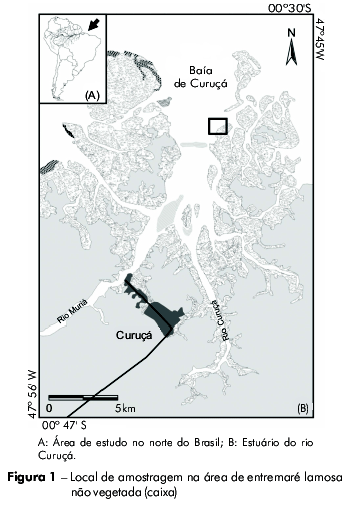
As amostras de peixes foram obtidas utilizando uma rede de arrasto-de-praia (picaré) de 9,5 m de comprimento, 1,70 m de altura e malha com 12 mm de abertura entre nós. As coletas foram realizadas na maré de quadratura no mês de junho de 2010, em três pontos escolhidos aleatoriamente e localizados em paralelo à margem da praia de Paxicu. As coletas foram efetuadas a cada 2 h, durante dois ciclos completos de maré, sendo a rede arrastada por um comprimento de 15 m de extensão por duas pessoas, obtendo-se um total de 36 amostras.
Em laboratório, foi realizada a biometria de todos os peixes capturados, sendo registrados o comprimento total (com precisão de 0,1 cm) e o peso total (com precisão de 0,01 g) por meio de uma balança semianalítica de precisão 0,01 g. A superfície do corpo, a região bucal e a branquial de cada peixe foram examinadas para verificação da presença de isópodes. Os parasitas foram removidos da cavidade bucal e branquial dos hospedeiros e preservados diretamente em tubos com álcool a 70%. Posteriormente, foi realizada a identificação taxonômica; a determinação do comprimento total (com precisão de 0,1 cm), peso (com precisão de 0,01 g), e sexo dos isópodes; e o registro do local no corpo do hospedeiro que estava sendo parasitado por isópode.
Os índices parasitológicos, tais como prevalência (número de hospedeiros infestados/número de hospedeiros examinados X 100), intensidade média (número total de parasitas/número de hospedeiros infestados) e abundância (número total de parasitas na amostra / número total de peixes examinados) foram calculados27. O teste de Mann-Whitney foi usado para verificar diferenças entre o comprimento total e peso de parasitas machos e fêmeas. O teste de correlação de Spearman foi usado para verificar a correlação entre o comprimento total (cm) do peixe com o número de parasitas e o comprimento total dos parasitas. O nível de significância adotado foi de 0,05.
RESULTADOS
Foram coletados 1.134 espécimes de C. edentulus com comprimento total médio de 9,7 cm (desvio padrão: ± 1,3 cm) variando entre 23,3 e 5,0 cm e com um peso médio de 7,13 g (desvio padrão: ± 3,87 g) variando entre 52 e 1,82 g.
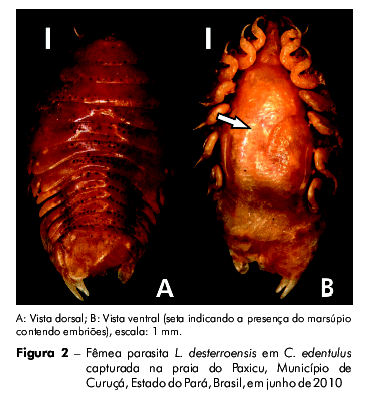
Das capturas totais, 80 peixes (7%) estavam parasitados por 83 isópodes da espécie L. desterroensis (Figura 2) sendo que 86% (71) e 14% (12) eram fêmeas e machos, respectivamente. Do número total de fêmeas encontradas, 41% estavam grávidas. Somente 2,4% (n = 2) dos isópodes foi encontrado na cavidade bucal e os restantes 97,6% (n = 81), nas brânquias dos hospedeiros. Os índices parasitários de C. edentulus mostraram uma prevalência de 7,05%, uma intensidade média de 1,04 parasitas por peixe e uma abundância de 0,073.
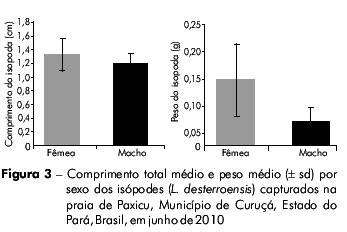
Agrupados por sexo, os parasitas apresentaram um comprimento total de 0,6 a 1,9 cm (média ± desvio padrão: 1,31 ± 0,23 cm) e peso de 0,01 a 0,33 g (média ± desvio padrão: 0,12 ± 0,07 g). Na análise por sexos separados, foi verificado que o comprimento total médio e o peso médio das fêmeas e dos machos foram de 1,32 cm (desvio padrão: ± 0,23) e 0,13 g (desvio padrão: ± 0,07 g) e 1,2 cm (desvio padrão: ± 0,13 cm) e 0,05 g (desvio padrão: ± 0,03 g), respectivamente (Figura 3). Foram verificadas diferenças significativas no comprimento total (Mann-Whitney teste-U= 307,5, p < 0,05) e no peso (Mann-Whitney teste-U= 113,5, p < 0,01) entre os sexos dos parasitas.
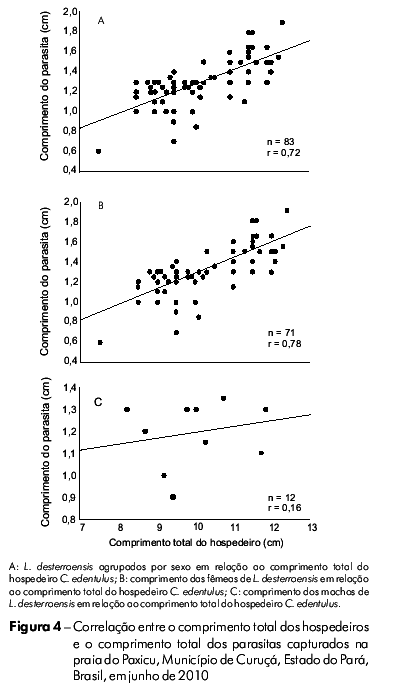
O comprimento total (cm) dos hospedeiros e o comprimento total (cm) dos parasitas, considerando os sexos agrupados, apresentaram uma forte correlação positiva (r = 0,72, p < 0,05) (Figura 4A). Quando considerados os sexos separadamente, a correlação positiva entre estas variáveis foi significativa somente com os parasitas fêmeas (r = 0,78, p < 0,05) (Figura 4B, C).
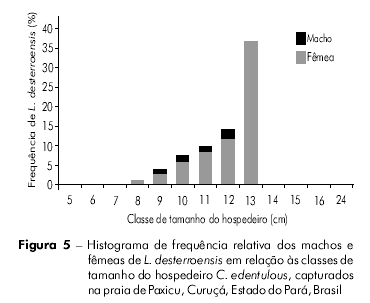
Na análise da classe de comprimento do hospedeiro (cm) em relação à frequência de machos e fêmeas de L. desterroensis, verificou-se uma maior predominância de parasitas fêmeas em relação aos machos ao longo de todas as classes de comprimento dos hospedeiros infestados (Figura 5). Foi observado também um aumento na frequência de fêmeas parasitas conforme o aumento na classe de tamanho do hospedeiro, sendo verificada uma maior frequência na classe de tamanho 13 cm. Já os parasitas machos foram mais frequentes na classe de tamanho 12 cm dos hospedeiros (Figura 5).
DISCUSSÃO
Levando em consideração a importância ecológica e econômica da espécie C. edentulus, pois serve como fonte de alimento para organismos de outros níveis tróficos e como fonte de alimentação e renda para ribeirinhos, estudos em relação à infestação por parasitas isópodes nos peixes dessa espécie são necessários objetivando identificar quais danos à saúde do hospedeiro podem ser causados por tal relação.
Os isópodes pertencentes à família Cymothoidae têm sido reportados por causar danos físicos consideráveis aos seus hospedeiros5,10,14. Poucos estudos investigaram a ocorrência de infestação do isópode L. desterroensis no peixe C. edentulus23,24, no entanto, pouco esclareceram sobre as interações entre parasita-hospedeiro.
Os isópodes podem apresentar preferência por hospedeiros imaturos e em estágio de maturação, como foi verificado para a espécie Livoneca redmanni parasitando o peixe Scomberomorus brasiliensis, e essa preferência foi explicada devido aos hospedeiros jovens apresentarem mais recursos energéticos disponíveis em relação aos adultos28. No presente estudo foi observado que os espécimes parasitados pertenceram a distintas classes etárias (5 a 23,3 cm) incluindo adultos, considerando que o tamanho de primeira maturação de C. edentulus é de 14,75 cm29. Este resultado é importante, pois os isópodes podem causar danos aos peixes imaturos de modo que estes não sobrevivem4. Além disso, podem afetar o sistema endócrino, reduzindo a capacidade reprodutiva, como foi observado no sudeste do Brasil, nos indivíduos maduros da espécie de peixe Cyphocharax gilbert parasitados pelo isópode Riggia paranensis (Cymothoidea)30.
Em relação a outros trabalhos de L. desterroensis parasitando C. edentulus, foi verificado que, neste estudo, a prevalência total (7,05%) foi inferior às observadas em um estudo realizado no norte do Brasil24 para o mês de maior prevalência (57,50%) e em outro estudo realizado no sul do Brasil23 (17,16%). Já em outra pesquisa foi verificado valor inferior de prevalência (5,9%) para indivíduos da espécie L. redmanni parasitando Chloroscombrus chrysurus no nordeste do Brasil31.
A abundância de L. desterroensis em C. edentulus encontrada neste trabalho (0,07 parasitas por peixes capturados) foi inferior à encontrada em um estudo no norte do Brasil que registrou maior abundância no mês de abril (0,58)24. Já em comparação com estudos realizados no nordeste do Brasil para espécie de isópode do mesmo gênero, foram registradas abundâncias superior (1,1) na espécie L. redmanni parasitando S. brasiliensis28 e inferior (0,05) L. redmanni parasitando C. chrysurus31.
Foram encontradas fortes correlações positivas (r > 0,72) entre o comprimento total (cm) dos hospedeiros e dos parasitas agrupados por sexo e para os parasitas fêmeas. Este resultado foi corroborado com o observado em outros estudos, onde foram verificadas associações positivas entre o comprimento total dos parasitas fêmeas de Cymothoa spinipalpa (r = 0,35) e Livoneca sp. (r = 0,82) e seus hospedeiros C. chrysurus e Atherinomorus lacunosus, respectivamente32,33. Adicionalmente, resultado semelhante também foi encontrado no nordeste do Brasil, onde foi observada uma regressão linear positiva (r = 0,67) em relação ao comprimento total de L. redmanni e comprimento furcal de C. chrysurus31.
Sugere-se que exista certa dependência positiva entre o tamanho de L. desterroensis e o tamanho de C. edentulus e isso pode ocorrer devido a uma maior disponibilidade de superfície de fixação para o habitat do parasita. Desta forma, os indivíduos de C. edentulus de maior tamanho estão sendo parasitados por L. desterroensis também de maior tamanho. Isto pode ser comprovado pelo fato de que os parasitas podem ser maiores ou menores, ou podem não mudar o tamanho do corpo, e isso dependerá da disponibilidade de espaço para a sua sobrevivência34.
A predominância na frequência de fêmeas de L. desterroensis conforme o aumento na classe de tamanho do hospedeiro sugere que as fêmeas encontram-se em maior número quanto mais elevada for a disponibilidade de espaço. Em uma análise do tamanho do corpo de machos e fêmeas de I. fushanensis foi sugerido que exista uma estratégia de troca do tamanho do corpo entre os dois sexos, permitindo um aumento no tamanho da fêmea e, consequentemente, um maior tamanho de ninhada34. Outros estudos são necessários para verificar se uma frequência menor de machos em relação às fêmeas ao longo das classes de maior tamanho do hospedeiro pode ser também uma estratégia para o sucesso reprodutivo.
CONCLUSÃO
O presente estudo demonstrou que o parasitismo em C. edentulus por isópodes L. desterroensis pode estar relacionado ao tamanho disponível oferecido pelo hospedeiro para o parasita. Além disso, mostrou que as fêmeas são mais frequentes em relação aos machos quando maior é o tamanho do hospedeiro e isso pode estar relacionado a uma estratégia reprodutiva.
APOIO FINANCEIRO
Os autores agradecem ao programa de Pós-Graduação em Ecologia Aquática e Pesca, da Universidade Federal do Pará, por ter fornecido suporte financeiro. T. Giarrizzo agradece ao Conselho Nacional de Desenvolvimento Científico e Tecnológico pela bolsa em produtividade científica (processo 308278/20127).
REFERÊNCIAS
1 Lester RJG. A review of methods for estimating mortality due to parasites in wild fish populations. Helgolander Meeresun. 1984;37(1-4):53-64. [Link]
2 Finley RJ, Forrester GE. Impact of ectoparasites on the demography of a small reef fish. Mar Ecol Prog Ser. 2003;248:305-9. DOI:10.3354/meps248305 [Link]
3 Ravichandran S, Balasubramanin T, Kannupandi T. Incidence of parasitic isopods on the fish Sphyraena obtusata. Res J Parasitol. 2007;2(1):45-50. [Link]
4 Ravichandran S, Rameshkumar G, Balasubramanian T. Infestation of isopod parasites in commercial marine fishes. J Parasitol Dis. 2010 Oct;34(2):97-8. DOI: 10.1007/s12639-010-0014-3 [Link]
5 Ravichandran S, Rameshkumar G, Mahesh Babu B, Kumaravel K. Infestation of Rastrelligerkanagurta, with cymothoid isopod, Joryma brachysoma in the Colachel environment of southwest coast of India. World J Fish Mar Sci. 2009 Oct;1(2):80-4.
6 Ravichandran S. Infestation of isopod parasite Lironeca puhi in slender needle fish Strongylura leiura. Res J Parasit. 2007;2(2):87-93. DOI: 10.3923/jp.2007.87.93 [Link]
7 Printrakoon C, Purivirojkul W. Prevalence of Nerocila depressa (Isopoda, Cymothoidae) on Sardinella albella from a Thai estuary. J Sea Res. 2011;65:322-6.
8 Östlund-Nilsson S, Curtis L, Nilsson GE, Grutter AS. Parasitic isopod Anilocra apogonae, a drag for the cardinal fish Cheilodipterus quinquelineatus. Mar Ecol Prog Ser. 2005;287:209-16. DOI:10.3354/meps287209 [Link]
9 Ramdane Z, Bensouilah MA, Trilles JP. The Cymothoidae (Crustacea, Isopoda), parasites on marine fishes, from Alegrian fauna. Belg J Zool. 2007;137(1):67-74.
10 Brusca RC. A monograph on the isopoda Cymothoidae (Crustacea) of the eastern Pacific. Zool J Linn Soc. 1981;73(2):117-99. [Link]
11 Ravichandran S, Rameshkumar G, Kumaravel K. Variation in the morphological features of isopod fish parasites. World J Fish Mar Sci. 2009;1(2):137-40. [Link]
12 Pavanelli GC, Eiras JC, Takemoto RM. Doenças de peixes: profilaxia, diagnóstico e tratamento. 3. ed. Maringá: Eduem; 2008. 311 p.
13 Rajkumar M, Kumaraguru Vasagam KP, Perumal P, Trilles JP. First record of Cymothoa indica (Crustacea, Isopoda, Cymothoidae) infecting the cultured catfish Mystus gulio in India. Dis Aquat Organ. 2005 Jul;65(3):269-72. [Link]
14 Thatcher VE. Amazon fish parasites. 2th ed. Sofia: Pensoft Publishers; 2006. 508 p.
15 Giarrizzo T, Krumme U. Temporal patterns in the occurrence of selected tropical fishes in mangrove creeks: implications for the fisheries management in north Brazil. Braz Arch Biol Technol. 2009 May-Jun;52(3):679-88. [Link ]
16 Espirito-Santos RV, Isaac VJ, Silva LMA, Martinelli JM, Higuchi H, Paul US. Peixes e camarões do litoral bragantino, Pará, Brasil. Belém: MADAM; 2005. 268 p.
17 Krumme U, Keuthen H, Barletta M, Saint-Paul U, Villwock W. Resuspended intertidal microphytobenthos as major diet component of planktivorous Atlantic anchoveta Cetengraulis edentulus (Engraulidae) from equatorial mangrove creeks. Ecotrop. 2008 Dec;14(4):121-8. [Link]
18 Giarrizzo T, Schwamborn R, Saint-Paul U. Utilization of carbon Sources in a northern Brazilian mangrove ecosystem. Est Coast Shelf Sci. 2011;95(4):447-57.
19 Simões-Lopes PC. Ocorrência de uma população de Sotalia Fluviatilis Gervais, 1853, (Cetacea, Delphinidae) no limite Sul de sua distribuição, Santa Catarina, Brasil. Biotemas. 1988;1(1):57-62.
20 Branco JO, Fracasso HAA, Machado IF, Evangelista CL, Hillesheim JC. Alimentação natural de Fregata magnificens (Fregatidae, Aves) nas ilhas Moleques do Sul, Santa Catarina, Brasil. Rev Bras Orn. 2007;15(1):73-9. [Link]
21 Daura-Jorge FG, Wedekin LL, Simões-Lopes PC. Feeding habitats of the Guiana dolphin, Sotalia guianensis (Cetacea: Delphinidae), in Norte Bay, southern Brazil. Seien Marin. 2011 Mar;75(1):163-9. DOI: 10.3989/scimar.2011.75n1163 [Link]
22 Cremer MJ, Pinheiro PC, Simões-Lopes PC. Prey consumed by Guiana dolphin Sotalia guianensis (Cetacea, Delphinidae) and franciscana dolphin Pontoporia blainvillei (cetacean, Pontoporiidae) in an estuarine environment in southern Brazil. Iheringia Ser Zool. 2012 Jun;102(2):131-7. http://dx.doi.org/10.1590/S0073-47212012000200003 [Link ]
23 Thatcher VE, Souza-Conceição JM, Jost GF. Lironeca desterroensis sp. nov. (Isopoda, Cymohoidae) from the gills of a marine fish, Cetengraulis edentulus Cuvier, of Santa Catarina Island, Brazil. Rev Bras Zool. 2003;2:251-5. [Link]
24 Monfort KCF, Fujimoto RY, Varella JEA, Guimarães MDF, Santos AFL, Diniz DG, et al. Ocorrência de Livoneca desterroensis (Isopoda Cymothoidae), parasita de sardinha - Cetengraulis edentulus (Cuvier, 1828) (Engraulidae, Clupeiforme), capturadas na região do nordeste Paraense, Brasil. Bol Inst Pesca. 2009;34(4):657-2. [Link]
25 Giarrizzo T, Krumme U. Spatial differences and seasonal cyclicity in the intertidal fish fauna from four mangrove creeks in a salinity zone of the Curuçá, North Brazil. Bull Mar Scienc. 2007 May;80(3):739-54.
26 Giarrizzo T, Krumme U, Wosniok W. Size-structured migration and feeding patterns in the banded puffer fish Colomesus psittacus (Tetraodontidae) from north Brazilian mangrove creeks. Mar Ecol Prog Ser. 2010;419:157-70. DOI:10.3354/meps08852 [Link]
27 Bush AO, Lafferty KD, Lotz JM, Shostak AW. Parasitology meets ecology on its own terms: Margolis et al. Revisited. J Parasitol. 1997;83(4):575-83. [Link ]
28 Lima JTAX, Chellappa S, Thatcher VE. Livoneca redmanni Leach (Isopoda, Cymothoidae) e Rocinela signata Schioedte and Meinert (Isopoda, Aegidae), ectoparasitos de Scomberomorus brasiliensis Collette, Russo & Zavala-Camim (Osteichthyes, Scombridae) no Rio Grande do Norte, Brasil. Rev Bras Zoo. 2005 Dec;22(4):1104-8. [Link]
29 Gallo Neto J. Aspectos reproductivos de la anchoveta rabo amarillo Cetengraulis edentulus (Cuvier, 1829) en la Cienaga Grande de Santa Marta (Magdalena, Colombia). Bol Cient INPA. 1993;(1):24-42. [Link]
30 Lima NRW, Azevedo JS, Silva LG, Dansa-Petretski M. Parasitic castration, growth, and sex steroids in the freshwater bonefish Cyphocharax gilbert (Curimatidae) infested by Riggia paranensis (Cymothoidea). Neotrop Ichthyol. 2007 Dec;5(4):471-8. http://dx.doi.org/10.1590/S1679-62252007000400006 [Link ]
31 Costa EFS, Chellappa S. New host record for Livoneca redmanni (LEACH, 1818) (Isopoda: Cymothoidae) in the Brazilian coastal waters with aspects of hostparasite interaction. Brazil J Oceanogr. 2010;58 Spec No 4:73-7. [Link]
32 Colorni A, Trilles JP, Golani D. Livoneca sp. (Flabellifera: Cymothoidae), an isopod parasite in the oral and branchial cavities of the Red Sea silverside Atherinomorus lacunosus (Perciformes, Atherinidae). Dis Aquat Organisms. 1997;31:65-71. [Link]
33 Costa EFS, Oliveira MR, Chellappa S. First record of Cymothoa spinipalpa (Isopoda: Cymothoidae) parasitizing the marine fish Atlantic bumper, Chloroscombrus chrysurus (Osteichthyes:Carangidae) from Brazil. Mari Biod Rec. 2010;3:1-6. DOI: http://dx.doi.org/10.1017/S1755267209991059 [Link ]
34 Tsai ML, Li JJ, Dai CF. How host size may constrain the evolution of parasite body size and clutch size. The parasitic isopod Ichthyoxenus fushanensis and its host fish, Variocorhinus bacbatulus, as an example. Oikos. 2001;92(1):13-9. DOI: 10.1034/j.1600-0706.2001.920102.x [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Sarita Nunes Loureiro
Laboratório de Biologia Pesqueira-Manejo
dos Recursos aquáticos,
Universidade Federal do Pará
Avenida Perimetral, 2651.
Bairro: Terra Firme
CEP: 66040170
Belém-Pará-Brasil
Tel.: +55 (91) 8271-1416
E-mail: saritanloureiro@gmail.com / loureirosn@yahoo.com
Recebido em / Received / Recibido en: 20/8/2012
Aceito em / Accepted / Aceito en: 8/2/2013













