Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.3 n.2 Ananindeua jun. 2012
http://dx.doi.org/10.5123/S2176-62232012000200008
COMUNICAÇÃO | COMMUNICATION | COMUNICACIÓN
Produção de fatores de virulência in vitro por isolados de Cryptococcus neoformans e Cryptococcus gattii de origem clínica em Belém, Estado do Pará, Brasil
Production of virulence factors in vitro by isolates of Cryptococcus neoformans and Cryptococcus gattii of clinical origin in Belém, Pará State, Brazil
Producción de factores de virulencia in vitro por aislados de Cryptococcus neoformans y Cryptococcus gattii de origen clínico en Belém, Estado de Pará, Brasil
Cláudia Cristina Brito PessoaI; Silvia Helena Marques da SilvaII; Fabíola Silveira GomesIII
IUniversidade do Estado do Pará, Belém, Pará, Brasil
IILaboratório de Micologia, Seção de Bacteriologia e Micologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIIPrograma de Pós-graduação em Biologia de Agentes Infecciosos e Parasitários, Instituto de Ciências Biológicas, Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Cryptococcus neoformans e Cryptococcus gattii são espécies causadoras de meningite criptocócica, implicadas no acometimento de pacientes imunocomprometidos e imunocompetentes, respectivamente. O modo de adesão, colonização e infecção de C. neoformans e C. gattii depende de alguns fatores de virulência, os quais permitem sua sobrevivência no organismo do hospedeiro. O presente trabalho investigou a atividade de exoenzimas (fosfolipase e proteinase), produção de biofilme e fator hemolítico por C. neoformans (n = 9) e C. gattii (n = 7) isolados em Belém, Estado do Pará, Brasil. Atividade de exoenzimas foi observada em todos os isolados testados. Fosfolipase foi observada em todos os isolados analisados, com intensidade discretamente mais elevada nos isolados de C. neoformans (22%) quando comparados aos isolados de C. gattii (14%). Paralelamente, os resultados de atividade proteinase mostraram que isolados de C. neoformans apresentaram maior intensidade na atividade desta exoenzima (33%) do que os resultados produzidos por C. gattii (14%). Não houve produção de fator hemolítico por quaisquer dos isolados estudados. Em relação à produção de biofilme, isolados de C. gattii demonstraram predomínio de formação de biofilme em superfície de poliestireno a 37o C quando comparados aos resultados de biofilme para isolados de C. neoformans. Este é o primeiro relato de atividade exoenzimática e produção de biofilme in vitro por isolados de Cryptococcus no Estado do Pará. A produção de fatores de virulência e, principalmente, a capacidade de produzir biofilme alerta-nos para a melhor análise dos isolados circulantes no Estado, principalmente quanto à determinação do perfil de suscetibilidade a antifúngicos.
Palavras-chave: Cryptococcus neoformans; Cryptococcus gattii; Exoenzimas; Biofilme; Virulência.
ABSTRACT
Cryptococcus neoformans and Cryptococcus gattii cause cryptococcal meningitis and are implicated in the infection of immunocompromised and immunocompetent patients, respectively. Their adhesion, colonization and infection attributes depend on some virulence factors, which enable their survival in the host's organism. This study investigated the activity of exoenzymes (phospholipase and proteinase), biofilm formation and production of a hemolytic factor by isolates of C. neoformans (n = 9) and C. gattii (n = 7) from Belém, Pará State, Brazil. Exoenzyme activity was observed in all isolates tested. Phospholipase was also observed in all isolates analyzed, and the C. neoformans isolates were slightly higher (22%) than C. gattii (14%). Proteinase data showed that isolates of C. neoformans presented greater intensity of exoenzyme activity (33%) than the results produced by C. gattii (14%). No production of hemolytic factors by any of the isolates studied was observed. Regarding the formation of biofilm, isolates of C. gattii showed a predominant formation on polysterene surface at 37o C when compared with the isolates of C. neoformans. This is the first report of in vitro exoenzyme activity and biofilm formation by isolates of Cryptococcus in Pará State. The production of virulence factors and the ability to form biofilms highlights the importance of a more accurate analysis of the circulating isolates in the state, especially when it comes to determining their susceptibility profile to antifungals.
Keywords: Cryptococcus neoformans; Cryptococcus gattii; Exoenzyme; Biofilms; Virulence.
RESUMEN
Cryptococcus neoformans y Cryptococcus gattii son especies causadoras de meningitis criptocócica, involucradas en el acometimiento de pacientes inmunocomprometidos e inmunocompetentes, respectivamente. El modo de adhesión, colonización e infección de C. neoformans y C. gattii depende de algunos factores de virulencia, los que permiten la supervivencia en el organismo del huésped. El presente trabajo investigó la actividad de exoenzimas (fosfolipasa y proteasa), producción de biofilm y factor hemolítico por C. neoformans (n = 9) y C. gattii (n = 7) aislados en Belém, Estado de Pará, Brasil. Se observó actividad de exoenzimas en todos los aislados analizados. También se observó fosfolipasa en todos los aislados analizados, con intensidad discretamente más elevada en los aislados de C. neoformans (22%) cuando comparados a los aislados de C. gattii (14%). Paralelamente, los resultados de actividad de la proteasa mostraron que aislados de C. neoformans presentaron una mayor intensidad en la actividad de esta exoenzima (33%) que los resultados producidos por C. gattii (14%). No hubo producción de factor hemolítico por ninguno de los aislados estudiados. En relación a la producción de biolfilm, aislados de C. gattii demostraron predominio de formación de biofilm en superficie de poliestireno a 37o C cuando comparados a los resultados de biofilm para aislados de C. neoformans. Este es el primer relato de actividad exoenzimática y de producción de biofilm in vitro por aislados de Cryptococcus en el Estado de Pará. La producción de factores de virulencia y, principalmente, la capacidad de producir biofilm nos alerta para mejores análisis de los aislados circulantes en el Estado, principalmente con relación a la determinación del perfil de susceptibilidad a antifúngicos.
Palablas clave: Cryptococcus neoformans; Cryptococcus gattii; Exoenzimas; Biofilmes; Virulencia.
INTRODUÇÃO
A criptococose é uma importante infecção oportunista, principalmente devido ao aumento do número de indivíduos imunocomprometidos, em especial aqueles infectados com HIV1,2. As espécies implicadas em grande parte dos casos são Cryptococcus neoformans e Cryptococcus gattii, causadoras de variadas formas clínicas da doença3,4,5. Neste contexto, indivíduos imunocompetentes podem adquirir a doença como micose primária, principalmente devido a C. gattii, em regiões tropicais e subtropicais6, bem como sob a forma de surtos7. Cryptococcus spp. são leveduras basidiomicetos, capsuladas, sapróbias do ambiente, sendo isoladas principalmente de excretas de aves e ocos de árvores, como por exemplo, eucalipto8 e Senna sp.9. C. neoformans é constituído pelos sorotipos A (tipos moleculares VNI, VNII), D (tipo molecular VNIV) e o híbrido AD (tipo molecular VNIII); C. gattii inclui o sorotipo B (tipos moleculares VGI, VGII, VGIII, VGIV) e o sorotipo C10,11,12.
Em Belém, Estado do Pará, Brasil, relatou-se o isolamento de C. gattii (nove casos) e C. neoformans (dez casos) provenientes de meningite criptocócica em crianças, das quais cinco foram a óbito13. Santos et al14 descreveram a ocorrência de criptococose primária endêmica devida ao tipo molecular VGII de C. gattii no Estado do Pará, com base na análise de isolados provenientes de 43 casos da doença no período de 2003 a 2007. A Região Norte do Brasil é atualmente considerada endêmica para o tipo molecular VGII (sorotipo B, MATα) de C. gattii15.
A cápsula polissacarídica, a produção de melanina e a atividade da enzima urease são fatores de virulência produzidos por C. neoformans e C. gattii. Exoenzimas, tais como oxidases e proteases têm sido implicadas tanto à virulência como às propriedades antifagocíticas16. Fosfolipases e proteinases são implicadas como fatores de virulência em leveduras17, sendo diretamente relacionadas à invasão e/ou evasão do sistema imunológico do hospedeiro, favorecendo a disseminação hematogênica e o acometimento das meninges18. No Brasil, amostras clínicas e ambientais de C. neoformans e C. gattii foram descritas anteriormente com intensa atividade na produção destas exoenzimas19,20.
A produção de biofilme por Cryptococcus spp. tem sido frequentemente descrita como uma estratégia associada à infecção crônica, como um resultado de resistência adquirida aos mecanismos imunológicos do hospedeiro21 e à terapia antifúngica22. O biofilme pode ser formado in vitro em superfícies de poliestireno; entretanto, de maneira alarmante, vem sendo observado em pontas de cateter23. O fator hemolítico ou hemolisina vem sendo descrito em leveduras, principalmente do gênero Candida, caracterizando-se como uma manoproteína de parede celular nestas leveduras, apresentando atividade de hemólise para liberação das moléculas de ferro e posterior utilização durante a manutenção do metabolismo fúngico durante a disseminação via hematogênica24.
Devido à inexistência de estudos que descrevam a produção de tais fatores de virulência em isolados de C. neoformans e C. gattii no Estado do Pará, o objetivo deste trabalho foi descrever a produção de fatores de virulência in vitro.
MATERIAIS E MÉTODOS
ORGANISMOS TESTADOS
Foram investigados: uma cepa de referência de C. neoformans sorotipo A (ATCC 6352), uma de C. gattii sorotipo B (ATCC 32269) e 16 isolados clínicos, C. neoformans (n = 9) e C. gattii (n = 7). Os isolados clínicos foram identificados com base na quimiotipagem por semeadura em meio Canavanina-Glicina-Azul de bromotimol (CGB), fenotipicamente produtores de cápsula, urease e fenoloxidase, como descrito anteriormente por Silveira-Gomes et al25. Estes foram recuperados de pacientes diagnosticados no período de 2005 a 2009, com base na revelação da cápsula polissacarídica do microrganismo utilizando tinta da China em amostras de líquido cefalorraquidiano. A distribuição de acordo com o gênero foi de 50% (8/16) para cada sexo, e a idade variou entre 8 e 56 anos. As leveduras foram isoladas e mantidas em ágar Sabouraud dextrose 2% (Difco, Detroit, Michigan) a 30o C na micoteca do Laboratório de Micologia da Seção de Bacteriologia e Micologia do Instituto Evandro Chagas.
PESQUISA DE ENZIMAS HIDROLÍTICAS
A produção de fosfolipase foi verificada utilizando-se o método de semeadura em placa contendo ágar gema de ovo (peptona 1%, dextrose 3%, NaCl 5,7%, CaCl 0,06%, gema de ovo 1%, ágar 1,5%), de acordo com Price et al26. O ensaio foi realizado a partir da incubação das placas de Petri a 30o C, sendo a leitura conduzida após sete dias. A formação de uma zona branca de precipitação ao redor das colônias indica a produção de fosfolipase. A produção de proteinase foi determinada mediante semeadura dos isolados em meio contendo soro albumina bovina fração V (Sigma), conforme Menezes et al27. Testes positivos foram observados a partir da formação de halos claros ao redor das colônias. Os índices de atividade foram obtidos com base na razão entre o diâmetro da colônia e o diâmetro da colônia adicionado da zona de precipitação (Pz). As atividades fosfolipase e proteinase foram determinadas de acordo com Price et al26: Pz = 1 indica atividade negativa; atividade enzimática positiva quando 0,64 < Pz < 1,0 e atividade enzimática fortemente positiva quando Pz ≤ 0,63. Todos os testes foram realizados em quatro replicatas e a média dos Pz obtida foi descrita como o resultado do teste.
ATIVIDADE HEMOLÍTICA
A produção de fator hemolítico foi avaliada empregando o método descrito por Noumi et al28. O ensaio foi realizado mediante a inoculação de 10 µL de suspensão de leveduras (escala 2 MacFarland) em pontos equidistantes de placas de Petri contendo meio Sabouraud-Sangue (peptona 1%, dextrose 2%, ágar 1,5%, sangue de carneiro 7%). As placas foram incubadas a 37o C em jarra anaeróbica por 48 h. A presença do halo de hemólise ao redor do inóculo indica atividade hemolítica.
PRODUÇÃO DE BIOFILME
A produção de biofilme foi determinada utilizando metodologia em tubos de poliestireno incubados a 37o C por 24 h, como descrito por Christensen et al29. A camada de biofilme aderente, corada com safranina 0,5%, foi descrita como negativo, fracamente positivo (+), moderadamente positivo (++ ou + + +), ou fortemente positivo (+ + + +). Cada tubo foi observado independentemente por dois observadores.
ANÁLISE ESTATÍSTICA
Atividades exoenzimáticas foram comparadas pelo teste Mann-Whitney utilizando software BioEstat versão 5.3. Em todos os testes, p < 0,05 foi considerado como estatisticamente significante.
RESULTADOS
Todos os isolados produziram exoenzimas, porém não produziram fator hemolítico (Tabela 1). Os isolados de C. neoformans produziram os fatores de virulência de maneira mais intensa quando comparado aos resultados produzidos pelos isolados de C. gattii. Os resultados de atividade fosfolipase mostraram que 22% (2/9) dos isolados de C. neoformans foram fortemente positivos, enquanto que 78% (7/9) foram moderadamente positivos. Dos isolados de C. gattii testados, 14% (1/7) foram fortemente positivos para atividade de fosfolipase e 86% (6/7) apresentaram atividade mais discreta. As diferenças na atividade fosfolipase observadas entre isolados de C. neoformans e C. gattii não foram estatisticamente significantes (p = 0,24). Os dados de atividade proteinase mostraram que 33% (3/9) dos isolados de C. neoformans foram fortemente positivos e 67% (6/9) apresentaram-se moderadamente positivos. O perfil de atividade proteinase dos isolados de C. gattii observados mostraram que 14% (1/7) foram fortemente positivos e 86% (6/7) positivos. Os isolados de C. neoformans apresentaram atividade de proteinase extracelular mais intensa que os isolados de C. gattii (p = 0,04).
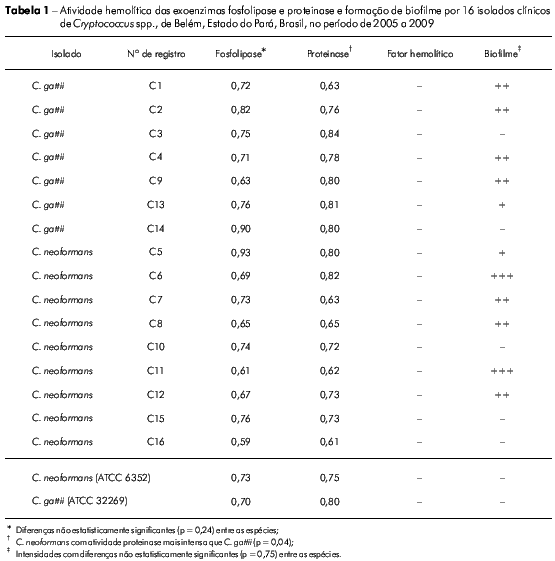
Quanto à produção de biofilme, observou-se uma discreta diferença (não significante (p = 0,75) nos resultados de isolados de C. gatti em relação aos resultados obtidos para isolados de C. neoformans. Negatividade foi observada em 33% (3/9) dos isolados de C. neoformans e 29% (2/7) dos isolados de C. gattii. Atividade fracamente positiva foi produzida por 11% (1/9) dos isolados de C. neoformans e 14% dos isolados de C. gattii.
DISCUSSÃO
O objetivo deste trabalho foi avaliar as atividades exoenzimáticas consideradas importantes fatores de virulência promovidos pelas espécies C. neoformans e C. gattii. Foram realizados ensaios para avaliar a produção proteinase, fosfolipase, fator hemolítico e produção de biofilme.
Neste trabalho, observamos que todos os isolados de C. neoformans e C. gattii analisados foram capazes de produzir exoenzimas in vitro. A produção de exoenzimas foi proposta porque elas constituem importantes fatores para virulência destes microrganismos. C. neoformans, submetido às mesmas condições de cultivo que C. gattii, demonstrou produção de fosfolipase mais acentuada quando comparada à produção demonstrada pelos isolados de C. gattii (p = 0,04). Sabe-se, no entanto, que alguns métodos de avaliação de atividade fosfolipase influenciam a discriminação dos resultados, tais como testes executados com sobrenadante de cultura e soro de pacientes. Chen et al30 observaram atividade fosfolipase positiva para sobrenadante de cultura, mas anticorpos antifosfolipase (PLB1) não foram detectados mediante soro de sete pacientes, baseando-se no teste ELISA. Sugere-se que a enzima é necessária para o estabelecimento do foco de infecção inicial, mas não se apresenta como imunógeno31.
Nos isolados testados, observou-se uma variação na intensidade de produção de proteinase por isolados de C. neoformans e C. gattii. Há algumas divergências nos registros de atividade de proteinase para Cryptococcus spp. Alguns estudos mostram que não há atividade, enquanto outros comprovaram a produção enzimática de proteinase por estas espécies. Staib32 relatou em um estudo com 32 isolados de C. neoformans que não houve nenhuma atividade proteolítica. Chan e Tay33 realizaram estudos de mesma natureza, notando forte ocorrência de atividades enzimáticas para isolados ambientais e clínicos de C. neoformans e C. gattii. A variação na produção da enzima em ensaios in vitro é, provavelmente, consequência de variações nas condições de cultivo; isto, pois estas são enzimas serina-proteases dependentes de Ca++ e Mg++ que apresentam atividade ótima em pH, variando entre 7,5-8,534. Silva et al35 e Pedroso et al36 indicaram que isolados ambientais de C. neoformans, utilizados em experimentação animal, produzem proteinase e fosfolipase antes e depois da inoculação, entretanto esta atividade não influencia nas diferenças de virulência entre os isolados estudados. A produção destes fatores de virulência decorre de estímulos exógenos que influenciam a ativação da expressão gênica durante o curso da infecção37. Portanto, suas atividades são fatores que, em conjunto, favorecem o estabelecimento destes patógenos no organismo do hospedeiro.
Todos os isolados foram incapazes de promover hemólise. Manns et al38 e Luo et al39 indicaram a necessidade de excesso de fontes de carbono durante a obtenção de ferro contido em hemoglobina por Cryptococcus albicans e Cryptococcus tropicalis. Em ensaios conduzidos em C. tropicalis, executou-se a avaliação de atividade hemolítica utilizando hemácias suspensas em tampão apropriado e após incubações pré-definidas, a leitura da densidade ótica foi conduzida para evidenciar a quantidade de fator hemolítico secretado40. Em estudos posteriores, a utilização de ensaios neste formato tornar-se-á útil na elevação da sensibilidade e discriminação da importância deste fator de virulência no curso da criptococose.
A formação de biofilme é um mecanismo comum, utilizado por microrganismos para sobreviver em ambientes hostis, colonizar e estabelecer-se em um novo ambiente, conferindo proteção contra sua eliminação41. Ravi et al42 descreveram melhores condições para a formação de biofilme criptocócico como: 25-37o C, pH neutro e tensão de CO2 ambiente. Em contrapartida, estes autores observaram que, sob condições de baixa tensão de oxigênio, ocorrem principalmente células planctónicas de C. neoformans. No presente estudo, a produção de biofilme foi conduzida de maneira adequada, observando-se diferentes perfis de formação do biofilme criptocócico de acordo com o isolado analisado. De maneira geral, isolados de C. gattii foram capazes de produzir biofilme de maneira mais intensa quando comparados aos isolados de C. neoformans. Estudos têm mostrado que células formadoras de biofilme criptocócico são menos suscetíveis à atividade de antifúngicos (Anfotericina B, caspofungina, fluconazol e voriconazol)22, bem como biomoléculas com ação antimicrobiana produzidas pelo sistema imunológico do hospedeiro21. Um dos possíveis fatores para a diminuída suscetibilidade aos antifúngicos em isolados formadores de biofilme é a produção de uma matriz polimérica extracelular que propicia a coesão entre as células de levedura, dificultando o acesso do fármaco às células do cerne do biofilme43,44. Em biofilmes criptocócicos esta matriz é formada de GlicuronoXiloManana (GXM) e resíduos de açúcares como a glicose, ribose e fucose45. Futuramente, poder-se-á avaliar a suscetibilidade aos antifúngicos de acordo com a estrutura da matriz polimérica extracelular presente no momento da formação do biofilme.
CONCLUSÃO
Embora C. neoformans e C. gattii apresentem diferenças clínicas e terapêuticas, ambas as espécies de levedura se mostraram similares no padrão de virulência, a partir da reunião dos resultados da produção de fosfolipase, proteinase e biofilme. Os papéis das exoenzimas estudadas estão atualmente bem esclarecidos para C. neoformans e C. gattii, sugerindo-nos que os isolados do Estado do Pará apresentam estes fatores como possíveis propriedades que permitam a sobrevivência do patógeno e a colonização do hospedeiro. Adicionalmente, a produção de biofilme por estes isolados foi um importante resultado, principalmente por isolados de C. gattii, reforçando a necessidade de estudos que focalizem na avaliação da formação de biofilme aliada à suscetibilidade aos antifúngicos no Estado do Pará.
REFERÊNCIAS
1 Hajjeh RA, Conn A, Stephens S, Baughman W, Hamill R, Graviss E, et al. Cryptococcosis: population-based multistate active surveillance and risk factors in human immunodeficiency virusinfected persons. J Infect Dis. 1999 Feb;179(2):449-54. DOI: 10.1086/314606 [Link]
2 Dromer F, Mathoulin-pelissier S, Fontanet A, Ronin O, Dupont B, Lortholary O. Epidemiology of HIV-associated cryptococcosis in France (1985-2001): comparison of the pre- and post-HAART eras. AIDS. 2004 Feb;18(3):555-62. [Link]
3 Bennett JE, Kwon-Chung JK, Howard DH. Epidemiologic differences among serotypes of Cryptococcus neoformans. Am J Epidemiol.1977 Jun;105(6):582-6. [Link]
4 Kwon-Chung JK, Bennett JE. Epidemiologic differences between the two varieties of Cryptococcus neoformans. Am J Epidemiol.1984 Jul;120(1):123-30. [Link]
5 Chen S, Sorrell T, Nimmo G, Speed B, Currie B, Ellis D, et al. Epidemiology and host- and variety-dependent characteristics of infection due to Cryptococcus neoformans in Australia and New Zealand. Clin Infect Dis. 2000 Aug;31(2):499-508. DOI: 10.1086/313992. [Link]
6 Georgi A, Schneemann M, Tintelnot K, Calligaris-Maibach RC, Meyer S, Weber R, et al. Cryptococcus gattii meningoencephalitis in an immunocompetent person: 13 months after exposure. Infection. 2009 Aug;37(4):370-3. DOI 10.1007/s15010-008-8211-z [Link]
7 MacDougall L, Kidd SE, Galanis E, Mak S, Leslie MJ, Cieslak PR, et al. Spread of Cryptococcus gattii in British Columbia, Canada, and detection in the Pacific Northwest, USA. Emerg Infect Dis. 2007 Jan;13(1):42-50. DOI: 10.3201/eid1301.060827 [Link]
8 Cabral Passoni LF. Wood, animals and human beings as reservoirs for human Cryptococcus neoformans infection. Rev Iberoam Micol. 1999 Jun;16(2):77-81. [Link]
9 Costa SPSE, Lazéra MS, Santos WRA, Morales BP, Bezerra CCF, Nishikawa MM, et al. First isolation of Cryptococcus gattii molecular type VGII and Cryptococcus neoformans molecular type VNI from environmental sources in the City of Belém, Pará, Brazil. Mem Inst Oswaldo Cruz. 2009 Jul;104(4):662-4. DOI: http://dx.doi.org/10.1590/S0074-02762009000400023 [Link ]
10 Meyer W, Marszewska K, Amirmostofian M, Igreja RP, Hardtke C, Methling K, et al. Molecular typing of global isolates of Cryptococcus neoformans var. neoformans by polymerase chain reaction fingerprinting and randomly amplified polymorphic DNA — a pilot study to standardize techniques on which to base a detailed epidemiological survey. Electrophoresis. 1999 Jun;20(8):1790-9. DOI: 10.1002/(SICI)1522-2683(19990101)20:8<1790::AID-ELPS1790>3.0.CO;2-2 [Link]
11 Meyer W, Castañeda A, Jackson S, Huynh M, Castañeda E. Molecular typing of IberoAmerican Cryptococcus neoformans isolates. Emerg Infect Dis. 2003 Feb;9(2):189-95. DOI: 10.3201/eid0902.020246 [Link]
12 Kwon-Chung JK, Varma A. Do major species concepts support one, two or more species within Cryptococcus neoformans? FEMS Yeast Res. 2006 Jun;6(4):574-87. DOI: 10.1111/j.1567-1364.2006.00088.x [Link]
13 Corrêa MPSC, Oliveira EC, Duarte RRBS, Pardal PPO, Oliveira FM, Severo LC. Criptococose em crianças no Estado do Pará, Brasil. Rev Soc Bras Med Trop. 1999 set-out;32(5):505-8. DOI: http://dx.doi.org/10.1590/S0037-86821999000500006 [Link ]
14 Santos WRA, Meyer W, Wanke B, Costa SPSE, Trilles L, Nascimento JLM. Primary endemic Cryptococcosis gattii by molecular type VGII in the state of Pará, Brazil. Mem Inst Oswaldo Cruz. 2008 Dec;103(8)13-8.
15 Trilles L, Lazéra MS, Wanke B, Oliveira RV, Barbosa GG, Nishikawa MM, et al. Regional pattern of the molecular types of Cryptococcus neoformans and Cryptococcus gattii in Brazil. Mem Inst Oswaldo Cruz. 2008 Aug;103(5):455-62. [Link]
16 Perfect JR, Casadevall A. Cryptococcosis. Infect Dis Clin North Am. 2002 Dec;16(4):837-74. [Link]
17 Buchanan KL, Murphy JW. What makes Cryptococcus neoformans a pathogen? Emerg Infect Dis.1998 Jan-Mar;4(1):71-83. [Link]
18 Santangelo RT, Nouri-Sorkhabi MH, Sorrell TC, Cagney M, Chen SC, Kuchel PW, et al. Biochemical and functional characterisation of secreted phospholipase activities from Cryptococcus neoformans in their naturally occurring state. J Med Microbiol. 1999 Aug;48(8):731-40. [Link]
19 Campos FL, Baroni FA. Isolados de Cryptococcus neoformans, C. gattii e C. laurentii produtores de protease e fosfolipase. Rev Patol Tropic. 2010 abr-jun;39(2):83-9.
20 Coutinho G. Fatores de virulência e resistência a antifúngicos de amostras clínicas e ambientais de Cryptococcus neoformans [dissertação]. São Paulo (SP): Secretaria da Saúde, Coordenadoria de Controle de Doenças; 2006. [Link ]
21 Martinez LR, Casadevall A. Cryptococcus neoformans cells in biofilms are less susceptible than planktonic cells to antimicrobial molecules produced by the innate immune system. Infect Immun. 2006 Nov;74(11):6118-23. DOI: 10.1128/IAI.00995-06 [Link]
22 Martinez LR, Casadevall A. Susceptibility of Cryptococcus neoformans biofilms to antifungal agents in vitro. Antimicrob Agents Chemother. 2006 Mar;50(3):1021-33. DOI: 10.1128/AAC.50.3.1021-1033.2006 [Link]
23 Walsh TJ, Schlegel R, Moody MM, Costerton JW, Salcman M. Ventriculoatrial shunt infection due to Cryptococcus neoformans: an ultrastructural and quantitative microbiological study. Neurosurgery. 1986 Mar;18(3):373-5. [Link]
24 Watanabe T, Takano M, Murakami M, Tanaka H, Matsuhisa A, Nakao N, et al. Characterization of a haemolytic factor from Candida albicans. Microbiology. 1999 Mar;145(Pt 3):689-94. [Link]
25 Silveira-Gomes F, Sarmento DN, Espírito Santo EPT, Marques-da-Silva SH. Quimiotipagem e caracterização fenotípica de Cryptococcus isolados em Belém, Estado do Pará, Brasil. Rev Pan-Amaz Saude. 2010 out-dez;1(4):43-9. [Link ]
26 Price MF, Wilkinson ID, Gentry LO. Plate method for detection of phospholipase activity in Candida albicans. Sabouraudia. 1982 Mar;20(1):7-14. [Link]
27 Menezes EA, Cavalcante MS, Farias RB, Teixeira AB, Pinheiro FG, Bezerra BP, et al. Freqüência e atividade enzimática de Candida albicans isoladas da mucosa bucal de crianças de uma creche da prefeitura de Fortaleza. J Bras Patol Med Lab. 2005 fev;41(1):9-13. DOI: http://dx.doi.org/10.1590/S1676-24442005000100004 [Link]
28 Noumi E, Snoussi M, Hentati H, Mahdouani K, del Castillo L, Valentin E, et al. Adhesive properties and hydrolytic enzymes of oral Candida albicans strains. Mycopathologia. 2010 Apr;169(4):269-78. DOI: 10.1007/s11046-009-9259-8 [Link]
29 Christensen GD, Simpson WA, Bisno AL, Beachey EH. Adherence of slime-producing strains of Staphylococcus epidermidis to smooth surfaces. Infect Immun. 1982 Jul;37(1):318-26. [Link]
30 Chen SCA, Wright LC, Golding JC, Sorrell TC. Purification and characterization of secretory phospholipase B, lysophospholipase and lysophospholipase/transacylase from a virulent strain of the pathogenic fungus Cryptococcus neoformans. Biochem J. 2000 Apr;347(Pt 2):431-9. [Link]
31 Chayakulkeeree M, Perfect JR. Cryptococcosis. Infect Dis Clin North Am. 2006 Sep;20(3):507-44. [Link]
32 Staib F. Das Verhalten von Candida albicans- und Cryptococcus neoformans-Stämmen gegenüber human-serum-proteinen. Mycopathol Mycol Appl. 1965 Aug;26(2):209-24.
33 Chan MY, Tay ST. Enzymatic characterisation of clinical isolates of Cryptococcus neoformans, Cryptococcus gattii and other environmental Cryptococcus spp. Mycoses. 2010 Jan;53(1):26-31. DOI: 10.1111/j.1439-0507.2008.01654.x [ Link]
34 Aoki S, Ito-Kuwa S, Nakamura K, Kato J, Ninomiya K, Vidotto V. Extracellular proteolytic activity of Cryptococcus neoformans. Mycopathologia. 1994 Dec;128(3):143-50. [Link]
35 Silva EG, Baroni FA, Viani FC, Ruiz LS, Gandra RF, Auler ME, et al. Virulence profile of strains of Cryptococcus neoformans var. grubii evaluated by experimental infection in BALB/c mice and correlation with exoenzyme activity. J Med Microbiol. 2006 Feb;55(Pt 2):139-42. [Link]
36 Pedroso RS, Lavrador MAS, Ferreira JC, Candido RC, Maffei CML. Cryptococcus neoformans var. grubii - pathogenicity of environmental isolates correlated to virulence factors, susceptibility to fluconazole and molecular profile. Mem Inst Oswaldo Cruz. 2010 Dec;105(8):993-1000. [Link ]
37 Baroni FA. Ocorrência de Cryptococcus neoformans em excretas de pombos localizados em torres de igrejas na Cidade do Rio de Janeiro: fatores de virulência e sensibilidade aos antifúngicos [tese]. São Paulo (SP): Universidade de São Paulo; 2001.
38 Manns JM, Mosser DM, Buckley HR. Production of a hemolytic factor by Candida albicans. Infect Immun. 1994 Nov;62(11):5154-6. [Link]
39 Luo G, Samaranayake LP, Yau JYY. Candida species exhibit differential in vitro hemolytic activities. J Clin Microbiol. 2001 Aug;39(8):2971-4. DOI: 10.1128/JCM.39.8.2971-2974.2001 [Link]
40 Favero D, Franca EJG, Furlaneto-Maia L, Quesada RMB, Furlaneto MC. Production of haemolytic factor by clinical isolates of Candida tropicalis. Mycoses. 2011 Nov;54(6):e816-20. DOI: 10.1111/j.1439-0507.2011.02035.x [Link]
41 Hall-Stoodley L, Costerton JW, Stoodley P. Bacterial biofilms: from the natural environment to infectious diseases. Nat Rev Microbiol. 2004 Feb;2(2):95-108. DOI:10.1038/nrmicro821 [Link]
42 Ravi S, Pierce C, Witt C, Wormley Jr. FL. Biofilm formation by Cryptococcus neoformans under distinct environmental conditions. Mycopathologia. 2009 Jun;167(6):307-14. DOI: 10.1007/s11046-008-9180-6 [Link ]
43 Mah TF, O'Toole GA. Mechanisms of biofilm resistance to antimicrobial agents. Trends Microbiol. 2001 Jan;9(1):34-9. [Link ]
44 Di Bonaventura G, Pompilio A, Picciani C, lezzi M, D'Antonio D, Piccolomini R. Biofilm formation by the emerging fungal pathogen Trichosporon asahii: development, architecture, and antifungal resistance. Antimicrob Agents Chemother. 2006 Oct;50(10):3269-76. [Link]
45 Martinez LR, Casadevall A. Cryptococcus neoformans biofilm formation depends on surface support and carbon source and reduces fungal cell susceptibility to heat, cold, and UV light. Appl Environ Microbiol. 2007 Jul;73(14):4592-601. DOI: 10.1128/AEM.02506-06 [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Fabíola Silveira Gomes
Universidade Federal do Pará
Av. Augusto Correa, 1. Bairro: Guamá
CEP: 66075-110
Belém-Pará-Brasil
Tel:.+ 55 (91) 3201-8412
E-mail: fabiolasilveiragomes@hotmail.com
Recebido em / Received / Recibido en: 3/8/2012
Aceito em / Accepted / Aceito en: 28/11/2012













