Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.3 n.3 Ananindeua set. 2012
http://dx.doi.org/10.5123/S2176-62232012000300004
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Análise preliminar do uso mesclado de neoglicolipídeos derivados do PGL-1 do Mycobacterium leprae: antígeno dissacarídeo (ND-O-BSA) e trissacarídeo (NT-P-BSA) como forma de aumentar a sensibilidade do teste ELISA anti-PGL-1
Preliminary analysis of the mixed use of derivated neoglycolipids of PGL-1 of Mycobacterium leprae: antigen disaccharide (ND-O-BSA) and trisaccharide (NT-P-BSA) as a way to increase the sensitivity of ELISA anti-PGL-1 test
Análisis preliminar del uso mezclado de neoglucolípidos derivados del PGL-1 de Mycobacterium leprae: antígeno disacárido (ND-O-BSA) y trisacárido (NT-P-BSA) como forma de aumentar la sensibilidad de la prueba ELISA anti-PGL-1
Maria do Perpétuo Socorro Amador Silvestre
Laboratório de Hanseníase, Seção de Bacteriologia e Micologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
Mesmo a hanseníase sendo uma doença milenar, ainda não foi possível o desenvolvimento de um teste diagnóstico considerado padrão-ouro em virtude da impossibilidade de se cultivar o agente in vitro. Os testes diagnósticos existentes, até o momento, não estão disponíveis na atenção básica, fato que, em geral, dificulta a classificação correta dos casos mais sutis e impossibilita o diagnóstico precoce, o que poderia contribuir para a quebra da cadeia de transmissão da doença. Assim sendo, por meio de um estudo experimental com amostra selecionada por conveniência, o objetivo deste trabalho foi analisar o uso adicionado dos antígenos semissintéticos derivados do glicolipídeo fenólico - 1 (PGL-1) do Mycobacterium leprae como estratégia para aumentar a sensibilidade do teste ELISA anti-PGL-1 utilizado como instrumento discriminatório entre pacientes classificados clínica e bacteriologicamente como multibacilares, paucibacilares e contatos, comparando-se o desempenho do teste ELISA anti-PGL-1 e fazendo uso dos antígenos mesclados comparados ao antígeno trissacáride isoladamente. Os resultados demonstraram níveis de anticorpos anti-PGL-1 mais elevados para os antígenos mesclados comparados ao antígeno trissacáride isoladamente, o que pode destacar a eficácia do teste ELISA como auxiliar no diagnóstico e classificação da hanseníase.
Palavras-chave: Hanseníase; Técnicas Imunoenzimáticas; Diagnóstico; Epidemiologia.
ABSTRACT
Although leprosy is an ancient disease, it has not been possible yet to develop a diagnostic test considered the gold standard because of the inability to cultivate the in vitro agent. The current diagnostic tests, so far, are not available in primary care, in general, it is a fact that complicates the correct classification of subtle cases and makes early diagnosis impossible, which could help to break the chain of disease transmission. Thus, by means of an experimental study using convenience sampling, the aim of this study was to analyze the added use of semisynthetic derivatives of phenolic glycolipid antigens - 1 (PGL-1) of Mycobacterium leprae as a strategy to increase the sensitivity of ELISA anti-PGL-1 used as a discriminatory instrument by clinical and bacteriological patients classified as multibacillary and paucibacillary and contacts, comparing the performance of the ELISA anti-PGL-1 and making use of mixed antigens compared to trisaccharide antigen. The results demonstrated anti-PGL-1 antibody levels higher for the mixed antigens compared to the trisaccharide antigen individually, which can highlight the effectiveness of ELISA test as a helper in diagnosis and classification of leprosy.
Keywords: Leprosy; Immunoenzyme Techniques; Diagnosis; Epidemiology.
RESUMEN
Aunque la hanseníasis sea una enfermedad milenaria, aún no ha sido posible desarrollar una prueba diagnóstica considerada estándar de oro en virtud de la imposibilidad de cultivar el agente in vitro. Las pruebas diagnósticas existentes, hasta el presente, no están disponibles en la atención básica, hecho que, en general, dificulta la clasificación correcta de los casos más sutiles e imposibilita el diagnóstico precoz, lo que podría contribuir a la ruptura de la cadena de transmisión de la enfermedad. Siendo así, a través de un estudio experimental con muestra seleccionada por conveniencia, el objetivo de este trabajo fue el de analizar el uso agregado de los antígenos semi-sintéticos derivados del glucolípido fenólico - 1 (PGL-1) del Mycobacterium leprae como estrategia para aumentar la sensibilidad de la prueba ELISA anti-PGL-1 utilizada como instrumento discriminatorio entre pacientes clasificados clínica y bacteriológicamente como multibacilares, paucibacilares y contactos, comparando el desempeño de la prueba ELISA anti-PGL-1 y usando los antígenos mezclados comparados al antígeno trisacárido aisladamente. Los resultados demostraron niveles de anticuerpos anti-PGL-1 más elevados para los antígenos mezclados comparados con el antígeno trisacárido aisladamente, lo que puede reforzar la eficacia de la prueba ELISA como auxiliar al diagnóstico y a la clasificación de la hanseníasis.
Palabras clave: Lepra; Técnicas para Inmunoenzimas; Diagnóstico; Epidemiología.
INTRODUÇÃO
A hanseníase ainda é endêmica na Amazônia brasileira e existem focos de transmissão ativa da doença na Amazônia Legal1,2,3 e em municípios do Estado do Pará, localizados ao sul e sudeste, principalmente. O diagnóstico é eminentemente clínico em função da ausência, até o momento presente, de um teste laboratorial sensível e específico4,5,6,7,8,9, características suficientes para justificar seu uso no diagnóstico da doença.
Na operacionalização do programa da hanseníase dentro dos serviços de saúde nem sempre estão disponíveis métodos laboratoriais padrão considerados auxiliares ao diagnóstico desta enfermidade, tais como a baciloscopia do esfregaço cutâneo, os testes cutâneos prognósticos (histamina, Mitsuda e pilocarpina) ou ainda, o exame histopatológico da mácula ou lesão de pele e, desta forma, o diagnóstico é feito exclusivamente baseado em dados clínicos e epidemiológicos. E comum e possível que esta lacuna corrobore para erros de diagnóstico ou de classificação10,11,12,13.
Baseados nos aspectos supracitados, é possível que o teste sorológico, tanto pelo método de leitura rápida (Ml Flow) ou mesmo o IgM-enzimaimunoensaio (ELISA) pudessem vir a ser instrumentos valiosos, não somente para auxiliar ao diagnóstico, mas principalmente na classificação correta da hanseníase, o que evitaria o excesso ou falta de tratamento específico5,6,7,10.
As técnicas em biologia molecular, reação em cadeia da polimerase (PCR), polimorfismo de fragmento de restrição (PCR-RFLP) e reação em cadeia da polimerase via transcriptase reversa (RT-PCR), embora apresentem melhor sensibilidade em relação às técnicas imunológicas (sorologia e cultura de células com antígenos específicos) também apresentam dificuldades na detecção de pacientes paucibacilares, os quais possuem baixa carga bacteriana, o que refletirá de forma importante na sensibilidade do teste, pois se forem utilizadas amostras de swab nasal ou sangue total, além dos cuidados relacionados à coleta, preservação e acondicionamento adequado da amostra, o resultado pode expressar dados inconclusivos, observáveis também em indivíduos sadios residentes em áreas endêmicas, fato que compromete a sensibilidade e adequação dos testes14,15,16.
Além disso, pacientes com hanseníase dimorfa e virchowiana serão facilmente diagnosticados por dados clínicos, baciloscópicos e sorológicos, não havendo necessidade das técnicas na biologia molecular, as quais são caras e dependem da existência de laboratório equipado e profissionais técnicos muito bem treinados, condições estas incompatíveis às encontradas na atenção básica dos serviços de saúde10,11,12,13.
É fato que testes de fácil execução e reagentes estáveis parecem ser uma opção ideal para uso em condições de campo em países endêmicos, pois são simples, rápidos, de baixo custo e não necessitam de capacitação demorada ou estrutura laboratorial para serem executados e/ou interpretados; há a necessidade somente de estratégias para aumentar a sensibilidade desses testes10,11,12,13.
Desta forma, este estudo teve como objetivo avaliar o uso mesclado dos antígenos derivados do glicolipídeo fenólico 1 (PGL-1) do Mycobacterium leprae como estratégia para aumentar a sensibilidade do teste ELISA anti-PGL-1 para o diagnóstico da hanseníase.
A pesquisa com o uso mesclado dos antígenos derivados do PGL-1 do M. leprae é um subprojeto de um projeto mais abrangente, aprovado em 9 de novembro de 2011 pelo Comitê de Ética em Pesquisa do Instituto Evandro Chagas, protocolo CEP/IEC/CAAE 0013.0072-000.
MATERIAIS E MÉTODOS
SELEÇÃO DOS PACIENTES
Pacientes previamente diagnosticados pelo staff das secretarias municipais de saúde do Estado do Pará e do Setor de Atendimento Médico Unificado do Instituto Evandro Chagas foram encaminhados à equipe do Laboratório de Hanseníase para procedimento padronizado: assinatura do termo de consentimento livre e esclarecido, exame clínico dermatoneurológico, teste de sensibilidade cutâneo e coleta de sangue de uma veia periférica após antissepsia com álcool a 70%.
Os indivíduos da amostra foram divididos em pacientes com hanseníase multibacilar (MB), pacientes paucibacilares (PB) e contatos (C), considerados o grupo controle de área endêmica, os quais foram avaliados para os antígenos trissacáride (NT-P-BSA) e dissacáride (ND-O-BSA) misturados e para o antígeno trissacáride, isoladamente. Os antígenos misturados (MIX) foram adicionados antes de serem diluídos nas respectivas soluções tampão, conforme descrito abaixo, e o antígeno trissacarídeo (NT-P-BSA) foi diluído conforme preconizado anteriormente por Bührer et al10.
COBERTURA DAS PLACAS - TÉCNICA DE MESCLAGEM DOS ANTÍGENOS
Placas NUNC 96 poços em "U" (poliestireno) foram cobertas com antígeno semissintético análogo ao PGL-1, dissacarídeo natural ligado a um radical octyl e a uma soroalbumina bovina - ND-O-BSA 0,1 mg/mL ou 100 µg/mL adicionado (mesclado) ao análogo trissacáride natural, ligado a um radical fenol e a uma soroalbumina bovina - NT-P-BSA 100 µg/mL ou 0,1 mg/mL.
ND-O-BSA
Previamente diluído com 100 µL de água Milli-Q puríssima estéril. Então, diluído na solução tampão de cobertura usando-se carbonato hidrogenado de amônio - (NH4) HCO3 0,1 M da seguinte forma:
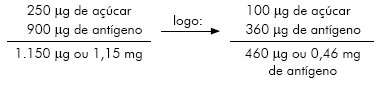
O quadro 1 mostra como se obter uma concentração do antígeno de 0,02 utilizada nos trabalhos de Bührer et al10, para uma diluição de 1:500 (Quadro 1).

NT-P-BSA
Previamente diluído com 100 µL de água Milli-Q puríssima estéril. Então, diluído na solução tampão de cobertura usando-se carbonato hidrogenado de amônio - (NH4) HCO3 0,1 M da seguinte forma:
Partindo do princípio que para produção do análogo semissintético trissacáride do PGL-1 em relação à composição da porção proteica e do antígeno, tem-se o antígeno constituído de:

Para se obter uma concentração de 0,01 µg de antígeno utilizada nos trabalhos de Bührer et al10,12, é necessária uma diluição de 1:10.000, conforme o quadro 2.

Antes de diluir o antígeno na solução tampão em sua respectiva concentração ótimo, adicionou-se 10 µL de ND-O-BSA + 5 µl de NT-P-BSA, então, realizou-se a diluição em suas respectivas soluções tampão = 5 mL + 50 mL = 55 mL de tampão de cobertura.
Para se cobrir uma placa, necessita-se de 2,4 mL de antígeno e/ou tampão, já que se adicionou 50 µL de antígeno por poço nas linhas A, C, E e G e tampão nas linhas B, D, F e H, logo, para 55 mL pode-se cobrir 23 placas de acordo com o que se segue abaixo:
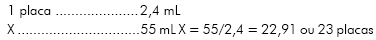
Preparo da solução tampão para diluição dos antígenos ND e NT. 15.812 g de (NH4) HCO3 em 2 L de água Milli-Q pH = 8,0
Ao se retirar 10 µL de ND-O-BSA e 5 µL de NT-P-BSA, partindo do total de 100 µL, restaram 90 µL de ND-O-BSA e 95 µL de NT-P-BSA para cobertura do restante das placas para uso posterior.
REALIZAÇÃO DOS TESTES ELISA
A pesquisa de anticorpos da classe IgM contra PGL-1 do M. leprae foi realizada por meio de ELISA padrão, utilizando-se antígeno semissintético, porção terminal trissacáride imunogênica da cadeia do PGL-1, denominado pela sigla NT-P-BSA (liofolizado 100 µg/mL), eluído com 100 µL de água Milli-Q, na concentração de 1:10.000 (concentração do antígeno: 0,01 µg de açúcar/mL), mesclado com antígeno ND-O-BSA na concentração de 0,02. Após diluição inicial dos antígenos, os mesmos foram mesclados e diluídos em suas respectivas concentrações e diluídos na solução tampão de carbonato hidrogenado de amônio (NH4) HCO3 - 15.812 g de (NH4) HCO3 em 2 L de água Milli-Q. As placas NUNC 96 poços em "U" foram sensibilizadas com 50 µL de antígeno nas linhas A, C, E, G e com 50 µL do tampão nas linhas B, D, F e H, as quais foram utilizadas para medir os níveis de anticorpos IgM anti-PGL-1 em amostras de soro. Por padronização prévia (Bührer et al10), considera-se resultado positivo, as amostras que atingirem uma densidade ótica (DO) na leitura da placa ao espectrofotômetro maior ou igual a 0,2.
As placas após secas e com a realização do ensaio ELISA, tiveram excelente desempenho. O próximo passo será analisar a sensibilidade/especificidade das placas equipadas com os antígenos misturados e separados em amostra significativa de doentes e sadios.
RESULTADOS
A amostra constou com um total de 30 indivíduos, dos quais dez pacientes foram classificados como MB (10/30 = 33,33%) e dez pacientes PB (10/30 = 33,33%) e dez C (10/30 = 33,33%) de área endêmica. A média dos níveis de anticorpos IgM contra PGL-1 do M. leprae entre pacientes MB para o antígeno MIX foi 0,270, maior que para o antígeno NT neste grupo, 0,1912. A média dos níveis de anticorpos para os pacientes PB para o antígeno MIX foi de 0,0134, maior que para o antígeno NT, 0,006.
Foram 17 indivíduos do sexo masculino (17/30 = 56,66%) e 13 do sexo feminino (13/30 = 43,33%). A média de idade entre os homens foi de 44,88 e entre as mulheres foi de 32,46. Os níveis de anticorpos IgM para PGL-1 entre as mulheres mostrou média de 0,102 e 0,079 para os antígenos MIX e NT-P-BSA respectivamente, semelhante ao observado entre os homens, 0,102 e 0,063 respectivamente para os antígenos MIX e NT-P-BSA.
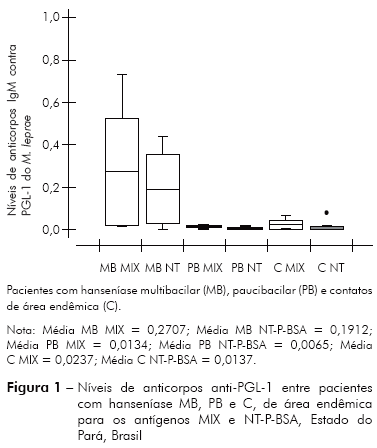
Análise de variância (ANOVA - dois critérios) mostrou-se significativa para a assertiva de que os níveis de anticorpos IgM contra PGL-1 do M. leprae são mais elevados para o antígeno MIX comparado ao antígeno NT-P-BSA, o qual mostrou F (tratamentos), aplicação dos antígenos = 9,2878 e p-valor = 0,000028 e F (blocos), os grupos MB, PB e C = 2,1453 e p-valor = 0,04452. O teste de Krustal-Wallis mostrou H = 34,7223 e p-valor < 0,0001 (Figura 1).
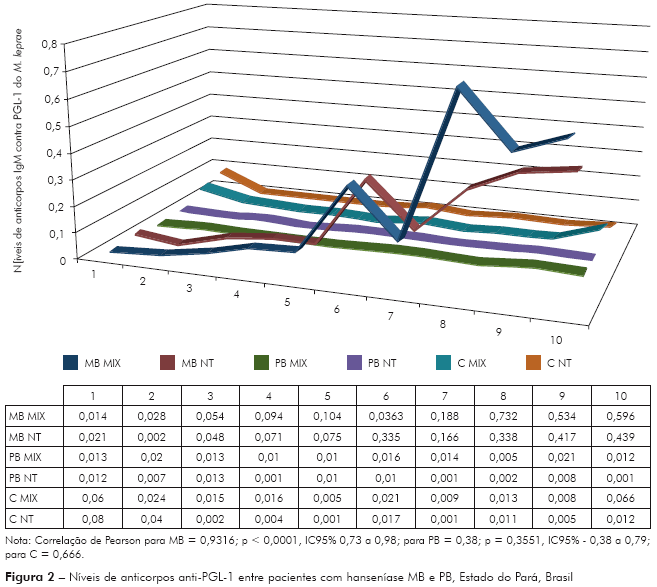
A correlação realizada entre o desempenho dos antígenos MIX e trissacarídeo entre pacientes com hanseníase MB e PB é mostrada na figura 2.
DISCUSSÃO
A ausência de um teste laboratorial sensível e específico para o diagnóstico da hanseníase tem sido uma lacuna para o acesso aos pacientes com sintomatologia sutil e mais difíceis de serem diagnosticados de forma precoce pelos métodos disponíveis na atualidade3,4,5,6.
Na década de 1980, quando Hunter e Brennan8 caracterizaram o maior antígeno de parede celular do M. leprae, o PGL-1, tornou-se possível estudos relacionados à imunidade humoral entre pacientes com hanseníase MB. Posteriormente com o advento da síntese de novos glicolipídeos, especialmente a porção terminal imunogênica do PGL-1, as porções dissacáride (ND-O-BSA) e trissacáride (NT-P-BSA) para uso em teste ELISA, houve um avanço quanto à sensibilidade/especificidade do ensaio com PGL-117,18,19,20,21, porém a resposta predominantemente humoral em alguns indivíduos aparentemente sadios, residentes em áreas endêmicas, sugere infecção subclínica com M. leprae e diminui a sensibilidade do teste, visto que nas regiões endêmicas existe um número significativo de pessoas infectadas sem sinais clínicos compatíveis com a hanseníase22,23,24,25.
Este estudo avaliou de forma preliminar o uso mesclado (concomitante) dos glicolipídeos sintéticos análogo ao PGL-1 do M. leprae, o antígeno dissacarídeo (ND-O-BSA) adicionado ao antígeno trissacarídeo (NT-P-BSA). O resultado demonstrou ótimo desempenho dos antígenos mesclados, aqui denominado de MIX, comparado ao antígeno trissacáride, isoladamente. Os níveis de anticorpos foram significativamente mais elevados para o antígeno MIX comparado ao NT-P-BSA (p = 0,000338) (Figura 1). Não foi objeto deste estudo a análise da sensibilidade/especificidade do teste ELISA anti-PGL-1 para o antígeno MIX comparado ao dissacaríde e/ou trissacáride, estudo a ser realizado posteriormente, em função de que o mesmo requer tamanho amostral maior e requer a participação de um grupo controle.
Estudos a respeito do desempenho dos antígenos sintéticos dissacarídeo e trissacarídeo demonstraram excelente correlação entre os níveis de anticorpos IgM anti-PGL-1 entre pacientes com hanseníase MB e PB13,20. Porém, o estudo de Chanteau et al20 mostrou que o antígeno trissacarídeo apresentou-se mais sensível e específico para o diagnóstico da forma PB. Tal fato sugere que em áreas não endêmicas, onde este estudo foi realizado, na Polinésia Francesa, por não existir número significativo de indivíduos infectados pelo M. leprae, o antígeno trissacarídeo apresenta-se mais sensível por alcançar mais doentes do que sadios.
A correlação encontrada entre os níveis de anticorpos IgM contra PGL-1 do M. leprae para os antígenos MIX e NT-P-BSA em pacientes com hanseníase MB foi excelente (r de Pearson = 0,9316, p-valor < 0,0001), ainda que se tenha observado níveis mais elevados para o antígeno MIX comparado ao NT-P-BSA (Figura 2), porém, nesta amostra, a correlação entre os níveis de anticorpos IgM contra PGL-1 do M. leprae entre pacientes PB não foi significativa (r de Pearson = 0,38; p = 0,3551, IC95% - 0,38 a 0,79) (Figura 2), entretanto outros estudos mostraram boa correlação entre os níveis de anticorpos IgM contra PGL-1 do M. leprae para os antígenos dissacáride, trissacáride, monossacáride ou PGL-1 nativo, entre pacientes MB e PB9,20,26.
CONCLUSÃO
Este estudo mostra a possibilidade de se aumentar a sensibilidade do teste ELISA anti-PGL-1 com o antígeno MIX (ND-O-BSA adicionado ao NT-P-BSA), porém é necessário realizar estudo soroepidemiológico com amostragem significativa para confirmação desta hipótese preliminar.
REFERÊNCIAS
1 Penna MLF, Oliveira WDR, Penna G. Spatial distribution of leprosy in the amazon region of Brazil. Emerg Infect Dis. 2009 Apr;15(4):650-2. Doi: 10.3201/eid1504.081378 [Link]
2 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Situação epidemiológica da hanseníase no Brasil, 2008 [Internet]. Brasília: Ministério da Saúde; 2008 [citado 2012 jan 15]. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/vigilancia_saude_situacao_hanseniase.pdf.
3 Geluk A, Klein M, Franken LMC, Van Meijgarden KE, Wieles B, Pereira KC, et al. Postgenomic approach to identify novel Mycobacterium leprae antigens with potential to improve immunodiagnosis of infection. Infect Immun. 2005 Sep;73(9):5636-44. Doi: 10.1128/IAI.73.9.5636-5644.2005 [Link]
4 Spencer JS, Dockrell HM, Kim HJ, Marques MA, Williams DL, Martins MV, et al. Identification of specific proteins and peptides in Mycobacterium leprae suitable for the selective. J Immunol. 2005 Dec;175(12):7930-8. Doi: 10.4049/jimmunol.175.12.7930 [Link]
5 Bührer-Sekula S, Sarno EN, Oskam L, Koop S, Wichers I, Nery JA, et al. Use of Ml dipstick leprosy patients. Int J Lepr Other Mycobact Dis. 2000 Dec;68(4):456-63.[Link]
6 Bührer-Sekula S, Cunha MGS, Ferreira WA, Klatser PR. The use of whole blood in a dipstick assay for detection of antibodies to Mycobcaterium leprae: a field evaluation. FEMS Immunol Med Microbiol. 1998 Jul;21(3):197-201. Doi: 10.1111/j.1574-695X.1998.tb01166.x [Link]
7 Bührer-Sekula S, Smits HL, Gussenhoven GC, Van Leeuwen J, Amador S, Fujiwara T, et al. Simple and fast lateral flow test for the classification of leprosy patients and identification of contacts with high risk of developing leprosy. J Clin Microbiol. 2003 May;41(5):1991-5. Doi: 10.1128/JCM.41.5.1991-1995.2003 [Link]
8 Hunter SW, Brennan PJ. A novel phenolic glycolipid from Mycobcaterium leprae possibly involved in immunogenicity and pathogenicity. J Bacteriol. 1981 Sep;147(3):728-35. [Link]
9 Wu QX, Ye GY, Li XY. Serological activity of natural disaccharide octyl bovine serum albumin (ND-O-BSA) in sera from patients with leprosy, tuberculosis, and normal controls. Int J Lep. 1988 Jan-Mar;56(1):50-5. [Link]
10 Bührer S. A simple dipstick assay for the detection of antibodies to phenolic Glycolipid 1 of Mycobacterium leprae [thesis]. Amsterdam (NL): Royal Tropical Institute; 1998.
11 Opromolla DVA, editor. Noções de hansenologia. Bauru: Centro de Estudos Dr. Reynaldo Quagliato; 2000. p. 101-15. [Link]
12 Cacilda SS. Hanseníase: formas clínicas e diagnóstico diferencial. Med Ribeirao Preto. 1997 jul-set;30(3):325-34. Doi: 10.11606/issn.2176-7262.v30i3p325-334 [Link]
13 Organização Mundial da Saúde. Estratégia global aprimorada para redução adicional da carga da hanseníase, 2011-2015: diretrizes operacionais atualizadas. Brasília: Organização Pan-Americana da Saúde; 2010. [Link]
14 Francheschi DSA, Sacramento WS, Mazini PS, Laguila JE. Hanseníase no mundo moderno: o que sabemos sobre a influência genética do hospedeiro no seu controle? Arq Med. 2009 ago;23(4):159-65. [Link]
15 Hirata MH, Tavares V, Hirata RDC. Da biologia molecular à medicina: métodos comumente utilizados em farmacogenética. Med Ribeirao Preto. 2006 out-dez;39(4):522-34. Doi: 10.11606/issn.2176-7262.v39i4p522-534 [Link]
16 Pontes ARB, Almeida MGC, Xavier MB, Quaresma JAS, Yassui EA. Detecção de DNA de Mycobacterium leprae em secreção nasal. Rev Bras Enferm. 2008 nov;61 Esp:734-7. [Link]
17 Cho SN, Kim SH, Cellona RV, Chan GP Fajardo TT, Walsh GP et al. Prevalence of IgM antibodies to phenolic glycolipid I among household contacts and controls in Korea and the Philipppines. Lepr Rev. 1992 Mar;63(1):12-20. [Link]
18 Bührer-Sekula S, Sarno EN, Oskam L, Koop S, Wichers I, Nery JA, et al. Use ML dipstick as a tool to classify leprosy patients. Int J Lepr Other Mycobact Dis. 2000 Dec;68(4):456-63. [Link]
19 Hunter SN, Fujiwara T, Brennan PJ. Structure and antigenicity of the major specific glycolipid antigen of Mycobacterium leprae. J Biol Chem. 1982 Dec;257(24):15072-8. [Link]
20 Chanteau S, Cartel JL, Roux J, Plichart R, Bach MA. Comparison of synthetic antigens for detecting antibodies to phenolic glycolipid. J Infect Dis. 1988 Apr;157(4):770-6. Doi: 10.1093/infdis/157.4.770 [Link]
21 Cho SN, Yanagihara DL, Hunter SW, Gelber RH, Brennan PJ. Serological specificity of phenolic glycolipid i from Mycobacterium leprae and use in serodiagnosis of leprosy. Infect Immun. 1983 Sep;41(3):1077-83. [Link]
22 Oskan L, Slim E, Bührer-Sekula S. Serology: recent developments, strengths, limitations and prospects: a state of the art overview. Lepr Rev. 2003 Sep;74(3):196-205. [Link]
23 Klatser PR, Cho SN, Brennan PJ. The contribution of serological tests to leprosy control. In: International Workshop on Leprosy Research, Bangkok, Thailand; 1996 Mar 11-13; Washington: International Leprosy Association, 1996. (International Journal of Leprosy and Other Mycobacterial Diseases; 1996 Dec; vol. 64, no. 4 Supp 1:S63-6). [Link]
24 Brasil MTRF, Oliveira LR, Melo CS, Nakamura PM, Rimolo NS, Cavalari-F S, et al. Aplicação do teste ELISA anti-PGL-1 em localidade com alta endemicidade de hanseníase na Região Norte do Estado de São Paulo. Hans Int. 1998;23(2):35-48. [Link]
25 Fuiiworo T, Hunter SW, Cho SN, Aspinall GO, Brennan PJ. Chemical synthesis and serology of disaccharides and trisaccharides of phenolic glycolipid antigen form the leprosy bacillus and preparation of a disaccharide protein coniugate for serodiagnosis of leprosy. Infect Immun. 1984 Jan;43(1):245-52. [Link]
26 Chujor SN, Bemheimer H, Lewis WR, Schwerer B. Serum IgA, and IgM antibodies against Mycbacterium leprae-derived phenolic glycolipid-I: a comparative study in leprosy patients and their contacts. Int J Lepr Other Mycobact Dis. 1991 Sep;59(3):441-9. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Maria do Perpétuo Socorro Amador Silvestre
Seção de Bacteriologia e Micologia,
Instituto Evandro Chagas/SVS/MS
Rodovia BR 316, km 7, s/n°. Bairro: Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
Tel.: +55 (91) 3214-2121
E-mail: socorroamador@iec.pa.gov.br
Recebido em / Received / Recibido en: 14/2/2012
Aceito em / Accepted / Aceito en: 17/7/2012













