Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.3 n.4 Ananindeua dez. 2012
http://dx.doi.org/10.5123/S2176-62232012000400001
ARTIGO ORIGINAL | ORIGINAL ARTICLE| ARTÍCULO ORIGINAL
Sensibilidade do teste ELISA anti-PGL-1 com dois antígenos sintéticos derivados do PGL-1 do Mycobacterium leprae
Sensitivity of ELISA anti-PGL-1 test with two derived synthetic antigens of PGL-1 of Mycobacterium leprae
Sensibilidad de la prueba ELISA anti-PGL-1 con dos antígenos sintéticos derivados del PGL-1 del Mycobacterium leprae
Maria do Perpétuo Socorro Amador Silvestre; André Brandão de Araújo; Gláucia Ferreira Barreto
Laboratório de Hanseníase, Seção de Bacteriologia e Micologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
O diagnóstico da hanseníase é eminentemente clínico, porém a identificação do principal antígeno de parede celular do Mycobacterium leprae, o glicolipídeo fenólico 1 (PGL-1), contribuiu para estudos sobre a imunidade humoral na hanseníase. Este estudo experimental avaliou a sensibilidade do teste ELISA anti-PGL-1 utilizando-se dois glicolipídeos semisintéticos, dissacarídeo (ND-O-BSA) e trissacarídeo (NT-P-BSA) como instrumento potencial auxiliar para o diagnóstico da hanseníase. A sensibilidade/especificidade aos antígenos trissacarídeo e dissacarídeo foi, respectivamente, 97% e 98% e 83,3% e 96,1% comparando-se pacientes com hanseníase multibacilar (MB) e contatos consanguíneos (CCOS) mais contatos não consanguíneos (CNCOS). O antígeno trissacarídeo (NT-P-BSA) apresentou melhor desempenho no diagnóstico dos pacientes com hanseníase MB (p < 0,0001) comparado ao antígeno dissacáride (ND-O-BSA), o qual mostrou ser mais adequado para o diagnóstico de pacientes com hanseníase paucibacilar - PB (sensibilidade PB x CCOS = 80%). Além disso, o antígeno trissacarídeo mostrou-se mais adequado para vigilância epidemiológica de CNCOS (X2 = 12.979, p = 0,0003). Em regiões endêmicas, o uso dos dois antígenos na sorologia da hanseníase é útil na análise de aspectos soroepidemiológicos relevantes para o diagnóstico e vigilância da hanseníase.
Palavras-chave: Hanseníase; Antígenos; Ensaio de Imunoadsorção Enzimática; Diagnóstico.
ABSTRACT
The diagnosis of leprosy is mainly clinical, but the identification of the main antigen of Mycobacterium leprae cell wall, phenolic glycolipid 1 (PGL-1), contributed to studies about humoral immunity in leprosy. This experimental study evaluated the sensitivity of ELISA anti-PGL-1 test using two semisynthetic glycolipids, disaccharide (ND-O-BSA) and trisaccharide (NT-P-BSA) as a potential tool for assisting the diagnosis of leprosy. The sensitivity/specificity to trisaccharide and disaccharide antigens was 97% and 98% and 83.3% respectively and 96.1% comparing patients with multibacillary leprosy (MB), consanguineous contacts (CCOS) and non-consanguineous (NCCOS). The trisaccharide antigen (NT-P-BSA) had a better development in the diagnosis with MB leprosy patients (p < 0.0001) compared to disaccharide antigen (ND-O-BSA), which was more suitable for the diagnosis of leprosy in paucibacillary patients - PB (PB x CCOS sensitivity = 80%). Besides that, the trisaccharide antigen was more suitable in the epidemiological surveillance CNCOS (X2 = 12,979, p = 0.0003). In endemic regions, the use of two antigens in the serology of leprosy is helpful in analyzing serum-epidemiological aspects that are important to the diagnosis and monitoring of leprosy.
Keywords: Leprosy; Antigens; Enzyme-Linked Immunosorbent Assay; Diagnosis.
RESUMEN
El diagnóstico de la lepra es eminentemente clínico, sin embargo, la identificación del principal antígeno de pared celular del Mycobacterium leprae, el glicolípido fenólico 1 (PGL-1) ha contribuido para estudios sobre la inmunidad humoral en la lepra. Este estudio experimental evaluó la sensibilidad de la prueba ELISA anti-PGL-1 utilizando dos glicolípidos semi-sintéticos, disacárido (ND-O-BSA) y trisacárido (NT-P-BSA) como instrumento potencial auxiliar al diagnóstico de la lepra. La sensibilidad/especificidad a los antígenos trisacárido y disacárido fue, respectivamente, 97,0% y 98,0% y 83,3% y 96,1% comparándose con pacientes con lepra multibacilar (MB) y contactos consanguíneos (CCOS) más contactos no consanguíneos (CNCOS). El antígeno trisacárido (NT-P-BSA) obtuvo un mejor desempeño en el diagnóstico de los pacientes con lepra MB (p < 0,0001) comparado al antígeno disacárido (ND-O-BSA), el que se mostró más adecuado para el diagnóstico de pacientes con lepra paucibacilar - PB (sensibilidad PB x CCOS = 80%). Además, el antígeno trisacárido se mostró más adecuado para la vigilancia epidemiológica de CNCOS (X2 = 12.979, p = 0,0003). En regiones endémicas, el uso de los dos antígenos en la serología de la lepra es útil en el análisis de aspectos seroepidemiológicos relevantes para el diagnóstico y la vigilancia de la lepra.
Palabras clave: Lepra; Antígenos; Ensayo de Inmunoadsorción Enzimática; Diagnóstico.
INTRODUÇÃO
Hanseníase é doença milenar, causada pelo bacilo de Hansen, descoberto por Gerard Henrick Amauer Hansen em 1873. O diagnóstico da hanseníase é clínico. Entretanto, diversas técnicas laboratoriais têm sido propostas com objetivo de auxiliar no diagnóstico e classificar corretamente casos novos da doença para fins terapêuticos1.
Na década de 1980 foi identificado o antígeno principal espécie-específico do Mycobacterium leprae, altamente imunogênico, denominado de glicolipídeo fenólico 1 (PGL-1). Desde que esse antígeno foi isolado e bem caracterizado, novos glicolipídeos foram produzidos com objetivo de se estabelecerem estudos da imunidade humoral na hanseníase. Estes antígenos são: a) monossacarídeo octil-BSA (M-O-BSA); b) dissacarídeo-BSA (D-BSA); c) dissacarídeo natural octil-BSA (ND-O-BSA); d) trissacarídeo natural fenol-BSA (NT-P-BSA) e, mais recentemente, o dissacarídeo natural octil-HSA (ND-O-HSA)2,3.
Vários ensaios sorológicos foram desenvolvidos baseados no PGL-1 nativo e seus derivados semissintéticos, no sentido de pesquisar anticorpos das classes IgM, IgA e IgG com aplicações no campo clínico e epidemiológico. As técnicas mais utilizadas incluem: ensaio imunoenzimático (ELISA) e o teste imunocromatográfico de leitura rápida em 10 min - Ml Flow3,4,5,6,7,8,9.
O teste ELISA é uma técnica que exige estrutura laboratorial e pessoal treinado para sua realização, interpretação dos resultados e correlação com dados clínicos e epidemiológicos. Entretanto, o teste do fluxo lateral de leitura em 10 min (Ml Flow), o qual possui excelente concordância com o teste ELISA (85,9%, kappa = 70), é simples de ser executado, não necessita de pessoal treinado ou estrutura laboratorial, e é rápido e adequado para utilização em trabalhos de campo10,11,12,13,14.
Embora o teste rápido, ou mesmo o ELISA, utilizando o antígeno PGL-1, tenha maior sensibilidade para o diagnóstico de pacientes com hanseníase multibacilar (MB) em virtude de avaliar a imunidade humoral, já se cogita a possibilidade de sensibilizar o teste Ml Flow com peptídeos e proteínas específicas do Mycobacterium leprae, as quais estimulam a produção de INFץ pelas células T(CD4), e essa possibilidade é promissora para aumentar significativamente a sensibilidade do teste para o diagnóstico da hanseníase MB e paucibacilar (PB). Parece óbvia a necessidade de se pensar em coletar sangue total com anticoagulante e estimular as células T(CD4) com os referidos peptídeos e proteínas específicas para, posteriormente, testar o sobrenadante na tira de nitrocelulose do teste Ml Flow15,16,17.
A utilização de anticorpos monoclonais mostrou que a remoção do resíduo terminal da estrutura química do PGL-1 ocasiona a perda da ligação com a maioria dos anticorpos, comprovando que a síntese química do último dissacarídeo representa o epítopo antigênico específico a ser aplicado na sorologia para hanseníase2,3,4,5,11.
Metas importantes estabelecidas pelo Ministério da Saúde para eliminação da hanseníase no Brasil são o diagnóstico precoce e a vigilância epidemiológica por meio do exame periódico de contatos, para que se tenha certo controle sobre focos de transmissão ativa da hanseníase em áreas endêmicas. Considerando a falta de um teste sensível e específico para o diagnóstico da hanseníase, é importante que seja possível utilizar os instrumentos disponíveis para viabilizar o diagnóstico precoce por meio do exame dos familiares de pacientes com hanseníase e, consequentemente, a descoberta de casos o mais precocemente possível, o que possibilita a quebra da cadeia de transmissão da doença em nosso meio18,19,20.
Poucos artigos publicados avaliaram de forma comparativa o desempenho dos dois principais glicolipídeos semisintéticos do PGL-1, dissacáride (ND-O-BSA) e trissacáride (NT-P-BSA). Desta forma, este trabalho tem como objetivo avaliar o desempenho do teste ELISA anti-PGL-1 utilizando dois glicolipídeos semissintéticos como instrumento potencial auxiliar ao diagnóstico da hanseníase e classificação dos casos diagnosticados em MB e PB.
MATERIAIS E MÉTODOS
POPULAÇÃO
A amostra total deste estudo constou de 179 indivíduos, sendo 107 do sexo feminino (107/179 = 58,8%), com média de idade de 37,40 anos e 72 do sexo masculino (72/179 = 40,2%), com média de idade de 38,15 anos. Os indivíduos foram classificados nas seguintes categorias: a) contatos consanguíneos (CCOS), indivíduos que possuíam caso de hanseníase na família e conviveram mais de cinco anos com esta pessoa; b) contatos não consanguíneos (CNCOS), indivíduos que não possuíam nenhum caso de hanseníase na família; c) pacientes com hanseníase MB, pacientes com sinais e/ou sintomas compatíveis com as formas dimorfa ou virchowiana; d) pacientes com hanseníase PB, pacientes com sinais e/ou sintomas compatíveis com as formas indeterminada (I) e tuberculoide (T) virgens de tratamento ou com até três meses de tratamento poliquimioterápico, recentemente diagnosticados e notificados por médicos das Secretarias Municipais de Saúde (SMS) de Breu Branco, Cametá e Curionópolis, ao sudeste do Estado do Pará e encaminhados à equipe do Instituto Evandro Chagas (IEC). Projeto aprovado pelo Comitê de Ética em Pesquisa do IEC, Protocolo CEP/IEC/CAAE 0013.0072000-09 de 11/2011.
PROCEDIMENTOS
Os indivíduos do estudo foram divididos em: a) 30 pacientes MB (30/179 = 16,8%); b) 40 pacientes PB (40/179 = 22,3%); c) 51 CCOS (51/179 = 28,5%) e d) 58 CNCOS (59/179 = 32,4%), os quais foram examinados clinicamente e submetidos ao teste de sensibilidade cutânea em presença de máculas, manchas e lesões e/ou áreas hipoestésicas na pele, pela equipe do IEC e, após assinatura do Termo de Consentimento Livre e esclarecido, foram submetidos à coleta do material biológico, o qual foi centrifugado e acondicionado em tubos KMA, devidamente rotulados e congelados em nitrogênio líquido até a realização dos testes ELISA. Após o exame físico dermatoneurológico, foi preenchida a ficha epidemiológica padrão e estabelecida a classificação do indivíduo nos grupos citados.
O total de 179 amostras séricas foi submetido ao teste ELISA para pesquisar anticorpos da classe IgM contra PGL-1 do M. leprae utilizando-se separadamente os antígenos dissacáride (ND-O-BSA) e trissacáride (NT-P-BSA), conforme protocolo ligeiramente modificado, estabelecido pelo Laboratório de Hanseníase do IEC e o protocolo previamente estabelecido pelos estudos de Bührer-Sékula6.
De forma breve descrevemos o protocolo utilizado para uso do antígeno ND-O-BSA: o antígeno ND-O-BSA (25 µg/mL, 0,0041 µg/ mL) gentilmente cedido pela dr.a Cristina Pessolani (FIOCRUZ), foi diluído com 25 µL de água Milli-Q esterilizada. Diluiu-se então 25 µL do antígeno em concentração de 1:4.000, em 100 mL de solução de carbonato/bicarbonato previamente preparada, pH = 9,61. Adicionou-se 100 µL do antígeno nas linhas A, C, E e G da placa de poliestireno de 96 poços de fundo chato e 100 µL da solução tampão nas linhas B, D, F e G. As placas (Nunc-Immunoplates - Life Technologies, Tasstrup, Denmark) foram incubadas overnight a 4°C por 24 h. Após essa incubação foram lavadas três vezes com 200 µL de solução tampão - PBST (Phosphate Buffer solution Tween-20), a 0,1% e bloqueadas com BSA 1% em tampão PBST por 1 h e 30 min a 37° C. Adicionou-se 50 µL de soro diluído com PBST a 10% NGS (1:300), ou seja, para cada 1,5 mL de PBST a 10% de NGS adicionou-se 5 µL de soro a ser analisado. As placas foram incubadas a 37°C por 2 h. Após lavagem com PBST três vezes adicionou-se 50 µL do conjugado anti-IgM-Peroxidadse (Cappel) previamente diluído (1:2.000) - para cada 10 mL de PBST a 10% de NGS acrescentou-se 5 µL do conjugado e adicionou-se 50 µL em toda a placa e, após incubação por 1 h a 37° C, as placas foram novamente lavadas com 200 µL de PBST quatro vezes, sendo bem enxugadas em papel toalha para procedimento de leitura, quando adicionou-se o substrato - TMB (Invitrogen), 50 µL, em toda a placa. A reação foi parada com 50 µL de ácido sulfúrico a 2,5 N e a intensidade da coloração foi determinada por meio da leitura da placa em 450/492 nm em leitor de ELISA. As placas foram incubadas em temperatura ambiente e no escuro por aproximadamente 30 min. Dependendo do substrato, este tempo varia bastante. A reação foi parada com a adição de 50 µL da solução de ácido sulfúrico 2,5 N de H2SO4 no soro padrão apresentou absorbância de 450 nm. Amostras consideradas positivas apresentaram média de absorbância ≥ 0,2 e as negativas ≤ 0,2.
ANÁLISE ESTATÍSTICA
Realizada com os software Epi-Info 2000 e BioStat 5.021. Foram feitas análises univariadas (frequências) das variáveis: idade, sexo, classificação, BCG, positividade ao antígeno tri e dissacáride; análises bivariadas (tabelas) das variáveis: positividade x classificação (para os dois antígenos) e cálculo da razão de chances para pacientes MB x CCOC + CNCOS, pacientes PB x CCOS + CNCOS. Com a variável numérica "níveis de anticorpos IgM anti-PGL-1 di e trissacáride" foi feita análise pela Curva ROC da sensibilidade/especificidade e ponto de corte entre pacientes MB, PB e CCOS e CNCOS.
RESULTADOS
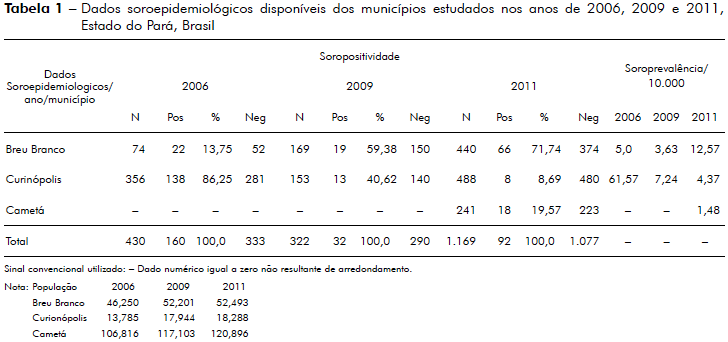
A tabela 1 mostra dados soroepidemiológicos, disponíveis em banco de dados do IEC, dos municípios estudados, usando-se a sorologia para pesquisa de anticorpos IgM contra PGL-1 do M. leprae pelo método ELISA, nos anos de 2006, 2009 e 2011.
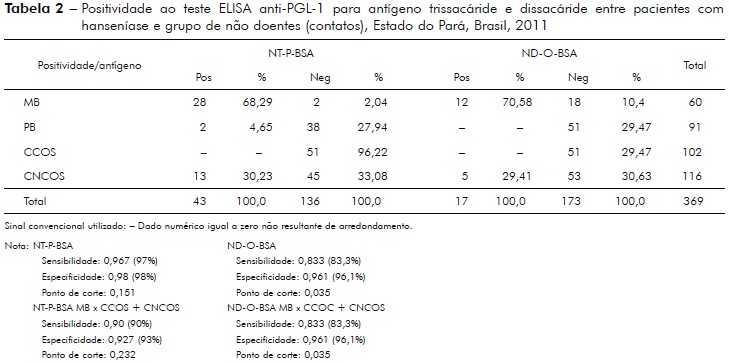
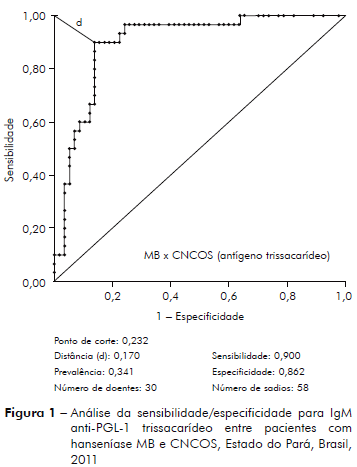
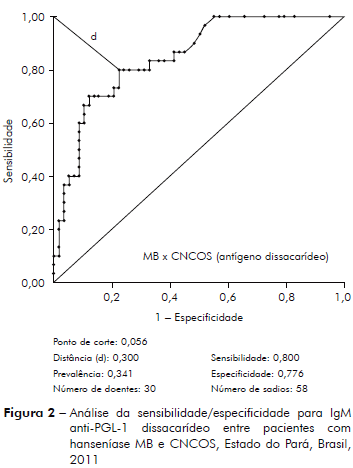
Análise da sensibilidade/especificidade ao teste anti-PGL-1, pelo método da Curva ROC, utilizando-se antígeno semi-sintético trissacáride (NT-P-BSA) e dissacáride (ND-O-BSA) entre pacientes MB comparados aos indivíduos sadios, CCOS é mostrada na tabela 2.
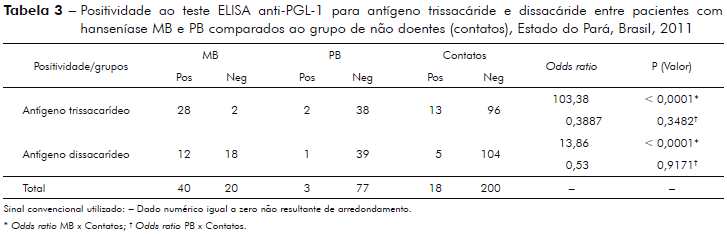
A tabela 3 mostra análise da efetividade do teste ELISA anti-PGL-1 comparando-se o desempenho do teste com uso do antígeno di e trissacáride entre pacientes com hanseníase MB e PB e os indivíduos classificados como contatos de pacientes consanguíneos (CCOS) e não consaguíneos (CNCOS).
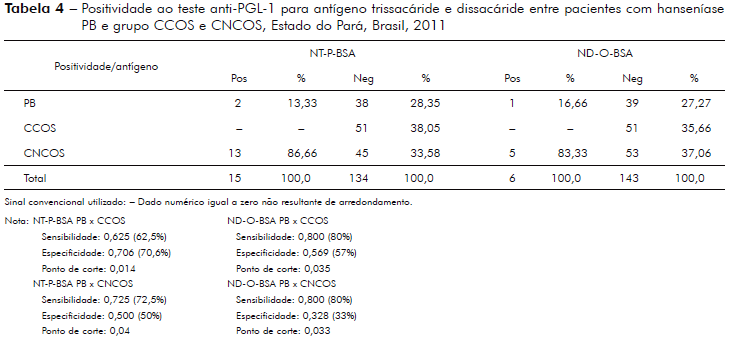
A positividade para o antígeno trissacáride e dissacáride entre pacientes com hanseníase PB e o grupo de indivíduos classificados como CCOS e pacientes PB x CNCOS, bem como o cálculo da sensibilidade/especificidade e ponto de corte pelo método da probabilidade condicional/ponto de corte Ayres et al21 é demonstrado na tabela 4.
As figuras 1 e 2 apresentam a sensibilidade/especificidade para IgM dirigidos contra PGL-1 do M. leprae para os antígenos NT e ND entre pacientes MB e CNCOS, comparando-se o desempenho dos dois antígenos.
DISCUSSÃO
Observou-se, neste estudo e com esta amostra, que o antígeno semissintético derivado do PGL-1 do M. leprae, dissacarídeo natural, apresentou melhor desempenho para o diagnóstico de pacientes com hanseníase PB, formas I e T, comparados aos pacientes MB, formas D e V (sensibilidade ao antígeno trissacáride para PB x CCOS = 80%) tabela 4. O antígeno trissacáride, por outro lado, apresentou melhor desempenho no diagnóstico e classificação dos pacientes com hanseníase MB comparados aos pacientes PB para o antígeno dissacarídeo (OR - MB x contatos = 103,38, p < 0,0001, IC95% 22,00 ≤ µ ≤ 485,68 e OR - PB x contatos = 0,387, p = 0,3482, IC95% - 0,0837 ≤ µ ≤ 1,804) tabela 3. Estudos que realizaram esta comparação10,11,12,13,14 são concordantes com o fato de que o antígeno dissacarídeo é mais específico e sensível que os outros antígenos, tais como: WML (Whole Mycobacterium leprae), a proteína total, o antígeno trissacarídeo natural e até o próprio PGL-1 nativo13,14,15,16,17.
Entretanto, o estudo de Chanteau et al16 encontrou que o antígeno trissacarídeo é mais sensível para o diagnóstico da hanseníase PB, ao contrário deste estudo, que observou que o antígeno dissacarídeo é que se apresentou mais sensível ao diagnóstico da hanseníase PB. E importante ressaltar que o estudo em questão foi realizado em área de baixa endemicidade, a Polinésia Francesa, e tal fato sugere que o desempenho do antígeno trissacarídeo é melhor para o diagnóstico dos pacientes PB em virtude de não haver proporção significativa de indivíduos clinicamente sadios infectados com o M. leprae, os quais seriam positivos à sorologia, reduzindo, desta forma a sensibilidade dele, diferente das regiões hiperendêmicas5,6,7,8,9,22,23,24,25, pois, nessas regiões, a proporção de indivíduos clinicamente sadios infectados é normalmente alta3,4,5,6,7,26.
Os antígenos trissacarídeo e dissacarídeo possuem melhor desempenho para o diagnóstico dos pacientes MB comparados aos pacientes PB; a correlação dos níveis de anticorpos anti-PGL-1 é positiva na análise dos pacientes MB para os dois antígenos (p < 0,0001; tabela 3, figuras 1 e 2); ao contrário, a correlação dos níveis de anticorpos contra PGL-1 entre pacientes PB para os dois antígenos é negativa (p = 0,6750; tabela 3). Os estudos da imunidade humoral na hanseníase, em sua maioria observam sensibilidade de 90 a 100% para o diagnóstico da hanseníase MB e de 40 a 60% para o diagnóstico da hanseníase PB3,4,5,6,7.
Por outro lado, o antígeno trissacarídeo parece ser mais adequado para a vigilância epidemiológica de CNCOS infectados com M. leprae, positivos ao anti-PGL-1, porém sem sinais clínicos compatíveis com hanseníase, comparados aos CCOS (X2 = 12.979; p = 0,0003). Associação mais fraca foi observada para o antígeno dissacarídeo, de acordo com a mesma comparação supracitada (X2 = 4.608; p = 0,03). Do ponto de vista epidemiológico, os CCOS podem ser classificados como contatos intradomiciliares e os CNCOS, como contatos extradomiciliares ou comunitários; em regiões consideradas hiperendêmicas observa-se, entre os CNCOS, maior proporção de indivíduos infectados, sem sinais clínicos, positivos ao teste anti-PGL-1, fato que sugere que a transmissão da hanseníase é difusa e ocorre mais na comunidade do que no interior do domicílio3,4,5,6,7.
A taxa de soropositividade ao teste IgM-ELISA anti-PGL-1 entre contatos de pacientes com hanseníase, nesta amostra, foi 16,51% (18/109); entre CNCOS ou extradomiciliares, para o antígeno trissacarídeo foi 22,41% (13/58) e para o dissacarídeo foi 8,62% (5/58). Entre os CCOS ou intradomiciliares para o antígeno trissacáride foi 0% (0/51) e para o dissacáride foi 9,8% (5/51). A proporção de soropositividade entre contatos intradomiciliares de pacientes com hanseníase é variável de acordo com o grau de endemicidade da região estudada; Silva et al24 observaram 6,9% de soropositividade para IgM-ELISA entre contatos intradomiciliares; Ferreira e Antunes25 encontraram 19,7% entre contatos intradomiciliares em área endêmica; Barreto et al26 encontraram 39% de soropositividade entre contatos intradomiciliares com PGL-1 nativo em área hiperendêmica; Bührer-Sékula et al6 encontraram 28,6% de soropositividade ao teste de leitura rápida Ml Flow com antígeno trissacarídeo em área hiperendêmica na Amazônia.
Neste estudo, observou-se que o antígeno trissacarídeo apresenta melhor desempenho na identificação de contatos de pacientes com hanseníase com maior risco de adoecimento por hanseníase comparado ao dissacarídeo, 22,41% e 8,62%, respectivamente (Tabela 2). A positividade geral entre contatos (CCOS + CNCOS) foi 16,51% (18/109), semelhante às taxas encontradas em outros estudos22,23,24,25,26.
A especificidade da sorologia anti-PGL-1 observada por Oskam et al13 foi de 98%, exatamente igual a especificidade encontrada neste estudo (Tabela 2), na comparação entre pacientes MB e CCOS.
CONCLUSÃO
Os resultados encontrados neste estudo sugerem que o antígeno sintético dissacáride derivado do PGL-1 do M. leprae parece ter melhor desempenho para o diagnóstico dos pacientes classificados como PB (formas I e T) comparados aos pacientes MB (sensibilidade trissacáride PB x CCOS = 62,5%; sensibilidade dissacáride P x CCOS = 80%). Por outro lado, o antígeno trissacáride (NT-P-BSA) parece ter melhor desempenho no diagnóstico e classificação dos pacientes MB (formas D e V) comparados aos PB (OR MB x contatos = 103,38, p < 0,0001, IC95% - 22,0 ≤ µ ≤ 485,68 e OR PB x contatos = 0,387, p = 0,3482, IC95% - 0,0837 ≤ µ ≤ 1,8046).
O antígeno trissacáride desempenha melhor a vigilância epidemiológica dos indivíduos clinicamente sadios classificados como CNCOS, porém infectados, ou seja, positivos para PGL-1 comparado ao antígeno dissacáride. A utilização dos dois antígenos é importante para validar métodos sorológicos mais adequados às características soroepidemiológicas das regiões a serem estudadas.
REFERÊNCIAS
1 World Heath Organization. Leprosy update. Wkly Epidemiol Rec. 2011 Sep;86(36):389-400. [Link]
2 Hunter SN, Fujiwara T, Brennan PJ. Structure and antigenicity of the major specific glycolipid antigen of Mycobacterium leprae. J Biol Chem. 1982 Dec;257(24):15072-8. [Link]
3 Bührer-Sékula S. Sorologia PGL-1 na hanseníase. Rev Soc Bras Med Trop. 2008;41 supl 2:3-5. Doi: 10.1590/S0037-86822008000700002 [Link]
4 Buhrer-Sékula S. A simple dipstick assay for the detection of antibodies to phenolic Glycolipid 1 of Mycobacterium leprae [thesis]. Amsterdam (NL): Royal Tropical Institute; 1998. 123 p.
5 Bührer-Sékula S, Cunha MG, Foss NT, Oskan L, Faber WR, Klatser PR. Dipstick assay to identify leprosy patients who an increased risk of relapses. Trop Med Int Health. 2001 Apr;6(4):317-23. Doi: 10.1046/j.1365-3156.2001.00704.x [Link]
6 Bührer-Sékula S, Smits HL, Gussenhoven GC, van Leeuwen J, Amador S, Fujiwara T, et al. Simple and fast lateral Flow test for the classification of leprosy patients and identification of contacts with high risk of developing leprosy. J Clin Microbiol. 2003 May;41(5):1991-5. Doi: 10.1128/JCM.41.5.1991-1995.2003 [Link]
7 Bührer-Sékula S, Cunha MGS, Ferreira WA, Klatser PR. The use of whole blood in a dipstick assay for detection of antibodies to Mycobcaterium leprae: a field evaluation. FEMS Immunol Med Microbiol. 2006 Jul;21(3):197-201. Doi: 10.1111/j.1574-695X.1998.tb01166.x [Link]
8 Spencer JS, Dockrell HM, Kim HJ, Marques MAM, Williams DL, Martins MVSB, et al. Identification of specific proteins and peptides in Mycobacterium leprae suitable for the selective diagnosis of leprosy. J Immunol. 2005 Dec;175(12):7930-8. Doi: 10.4049/jimmunol.175.12.7930 [Link]
9 Sampaio LH, Stefani MMA, Oliveira RM, Sousa ALM, Ireton GC, et al. Immunologically reactive M. leprae antigens with relevance to diagnosis and vaccine development. BMC Infect Dis. 2011 Jan;11(26):1-11. Doi:10.1186/1471-2334-11-26 [Link]
10 Bùhrer-Sekula S, Sarno EN, Oskan L, Koop S, Wichers I, Nery JA, et al. Use of ML dipstick as a tool to classify leprosy patients. Int J Lepr Mycobact Dis. 2000 Dec;68(4):456-63. [Link]
11 Klatser PR, Cho SN, Brennan PJ. The contribution of serological tests to leprosy control. Int J Lepr Other Mycobact Dis. 1996 Dec;64(4 Suppl 1):S63-6.
12 Brasil MTLRF, Oliveira LR, Melo CS, Nakamura PM, Rimolo NS, Oliveira MB, et al. Aplicação do teste ELISA anti-PGL-1 em localidade com alta endemicidade de hanseníase na região Norte do estado de São Paulo. Hans Int. 1998;23(2):35-8. [Link]
13 Oskan L, Slim E, Bùhrer-Sekula SS. Serology recent developments, strengths, limitations and prospects: a state of the art overview. Lepr Rev. 2003 Sep;74(3):196-205. [Link]
14 Soebono H, Klatser PR. A seroepidemiological study of leprosy in high- and low-endemic Indonesian Villages. Int J Lepr Other Mycobact Dis. 1991 Sep;59(3):416-25. [Link]
15 Wu QX, Ye GY, Li XY. Serological activity of natural disaccharide octyl bovine serum albumin (ND-O-BSA) in sera from patients with leprosy, tuberculosis, and normal controls. Int J Lepr. 1988 Mar;56(1):50-5. [Link]
16 Chanteau S, Cartel JL, Roux J, Plichart R, Bach MA. Comparison of synthetic antigens for detecting antibodies to phenolic glycolipid. J Infect Dis. 1988 Apr;157(4):770-6. Doi: 10.1093/infdis/157.4.770 [Link]
17 Hunter SW, Brennan PJ. A novel phenolic glycolipid from Mycobacterium leprae possibly involved in immunogenicity and pathogenicity. J Bacteriol. 1981 Sep;147(3):728-35. [Link]
18 Penna MLF, Oliveira WDR, Penna G. Spatial distribuition of leprosy in the Amazon Region of Brazil. Emerg Infect Dis. 2009 Apr;15(4):650-2. Doi: 10.3201/eid1504.081378 [Link]
19 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Vigilância em saúde: situação epidemiológica da hanseníase no Brasil, 2008. Brasília: Ministério da Saúde; 2008. [Link]
20 Geluk A, Klein M, Franken LMC, van Meijgaarden KE, Wieles B, Pereira KC, et al. Postgenomic approach to identify novel Mycobacterium leprae antigens with potential to improve immunodiagnosis of infection. Infect Immun. 2005 Sep;73(9):5636-44. Doi: 10.1128/IAI.73.9.5636-5644.2005 [Link]
21 Ayres SM, Ayres Jr M, Ayres DL, Santos AA. BioEstat: aplicações e estatísticas nas áreas das ciências biomédicas. 5. ed. Belém: Sociedade Civil Mamirauá; 2007. 324 p. [Link]
22 Cho SN, Donna LY, Hunter SW, Gelber RH, Brennan PJ. Serological specificity of phenolic glycolipid i from Mycobacterium leprae and use in serodiagnosis of leprosy. Infect Immun. 1983 Sep;41(3):1077-83. [Link]
23 Brett SJ, Payne SN, Gigg J, Burgess P, Gigg R. Use of synthetic glycoconjugates containing the Mycobacterium leprae specific and immunodominant epitope of phenolic glycolipid 1 in the serology of leprosy. Clin Exp Immunol. 1986 Jun;64(3):476-83. [Link]
24 Silva RC, Lyon S, Araos R, Lyon AC, Grossi MAF, Lyon SH, et al. Comportamento dos testes sorológicos ML Flow e ELISA (PGL-1) em áreas endêmica e não endêmica de hanseníase. Rev Soc Bras Med Trop. 2008;41 supl 2:19-22. Doi: 10.1590/S0037-86822008000700005 [Link]
25 Ferreira MAA, Antunes CMF. Fatores associados à soropositividade de teste ML Flow em pacientes e contatos de pacientes com hanseníase menores de 18 anos. Rev Soc Bras Med Trop. 2008;41 suppl 2:60-6. Doi: 10.1590/S0037-86822008000700013 [Link]
26 Barreto JG, Guimarães LS, Leão MR, Ferreira DVG, Lima RAA, Salgado CG. Anti-PGL-1 seroepidemiology in leprosy cases: household contacts and school children from a hyperendemic municipality of the Brazilian Amazon. Lepr Rev. 2011 Dec;82(4):358-70. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Maria do Perpétuo Socorro Amador Silvestre
Instituto Evandro Chagas
Rodovia BR 316, km 7, s/n. Bairro: Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
Tel.: + 55 (91) 3214-2121
E-mail: socorroamador@iec.pa.gov.br
Recebido em / Received / Recibido en: 9/3/2012
Aceito em / Accepted / Aceito en: 10/8/2012













