Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.4 n.2 Ananindeua jun. 2013
http://dx.doi.org/10.5123/S2176-62232013000200003
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Imunorreatividade das células dendríticas nas lesões foveolares da hanseníase dimorfa
Immunoreactivity of dendritic cells in foveolar lesions in borderline leprosy
Inmunorreactividad de las células dendríticas en las lesiones foveolares de la hanseniasis dimorfa
Gabriel Izan Santos BotelhoI; Tinara Leila de Souza AarãoII; Luís Paulo Miranda Araújo SoaresI; Beatriz Santos BotelhoI; Denise da Silva PintoII; Hellen Thais FuziiII; Juarez Antônio Simões QuaresmaIII; Francisca Regina Oliveira CarneiroI
ICentro de Ciências Biológicas e da Saúde, Universidade do Estado do Pará, Belém, Pará, Brasil
IILaboratório de Imunopatologia do Núcleo de Medicina Tropical da Universidade Federal do Pará, Belém, Pará, Brasil
IIICentro de Ciências Biológicas e da Saúde, Universidade do Estado do Pará, Belém, Pará, Brasil. Laboratório de Imunopatologia do Núcleo de Medicina Tropical da Universidade Federal do Pará, Belém, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
A hanseníase é uma doença infecto-contagiosa cujo agente etiológico é o Mycobacterium leprae, sendo caracterizada predominantemente por lesões dermatológicas e neurológicas. As formas de hanseníase tuberculoide e virchowiana são denominadas polares e consideradas estáveis. Entre esses polos, existe a forma dimorfa, caracterizada por uma instabilidade imunológica em que as manifestações clínicas são variáveis. Esta forma apresenta uma lesão com área de pele sã circundada por área infiltrada, nomeada de lesão foveolar. O objetivo deste estudo foi analisar o padrão imunorreativo das células dendríticas na área de pele aparentemente sã da região central e da borda infiltrada da lesão foveolar na hanseníase dimorfa. Trata-se de um estudo transversal e analítico. Utilizaram-se os marcadores CD1a e FXIIIa para a contagem das células dendríticas nas amostras de pele. Obteve-se predominância de células CD1a+ e FXIIIa+ na borda da lesão foveolar em comparação com a área central da lesão. O predomínio de células dendríticas na borda da lesão foveolar pode ser justificado pelo padrão de resposta inflamatória e imunológica ao M. leprae. A distribuição do M. leprae pode estar concentrada nesta região, promovendo uma maior exposição antigênica. Por meio da comparação entre o centro e a borda da lesão foveolar obteve-se uma diferença quantitativa que permite indicar uma função elementar das células dendríticas na resposta ao M. leprae e, consequentemente, no curso da doença.
Palavras-chave: Hanseníase Dimorfa; Imunoistoquímica; Células dendríticas.
ABSTRACT
Leprosy is an infectious and contagious disease, whose etiologic agent is the Mycobacterium leprae, mainly characterized by neural and dermatologic injures. The tuberculoid and lepromatous leprosy types are called polar and considered stable forms. Between them there is the borderline group that shows immunologic instability with variable clinical forms, and it presents a lesion with infiltred border and center of healthy skin, called foveolar lesion. This study aimed to analyze the immunoreactivity of dendritic cells in the apparently healthy skin inside the central region and the infiltred edge of the foveolar lesion in borderline leprosy. It is an analytical and transversal study. CD1a and FXIIIa markers were used to count the dendritic cells in skin samples. A predominance of CD1a and FXIIIa cells in the foveolar border lesion was observed as compared to the center area of the lesion. The prevalence of dendritic cells at the edge of the foveolar lesion can be justified by the pattern of inflammatory and immune response to M. leprae. The distribution of M. leprae may be concentrated in this region, promoting a greater antigenic exposure. The comparison between the center and the edge of the foveolar lesion has obtained a quantitative difference indicating a basic function of dendritic cells in response to M. leprae and, consequently, in the course of the disease.
Keywords: Leprosy, Borderline; Immunohistochemistry; Dendritic Cells.
RESUMEN
La hanseniasis es una enfermedad infecto-contagiosa cuyo agente etiológico es el Mycobacterium leprae, caracterizándose, predominantemente, por lesiones dermatológicas y neurológicas. Las formas de hanseniasis tuberculoide y virchowiana se denominan polares y son consideradas estables. Entre esos polos, existe la forma dimorfa, caracterizada por una inestabilidad inmunológica en la cual las manifestaciones clínicas son variables. Esta forma presenta una lesión con área de piel sana circundada por área infiltrada, llamada de lesión foveolar. El objetivo de este estudio fue el de analizar el estándar inmunorreactivo de las células dendríticas en el área de piel aparentemente sana de la región central y del borde infiltrado de la lesión foveolar en la hanseniasis dimorfa. Se trata de un estudio transversal y analítico. Fueron utilizados los marcadores CD1a y FXIIIa para el conteo de las células dendríticas en las muestras de piel. Se obtuvo predominancia de células CD1a+ y FXIIIa+ en los bordes de la lesión foveolar en comparación con el área central de la lesión. El predominio de células dendríticas en el borde de la lesión foveolar puede ser justificado por el patrón de respuesta inflamatoria e inmunológica a M. Leprae. La distribución de M. leprae puede estar concentrada en esta región, promoviendo una mayor exposición antigénica. A través de comparación entre el centro y el borde de la lesión foveolar se obtuvo una diferencia cuantitativa que permite indicar una función elemental de las células dendríticas en la respuesta a M. leprae y, consecuentemente, en el transcurso de la enfermedad.
Palabras clave: Lepra Dimorfa; Inmunohistoquímica; Células dendríticas.
INTRODUÇÃO
A hanseníase é uma doença infectocontagiosa cujo agente etiológico é o Mycobacterium leprae1. Possui diversos aspectos clínicos, sendo caracterizada predominantemente por lesões dermatológicas e neurológicas que podem acarretar, após longa evolução, as deformidades e mutilações que tanto concorrem para a estigmatização de seus portadores. Tem importante impacto na economia dos países subdesenvolvidos2,3.
O Brasil é considerado o segundo país com maior número de casos de hanseníase no mundo e o primeiro na América Latina, sendo o responsável pela endemia neste continente. No ano de 2009 apresentou uma incidência de 37.610 casos e um coeficiente de detecção de casos novos de hanseníase de 19,64/100.000 habitantes4.
No Brasil a epidemiologia dessa doença reflete a heterogeneidade das condições socioeconômicas e da desigualdade no acesso às ações de saúde nos diferentes Estados do país. Dados epidemiológicos do ano de 2009 demonstram que os estados de Mato Grosso, Tocantins, Rondônia, Maranhão e Pará apresentaram os maiores coeficientes de detecção da doença e o Rio Grande do Sul e Santa Catarina os menores, repetindo, com alguma variação na posição de cada Estado, o padrão de anos anteriores4.
A manifestação clínica inicial da doença é a forma denominada indeterminada e, a partir desta, de acordo com o estado imunológico do hospedeiro, a doença pode evoluir para a cura espontânea ou para as formas tuberculoide; dimorfa ou borderline; e virchowiana5.
O grupo dimorfo é altamente complexo e se manifesta clinicamente por numerosas lesões infiltradas, com bordas externas mal definidas e região central aparentemente poupada, configurando as denominadas lesões foveolares6.
O estudo da pele clinicamente sã nos pacientes de hanseníase tem despertado interesse nos últimos anos. Inicialmente, esperava-se que nessas áreas não fossem encontradas alterações histopatológicas; no entanto, alguns trabalhos recentes têm demonstrado comprometimento da pele sã nas diversas formas da doença7.
As células dendríticas têm a função de serem as apresentadoras iniciais dos antígenos às células efetoras, e o linfócito Th17 surge como agente da resposta efetora8. Na epiderme da pele e das mucosas recebem a denominação de células de Langerhans, expressando glicoproteínas da família CD1 e, na derme, são denominadas de dendrócitos dérmicos, expressando o fator pró-coagulante XIIIa9.
Levando em consideração que o grupo dimorfo é instável do ponto de vista imunológico e até mesmo do clínico, e que a lesão foveolar apresenta área de pele aparentemente sã circundada por área infiltrada, a demonstração da presença ou não dessas células nessas áreas, bem como a comparação entre elas pode auxiliar na compreensão da imunologia desta doença.
Desta maneira, este estudo tem como objetivo analisar o padrão imunorreativo das células dendríticas na área de pele aparentemente sã da região central e da borda infiltrada da lesão foveolar na hanseníase dimorfa.
MATERIAIS E MÉTODOS
DESENHO DO ESTUDO
Trata-se de um estudo transversal, analítico, que analisou dados imunohistoquímicos de 11 pacientes com hanseníase dimorfa e pelo menos uma lesão foveolar.
LOCAL DO ESTUDO
O estudo foi realizado no Ambulatório de Dermatologia da Universidade do Estado do Pará (UEPA) e no Núcleo de Medicina Tropical (NMT) da Universidade Federal do Pará (UFPA), onde foram realizadas as baterias imunohistoquímicas.
POPULAÇÃO DO ESTUDO
A amostra foi composta por 11 pacientes, sendo nove do sexo masculino e dois do sexo feminino, todos diagnosticados com hanseníase dimorfa. A média de idade foi de 28,73 anos.
COLETA DE AMOSTRAS
O diagnóstico da forma clínica dimorfa obedeceu aos critérios estabelecidos por Ridley e Joplin10. Para a coleta destes dados foi aplicado protocolo de pesquisa elaborado pelos pesquisadores, utilizado na rotina de pesquisa do laboratório de Imunopatologia do NMT11.
No momento do atendimento foi solicitada biópsia cutânea. Para esta, adotou-se o critério de escolher uma lesão foveolar típica, caracterizada por possuir uma área central de pele hipocrômica ou aparentemente sã, delimitada de maneira nítida por uma infiltração eritêmato-pigmentar, cujos limites com a pele normal são imprecisos12.
Após antissepsia com PVPI tópico e anestesia local com lidocaína a 2%, sem vasoconstritor, aplicada por seringa descartável de 5 mL e com agulhas 26G 1/2" 0,45x13 mm, foram coletados dois fragmentos de pele por meio de biópsia com punch descartável de 4 mm de diâmetro, sendo o primeiro da área central aparentemente sã da lesão e o segundo, da borda infiltrada.
PROCESSAMENTO DA AMOSTRA
O material coletado foi fixado em formol tamponado a 10% e encaminhado para o Laboratório de Histopatologia do Ambulatório de Dermatologia da UEPA. Os espécimes foram incluídos em blocos de parafina e, posteriormente, cortados em micrótomo rotativo, em cortes histológicos de cinco micrômetros de espessura. Os cortes foram colocados em banho-maria histológico e depositados em lâminas para, em seguida, serem submetidos às colorações.
Os cortes foram submetidos às colorações de Hematoxilina-Eosina (HE) e Ziehl-Nielsen (ZN). A análise do padrão histopatológico foi realizada com base no standard das características microscópicas da hanseníase, de acordo com Ridley e Jopling10.
A coloração Ziehl-Nielsen avaliou a presença de bacilos álcool-ácido resistentes (BAAR) íntegros ou não, além da presença de globias.
Para pesquisar a densidade das células dentríticas nas lesões foveolares foram utilizados os imunomarcadores CD1a+ e FXIIIa nos espécimes teciduais. Esta imunomarcação seguiu as seguintes etapas:
a. As secções obtidas por microtomia foram colocadas em banho-maria histológico e os cortes maintados em lâminas tratadas com silano;
b. Desparafinização com xilol frio e hidratação com concentrações decrescentes de alcoóis, sendo posteriormente lavados em PBS;
c. Bloqueio para ligações inespecíficas por meio de peroxidase endógena com H2O2 por cinco minutos;
d. Incubação de anticorpos primários (CD1a e FXIIIa) em cortes independentes, diluídos em solução de soroalbumina-bovina em over-night;
e. Após lavagens, os cortes foram incubados em anticorpo secundário biotinilado específico para a espécie animal da qual foi produzido o primário;
f. Na sequência, foram lavados e incubados em estreptavidina-peroxidase-streptavidin-biotin-complex;
g. Revelação com substrato cromogênico;
h. Contra coloração com hematoxilina de Harris;
j. Montagem em Entellan ou bálsamo.
ANÁLISE DE DADOS
Para a contagem das células marcadas, as lâminas foram observadas em microscópio ótico NIKON E200, utilizando-se oculares CPLW 10 x 18 e a leitura foi realizada em objetiva de 10X, com confirmação em 40X. Foi processada análise quantitativa de acordo com a intensidade de imunomarcação no tecido para cada campo microscópico. Foram consideradas células que apresentaram imunomarcação positiva as que obtiveram coloração acastanhada inequívoca, em um fundo azulado devido à coloração pela Hematoxilina. A análise quantitativa dos eventos foi realizada utilizando-se gartículo graduado com 10 x 10 subdivisões (compreendendo uma área total de 0.0625 mm2 da lâmina) com contagem de cinco campos de grande aumento escolhidos aleatoriamente ao longo de cada área da lesão.
Este procedimento foi realizado no Laboratório de Imunopatologia do NMT/UFPA.
Todos os resultados foram registrados e armazenados em Protocolo de Pesquisa e, posteriormente, registrados em banco de dados do Microsoft Excel 2007 para análise estatística com o programa BioStat 5.0 e apresentação de gráficos e tabelas com o programa GraphPad Prism 5.0.
De acordo com a natureza das variáveis, foi aplicada análise estatística descritiva, com a obtenção de medidas de tendência central e dispersão e a estatística inferencial empregando-se o teste U de Mann-Whitney para comparar os níveis de células CD1a+ e FXIIIa+ entre as amostras, rejeitando-se ou aceitando-se a hipótese de nulidade conforme os valores de "p" obtidos, considerando-se um nível alfa de 5%. Tais análises foram realizadas no software GraphPad Prism 5.0.
ASPECTOS ÉTICOS
O presente estudo foi iniciado após aprovação do projeto de pesquisa pelo Núcleo de Pesquisa e Extensão em Medicina (NUPEM) da UEPA e pelo Comitê de Ética em Pesquisa Envolvendo Seres Humanos do Centro de Ciências Biológicas e da Saúde da UEPA, em protocolo de número 123 do ano de 2010, com data de aprovação no dia 23 de fevereiro de 2011.
RESULTADOS
Em todos os pacientes incluídos neste trabalho foi observada a presença de pelo menos uma lesão foveolar. Foi utilizada medida de tendência central, média, obtida pelo número de imunomarcações das células CD1a+ e de células FXIIa+ do centro e da borda da lesão. A análise por imunohistoquímica foi caracterizada pela deposição do material castanho no citoplasma da célula, sendo observado uma imunomarcação mais intensa na borda quando comparada ao centro das lesões desses pacientes (Figura 1).
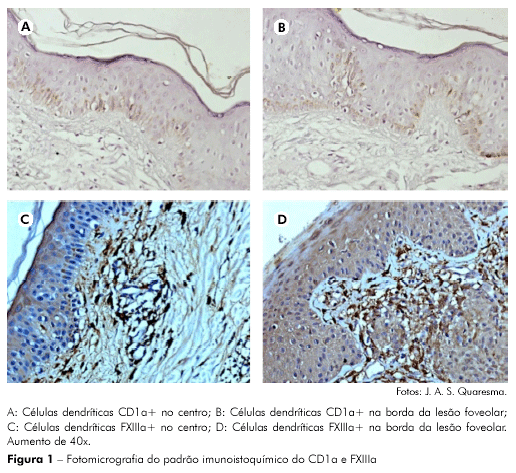
Quanto à população estudada, obteve-se o sexo masculino predominante (81,8%), a média de idade 28,73 anos e a maior parte dos pacientes procedente de Belém e Região Metropolitana (81,8%). A maioria dos pacientes possuía mais de dez lesões (72,7%) e teve como o local de biópsia preferido o tronco (45,5%).
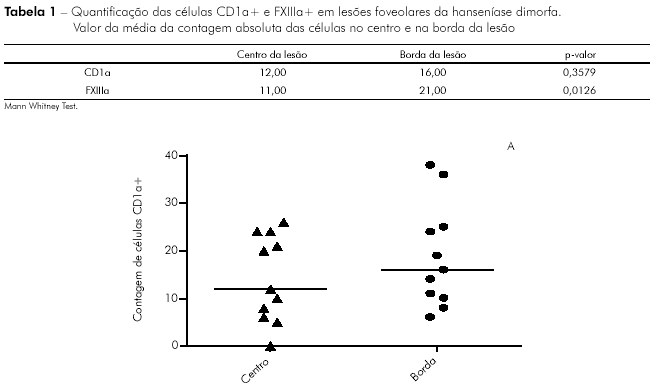
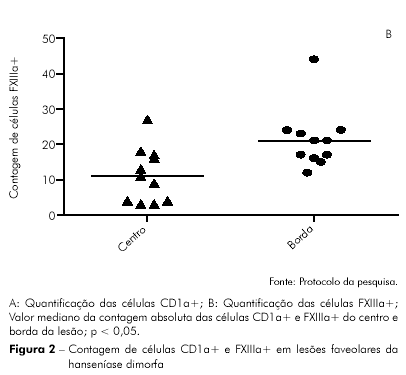
No presente estudo, em relação à contagem das células dendríticas na lesão foveolar, não houve diferença estatisticamente significativa na comparação dos níveis de células CD1a+ entre a pele aparentemente sã do centro (valor mediano: 12) e a da borda da lesão foveolar (valor mediano: 16). Em contraposição, constatou-se diferença estatisticamente significativa quando se comparou os níveis de células FXIIIa+ entre a área de pele aparentemente sã do centro (valor mediano: 11) e a da borda da lesão foveolar (valor mediano: 21), obtendo-se predominância de células FXIIIa+ nesta área.
Na tabela 1 demonstra-se que a expressão de CD1a+ é maior na borda da lesão (p = 0,3579), assim como na expressão do FXIIIa+, que se apresentou de forma estatisticamente significante (p = 0,0126) (Figura 2).
DISCUSSÃO
Existem poucos estudos que avaliam a interação entre hospedeiro e parasita na hanseníase, bem como pesquisas que avaliem a composição celular da lesão pelo M. leprae. A importância deste estudo está na investigação imunohistoquímica de estruturas hansênicas de pacientes com hanseníase. O padrão imunohistoquímico com os marcadores CD1a e FXIIIa encontrado na lesão foveolar do tipo dimorfa ainda não foi descrito, e ele pode ajudar a explicar a patologia dessa forma considerada instável.
Esses achados podem ser justificados pelo fato de que as células dendríticas da epiderme são recrutadas para a derme quando há um evento inflamatório local. Semelhante ao presente estudo, tal fato é descrito por Meymandi et al13 em estudo com pacientes com leishmaniose cutânea. Estes autores justificam que a resposta inflamatória local induz as células de Langerhans a atravessarem a junção dermoepidérmica para combater parasitas na derme, relatando também fortes evidências que as células dendríticas de origem epidérmica são essenciais para uma resposta imune eficaz contra o agente infeccioso.
O padrão de resposta inflamatória na hanseníase pode ser comparado ao da leishmaniose, visto que o padrão de resposta imunológica contra os agentes infecciosos destas doenças é similar, pois estes agentes são parasistas intracelulares e com preferência para macrófagos. Tal fato é também descrito por Azadeh e Dabiri14 em estudo com pele de pacientes com hanseníase.
Pode-se inferir que a borda da lesão foveolar apresentou predominância de células dendríticas em relação à pele aparentemente sã do centro da lesão. Este aumento quantitativo de células dendríticas na borda da lesão pode ser explicado pelo padrão de resposta imunológica ao M. leprae, em que ocorre uma resposta inflamatória maior nesta área, visto que a distribuição do M. leprae pode estar concentrada nesta região, ocasionando uma maior exposição antigênica. Tal fato está de acordo com o encontrado por Miranda et al15 que apontam a maior concentração de células de Langerhans em lesões hansênicas da forma tuberculoide como resultado à exposição antigênica.
A maior proliferação celular na borda da lesão foveolar apresenta efeito protetor, porém destrutivo. A presença da lesão infiltrada pode ser resultado dessa ação deletéria ao tecido. Sieling et al16 relacionam esse fato ao perfil citocínico do meio, onde, nas formas paucibacilares, a resposta Th1 é predominante e há uma facilidade para o desenvolvimento e ativação das células dendríticas. Isto significa que a proliferação frente à exposição antigência é importante em fases iniciais, ocasionando uma secreção de citocinas favoráveis a uma resposta Th1 (IFN-γ, IL-2, TNF-α).
Quaresma et al9 descreveram uma comparação quantitativa de células dendríticas entre as formas polares da hanseníase e observaram uma forte expressão de células CD1a+ e FXIIIa+ nas amostras de forma tuberculoide, enquanto que estas células foram menos detectadas nos casos de hanseníase virchowiana. No presente estudo obteve-se um padrão quantitativo de células CD1a+ e FXIIIa+ próximo do pólo tuberculoide. Levando em consideração que no grupo dimorfo há uma ampla variação do padrão imunológico, pode-se analisar o padrão de distribuição das células dendríticas nesta forma de hanseníase, observando-se uma correlação positiva, o que corrobora a hipótese proposta por Barreto (2005)17 de que, com a evolução da doença, a forma dimorfa poderia caminhar para uma das formas polares.
Além dos dados acima avaliados, pode-se aventar a hipótese de que as lesões foveolares apresentam uma evolução centrípeta, visto que foi encontrada uma quantidade significativa de células dendríticas no centro aparentemente são da lesão. No estudo de Rastogi et al18 são descritas alterações histopatológicas em áreas de pele normal próximas às lesões hansênicas, o que pode justificar a presença do M. leprae nesta área.
Como primeiras linhas de defesa, as células dendríticas têm importância na patogenia das doenças infecciosas, como determinantes de um ambiente citocínico favorável à resposta imune Th1, por meio de suas interrelações célula x bacilo e célula x célula. Quando se trata da fisiopatogenia da moléstia hansênica, estas células adquirem importância fundamental, atuando como células-chave para o sucesso imunológico da resposta do hospedeiro.
Tornam-se necessárias pesquisas com uma amostragem maior de pacientes dimorfos, bem como a análise da influência do tratamento na imunopatologia da lesão foveolar, uma vez que a resposta é individualizada, de acordo com a reatividade do sistema imune do hospedeiro. Outro aspecto a ser avaliado é a influência de outras citocinas na imunopatologia da lesão. Um exemplo é o grupo de citocinas produzidas pelo linfócito Th17 (IL-17,IL-17F, IL-6, IL-21, IL-22 e TNF-α), o qual tem características pró-inflamatórias podendo ser responsável pelo aspecto foveolar da lesão19. Tal conhecimento poderá levar ao incremento de novas abordagens terapêuticas evitando maiores danos para os pacientes e diminuindo a estigmatização da doença.
CONCLUSÃO
A borda da lesão foveolar apresentou predominância de células dendríticas em relação ao centro. As diferenças quantitativas observadas no presente estudo indicam uma participação efetiva das células dendríticas na resposta ao M. leprae e, consequentemente, no curso da doença.
REFERÊNCIAS
1 Carsalade GY, Wallach D, Spindler E, Pennec J, Cottenot F, Flageul B. Daily multidrug therapy for leprosy: results of a fourteen-year experience. Int J Lepr Other Mycobact Dis. 1997 Mar;65(1):37-44. [Link]
2 Brown W. Can social marketing approaches change community attitudes towards leprosy. Lepr Rev. 2006 Jun;77(2):89-98. [Link]
3 Daramola OO, Ismaili A. Hansen's disease and its far-reaching social consequences. Trop Doct. 2006 Jul;36(3):191. [Link]
4 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Coordenação Geral do Programa Nacional de Controle da Hanseníase. Relatório de Gestão: janeiro de 2009 a dezembro de 2010. Brasília: Ministério da Saúde; 2011. [Link]
5 Narang T, Kaur I, Kumar B, Radotra BD, Dogra S. Comparative evaluation of immunotherapeutic efficacy of BCG and mw vaccines in patients of borderline lepromatous and lepromatous leprosy. Int J Lepr Other Mycobact Dis. 2005 Jun;73(2):105-14. [Link]
6 Foss NT. Hanseníase: aspectos clínicos, imunológicos e terapêuticos. An Bras Dermatol. 1999 mar-abr;74(2):113-9. [Link]
7 Mathew D, Kishore BN, Shwethadri GK, Sukumar, Shetty NJ. An evaluation of clinical and histopathological status in paucibacillary leprosy patients after completion of fixed duration therapy. Indian J Lepr. 2004 Jan-Mar;76(1):11-8. [Link]
8 Matsushita S, Higashi T. Human Th17 cell clones and natural immune responses. Allergol Int. 2008 Jun;57(2):135-40. Doi: 10.2332/allergolint.R-08-162. [Link]
9 Quaresma JAS, Oliveira MF, Guimarães ACR, Brito EB, Brito RB, Pagliari C, et al. CD1a and factor XIIIa immunohistochemistry in leprosy: a possible role of dendritic cells in the pathogenesis of Mycobacterium leprae infection. Am J Dermatopathol. 2009 Aug;31(6):527-31. Doi: 10.1097/DAD.0b013e31819f1997. [Link]
10 Ridley DS, Jopling WH. Classification of leprosy according to immunity. A five-group system. Int J Lepr Other Mycobact Dis. 1966 Jul-Sep;34(3):255-73. [Link]
11 Quaresma JAS, Almeida FA, Aarao TLS, Soares LPMA, Magno IMN, Fuzii HT, et al. Transforming growth factor β and apoptosis in leprosy skin lesions: possible relationship with the control of the tissue immune response in the Mycobacterium leprae infection. Microbes Infect. 2012 Aug;14(9):696-701. Doi: 10.1016/j.micinf.2012.02.010. [Link]
12 Sampaio SAP, Rivitti EA. Dermatologia. 2. ed. São Paulo: Artes Médicas; 2001. 1156 p.
13 Meymandi S, Dabiri S, Dabiri D, Crawford RI, Kharazmi A. A quantitative study of epidermal Langerhans cells in cutaneous leishmaniasis caused by Leishmania tropica. Int J Dermatol. 2004 Nov;43(11):819-23. [Link]
14 Azadeh B, Dabiri S. Langerhans cells in skin lesions of leprosy. Ir J Med Sci. 2004 Jun;29(2):51-5. [Link]
15 Miranda A, Amadeu TP, Schueler G, Alvarenga FB, Duppré N, Ferreira H, et al. Increased langerhans cell accumulation after mycobacterial stimuli. Histopathology. 2007 Nov;51(5):649-56. [Link]
16 Sieling PA, Jullien D, Dahlem M, Tedder TF, Rea TH, Modlin RL. CD1 expression by dendritic cells in human leprosy lesions: correlation with effective host immunity. J Immunol. 1999 Feb;162(3):1851-8. [Link]
17 Barreto JA. Hanseníase dimorfa reacional: estudo comparativo, em biópsias cutâneas, entre reações tipo 1 ocorridas antes e durante a poliquimioterapia [dissertação]. São Paulo (SP): Programa de Pós-Graduação em Ciências da Coordenadoria de Controle de Doenças da Secretaria de Estado de Saúde de São Paulo; 2005. [Link]
18 Rastogi R, Budhiraja V, Babu CS, Madan M, Krishna A, Asthana AK. Micropathological changes in the sub-epidermal zone of normal appearing skin in leprosy. Rom J Morphol Embryol. 2011;52(1):165-9. [Link]
19 Miossec P, Korn T, Kuchroo VK. Interleukin-17 and type 17 helper T cells. N Engl J Med. 2009 Aug;361(9):888-98. Doi: 10.1056/NEJMra0707449. [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Francisca Regina de Oliveira Carneiro
Universidade do Estado do Pará
Centro de Ciências Biológicas e da Saúde,
Serviço de Dermatologia
Trav. Perebebuí, 2623. Bairro: Marco
CEP: 66087-670
Belém-Pará-Brasil
E-mail: frocarneiro@hotmail.com
Recebido em / Received / Recibido en: 19/8/2012
Aceito em / Accepted / Aceito en: 11/1/2013













