Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.4 n.2 Ananindeua jun. 2013
http://dx.doi.org/10.5123/S2176-62232013000200008
ARTIGO DE REVISÃO | REVIEW ARTICLE | ARTÍCULO DE REVISIÓN
Riscos da poliomielite para adolescentes e adultos na era da pré-erradicação global
Poliomyelitis risks in adolescents and adults in global pre-eradication era
Riesgos de la poliomielitis para adolescentes y adultos en la era de la erradicación global
Lucia Ferro BricksI; Jose Cassio de MoraesII
ISanofi Pasteur Divisão Vacinas do grupo Sanofi, São Paulo, São Paulo, Brasil
IIFaculdade de Ciências Médicas, Santa Casa de São Paulo, São Paulo, São Paulo, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
INTRODUÇÃO: Em 2012, somente 218 casos de paralisia por poliovírus selvagens foram notificados em todo o mundo, mas o risco de adquirir-se pólio por vírus selvagens ou por vírus derivados de poliovírus vacinais (VDPV) não está eliminado. Atualmente, a maioria das crianças está protegida pela vacinação, mas existem preocupações com adolescentes e adultos que perdem os anticorpos protetores.
OBJETIVO: Analisar criticamente os artigos que abordam os riscos pólio e as estratégias de vacinação para adolescentes e adultos.
MÉTODOS: Os artigos foram identificados através de pesquisa nas bases de dados do PubMed e SciELO no período de janeiro de 2000 a dezembro de 2012. Também foram consultados os sites da Organização Mundial de Saúde, Centro de Controle e Prevenção de Doenças dos Estados Unidos, Centro Europeu de Controle de Doenças, Organização Pan-Americana da Saúde e Ministério da Saúde do Brasil para checar as informações mais recentes sobre epidemiologia e esquemas de vacinação.
RESULTADOS: A pólio é mais grave em adolescentes e adultos do que em crianças. A proporção de pessoas potencialmente desprotegidas aumenta com a idade e grande número de indivíduos com idade maior que 15 anos não têm anticorpos neutralizantes contra poliovírus, principalmente PV3. Crianças vacinadas com a vacina oral contra pólio (VOP) eliminam os vírus vacinais por aproximadamente dois a três meses e os imunocomprometidos podem eliminar os vírus durante anos. As cepas Sabin são geneticamente instáveis e a exposição a VDPV pode representar risco para pessoas não imunes de qualquer idade.
CONCLUSÃO: É necessário rever as recomendações para vacinação de adolescentes e adultos, principalmente profissionais de saúde e viajantes. A vigilância ambiental deve ser estimulada para detectar os riscos de emergência de cepas mutantes e possível importação de poliovírus por imigrantes. A realização de inquéritos soroepidemiológicos pode auxiliar na decisão sobre as melhores estratégias de vacinação para esses grupos.
Palavras-chave: Poliomielite; Vacinas contra Poliovirus; Esquemas de Imunização; Adolescente; Adulto; Pessoal de Saúde.
INTRODUCTION: In 2012 only 218 cases of paralysis by wild polioviruses were reported around the world, but the risk of contracting polio by wild polioviruses or by vaccine-derived polioviruses (VDPV) has not been wholly eliminated. Currently, most children is protected by polio vaccination, but there are concerns about adolescents and adults who lose the protective antibodies.
OBJECTIVE: To critically analyze the articles that deal with the risks of polio, and vaccination strategies for adolescents and adults.
METHODS: The articles were identified through PubMed and SciELO databases searches in the period from January 2000 to December 2012. World Health Organization, US Centers for Disease Control and Prevention, European Centre for Disease Prevention and Control, Pan American Health Organization, and the Brazilian Ministry of Health websites were also consulted to check the most recent information about epidemiology and diagrams of vaccination.
RESULTS: Polio is more severe in adolescents and adults than in children. The proportion of potentially unprotected people increases with age and a large number of individuals aged over 15 do not have neutralizing antibodies against poliovirus, mainly PV3. Children who have received oral poliovirus vaccine eliminate the vaccine viruses by approximately two to three months and those are immunocompromised can eliminate the virus for years. The Sabin strains are genetically unstable and exposure to VDPV may represent risk for non-immune people of any age.
CONCLUSION: It is necessary to review the recommendations to vaccinate adolescents and adults, mainly healthcare professionals and travelers. Environmental surveillance must be stimulated to detect the risks of the emergence of mutant strains and possible importation of poliovirus by immigrants. The carrying out of seroepidemiologic studies can help to decide on the best vaccination strategies for such groups.
Keywords: Poliomyelitis; Poliovirus Vaccines; Immunization Schedule; Adolescent; Adult; Health Personnel.
INTRODUCCIÓN: En 2012, solamente 218 casos de parálisis por poliovirus salvajes fueron notificados en todo el mundo, pero el riesgo de adquirir polio por virus salvajes o por virus derivados de poliovirus vacunales (VDPV) no está eliminado. Actualmente, la mayoría de los niños está protegida por la vacunación, pero existen preocupaciones con los adolescentes y adultos que pierden los anticuerpos protectores.
OBJETIVO: Analizar críticamente los artículos que abordan los riesgos de polio y las estrategias de vacunación para adolescentes y adultos.
MÉTODOS: Los artículos fueron identificados por investigación en las bases de datos de PubMed y SciELO en el período de enero de 2000 a diciembre de 2012. También se consultaron los sitios de la Organización Mundial de la Salud, Centro de Control de Enfermedades de los Estados Unidos, Centro Europeo de Control de Enfermedades, Organización Panamericana de Salud y Ministerio de Salud de Brasil para verificar las informaciones más recientes sobre epidemiología y esquemas de vacunación.
RESULTADOS: La polio es más grave en adolescentes y adultos que en niños. La proporción de personas potencialmente desprotegidas aumenta con la edad y gran número de individuos con edad superior a 15 años no tiene anticuerpos neutralizantes contra poliovirus, principalmente PV3. Niños vacunados con la vacuna oral (VOP) eliminan los virus vacunales por aproximadamente dos a tres meses y los inmunocomprometidos pueden eliminar los virus durante años. Las cepas Sabin son genéticamente inestables y la exposición a VDPV puede representar riesgo para personas no inmunes de cualquier edad.
CONCLUSIÓN: Es preciso revisar las recomendaciones para vacunación de adolescentes y adultos, principalmente los profesionales de la salud y viajantes. Debe ser estimulada la vigilancia ambiental para detectar los riesgos de emergencia de cepas mutantes y la posible importación de poliovirus por inmigrantes. La realización de investigaciones seroepidemiológicas puede auxiliar en la tomada de decisión sobre mejores estrategias de vacunación para esos grupos.
Palabras clave: Poliomielitis; Vacunas contra Poliovirus; Esquemas de Inmunización; Adolescente; Adulto; Personal de Salud.
INTRODUÇÃO
De acordo com a Organização Mundial de Saúde (OMS), em 2011 foram registrados apenas 325 casos de poliomielite por vírus selvagens (PVs) em todo o mundo e o último caso da doença por PVs na Índia foi registrado em janeiro de 2011. Em 2012, foram registrados apenas 218 casos de paralisia por PVs, uma redução de 60% em comparação com o ano anterior1. Apesar dos progressos do Programa Global de Erradicação da Poliomielite, desde o ano 2000 existem preocupações com os riscos de paralisia associada aos vírus derivados de poliovírus vacinais (VDPV), denominados vírus circulantes derivados dos poliovírus vacinais (cVDPV), que podem circular e causar epidemias, ser excretados durante anos por imunodeficientes (iVDPV) ou identificados pela vigilância ambiental (aVDPV), sem que se conheça sua origem. Baixas coberturas vacinais em alguns países endêmicos ou recentemente reinfectados por vírus selvagens, escassez de recursos para manter o programa global de erradicação da pólio e a baixa aceitação da vacina em algumas comunidades são motivo de grande preocupação1,2,3,4,5.
Embora a maioria dos casos de paralisia por PVs seja diagnosticada em crianças menores de 5 anos de idade, a poliomielite pode acometer pessoas não imunes de qualquer faixa etária6-13. Na Europa, diversos países introduziram uma dose de reforço da vacina inativada contra poliomielite (VIP) isolada ou combinada com outras vacinas (dT-IPV ou dTpa-IPV) para adolescentes, adultos5 e profissionais de saúde14.
Nos EUA, embora a revacinação contra pólio não seja indicada na rotina, desde o ano 2000 o Centro de Controle e Prevenção de Doenças (CDC) recomenda que adultos não vacinados ou que não tenham comprovação de vacinação contra poliomielite recebam três doses da VIP, no esquema zero, dois e seis meses. Adultos que pretendem viajar para países endêmicos ou recentemente reinfectados por poliovírus selvagens; profissionais de saúde que tenham contato com imunocomprometidos ou trabalhem em laboratórios com amostras biológicas potencialmente contaminadas por poliovírus; e adultos em contato com crianças imunizadas com vacina oral contra pólio (VOP) devem receber uma dose de reforço da VIP, mesmo que tenham sido vacinados na infância15.
Esta revisão tem como objetivo apresentar uma análise crítica das informações mais recentes sobre a poliomielite, com foco nos riscos de exposição de adolescentes e adultos a vírus selvagens e VDPV.
Os artigos foram identificados pelos autores por meio de pesquisa nas bases de dados do PubMed e SciELO, no período de janeiro de 2000 a dezembro de 2012 com o uso das seguintes palavras-chave: poliomielite, vacinas, imunização, profissionais de saúde e adultos, nos idiomas inglês, espanhol, português e francês. Foram também consultadas referências relevantes sobre o tema citadas nesses artigos, assim como os sites da OMS, CDC, Centro Europeu de Controle de Doenças, Organização Pan-Americana da Saúde e Ministério da Saúde do Brasil para checar as mais recentes informações epidemiológicas e esquemas de vacinação.
RISCOS DA POLIOMIELITE PARA ADOLESCENTES E ADULTOS
Diversos estudos indicam que a gravidade da pólio é maior em adultos do que em crianças10,16,17. Em surtos registrados na Albânia, Cabo Verde e Namíbia, além de adolescentes e adultos constituírem a maioria dos casos, as taxas de letalidade, variando entre 12% e 57%, foram muito mais elevadas do que as observadas nas crianças9,18.
Na Namíbia, após dez anos sem nenhum caso de PVs, em apenas dois meses foram registrados 19 casos de poliomielite e seis mortes, no ano de 2006. O mapeamento genético dos vírus permitiu identificar que o surto foi importado de Angola18, um dos países ainda considerados de risco para poliomielite em 20128.
O risco de reinfecção por PVs em países certificados como livres de pólio é um problema devido ao aumento no fluxo de viajantes, seja a passeio, seja por motivos de trabalho, intercâmbio cultural ou em missões políticas, religiosas e eventos culturais.
De 2002 a 2008, 26 países livres de pólio foram reinfectados por meio da importação de poliovírus selvagens3,4; em 2008 e 2009, 30 importações de poliovírus resultaram em 215 casos da doença em 15 países africanos12 e, em 2010, foi registrada a primeira importação de PVs para a Europa desde que a região foi declarada como livre de pólio, no ano 200211.
Em 2010, foram registradas 11 novas importações de pólio para seis países da África e Ásia e, no Congo, causou espanto o grande número de pessoas de 15 a 25 anos de idade acometidas durante uma epidemia de PVs1, que resultou em 476 casos de paralisia e 179 mortes (letalidade = 45%), tendo em vista que os PVs circularam amplamente na região, sendo esperado que a maioria dos adolescentes e adultos tivesse desenvolvido imunidade natural por exposição prévia aos vírus selvagens12,13.
Na China, onde o último caso autóctone de paralisia por PVs havia sido registrado em 1999 e o último caso importado, em 1994, também causou surpresa o registro de casos de PVs1 em crianças e adultos. Dos primeiros dez casos registrados, quatro foram confirmados em adultos, sendo necessário ampliar a campanha de vacinação para pessoas com até 39 anos de idade19,20.
A reintrodução dos vírus selvagens em diversos países e a enorme migração entre países da Ásia, África e Europa motivou a Arábia Saudita a exigir comprovante de vacinação contra pólio para adultos que participam do Hajj21.
Em 2007, um jovem de 22 anos de idade desenvolveu paralisia por PVs1 na Austrália, após retornar do Paquistão. A investigação e adoção de medidas de controle foram dificultadas, pois centenas de pessoas haviam sido potencialmente expostas a esse indivíduo, seja durante o voo, seja na investigação no hospital22,23.
Embora as crianças não vacinadas sejam o principal grupo envolvido na cadeia de transmissão da pólio, o papel de adultos com infecção assintomática por poliovírus não deve ser subestimado. Em um estudo em que foram investigadas duas epidemias de pólio registradas em Angola em 2007 e 2008, constatou-se que as pessoas que tinham tido contato com adultos que haviam viajado para fora do país tiveram risco quatro vezes maior de desenvolver paralisia. Os autores sugerem que adultos assintomáticos que haviam viajado para o exterior poderiam ter sido responsáveis pela reintrodução de poliovírus selvagens naquele país24.
Apesar de a vacina oral contra a poliomielite apresentar como vantagem a maior capacidade de estimular a imunidade de mucosas, em comparação com a vacina inativada, ela apresenta algumas desvantagens, principalmente relacionadas ao risco de causar paralisia associada aos vírus vacinais (PAVV) e por VDPV (Quadro 1)16,17.

Nos EUA, a adoção da VIP, inicialmente em esquema sequencial (1997) e a partir do ano 2000 em esquema completo, foi motivada pela constatação de que todos os casos de poliomielite registrados após 1979 eram casos de PAVV. De 1965 a 1967, oito casos de PAVV foram registrados em receptores da vacina e o dobro (16) em familiares ou contatos de crianças vacinadas. De 1980 a 1996, a maioria dos casos de PAVV registrada em adultos estadunidenses era constituída de pessoas previamente saudáveis, como mães e pais de bebês recentemente vacinados com a VOP25-27.
No Japão, onde a circulação de poliovírus selvagens foi interrompida em 1980, também foi confirmada a transmissão de vírus Sabin de bebê para o pai, previamente saudável, que desenvolveu a forma paralítica da doença28.
Embora os casos de PAVV sejam raros, é evidente que o uso da VOP se transformou num obstáculo à erradicação global da poliomielite, sendo necessário buscar novas estratégias para reduzir o risco de paralisia após a erradicação da doença29.
A preocupação em vacinar adolescentes e adultos contra a poliomielite é maior na Europa, devido ao grande fluxo de turistas e migrantes. Na Europa, VIP é indicada para adolescentes e adultos em 13 países5. Desde 1999, é administrada na forma combinada com a dupla-adulto (dT-IPV)30 e, mais recentemente, também na forma combinada com vacina pertussis (dTpa-IPV)25.
Os vírus Sabin são muito instáveis, sofrem frequentes mutações, podendo readquirir virulência e causar paralisia. Estima-se que as taxas de mutação das cepas Sabin sejam de 1% por ano. A classificação dos casos de PAVV é feita de acordo com taxas de variação genética entre cepas dos vírus da poliomielite e o padrão genético das cepas Sabin. Variações inferiores a 1% são típicas dos casos de PAVV, enquanto as variações entre 1 e 15% são classificadas como causadas por VDPV e subdivididas em três grupos: cVDPV (quando mais de um caso é confirmado), iVDPV (quando um caso é identificado em pessoa imunodeficiente) e aVDPV (casos isolados ou identificação de poliovírus com mais de 1% de variação genética na proteína VP1 das cepas Sabin, em água de esgoto29,31.
A capacidade de os VDPV se disseminarem e causarem paralisia já está amplamente comprovada e, recentemente, confirmou-se que mesmo as cepas Sabin com menos de 1% de mutação (pré-VDPV) podem causar paralisia32.
A pesquisa de vírus da poliomielite em água de esgoto (vigilância ambiental) permitiu identificar cepas originadas da vacina Sabin com mais de 10% de mutação na proteína VP1 em diversos países, sendo considerada essencial para monitorar o risco de exposição aos vírus mutantes. Infelizmente, esse tipo de pesquisa não é feito rotineiramente no Brasil, não sendo possível identificar o risco de exposição a cepas mutantes no país33-39.
É interessante ressaltar que, mesmo em países que adotaram a VIP há muitos anos, como Finlândia e Suíça, foram isoladas cepas de poliovírus com elevadas taxas de mutação, cuja origem é desconhecida. Felizmente, as elevadas coberturas vacinais, a excelente imunogenicidade da VIP utilizada nesses países, assim como os bons padrões de higiene têm impedido a circulação desses vírus na Europa, mas o risco de paralisia por VDPV não está eliminado, mesmo nos países que adotaram a VlP31,36-38.
Em 2005, durante a investigação de um caso de paralisia em criança não vacinada de uma comunidade religiosa, 35% (8 de 23) dos contatos apresentavam excreção do mesmo tipo de vírus. No mesmo ano, foi confirmado o primeiro caso de paralisia por VDPV em mulher adulta que havia viajado para América Latina e teve contato com crianças vacinadas com a VOP40,41. Em 2011, uma mulher de 44 anos de idade desenvolveu paralisia e foi a óbito por infecção por VDPV nos EUA. Essa mulher era imunodeficiente, nunca havia saído do país e, pela alta taxa de mutação dos vírus (12%), acredita-se que ela tenha se infectado antes da suspensão da vacina oral nos EUA por seu filho, que havia recebido a vacina oral42.
Na Espanha, um bebê imunocomprometido desenvolveu paralisia após ter sido vacinado com a vacina oral em outro país. Durante a investigação, cepas mutantes da vacina Sabin (iVDPV) foram isoladas de seu pai e irmãos adolescentes, que não desenvolveram a doença43.
Esses dados demonstram que crianças e adultos podem desenvolver paralisia por VDPV, mesmo residindo em países que adotam exclusivamente a VIP como EUA e Espanha40,41,42,43.
O número de casos de paralisia por cVDPV tem crescido nos últimos anos e, embora na maioria dos surtos o número de pessoas acometidas seja pequeno, estima-se que, quando um caso é identificado, milhares de pessoas já tenham sido expostas a esses vírus44. Entre 2009 e 2011, foi registrada uma epidemia de paralisia por cVDPV na Nigéria em que foram acometidas 355 pessoas32. Durante a investigação dos casos, verificou-se que, além dos vírus cVDPV, vírus com baixas taxas de mutação (<1%) também causavam paralisia e morte32.
SOROPREVALÊNCIA DE ANTICORPOS NEUTRALIZANTES PARA POLIOVÍRUS
A proteção contra poliomielite é fundamentalmente conferida pela presença de anticorpos neutralizantes contra os poliovírus 1 (PV1), 2 (PV2) e 3 (PV3), tendo em vista que proteção é específica por sorotipo. Na era pré-vacinal, a maioria das pessoas adquiria imunidade aos poliovírus após exposição natural aos vírus selvagens. Como a doença é transmitida pela via fecal-oral, a aquisição de anticorpos era mais precoce em países ou regiões com baixas condições de higiene e menor oferta de água tratada e saneamento básico. Pessoas residentes em locais com melhores condições socioeconômicas permaneciam desprotegidas até a idade adulta e poderiam adquirir a doença quando expostas aos vírus selvagens depois da adolescência. Assim como ocorre com a hepatite A45, adultos que não se infectaram na infância, ao contrair a infecção apresentam doença de maior gravidade, com maior taxa de sequelas permanentes e maiores taxas de letalidade10,16,17.
Após a introdução e uso em larga escala das vacinas inativada e oral contra a poliomielite nos programas de vacinação, a maioria das pessoas passou a adquirir imunidade contra os três poliovírus na infância, porém ainda são desconhecidas a duração da proteção conferida por essas vacinas e a extensão em que os vírus vacinais se disseminam na comunidade. Altos títulos de anticorpos neutralizantes contra poliovírus em adolescentes e adultos podem resultar da vacinação na infância ou de exposição a vírus selvagens ou vacinais, em geral excretados por pessoas assintomáticas (booster natural)46.
Embora as vacinas que contêm vírus vivos induzam imunidade duradoura, não se sabe se a proteção conferida pela vacina oral é permanente e, como sua imunogenicidade é baixa em países de clima tropical, é possível que não apresentem soroconversão apropriada, mesmo após a aplicação de várias doses da vacina. Diversos estudos realizados em diferentes países indicam que, com o passar dos anos, a média geométrica dos títulos (MGT) de anticorpos contra pólio cai substancialmente. Na ausência de doses de reforço da vacina, grande percentual de crianças, adolescentes e adultos pode estar desprotegida, especialmente contra os poliovírus 3 e 147-70 (Tabela 1).
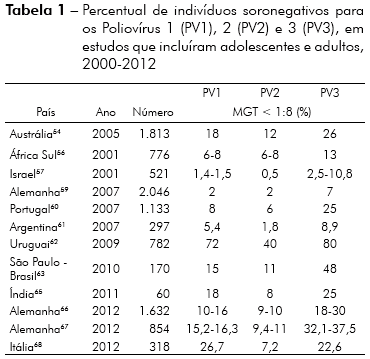
Como raramente se consegue comprovar o histórico vacinal de adolescentes e adultos durante a realização dos inquéritos soroepidemiológicos, não é possível saber se a ausência de anticorpos neutralizantes se deve a falhas na resposta às vacinas recebidas na infância (falha primária por ausência de soroconversão) ou a falhas secundárias, que ocorrem também com outras vacinas47-72.
Falhas vacinais primárias após uso da VOP são muito comuns, particularmente em países de clima tropical, onde as taxas de soroconversão e as MGT de anticorpos neutralizantes contra poliovírus são inferiores às observadas após uso da vacina inativada16,17,68,72. Mesmo pessoas vacinadas previamente com a VIP podem apresentar baixos títulos de anticorpos neutralizantes após alguns anos, como foi demonstrado em estudo recente realizado na França. Quanto maior o intervalo entre a última dose de vacina recebida na infância e a dose de reforço, menores as MGTs de anticorpos neutralizantes contra poliovírus71.
RESPOSTA IMUNE APÓS DESAFIO COM VACINAS EM PESSOAS COM BAIXOS TÍTULOS DE ANTICORPOS NEUTRALIZANTES CONTRA POLIOVÍRUS
O período de incubação dos poliovírus é bastante curto (variando entre um e seis dias), portanto não é possível garantir que os indivíduos que perderam os anticorpos, mesmo tendo memória imune, possam responder com títulos altos de anticorpos neutralizantes na primeira semana após exposição aos vírus selvagens ou derivados da vacina16,17.
Nesta revisão da literatura sobre o tema, foram encontradas apenas duas publicações em que foi avaliada a resposta imune de pessoas que tinham baixos títulos de anticorpos neutralizantes contra poliovírus após desafio vacinal56,70. Em um estudo realizado com 776 profissionais de um laboratório de virologia na África do Sul, 93 (12%) eram soronegativos para um ou mais poliovírus; desses, 14% (13/96) falharam em apresentar resposta secundária após desafio com vacina oral. Nesse estudo não foram avaliados os registros de vacinação, não sendo possível saber se os soronegativos tinham ou não sido expostos previamente à vacina ou a vírus selvagens e perdido a imunidade ou se eram naives56. Em outro estudo, realizado na Holanda, apenas 5% a 30% de indivíduos idosos soronegativos para poliovírus 1 e 3 apresentaram resposta imune de memória para após desafio com a vacina oral73.
Um estudo realizado com recrutas militares do Brasil e EUA na década de 1960 revelou que não chegava a 10% o número de recrutas brasileiros que não tinham anticorpos contra poliovírus 1, 2 e 3; enquanto 15% dos recrutas americanos estavam desprotegidos contra os PV1 e PV2 e 25% desprotegidos contra PV347. Possivelmente, esses resultados refletiram diferenças na exposição dos brasileiros aos vírus selvagens na década de 1960, associadas às condições socioeconômicas e ambientais. Mais recentemente, entretanto, a situação mudou, como pode ser verificado pelos resultados de um estudo realizado no Estado de São Paulo, com 411 doadores de sangue, em que 40% estavam desprotegidos contra o PV363. Possivelmente, o elevado percentual de indivíduos soronegativos para poliovírus revela a melhoria das condições socioeconômicas no país, aliada à redução na circulação dos vírus selvagens. Embora nos últimos 30 anos tenham sido realizadas duas campanhas anuais de vacinação contra a poliomielite, pelo menos para o PV3, a exposição aos vírus Sabin na comunidade parece ser insuficiente para manter altos títulos de anticorpos contra poliomielite em adultos que vivem em São Paulo.
Tendo em vista o grande percentual de pessoas com mais de 15 anos de idade que podem estar desprotegidas contra a pólio e que o risco de contaminação por vírus selvagens não será eliminado até a erradicação global da doença, a hipótese de que a imunidade coletiva é suficiente para evitar a ocorrência da pólio em adolescentes e adultos não pode mais ser aceita passivamente. Vale lembrar que a detecção de casos em adultos é particularmente difícil, devido à baixa conscientização sobre possíveis riscos, visto que a vigilância das paralisias flácidas agudas é focada em menores de 15 anos de idade6-10,15-17,20-23,73,74.
O recente surto de PV1 detectado na República Democrática do Congo, com 445 casos, dos quais 331 foram registrados em adultos, com letalidade de 43%, confirma a gravidade de pólio em adultos74,75. A análise dos fatores de risco para sequelas e complicações revelou que o risco foi significativamente maior nos maiores de 15 anos de idade74,75.
Adicionalmente, devem ser considerados os riscos de exposição aos VDPV que somente foram reconhecidos após o ano 200016,17,29. O PV2 selvagem já foi erradicado, porém 80% dos casos de paralisia associada a cVDP são causados pelo PV21. Embora os inquéritos soroepidemiológicos revelem maior perda de imunidade para o PV350-71, qualquer um dos sorotipos selvagens ou derivados da vacina oral pode causar paralisia e sequelas graves16,17,76,77.
Vale ressaltar que os vírus Sabin são muito instáveis, frequentemente sofrem reversão à neurovirulência29,78 e, assim como os vírus selvagens, podem causar paralisia em pessoas não imunes de qualquer faixa etária16,17,29.
Outro motivo para preocupação é a comprovação de que a imunidade de mucosas conferida pela vacina oral não impede a excreção de vírus vacinais, nem de vírus selvagens. A duração da imunidade de mucosas é muito limitada e parece estar associada à presença de altos títulos de anticorpos séricos. Seis meses após vacinação com a vacina oral, crianças desafiadas com a vacina Sabin voltaram a excretar os vírus vacinais em taxas elevadas79.
Após receber a vacina oral, pessoas vacinadas podem excretar os vírus Sabin por 13 semanas16,39,80 e, durante esse período, adultos em contato com as fezes de crianças podem se contaminar com vírus vacinais ou VDPV. Se a criança vacinada ou contato exposto for imunodeficiente, a excreção viral pode persistir por muitos anos de forma assintomática, permitindo a contaminação da água de esgotos e transmissão secundária para outros contatos42,44. Acredita-se que a maioria das cepas aVDPV se devam à excreção de poliovírus por imunodeficientes assintomáticos31, e a vigilância ambiental, implementada em diversos países, pode contribuir para avaliar o risco de reintrodução dos vírus34-39.
No Brasil, existem poucas informações sobre a imunidade aos poliovírus em adultos47,63. Casos esporádicos de PAVV têm sido registrados, na maioria das vezes, após a primeira ou segunda dose da vacina oral29,76,77. Em 2012, o Brasil adotou esquema sequencial, em que as duas primeiras doses da vacina contra pólio são de VIP, seguidas pela VOP81. Essa iniciativa deve reduzir ainda mais os raros casos de PAVV, entretanto não eliminará totalmente os casos de pólio enquanto não houver a erradicação global da doença e não for totalmente interrompido o uso da vacina oral.
Os progressos conseguidos pelo programa global de erradicação da pólio estão ameaçados pelas guerras civis, que acarretam redução nas coberturas vacinais, assim como pela ignorância que, recentemente, foi responsável pela morte de voluntários que trabalhavam nas campanhas de vacinação no Afeganistão82,83. A baixa percepção sobre riscos da pólio em adultos74,75, aliada à falta de recursos laboratoriais sensíveis e específicos para identificação de cepas recombinantes de poliovírus na investigação de problemas neurológicos em adultos poderão predispor ao atraso no diagnóstico de casos da doença e permitir sua disseminação na comunidade40,42,44. Causa preocupação o aumento do conjunto de adolescentes e adultos suscetíveis, particularmente entre profissionais de saúde e pessoas que viajam para áreas de risco. Considerando os riscos potenciais de uma doença para a qual não há nenhum tratamento específico1,16,17, adolescentes e adultos que têm contato com imunocomprometidos ou que trabalham em laboratórios ou em locais onde é possível a contaminação por poliovírus deveriam ser revacinados com a vacina inativada, assim como já ocorre em diversos países europeus e nos EUA5,14,16,25,31,71,84. A mesma orientação deve ser dada a pessoas que viajam para países endêmicos ou recentemente reinfectados pela pólio, por motivos de trabalho, turismo ou intercâmbio cultural.
CONCLUSÃO
A pólio pode acometer pessoas de qualquer idade e os dados disponíveis na literatura indicam que o risco de complicações e sequelas é maior em adolescentes e adultos não imunes do que em crianças.
A imunidade de mucosas não é permanente e tanto indivíduos previamente vacinados com VIP como os vacinados com VOP podem excretar poliovírus alguns meses após a vacinação.
Os vírus Sabin são muito instáveis, tendo sido descritas recombinações entre os diferentes sorotipos, assim como entre poliovírus e outros enterovírus, sendo necessário investigar a possibilidade de infecções por pólio em adultos utilizando recursos diagnósticos que permitam identificar infecções por VDPV (cVDPV, iVDPV e aVDPV) e por poliovírus recombinantes com outros enterovírus não apenas em menores de 15 anos de idade, foco da vigilância de paralisias flácidas agudas, mas também em adolescentes e adultos.
A introdução da vigilância ambiental para avaliar os riscos de emergência de cepas mutantes e possível importação de poliovírus por imigrantes também deve ser estimulada.
Considerando que, até o presente, não existe nenhum medicamento efetivo para tratar a pólio; que o percentual de adolescentes e adultos desprotegidos pode ser significativo e parece estar aumentando nas duas últimas décadas; e que existem vacinas seguras e imunogênicas contra a pólio, combinadas ou não com outras vacinas para prevenção dessa doença, é preciso rever as estratégias de prevenção da doença em adolescentes e adultos, particularmente entre os que podem estar mais expostos à infecção, como profissionais de saúde, viajantes para áreas de risco e contatos próximos de crianças que recebem a vacina oral. A realização de inquéritos soroepidemiológicos poderá trazer dados úteis para orientar sobre necessidade de doses de reforço na população ou em grupos específicos.
REFERENCIAS
1 World Health Organization. Global polio eradication iniciative [Internet]. Geneva: World Health Organization; 2013 [cited 2013 Jan 6]. Available from: http://www.polioeradication.org.
2 World Health Organization. Global polio eradication iniciative. Assessment of risks to the global. Polio eradication initiative. Strategic plan 2010-2012 [Internet]. Geneva: World Health Organization; 2010 [cited 2012 Jun 13]. Available from: http://www.polioeradication.org/Dataandmonitoring/Polioeradicationtargets/Riskassessments.aspx.
3 Pallansch MA, Sandhu HS. The eradication of polio: progress and challenges. N Engl J Med. 2006 Dec;355(24):2508-11. [Link]
4 World Health Organization. Global polio eradication iniciative. Budgetary implications of the GPEI strategic plan and financial resource requirements [Internet]. Geneva: World Health Organization; 2009 [cited 2012 Sep 20]. Available from: http://www.polioeradication.org/content/general/FinalFRR_English2009-2013_ January09.pdf.
5 Centers for Disease Prevention and Control [Internet]. Health topics A-Z. Poliomyelitis. Basic facts: factsheet for health professionals. [cited 2013 Jan 6]. Available from: www.ecdc.europa.eu/en/activities/surveillance/euvac/sch.
6 Morse LJ, Rubin HE, Blount Jr RE. Vaccine acquired paralytic poliomyelitis in an unvaccinated mother. JAMA. 1966 Sep;197(12):1034-5. [Link]
7 Swanson PD, McAlister R, Peterson DR. Poliomyelitis associated with type 2 virus. Paralytic disease in the father of a recently immunized child. JAMA. 1967 Sep;201(10):771-3. [Link]
8 Centers for Disease Control and Prevention. Infectious diseases related to travel. Yellow book [Internet]. Atlanta: Centers for Disease Control and Prevention; 2009. [cited 2012 Jun 10]. Available from: http://wwwnc.cdc.gov/travel/page/yellowbook-2012-home.htm.
9 Prevots DR, Ciofi degli Atti ML, Sallabanda A, Diamante E, Aylward RB, Kakariqqi E, et al. Outbreak of paralytic poliomyelitis in Albania, 1996: high attack rate among adults and apparent interruption of transmission following nationwide mass vaccination. Clin Infect Dis. 1998 Feb;26(2):419-25. [Link]
10 Nathanson N, Kew OM. From emergence to eradication: the epidemiology of poliomyelitis deconstructed. Am J Epidemiol. 2010 Dec;172(11):1213-29. Doi:10.1093/aje/kwq320. [Link]
11 Centers for Disease Control and Prevention. Outbreaks following wild poliovirus importations: Europe, Africa, and Asia, January 2009-September 2010. Morb Mortal Wkly Rep. 2010 Nov;59(43):1393-9. [Link]
12 Roberts L. Infectious disease. Polio outbreak breaks the rules. Science. 2010 Dec;24;330(6012):1730-1. Doi:10.1126/science.330.6012.1730. [Link]
13 Menach A, Llosa AE, Mouniaman-Nara I, Kouassi F, Ngala J, Boxall N, et al. Poliomyelitis outbreak, Pointe-Noire, Republic of the Congo, September 2010-February 2011. Emerg Infect Dis. 2011 Aug;17(8):1506-9. [Link]
14 Maltezou HC, Wicker S, Borg M, Heininger U, Puro V, Theodoridou M, et al. Vaccination policies for health-care workers in acute health-care facilities in Europe. Vaccine. 2011 Nov;29(51):9557-62. Doi:10.1016/j.vaccine.2011.09.076. [Link]
15 Centers for Disease Control and Prevention. Poliomyelitis prevention in the United States. Morb Mortal Wkly Rep [Internet]. 2000 May [cited 2011 Nov 12];49(RR-05):1-22. Available from: http://www.cdc.gov/mmwr/preview/mmwrhtml/rr4905a1.htm.
16 Plotkin SA, Vidor E. Poliovirus vaccine: live. In: Plotkin SA, Orenstein WA, Offit PA. Vaccines. 5th. ed. Philadelphia: Saunders Elsevier; 2008. p. 631-86.
17 Sutter RW, Kew OM, Cochi SL. Poliovirus vaccine: live. In: Plotkin SA, Orenstein WA, Offit PA. Vaccines. 5th. ed. Philadelphia: Saunders Elsevier; 2008. p. 605-30.
18 Centers for Disease Control and Prevention. Outbreak of polio in adults: Namibia, 2006. Morb Mortal Wkly Rep. 2006 Nov;55(44):1198-201. [Link]
19 World Health Organization. Global polio eradication iniciative. China responds to outbreak of polio [Internet]. Geneva: World Health Organization; 2009 [cited 2011 Sep 1]. Available from: http://www.polioeradication.org/tabid/408/iid/158/Default.aspx.
20 World Health Organization. Global polio eradication iniciative. China's all-out fight against polio [Internet]. Geneva: World Health Organization; 2010 [cited Oct 1]. Available from: http://www.polioeradication.org/Mediaroom/Newsstories/Newsstories2011/tabid/408/iid/173/Default.aspx.
21 Gautret P, Wilder-Smith A. Vaccination against tetanus, diphtheria, pertussis and poliomyelitis in adult travellers. Travel Med Infect Dis. 2010 May;8(3):155-60. Doi:10.1016/j.tmaid.2010.02.007. [Link]
22 Stewardson AJ, Roberts JA, Beckett CL, Prime HT, Loh PS, Thorley BR, et al. Imported case of poliomyelitis, Melbourne, Australia, 2007. Emerg Infect Dis. 2009 Jan;15(1):63-5. Doi:10.3201/eid1501.080791. [Link]
23 Carnie JA, Lester R, Moran R, Brown L, Meagher J, Roberts JA, et al. Public health response to imported case of poliomyelitis, Australia, 2007. Emerg Infect Dis. 2009 Nov;15(11):1733-7. Doi:10.3201/eid1511.090027. [Link]
24 Kidd S, Goodson JL, Aramburu J, Morais A, Gaye A, Wannemuehler K, et al. Poliomyelitis outbreaks in Angola genetically linked to India: risk factors and implications for prevention of outbreaks due to wild poliovirus importations. Vaccine. 2011 May;29(21):3760-6. Doi:10.1016/j.vaccine.2011.03.034. [Link]
25 Larnaudie S, Guiso N, Baptiste C, Desaint C, Desforges L, Lebon P, et al. Humoral immunity of dTap-IPV vaccine (REPEVAX®) administered one month after dT-IPV vaccine (REVAXIS®) in adults with unknown vaccination history. Hum Vaccin. 2010 Oct;6(10):829-34. Doi:10.4161/hv.6.10.12582. [Link]
26 Hopkins CC, Dismukes WE, Glick TH, Warren RJ. Surveillance of paralytic poliomyelitis in the United States 1966 and 1967 cases, and 1965-1967 cases associated with oral poliovirus vaccine. JAMA. 1969 Oct;210(4):694-700. [Link]
27 Lehman D, Lieberman JM. Poliovacines: time for a change. Contemp Pediatr. 1988;15(1):58-76.
28 Okuda B, Uetani E, Okamoto K. Vaccine-associated paralytic poliomyelitis caused by contact infection. Intern Med. 2006 Apr;45(6):373-5. [Link]
29 Bricks LF. Polio vaccines: a new paradigma. Rev Paul Pediatr. 2007 Jun;25(2):172-9.
30 Laroche P, Barrand M, Wood SC, Van Hasbrouck K, Lang J, Harzer E, et al. The immunogenicity and safety of a new combined diphtheria, tetanus and poliomyelitis booster vaccine (Td-eIPV). Infection. 1999 Jan-Feb;27(1):49-56. [Link]
31 Centers for Disease Control and Prevention. Update on vaccine-derived polioviruses--worldwide, July 2009-March 2011. Morb Mortal Wkly Rep. 2011 Jul;60(25):846-50. [Link]
32 Wassilak S, Pate MA, Wannemuehler K, Jenks J, Burns C, Chenoweth P, et al. Outbreak of type 2 vaccine derived poliovirus in Nigeria: emergence and widespread circulation in an underimmunized population. J Infect Dis. 2011 Apr;203(7):898-909. Doi:10.1093/infdis/jiq140 [Link]
33 Yoshida H, Horie H, Matsuura K, Miyamura T. Characterisation of vaccine-derived polioviruses isolated from sewage and river water in Japan. Lancet. 2000 Oct;356(9240):1461-3. [Link]
34 Shulman LM, Manor Y, Sofer D, Handsher R, Swartz T, Delpeyroux F, et al. Neurovirulent vaccine derived polioviruses in sewage from highly immune populations. PLoS One. 2006 Dec;1:69. [Link]
35 Swartz TA, Green MS, Handscher R, Sofer D, Cohen-Dar M, Shohat T, et al. Intestinal immunity following a combined enhanced inactivated polio vaccine/oral polio vaccine programme in Israel. Vaccine. 2008 Feb;26(8):1083-90. Doi:10.1016/j.vaccine.2007.12.021 [Link]
36 Roivainen M, Blomqvist S, Al-Hello H, Paananen A, Delpeyroux F, Kuusi M, et al. Highly divergent neurovirulent vaccine derived polioviruses of all three serotypes are recurrently detected in Finnish sewage. Euro Surveill. 2010 May;15(19):19566. [Link]
37 Paximadi E, Karakasiliotis I, Papaventsis D, Papageorgiou G, Markoulatos P. Recombinant Sabin environmental isolates in Greece and Cyprus. J Appl Microbiol. 2008 Apr;104(4):1153-62. [Link]
38 Zurbriggen S, Tobler K, Abril C, Diedrich S, Ackermann M, Pallansch MA, et al. Isolation of sabin-like polioviruses from wastewater in a country using inactivated polio vaccine. Appl Environ Microbiol. 2008 Sep;74(18):5608-14. [Link]
39 Troy SB, Ferreyra-Reyes L, Huang C, Mahmud N, Lee YJ, Canizales-Quintero S, et al. Use of a novel real-time PCR assay to detect oral polio vaccine shedding and reversion in stool and sewage samples after a mexican national immunization day. J Clin Microbiol. 2011 May;49(5):1777-83. Doi:10.1128/JCM.02524-10 [Link]
40 Alexander JP, Ehresmann K, Seward J, Wax G, Harriman K, Fuller S, et al. Transmission of imported vaccine derived poliovirus in an undervaccinated community in Minnesota. J Infect Dis. 2009 Feb;199(3):391-7. Doi:10.1086/596052 [Link]
41 Centers for Disease Control and Prevention. Imported vaccine associated paralytic poliomyelitis: United States, 2005. Morb Mortal Wkly Rep. 2006 Feb;55(4):97-9. [Link]
42 DeVries AS, Harper J, Murray A, Lexau C, Bahta L, Christensen J, et al. Vaccine derived poliomyelitis 12 years after infection in Minnesota. N Engl J Med. 2011 Jun;364(24):2316-23. Doi:10.1056/NEJMoa1008677. [Link]
43 Avellón A, Cabrerizo M, Miguel T, Pérez-Breña P, Tenorio A, Pérez JL, et al. Paralysis case and contact spread of recombinant vaccine derived poliovirus, Spain. Emerg Infect Dis. 2008 Nov;14(11):1807-9. Doi:10.3201/eid1411.080517. [Link]
44 Wringe A, Fine PE, Sutter RW, Kew OM. Estimating the extent of vaccine derived poliovirus infection. PLoS One. 2008;3(10):3433. Doi:10.1371/journal.pone.0003433 [Link]
45 Melnick JL. History and epidemiology of hepatitis A virus. J Infect Dis. 1995 Mar;171 Suppl 1:2-8. [Link]
46 Chen RT, Hausinger S, Dajani AS, Hanfling M, Baughman AL, Pallansch MA, et al. Seroprevalence of antibody against poliovirus in inner-city preschool children. Implications for vaccination policy in the United States. JAMA. 1996 Jun;275(21):1639-45. [Link]
47 Niederman JC, Henderson JR, Opton EM, Black FL, Skvrnova K. A nationwide serum survey of Brazilian military recruits, 1964. II. Antibody patterns with arboviruses, polioviruses, measles and mumps. Am J Epidemiol. 1967 Sep;86(2):319-29. [Link]
48 Rousseau WE, Noble GR, Tegtmeier GE, Jordan MC, Chin TD. Persistence of poliovirus neutralizing antibodies eight years after immunization with live, attenuated-virus vaccine. N Engl J Med. 1973 Dec;289(25):1357-9. [Link]
49 Roebuck M, Chamberlain R. Prevalence of antibodies to poliovirus in 1978 among subjects aged 0-88 years. Br Med J. 1982 Mar;284(6317):697-700. [Link]
50 Kelley PW, Petruccelli BP, Stehr-Green P, Erickson RL, Mason CJ. The susceptibility of young adult americans to vaccine-preventable infections. A national serosurvey of US Army recruits. JAMA. 1991 Nov;266(19):2724-9. [Link]
51 Malvy D, Fuchs F, Dubois F, Roure C, Aumard M, Drucker J. A study of poliomyelitis related sero-immunity in a selected sample of the french population. Med Mal Infect. 1996;26(6-7):714-20.
52 Pianetti A, Salvaggio L, Biffi MR, Baffone W, Bruscolini F, Donato S, et al. Antipoliomyelitis immunity status in a cohort of young men drafted into military service, residing in the suburban Milan area. Eur J Epidemiol. 1997 Sep;13(6):725-7. [Link]
53 Gabrieli R, Divizia M, El Ghazzawi E, Kader OA, El Gawhary Z, Renganathan E, et al. Serum antibodies to polioviruses in Alexandria, Egypt. Eur J Epidemiol. 1999 Mar;15(3):267-70. [Link]
54 Gidding HF, Backhouse JL, Gilbert GL, Burgess MA. National serosurvey of poliovirus immunity in Australia, 1996-99. Aust N Z J Public Health. 2005 Feb;29(1):48-52. [Link]
55 Sutter RW, Suleiman AJ, Malankar P, Al-Khusaiby S, Mehta F, Clements GB, et al. Trial of a supplemental dose of four poliovirus vaccines. N Engl J Med. 2000 Sep;343(11):767-73. [Link]
56 Schoub BD, Blackburn NK, McAnerney JM. Seroprevalence to polio in personnel at a virology institute. J Infect. 2001 Aug;43(2):128-31. [Link]
57 Grotto I, Handsher R, Gdalevich M, Mimouni D, Huerta M, Green MS, et al. Decline in immunity to polio among young adults. Vaccine. 2001 Jul;19(30):4162-6. [Link]
58 Baer G, Bonhoeffer J, Schaad UB, Heininger U. Seroprevalence and immunization history of selected vaccine preventable diseases in medical students. Vaccine. 2005 Mar;23(16):2016-20. [Link]
59 Wicker S, Rabenau HF, Gottschalk R, Doerr HW, Allwinn R. Seroprevalence of vaccine preventable and blood transmissible viral infections (measles, mumps, rubella, polio, HBV, HCV and HIV) in medical students. Med Microbiol Immunol. 2007 Sep;196(3):145-50. [Link]
60 Miranda MP, Gomes MC, Andrade HR. Seroprevalence of antibodies to poliovirus in individuals living in Portugal, 2002. Euro Surveill. 2007;12(6):7-8. [Link]
61 Nates SV, Martinez LC, Barril PA, Ferreyra LJ, Giordano MO, Masachessi G, et al. Long-lasting poliovirus-neutralizing antibodies among Argentinean population immunized with four or five oral polio vaccine doses 1 month to 19 years previously. Viral Immunol. 2007;20(1):3-10. [Link]
62 Pírez MC, Olivera I, Diabarboure H, Montano A, Baranano R, Badía F, et al. Seroprevalence of anti-polio antibodies in a population 7 months to 39 years of age in Uruguay: implications for future polio vaccination strategies. Vaccine. 2009;27(20):2689-94. Doi:10.1016/j.vaccine.2009.02.042. [Link]
63 Luchs A, Cilli A, Russo DH, Costa FF, Carmona RCC, Timenetsky MCST. Monitoring of poliovirus neutralizing antibodies in São Paulo State, Brazil. Trans R Soc Trop Med Hyg. 2010;104(9):625-7. Doi:10.1016/j.trstmh.2010.05.004. [Link]
64 Pliaka V, Ruether IG, Kyriakopoulou Z, Kioussi P, Plakokefalos E, Megalou M, et al. A seroprevalence study of poliovirus antibody against a collection of recombinant and non-recombinant poliovirus vaccine strains in the population of southern Greece. Clin Microbiol Infect. 2010 Nov;16(11):1672-5. Doi:10.1111/j.1469-0691.2010.03188.x. [Link]
65 John J, Abraham AM, Muliyil J, John TJ, Deshpande JM, Kang G. Gap in the prevalence of neutralising antibodies to polioviruses in antenatal women in southern India. Trans R Soc Trop Med Hyg. 2011;105(3):179-80. Doi:10.1016/j.trstmh.2010.12.005. [Link]
66 Reinheimer C, Friedrichs I, Rabenau HF, Doerr HW. Deficiency of immunity to poliovirus type 3: a lurking danger? BMC Infect Dis. 2012 Jan;12:24. Doi:10.1186/1471-2334-12-24. [Link]
67 Külshammer M, Winke U, Frank M, Skali-Lami U, Steudel H, Schilling G, et al. Poor immunity status against poliomyelitis in medical students: a semi-anonymous study. Med Microbiol Immunol. 2013 Feb;202(1):63-5. Doi:10.1007/s00430-012-0237-2. [Link]
68 Baldo V, Baldovin T, Cocchio S, Lazzari R, Saracino E, Bertoncello C, et al. Seroepidemiology of polioviruses among university students in northern Italy. Clin Vaccine Immunol. 2012 Aug;19(8):1292-5. Doi:10.1128/CVI.00054-12. [Link]
69 Lai FY, Thoon KC, Ang LW, Tey SH, Heng D, Cutter JL, et al. Comparative seroepidemiology of pertussis, diphtheria and poliovirus antibodies in Singapore: waning pertussis immunity in a highly immunized population and the need for adolescent booster doses. Vaccine. 2012 May;30(24):3566-71. Doi:10.1016/j.vaccine.2012.03.059. [Link]
70 Lee HC, Tay J, Kwok CY, Wee MK, Ang LW, Kita Y, et al. Certification of poliomyelitis eradication in Singapore and the challenges ahead. Ann Acad Med Singapore. 2012 Nov;41(11):518-28. [Link]
71 Grimprel E, von Sonnenburg F, Sänger R, Abitbol V, Wolter JM, Schuerman LM. Combined reduced-antigen-content diphtheria-tetanus-acellular pertussis and polio vaccine (dTpa-IPV) for booster vaccination of adults. Vaccine. 2005 May;23(28):3657-67. [Link]
72 O'Reilly KM, Durry E, ul Islam O, Quddus A, Abid N, Mir TP, et al. The effect of mass immunisation campaigns and new oral poliovirus vaccines on the incidence of poliomyelitis in Pakistan and Afghanistan, 2001-11: a retrospective analysis. Lancet. 2012 Aug;380(9840):491-8. Doi:10.1016/S0140-6736(12)60648-5. [Link]
73 Abbink F, Buisman AM, Doornbos G, Woldman J, Kimman TG, Conyn-van Spaendonck MA, et al. Poliovirus-specific memory immunity in seronegative elderly people does not protect against virus excretion. J Infect Dis. 2005 Mar;191(6):990-9. [Link]
74 Gregory CJ, Ndiaye S, Patel M, Hakizamana E, Wannemuehler K, Ndinga E, et al. Investigation of elevated case-fatality rate in poliomyelitis outbreak in Pointe Noire, Republic of Congo, 2010. Clin Infect Dis. 2012 Nov;55(10):1299-306. Doi:10.1093/cid/cis715. [Link]
75 Patel MK, Konde MK, Didi-Ngossaki BH, Ndinga E, Yogolelo R, Salla M, et al. An outbreak of wild poliovirus in the Republic of Congo, 2010-2011. Clin Infect Dis. 2012 Nov;55(10):1291-8. Doi:10.1093/cid/cis714 [Link]
76 Dias-Tosta E, Kückelhaus CS. Neurological morbidity in vaccine-associated paralytic poliomyelitis in Brazil from 1989 up to 1995. Arq Neuropsiquiatr. 2004 Jun;62(2B):414-20. Doi:10.1590/S0004-282X2004000300008 [Link]
77 Teixeira-Rocha ES, Carmo EH, Tavares-Neto J. The occurrence of vaccine-associated paralytic poliomyelitis in Brazil, 1995 to 2001. Rev Panam Salud Publica. 2005 Jul;18(1):21-4. Doi:10.1590/S102049892005000600004 [Link]
78 Combelas N, Holmblat B, Joffret ML, Colbère-Garapin F, Delpeyroux F. Recombination between poliovirus and coxsackie. A viruses of species C: a model of viral genetic plasticity and emergence. Viruses. 2011 Aug;3(8):1460-84. Doi:10.3390/v3081460 [Link]
79 Grassly NC, Jafari H, Bahl S, Sethi R, Deshpande JM, Wolff C, et al. Waning intestinal immunity after vaccination with oral poliovirus vaccines in India. J Infect Dis. 2012 May;205(10):1554-61. Doi:10.1093/infdis/jis241 [Link]
80 Mueller JE, Bessaud M, Huang QS, Martinez LC, Barril PA, Morel V, et al. Environmental poliovirus surveillance during oral poliovirus vaccine and inactivated poliovirus vaccine use in Córdoba Province, Argentina. Appl Environ Microbiol. 2009 Mar;75(5):1395-401. Doi:10.1128/AEM.02201-08 [Link]
81 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Coordenação Geral do Programa Nacional de Imunizações. Informe técnico da introdução da vacina inativada da poliomielite. Portal da saúde [Internet] [citado em 2012 ago 2]. Disponível em: http://portal.saude.gov.br/portal/arquivos/pdf/informe_introducao_vacina_inativada_polio_vip_2012.pdf.
82 Pliaka V, Kyriakopoulou Z, Markoulatos P. Risks associated with the use of live-attenuated vaccine poliovirus strains and the strategies for control and eradication of paralytic poliomyelitis. Expert Rev Vaccines. 2012 May;11(5):609-28. Doi:10.1586/erv.12.28 [Link]
83 Arya SC, Agarwal N. Apropos risks associated with the use of live-attenuated vaccine poliovirus strains and the strategies for control and eradication of paralytic poliomyelitis. Expert Rev Vaccines. 2012 Nov;11(11):1291. Doi:10.1586/erv.12.110 [Link]
84 Guthmann JP, Fonteneau L, Ciotti C, Bouvet E, Pellissier G, Lévy-Bruhl D, et al. Vaccination coverage of health care personnel working in health care facilities in France: results of a national survey, 2009. Vaccine. 2012 Jun;30(31):4648-54. Doi:10.1016/j.vaccine.2012.04.098 [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Lucia Ferro Bricks
Diretora em Saúde Pública Sanofi Pasteur
Divisão de Vacinas do Grupo Sanofi, Brasil
Av. Sylvio de Magalhães Padilha, 5200.
Bairro: Jardim Morumbi
CEP: 01246-902
São Paulo-São Paulo-Brasil
Tel.: +55 (11) 3759-6260 / (11) 9155-3913
E-mail: lucia.bricks@sanofipasteur.com
Recebido em / Received / Recibido en: 8/1/2013
Aceito em / Accepted / Aceito en: 21/6/2013











 Curriculum ScienTI
Curriculum ScienTI