Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.4 n.4 Ananindeua dic. 2013
http://dx.doi.org/10.5123/S2176-62232013000400008
COMUNICAÇÃO | COMMUNICATION | COMUNICACIÓN
Produção de ácido lático e viabilidade celular de Lactobacillus plantarum inoculado em caldo de cana-de-açúcar (Saccharum spp.) suplementado
Lactic acid production and cell viability of Lactobacillus plantarum inoculated into sugarcane juice (Saccharum spp.) supplemented
Producción de ácido láctico y viabilidad celular de Lactobacillus plantarum inoculado en melaza de caña de azúcar (Saccharum spp.) suplementada
Débora Francielly de OliveiraI; Ivane Benedetti TonialI; Claudia Eugênia Castro BravoII
ILaboratório de Química de Alimentos, Departamento de Tecnologia de Alimentos, Universidade Tecnológica Federal do Paraná, Francisco Beltrão, Paraná, Brasil
IILaboratório de Microbiologia de Alimentos, Departamento de Tecnologia de Alimentos, Universidade Tecnológica Federal do Paraná, Francisco Beltrão, Paraná, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
A inoculação de silagem com bactérias láticas representa um avanço tecnológico eficiente porque garante uma elevada concentração inicial de tais bactérias que, em condições favoráveis, multiplicam-se, garantindo produção intensiva de ácido lático e fermentação de forma rápida e eficiente. Considerando que vários subprodutos e matérias primas têm sido utilizados como meio de cultura viável para o crescimento de microrganismos de interesse biotecnológico, o estudo objetivou verificar a melhor composição de um meio de cultura constituído de caldo de cana-de-açúcar em diferentes concentrações de sólidos solúveis (oBrix), extrato de levedura e sulfato de amônia, tomados no estudo como variáveis independentes e avaliados em três níveis equidistantes de variação por meio de desenho experimental de combinação central 23 por metodologia de superfície de resposta (MSR), tendo sido avaliadas como funções resposta a produção de ácido lático e células viáveis de Lactobacillus plantarum, essas, variáveis dependentes. O meio de cultura constituído de caldo de cana-de-açúcar a 5 oBrix suplementado com 1,1% de extrato de levedura e 1,1% de sulfato de amônia, foi a melhor condição para a produção de ácido lático (1,53%) e de células viáveis (8,63 log UFC mL-1) de L. plantarum.
Palavras-chave: Lactobacillus plantarum; Saccharum spp.; Ácido Lático.
ABSTRACT
Silage inoculation with lactic bacteria is an efficient technological advance used for ensuring high initial concentration of those bacteria that are multiplied in good conditions, allowing intensive lactic acid production and a prompt and efficient fermentation. Whereas many subproducts and raw materials have been used as a viable culture medium for microorganism growth of biotechnological interest, this study aimed to verify the best composition of a culture medium, and had sugarcane juice in different soluble solids concentrations (oBrix), yeast extract and ammonium sulfate as independent variables which were evaluated in three equidistant levels of variation through experimental design of 23 central combination by response surface methodology (RSM); the dependent variables were lactic acid production and Lactobacillus plantarum viable cells, both denoted as response function. The best condition for lactic acid production (1.53%) and L. plantarum viable cells (8.63 log CFU mL-1) was the culture medium containing sugarcane juice at 5 oBrix, supplemented with 1.1% yeast extract, and 1.1% ammonium sulfate.
Keywords: Lactobacillus plantarum; Saccharum spp.; Lactic Acid.
RESUMEN
El inoculado del ensilaje con bacterias lácticas representa un avance tecnológico eficiente por que garantiza una elevada concentración inicial de tales bacterias que, en condiciones favorables, se multiplican, garantizando la producción intensiva de ácido láctico y la fermentación de forma rápida y eficiente. Considerando que varios subproductos y materias primas han sido utilizadas como medio de cultivo viable para el crecimiento de microorganismos de interés biotecnológico, el estudio tuvo como objetivo comprobar la mejor composición de un medio de cultivo constituido de melaza de caña de azúcar en diferentes concentraciones de sólidos solubles (oBrix), extracto de levadura y sulfato de amonio, tomados en el estudio como variables independientes y evaluados en tres niveles equidistantes de variación, a través de diseño experimental de combinación central 23 por metodología de superficie de respuesta (RSM), habiendo sido evaluadas como funciones respuesta a la producción de ácido láctico y células viables de Lactobacillus plantarum, estas, variables dependientes. El medio de cultivo constituido por melaza de caña de azúcar a 5 oBrix suplementado con 1,1% de extracto de levadura y 1,1% de sulfato de amonio fue la mejor condición para la producción de ácido láctico (1,53%) y de células viables (8,63 log de UFC mL-1) de L. plantarum.
Palabras clave: Lactobacillus plantarum; Saccharum spp.; Acido Láctico.
INTRODUÇÃO
As bactérias ácido-láticas (BAL) têm sido estudadas na aplicação em silagens usadas para a alimentação animal. No entanto, para o crescimento numeroso de BAL é necessário o fornecimento de nutrientes específicos e em quantidades ideais1. As BAL que estão regularmente associadas à fermentação de silagem são as espécies dos gêneros Lactobacillus, Pediococcus, Leuconostoc, Enterococcus, Lactococcus e Streptococcus2.
A aplicação de inoculantes biológicos em silagens implica na adição de BAL em quantidade suficiente para dominar o processo fermentativo e produzir rapidamente ácido lático, favorecendo a diminuição do pH que, junto com o peróxido de hidrogênio (H2O2) e as bacteriocinas produzidas no processo de fermentação, auxiliam na preservação e melhoram as propriedades nutritivas da silagem3.
O meio de cultura formulado por De Man et al4 está entre os meios comumente mais usados para o crescimento de Lactobacillus. No entanto, este meio de cultura inclui componentes muito caros para aplicações industriais5. Sabe-se que por ser o meio de cultura Man, Rajosa e Sharpe (MRS) constituído com 0,4% de extrato de levedura, a utilização de um meio de cultivo com quantidades elevadas de extrato de levedura torna-se inviável, em função do alto custo desse constituinte. Este estudo propôs a redução do percentual de 0,4% para 0,1% de extrato de levedura na formulação do meio de cultura, sugerindo uma melhor relação custo-benefício.
Estudos pertinentes, relatados na literatura, foram realizados para encontrarem-se meios de cultivo mais baratos para favorecer o crescimento de Lactobacillus em escala industrial. Esses meios incluíram carboidratos e fontes de nitrogênio, tais como soro de leite6, melaço de cana7, hidrolisados de farelo de trigo combinado com milhocina8 e vinhaça de trigo e melaço de açúcar de beterraba5. A maioria desses estudos destinou-se somente a otimizar o meio de cultura para a produção de ácido lático, com exceção dos realizados por Krzywonos e Eberhard5, que estudaram meio de cultura alternativo visando baixar o custo para a produção de biomassa de L. plantarum e ácido lático.
Poucos trabalhos podem ser encontrados na literatura sobre um processo viável e eficiente para a produção de ácido lático e, também, de viabilidade celular da cultura estudada. Entre os existentes, nota-se o que trata da produção de biomassa de Lactobacillus casei9.
A MSR é uma das técnicas mais eficientes para a otimização de processos. Ela tem como objetivo principal determinar as condições para operação ótima de um sistema, ou determinar a região do espaço dos fatores que satisfazem as condições de operação. Essa metodologia é utilizada com êxito na indústria química e, nos últimos anos, tem tido aplicação na microbiologia, para a formulação de meios de cultivo, inclusive na produção de enzimas por processos fermentativos, usando extrato de levedura e glicose, entre outros componentes10.
Este trabalho propôs-se a avaliar os efeitos da adição de extrato de levedura e sulfato de amônia sobre a fermentação lática por Lactobacillus plantarum em caldo de cana-de-açúcar (5, 10 e 15 oBrix), bem como a otimização da produção de ácido lático e células viáveis por meio da MSR.
MATERIAIS E MÉTODOS
AMOSTRAGEM E LOCAL DE CONDUÇÃO DO ESTUDO
O experimento foi conduzido na Universidade Tecnológica Federal do Paraná, Campus Francisco Beltrão. A bactéria ácido lática utilizada foi Lactobacillus plantarum (ATCC 4005), mantida em tubos de ensaio contendo meio de cultura MRS4, específicos para cultivo de bactérias láticas, no qual o microrganismo foi ativado através de repiques sucessivos realizados a cada 48 h.
PREPARO DO MEIO E CULTIVO DE L. PLANTARUM
O caldo de cana-de-açúcar foi diluído em água destilada para obtenção das concentrações de oBrix (quantidade de compostos solúveis, ou seja, açúcares na solução) correspondentes aos níveis desta variável (A) no delineamento estatístico indicado na tabela 1. O caldo de cana-de-açúcar foi suplementado com extrato de levedura (B) e sulfato de amônia (C) e o pH ajustado para 6,2. O processo fermentativo foi desenvolvido utilizando frascos erlenmeyers de 250 mL contendo 50 mL do respectivo meio de cultivo. Os inóculos de 1% (v/v) foram transferidos para o caldo de cana-de-açúcar (estéril) suplementado com extrato de levedura e sulfato de amônia, posteriormente incubados à temperatura de 37o C por 72 h. Após o processo fermentativo, a viabilidade celular foi determinada por meio da técnica de contagem em placas, utilizando ágar MRS, tendo o caldo sido centrifugado durante 10 min com força centrífuga de 2.000 x g, e submetido à determinação de ácido lático de acordo com Taylor11.

PLANEJAMENTO EXPERIMENTAL
Foram investigadas três variáveis independentes: caldo de cana-de-açúcar (oBrix), extrato de levedura e sulfato de amônia, representadas por A, B e C, respectivamente, por meio da MSR, um método de planejamento de experimentos para otimização de processos. Estas variáveis foram avaliadas em três níveis equidistantes de variação, por meio do desenho experimental de combinação central 23, obtendo 16 diferentes tratamentos, conforme demonstrado na tabela 1. A resposta avaliada foi a produção de ácido lático e células viáveis de L. plantarum (variáveis dependentes).
DETERMINAÇÃO DE ÁCIDO LÁTICO
A quantificação do ácido lático foi obtida por método espectrofotométrico na região do espectro visível, tendo o comprimento de onda sido fixado a 570 nm11. A formação dos grupos cromógenos absorventes de luz se deu por meio de reação prévia, a quente, entre ácido sulfúrico PA e o ácido lático produzido durante a fermentação.
DETERMINAÇÃO DE CÉLULAS VIÁVEIS
Para a determinação de células viáveis de L. plantarum utilizou-se a técnica de semeadura por profundidade em placas de petri contendo ágar MRS, as quais foram previamente incubadas em estufa durante 48 h a uma temperatura de 37o C, para depois serem submetidas à contagem de unidades formadoras de colônias por mL de caldo fermentado (UFC mL-1).
RESULTADOS
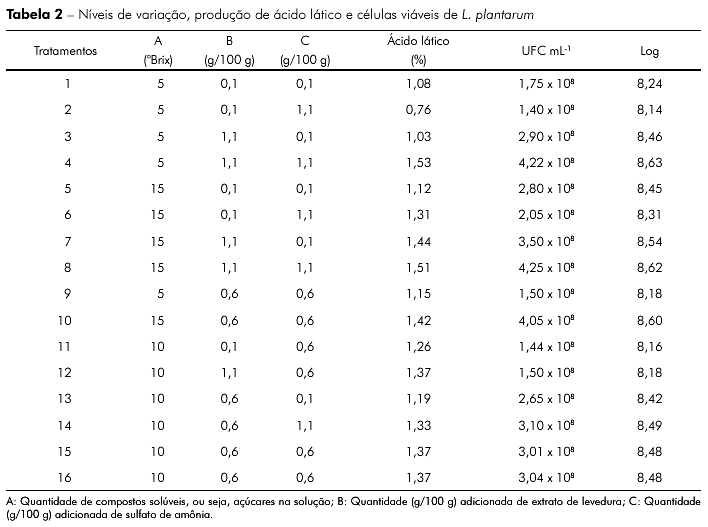
Na tabela 2 são demonstrados os níveis de variação utilizados no meio de cultura, produção de ácido lático e células viáveis de L. plantarum nas diferentes condições.
DISCUSSÃO
A composição do meio, bem como as condições de cultivo, são essenciais para um bom crescimento da cultura iniciadora. Os resultados obtidos mostram a melhor composição de meio de cultivo tendo como base caldo de cana-de-açúcar suplementado com extrato de levedura e sulfato de amônia.
Conforme pode ser observado na tabela 1, o melhor resultado experimental para contagem de células viáveis e produção de ácido lático foi obtido no tratamento 4, constituído de caldo de cana-de-açúcar 5 oBrix suplementado com 1,1% de extrato de levedura e 1,1% de sulfato de amônia. A condição que pareceu menos adequada para o crescimento bacteriano e produção de ácido lático foi obtida no tratamento 2, constituído de caldo de cana-de-açúcar 5 oBrix suplementado com 0,1% de extrato de levedura e 1,1% de sulfato de amônia. Utilizando a MSR foi possível intrapolar entre os valores mínimos e máximos das variáveis estudadas (oBrix, extrato de levedura e sulfato de amônia), predizendo que o meio de cultivo com cana-de-açúcar a 12 oBrix suplementado com 1,1% de extrato de levedura e 0,6% de sulfato de amônia também ocasionaria condição favorável para a produção de ácido lático (1,50%).
Ao estudarem a influência da adição de aditivos (sulfato de amônia e ureia) em silagens de cana-de-açúcar, Bravo-Martins et al12 verificaram que a população de BAL nas silagens sem aditivos foi de aproximadamente 8.62 log UFC g-1 de silagem, enquanto que nas silagens contendo 1% de sulfato de amônia e 1% de ureia a contagem foi 6,40 e 6,54 log UFC g-1 de silagem, respectivamente. Oliveira et al13 verificaram que o meio de cultivo à base de melaço de cana-de-açúcar, suplementado com 2% de extrato de levedura e 2% de peptona, atingiu bons resultados para a produção de ácido e viabilidade celular de Lactobacillus casei. Krzywonos e Eberhard5 constataram que a combinação de vinhaça de trigo, melaço de beterraba e extrato de levedura obteve bons resultados para o cultivo de bactérias produtoras de ácido lático, tendo demonstrado que o meio de cultura avaliado poderia ser utilizado para a produção de BAL em escala industrial.
A população de bactérias ácido-láticas mostrou-se superior a 6 log UFC g-1 de silagem em todos os experimentos deste estudo, o que corrobora com os estudos de Muck14 e Pereira et al15, os quais relataram que concentrações inferiores a esse valor podem acarretar perdas significativas durante o processo fermentativo de silagens.
CONCLUSÃO
A cepa L. plantarum ATCC 4005 demonstrou potencial de aplicação em silagens como cultura iniciadora. Com base nos resultados preliminares, sugere-se que o uso de meio de fermentação constituído de caldo de cana-de-açúcar suplementado, nas condições experimentais, com extrato de levedura e sulfato de amônia, forneça nutrientes necessários para o desenvolvimento de L. plantarum, podendo ser utilizado para a obtenção de produtos de valor agregado como a biomassa de BAL e ácido lático em substituição aos meios tradicionais. No entanto, é necessária a continuidade do estudo.
APOIO FINANCEIRO
A pesquisa foi fomentada pela Universidade Tecnológica Federal do Paraná e Fundação Araucária de Apoio ao Desenvolvimento Científico e Tecnológico por meio de concessão de bolsa.
REFERÊNCIAS
1 Dumbrepatil A, Adsul M, Chaudhari S, Khire J, Gokhale D. Utilization of molasses sugar for lactic acid production by Lactobacillus delbrueckii subsp. delbrueckii mutant uc-3 in batch fermentation. Appl Environ Microbiol. 2008 Jan;74(1):333-5. Doi:10.1128/AEM.01595-07 [Link]
2 Coan RM, Reis RA, Rojas Garcia G, Schocken-Iturrino RP, Ferreira DS, Resende FD, et al. Dinâmica fermentativa e microbiológica de silagens dos capins tanzânia e marandu acrescidas de polpa cítrica peletizada. Rev Bras Zootec. [Internet]. 2007 set-out [citado 2013 jan 12];36(5):1502-11. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S151635982007000700007. Doi:10.1590/S1516-35982007000700007 [Link]
3 Gollop N, Zakin V, Weinberg ZG. Antibacterial activity of lactic acid bacteria included in inoculants for silage and in silages treated with these inoculants. J Appl Microbiol. 2005 Mar;98(3):662-6. Doi:10.1111/j.1365-2672.2004.02504.x [Link]
4 De Man JD, Rogosa M, Sharpe ME. A medium for the cultivation of Lactobacilli. J Appl Bacteriol. 1960 Apr;23(7):130-5. Doi:10.1111/j.1365-2672.1960.tb00188.x [Link]
5 Krzywonos M, Eberhard T. High density process to cultivate Lactobacillus plantarum biomass using wheat stillage and sugar beet molasses. Electron J Biotechnol. 2011 Mar;14(2):99-105. Doi: 10.2225/vol14-issue2-fulltext-10 [Link]
6 Mondragón-Parada ME, Nájera-Martínez M, Juárez-Ramírez C, Galíndez-Mayer J, Ruiz-Ordaz N, Cristiani-Urbina E. Lactic acid bacteria production from whey. Appl Biochem Biotechnol. [Internet]. 2006 [cited 2013 Jan 12];134(3):223-32. Available from: http://www.mendeley.com/research/lactic-acid-bacteria-production-whey/. Doi:10.1385/ABAB:134:3:223.
7 Tondee T, Sirianuntapiboon S. Decolorization of molasses wastewater by Lactobacillus plantarum No. PV71-1861. Bioresour Technol. 2008 Sep;99(14):6258-65. Doi:10.1016/j.biortech.2007.12.028 [Link]
8 Zheng L, Lu H, Yizhi J, Xiaonan W, Tianwei T. Fermentative production of l-lactic acid from hydrolysate of wheat bran by Lactobacillus rhamnosus. Bioch Eng J. 2010 Mar;49(1):138-42. Doi:10.1016/j.bej.2009.10.014 [Link]
9 Aguirre-Ezkaurialza EJ, Aguilar-Yáñez JM, Ramírez-Medrano A, Alvarez MM. Production of probiotic biomass (Lactobacillus casei) in goat milk whey: comparison of batch, continuous and fed-batch cultures. Bioresour Technol. 2010 Apr;101(8):2837-44. Doi:10.1016/j.biortech.2009.10.047 [Link]
10 Udeh KO, Achremowicz B. Optimization of cultivation medium composition of an L-lysine producing mutant: the use of response surface methodology. Acta Microbiol Polonic. 1993;42(2):171-80. [Link]
11 Taylor KACC. A simple colorimetric assay for muramic and lactic acid. Appl Biochem Biotechnol. 1996 Jan;56(1):49-58. Doi:10.1007/BF02787869 [Link]
12 Bravo-Martins CEC, Carneiro H, Castro-Gómez RJH, Figueiredo HCP, Schwan RF. Chemical and microbiological evaluation of ensiled sugar cane with different additives. Braz J Microbiol. 2006 Oct-Dec;37(4):499-504. Doi:10.1590/S1517-83822006000400018 [Link]
13 Oliveira RF, Sousdaleff M, Lima MVS, Lima HOS. Produção fermentativa de ácido lático a partir do melaço da cana-de-açúcar por Lactobacillus casei: VII BMCFB. Braz J Food Technol. [Internet]. 2009 jun [citado 2013 jan 8];12:34-40. Disponível em: http://bjft.ital.sp.gov.br/artigos/especiais/especial_2009_2/v12ne_t0081.pdf.
14 Muck RE. Factors influencing silage quality and they implications for management. J Dairy Sci. 1988 Nov;71(11):2992-3002. Doi:10.3168/jds.S0022-0302(88)79897-5 [Link]
15 Pereira OG, Rocha KD, Ferreira CLLF. Composição química, caracterização e quantificação da população de microrganismos em capim-elefante cv. Cameroon (Pennisetum purpureum, Schum.) e suas silagens. Rev Bras Zootec. 2007 nov-dez;36(6):1742-50. Doi:10.1590/S1516-35982007000800006 [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Débora Francielly de Oliveira
Laboratório de Química de Alimentos,
Departamento de Tecnologia de Alimentos,
Universidade Tecnológica Federal do Paraná
Rua Porto Alegre, 909, apto. 12. Bairro: Alvorada
CEP: 85480-000 Francisco Beltrão-Paraná-Brasil
Tel.: (46) 3525-3445
E-mail: deborafolhe@hotmail.com
Recebido em / Received / Recibido en: 22/4/2013
Aceito em / Accepted / Aceito en: 1/10/2013













