INTRODUÇÃO
Os adenovírus pertencem à família Adenoviridae, gênero Mastadenovirus, que contém sete espécies diferentes (A a G), constituídas por 67 tipos1),(2),(3),(4.
Em virtude da emergência de novas tecnologias de biologia molecular, a revelação de novos vírus tem sido comumente relatada e, recentemente, foi sugerido um novo tipo de adenovírus - tipo 68 da espécie B. Os 51 tipos pré-existentes de adenovírus foram identificados por métodos sorológicos tradicionais, levando em consideração a composição viral e a patogenicidade, diferentemente dos tipos 52 a 68 que foram identificados por meio do sequenciamento genômico e análises de bioinformática5.
Os adenovírus humanos (HAdV) são vírus não envelopados de 90 nm de diâmetro, simetria icosaédrica, com genoma de ADN de fita dupla, contendo em média 36 Kb. O vírion é constituído de 11 proteínas (II, III, IIIa, IV, V, VI, VII, VIII, IX, X e TP); sete das quais estão no capsídeo (II, III, IIIa, IV, VI, VIII e IX), que é composto por 252 subunidades de capsômeros. Destas, 240 são constituídas pela proteína héxon (pII) - as quais compõem as faces do icosaedro - e as demais (12 capsômeros) são compostas pelas proteínas penton-base (pIII) e fibra (pIV) que juntas compõem o vértice viral1.
Nos HAdV, destaca-se como determinante viral de infecção, a região globular carboxi-terminal (C-terminal) da fibra que é a responsável pelo reconhecimento do receptor primário, adsorvendo a partícula viral à célula. Enquanto que os receptores celulares são importantes determinantes de infecção do hospedeiro, e no caso dos HAdV o principal é denominado de CAR (receptor para adenovírus e coxsackievírus)6. A fibra viral desempenha uma importante função na infecção celular e esse fato é demonstrado quando a infecção, com partículas virais sem fibras, fica profundamente comprometida, desse modo, a boa interação entre a região globular da fibra e o receptor celular é de extrema importância para o sucesso da infecção viral7),(8),(9.
A capacidade que o vírus tem de infectar seletivamente um subconjunto determinado de células, denominado histotropismo viral, é influenciado pelos receptores celulares reconhecidos pela fibra e pelo penton. Logo, é de se esperar que os adenovírus não apresentem tropismo definido, visto que seu receptor principal é expresso em quase todas as células epiteliais10. Portanto, a patogenia dos HAdV variam de acordo com a espécie, embora possam causar infecções assintomáticas, também podem levar diferentes quadros clínicos que incluem infecções respiratórias, gastrointestinais, urinárias e oculares, além de serem vírus com capacidade de permanecerem latentes no hospedeiro humano. A duração de excreção viral no início dos sintomas é de uma semana em infecções respiratórias e de duas semanas em infecções oculares, assim como na urina e nas fezes11),(12.
Recentes investigações têm demonstrado que os HAdV podem estar implicados na gênese de infecções do sistema nervoso central (SNC), tal como, menigoencefalite, encefalite e paralisia flácida aguda (PFA)13),(14),(15),(16),(17),(18.
O presente estudo teve como objetivo identificar e caracterizar os adenovírus em casos de PFA, os quais eram negativos para poliovírus e enterovírus não pólio.
MATERIAIS E MÉTODOS
AMOSTRAS
A amostra fecal foi o material clínico utilizado no presente estudo por ser considerado o espécime de escolha para pesquisa de agentes entéricos como o adenovírus. Essas amostras pertenciam ao Programa da Rede de Vigilância Nacional para PFA, recebidas no Laboratório de Enterovírus do Instituto Evandro Chagas (IEC), e que foram negativas para poliovírus e enterovírus não pólio no período de 1998 a 2012. O estudo foi apreciado pelo Comitê de Ética em Pesquisa do IEC, no 0027/2008, aprovado em 29 de abril de 2009.
PREPARO DAS SUSPENSÕES FECAIS
As suspensões das amostras fecais foram preparadas de acordo com a metodologia descrita no Polio Laboratory Manual (World Health Organization -WHO)19. Para o procedimento foram adicionados 10 mL de PBS (tampão fosfato salino - phosphate-buffered saline) suplementado com penicilina e estreptomicina, 1 g de pérolas de vidro de aproximadamente 3 mm de diâmetro e 1 mL de clorofórmio em tubo de polietileno. Em seguida, foram transferidas aproximadamente 2 g de cada amostra fecal para o tubo correspondente, com movimentação vigorosa por 20 min usando um agitador mecânico, centrifugando-se por 20 min a 1.500 g em centrífuga refrigerada a 8o C. O sobrenadante foi armazenado a -20o C para uso posterior.
PROPAGAÇÃO VIRAL EM CULTURA DE CÉLULAS
As amostras foram submetidas ao cultivo em células HEp-2 (carcinoma epidermoide de laringe humana) e L20-B (células de camundongo que expressam receptor para poliovírus). Esses cultivos foram mantidos em garrafas plásticas contendo MEM (minimum essential medium) com sais de Eagle, acrescido de bicarbonato de sódio na concentração de 1,5 g/L, soro bovino fetal 10%, L-glutamina 4 mM, HEPES (ácido N-(2-hidroxietil)-piperazina-N'-2-etanessulfónico) 10 mM, penicilina 100 U/mL e estreptomicina 100 µ.g/mL.
Para a inoculação, inicialmente a monocamada foi lavada duas vezes com 2 mL de solução de PBS e foram adicionados 500 µL da suspensão fecal, e mantido para adsorção por 30 min na estufa a 37o C. Após a adsorção, adicionaram-se 7,5 mL de MEM a 2% de soro bovino fetal.
As garrafas foram observadas ao microscópio ótico invertido de sete a nove dias para visualização do efeito citopático (ECP). As amostras que apresentaram ECP foram usadas para testes de biologia molecular. As negativas foram congeladas e descongeladas e submetidas a uma nova inoculação (passagem), sendo realizado, no máximo, até três passagens.
CARACTERIZAÇÃO MOLECULAR
A extração do DNA viral foi realizada a partir do vírus isolado em cultura, utilizando do kit QIAamp® DNA Stool Mini Kit (Qiagen, Alemanha) disponível comercialmente, seguindo o protocolo descrito pelo fabricante.
Após a extração, as amostras foram submetidas à reação em cadeia mediada pela polimerase (PCR) em tempo real (qPCR) utilizando iniciadores e sondas específicos para os adenovírus20. Para as amostras positivas na qPCR, foi realizada uma nova PCR, tal como descrito na literatura21, contudo, utilizando iniciadores universais Ad1 (TTCCCCATGGCICAYAACAC) e Ad2 (CCCTGGTAKCCRATRTTGTA)22 que amplificam um fragmento de 482 pb de uma região do gene héxon conservada entre todos os tipos humanos reconhecidos.
As amostras positivas na PCR foram purificadas pelo kit QIAquick® PCR Purification (Qiagen, Alemanha), seguindo o protocolo descrito pelo fabricante, e então sequenciadas pelo método de Sanger23, segundo o fabricante do kit BigDye® Terminator (Applied Biosystems, EUA). O produto dessa reação foi precipitado com isopropanol e ressuspenso em formamida, seguido de eletroforese em sequenciador automático (ABI PRISM 3130 xl, Applied Biosystems, EUA).
As sequências nucleotídicas foram editadas e analisadas utilizando-se o programa Geneious Pro (Biometters, Nova Zelândia). Posteriormente foram comparadas com as sequências contidas no GenBank (http://www.ncbi.nlm.nih.gov/genbank/), usando o programa Blast, para determinação do tipo e confirmação da identidade viral. O programa jModeltest 2.024 define o modelo mais adequado de substituição nucleotídica empregado para as sequências, de acordo com o critério de informação Akaike (CIA). Para a construção da árvore filogenética foi realizado o método de máxima verossimilhança (maximum likelihood - ML), usando o programa RAxML25.
RESULTADOS
Levando em consideração os critérios de estudo, 19 amostras foram positivas em HEp-2 e L20-B, com ECP compatível com o isolamento dos adenovírus, caracterizado por células aglomeradas que lembram a formação de "cachos", ocorrendo em seguida a contração da camada celular, provocando a dissociação da superfície da cultura deixando as células soltas no sobrenadante (Figura 1).

A: Controle negativo em células HEp-2; B: Cultura celular infectada após 24 h de inoculação em células HEp-2; C: Controle negativo em células L20B; D: Cultura celular infectada após 24 h de inoculação em células L20B.
Figura 1 - Efeito citopático semelhante ao causado por adenovírus em células HEp-2 (Figuras A e B) e L20B (Figuras C e D) obtidos por microscopia óptica de inversão 20x
Dos 19 isolamentos, 13 (68,4%) foram confirmados por qPCR. Os outros seis foram negativos para HAdV em qPCR e PCR; desse modo, as amostras foram consideradas como não tipadas. Dados do sequenciamento estão dispostos na figura 2 e tabela 1.
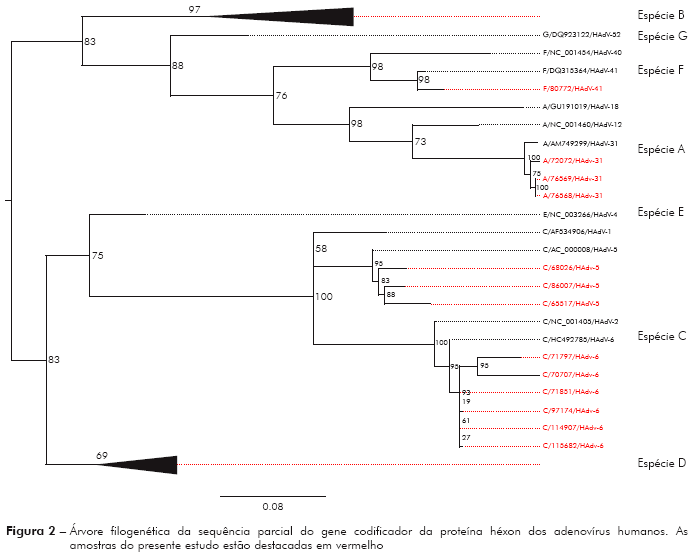
Figura 2 - Árvore filogenética da sequência parcial do gene codificador da proteína héxon dos adenovírus humanos. As amostras do presente estudo estão destacadas em vermelho
Considerando a positividade das amostras, 6/13 (46,2%) são oriundas do Estado do Amazonas, 6/13 (46,2%) do Estado do Pará e1/13 (7,6%) do Acre, não havendo positividade nos outros Estados da região. Com relação à faixa etária, dos 13 casos positivos, 12 são de crianças menores de 5 anos de idade, representando 92,3% dos casos. E quanto ao sexo, oito casos (61,5%) correspondem ao masculino e cinco ao feminino (38,5%). Todos esses dados estão demonstrados na tabela 1.
DISCUSSÃO
Após a erradicação do poliovírus selvagem no Brasil, a participação de outros agentes virais tais como os adenovírus, com capacidade de causar doença no SNC, tornou-se mais aparente26),(27. No presente estudo foram isolados 13 HAdV das amostras de pacientes com PFA.
Achados semelhantes foram detectados na Finlândia durante a vigilância de pacientes com PFA, onde se detectaram quatro HAdV provenientes de amostras negativas para poliovírus e enterovírus28. Na China, em 5,7% das amostras isoladas a partir de casos de PFA, foi identificado o adenovírus29.
Em concordância com resultados anteriormente descritos em 1997, na Malásia, adenovírus da espécie B foram isolados de crianças com PFA que chegaram a óbito durante uma epidemia da doença mão-pé-boca13.
No período de 1997 a 2002 foram pesquisados casos de PFA que ocorreram no Brasil, Peru e Bolívia, isolando-se os HAdV a partir de espécimes fecais de casos suspeitos de PFA, sendo identificadas as seguintes espécies: A (três isolamentos), B (20 isolamentos), C (38 isolamentos), D (dois isolamentos) e E (um isolamento), atribuindo-se aos adenovírus da espécie B (31,3%) o possível envolvimento como agente etiológico da PFA17.
Diferentemente dos achados anteriormente referidos, os resultados obtidos no presente estudo demonstraram que os adenovírus da espécie C foram mais frequentemente encontrados nos casos de PFA, seguidos das espécies AeF. Tais espécies possuem tropismo pelo trato gastrointestinal, provocando gastroenterites e podendo ser isolados naturalmente das fezes11),(12. O seu papel para doença degenerativa não foi considerado no presente estudo, uma vez que foi utilizada suspensão fecal para o isolamento viral. Desse modo, foram considerados apenas os adenovírus da espécie C.
De acordo com Wold e Ison1, é incomum isolar qualquer um dos tipos de adenovírus do líquido cefarrolaquidiano (LCR) ou do cérebro, contudo, estudos têm demonstrado o isolamento de HAdV (HAdV- 3, 5, 6, 7, 7A e 12) de LCR em pacientes com meningoencefalite. Nesse sentido, os mesmos autores afirmam que HAdV-C5 foi cultivado do LCR de dois pacientes imunocompetentes, sendo que um apresentava meningoencefalite e o outro meningite.
Por outro lado, no estudo de Ory et al30, considera-se a hipótese de que a infecção viral por HAdV no SNC, como a meningite, pode ser ocasionada por uma complicação secundária à pneumonia. No mesmo estudo, foi identificado HAdV-5 em um caso de cerebelite, com um histórico de conjuntivite, e outro de meningite.
Certamente ainda é preliminar a afirmação de que os adenovírus possam ser um dos agentes etiológicos de PFA, pois ainda faltam investigações e dados que demonstrem o possível mecanismo viral para dada infecção. Além disso, uma das limitações do presente estudo é que há a necessidade paralela de um grupo controle (pacientes sem PFA), com a finalidade de se comparar e verificar em qual grupo (pacientes com PFA e sem PFA) os adenovírus seriam mais prevalentes.
Além disso, é pertinente relatar que novos HAdV têm sido originados por recombinação de no mínimo dois vírus. Tal como ocorreu com o HAdV-58, recentemente caracterizado como um novo adenovírus com genes da fibra e do héxon do HAdV-25 e HAdV-2931. Matsushima et al2),(3 têm sugerido que, para fins de identificação e classificação viral se realize o sequenciamento nucleotídico completo dos genes da fibra, penton base e héxon, pois de acordo com os autores, as regiões conservadas destes três genes têm apresentado papel importante na recombinação. Frente a essa nova proposta, a investigação destes genes nos HAdV encontrados no presente estudo, seria muito interessante para investigação de uma possível recombinação, assim como para a maior fidedignidade quanto ao tipo viral. Em relação a isso, o sequenciamento parcial ofereceu um norte quanto à identificação no presente estudo, levando em consideração que os tipos encontrados variaram de 95% a 100% de similaridade em relação à sequência protótipo (Figura 2). No entanto, a proposta de Matsushima et al2),(3 é muito relevante.
Outro fator importante é o conhecimento das bases moleculares do vírus que colaboram para o tropismo tecidual, tal como da região E3 da fibra viral32),(33. E levando em consideração que a PFA é uma doença que causa deficiência motora flácida, devido à destruição dos neurônios do córtex motor, a possível replicação dos HAdV em neurônios motores deve ser amplamente investigada para a melhor compreensão do histotropismo dos HAdV associados à PFA.
De acordo com Roy et al34, os adenovírus podem fazer parte da flora normal do intestino, pois foi identificado em linfócitos e tecido intestinal de pessoas assintomáticas o DNA de vários tipos de adenovírus, verificando HAdV-C (tipos 7 e 1). Por isso, também se faz necessário a investigação em outros espécimes clínicos tais como LCR e soro.
Contudo, é admissível o envolvimento de outros agentes virais com a capacidade de invadir e replicar em células do SNC e causar PFA, principalmente nas regiões onde o poliovírus foi erradicado. Somando-se a isso, a positividade obtida no presente estudo de 68,4% para os HAdV em amostras negativas para poliovírus e enterovírus não pólio (principais agentes da infecção) foi aparentemente expressiva.
Nossos resultados, combinados com a existência de pesquisas sobre a participação de adenovírus em doenças que envolvem o SNC, sugerem que estes vírus possam estar envolvidos na etiologia dos casos de PFA. No entanto, outras investigações devidamente controladas sobre essa possível associação devem ser realizadas.
CONCLUSÃO
Diferentemente dos demais estudos, no presente, os adenovírus da espécie C foram identificados com mais frequência aos casos de PFA. A positividade obtida no presente estudo foi de 68,4% para os HAdV. Mais estudos devem ser realizados pra verificar a possível associação de outros agentes virais, tais como o adenovírus, na participação da etiologia de casos de PFA.