INTRODUÇÃO
A mortalidade infantil constitui um relevante problema de saúde pública, uma vez que aproximadamente 6,3 milhões de crianças menores de 5 anos de idade morrem anualmente em todo mundo. Estima-se que as doenças infecciosas, dentre as quais diarreia e a pneumonia, são responsáveis por aproximadamente 3 milhões de óbitos entre crianças nesta faixa etária, a maioria nos países em desenvolvimento1.
A diarreia aguda tem como característica o aspecto gorduroso das fezes, o aumento do número de evacuações e caráter explosivo, além de vômito, febre e dor abdominal, durando de dois a 14 dias. Esta doença ocasiona um grande impacto na saúde da população infantil, bem como no contexto da sociedade em geral2. As complicações devem-se à desidratação e ao desequilíbrio hidroeletrolítico, podendo levar a óbito3.
Os agentes patogênicos envolvidos na etiologia das doenças diarreicas variam desde toxinas até vírus, bactérias e parasitas. Observa-se que as bactérias assumem maior importância nos países desenvolvidos. No entanto, os agentes virais são de significativa relevância tanto nos países desenvolvidos como naqueles em desenvolvimento, contribuindo para as elevadas taxas de hospitalização e pelos altos índices de morbimortalidade infantil4,5,6.
Nos países em desenvolvimento e no que se refere às infecções virais, epidemiologicamente, os rotavírus do grupo A (RV-A) destacam-se por aproximadamente 36% dos casos de gastrenterite infantil que resultam em hospitalizações entre as crianças menores de 5 anos de idade, resultando em até 453.000 óbitos anuais7,8.
No mundo todo, os RV-A infectam crianças de diferentes classes sociais tanto nos países desenvolvidos como em desenvolvimento. Apenas melhorias nas condições sanitárias e de higiene não podem determinar a prevenção e controle destes, uma vez que os fatores demográficos e socioeconômicos são os principais responsáveis pelas variações dos índices de mortalidade, tendo os locais de difícil acesso valores mais elevados devido às dificuldades em relação à saúde básica primária9,10.
A realidade brasileira não difere da mundial. Embora nas últimas décadas o Brasil tenha tido melhorias significativas em saneamento básico, no ano de 2006 ocorreram 2.236 mortes de crianças menores de 5 anos de idade por doenças diarreicas. A análise desses casos diarreicos por região de origem mostra que foram registrados 1.291 óbitos na Região Nordeste; 363 na Região Norte; 348 na Região Sudeste; 143 na Região Centro-Oeste; e 91 na Região Sul11,12.
Em março de 2006, o Brasil foi o primeiro País do mundo a introduzir a vacina Rotarix® no programa nacional de imunização. A inclusão da vacina oral contra o RV constituiu um fator determinante para a diminuição de doenças e óbitos no Brasil, objetivando abranger um coorte de nascimentos anuais de aproximadamente 3,5 milhões13.
A infecção por RV-A pode ser assintomática ou se expressar como gastrenterite moderada ou grave, manifestando-se com o aparecimento de diarreia aquosa que perdura por cinco a oito dias, além de febre e vômitos, os quais podem culminar com desidratação e óbito. O tratamento consiste em prevenir a desidratação e distúrbios hidroeletrolíticos2,14. O risco de morte por complicações desta doença aumenta nos casos de desnutrição grave e se o paciente estiver com o sistema imunológico deprimido15.
A primeira técnica utilizada para detecção do RV foi a microscopia eletrônica, que permite a visualização direta do vírus a partir do material fecal. Além da microscopia eletrônica, as outras técnicas não imunológicas existentes são a eletroforese do genoma de RNA em gel de poliacrilamida ou a reação em cadeia da polimerase, com visualização do resultado em gel de agarose16. No entanto, por apresentarem elevada sensibilidade e praticidade, as técnicas imunológicas são mais utilizadas na rotina laboratorial. Dentre estas destacam-se os testes imunocromatográfico e o ensaio imunoenzimático (ELISA)14, utilizando o kit comercial Premier™ Rotaclone® Rotavirus (Meridian Bioscience Inc., Cincinnati, EUA) este tido como padrão-ouro na detecção dos RV-A.
Contudo, é importante avaliar alternativas disponíveis, dentre as quais se destaca o teste imunoenzimático RIDASCREEN® Rotavírus (R-Biopharm AG, Darmstadt, Alemanha), visando a redução dos custos e a agilidade no diagnóstico do RV-A.
No presente estudo procurou-se validar o método RIDASCREEN® analisando vários parâmetros de seu desempenho comparado ao Rotaclone®.
MATERIAIS E MÉTODOS
As amostras selecionadas para este estudo foram provenientes de um estudo anterior, realizado no período de maio de 2008 a maio de 2009, quando se coletaram cerca de 12.000 unidades e, destas, 537 amostras foram positivas para RV na Cidade de Belém, Estado do Pará, Brasil e incluídas na rede de vigilância estabelecida para avaliar a efetividade da vacina Rotarix® na prevenção de gastrenterite grave por RV-A, bem como a diversidade antigênica das amostras positivas circulantes entre crianças hospitalizadas nascidas após 6 de março de 2006 e com pelo menos 12 semanas de idade. Tal estudo fez-se necessário, pois desde março de 2006 a vacina contra RV-A passou a ser utilizada em larga escala no Brasil, fazendo parte do Calendário Nacional de Vacinação adotado pelo Ministério da Saúde17.
Todas as amostras positivas para RV-A foram submetidas a uma distribuição aleatória usando o software BioEstat 2008 v.5.4.0.0, a partir do qual foram selecionadas 30 amostras de RV. Um adicional de dez amostras negativas para RV-A foram utilizadas, provenientes de um painel de fezes previamente fornecido pela GSK (GlaxoSmithKline, Rixensart, Bélgica) para fins de ensaios de proficiência. As amostras selecionadas foram marcadas sequencialmente (1 a 40) para mais testes. Estes procedimentos aleatórios foram realizados por um técnico que forneceu as amostras codificadas para outros dois técnicos (A e B) que não tinham conhecimento da identificação das amostras originais ou dos demais resultados laboratoriais.
A investigação que ofereceu as bases para a presente análise foi previamente aprovada pelo Comitê de Etica em Pesquisa do Instituto Evandro Chagas (IEC), em 25 de fevereiro de 2008 (Protocolo No 003/08) e registrado sob o CAAE: 0003.0.072.000-08 em respeito às normas nacionais e internacionais que regulamentam tal atividade.
Foram comparados os dois ensaios imunoenzimáticos denominados RIDASCREEN® e Rotaclone®. Ambos os testes são de fase sólida em formato sandwich que utilizam anticorpos monoclonais para detecção da proteína VP6 dos RV-A nas fezes. A leitura dos resultados foi realizada visualmente e, quantitativamente, com a utilização do espectrofotômetro (filtro A450) conforme especificações do método. O valor de corte (cut-off) foi determinado como sendo aquele de absorbância do controle negativo acrescido de 0,15.
O princípio biológico do kitRotaclone® é essencialmente semelhante ao do RIDASCREEN®, mesmo no que diz respeito ao complexo enzima-substrato. Enquanto o método anterior permite 48 determinações, o RIDASCREEN® permite testar até 96 amostras simultaneamente, além de ser mais facilmente encontrado no Brasil e menos oneroso do que o teste Rotaclone®18.
ESPECIFICIDADE, SENSIBILIDADE, VALORES PREDITIVOS POSITIVOS E NEGATIVOS
No seu conjunto, os resultados obtidos a partir das 40 amostras de fezes testadas pelos dois métodos sob comparação permitiram o cálculo de especificidade, sensibilidade e valores preditivos positivos e negativos.
Uma concordância maior que 85% foi utilizada como critério de desempenho aceitável para o kit sob avaliação.
PRECISÃO
Dados quanto à reprodutibilidade (intra-ensaio) e precisão intermediária (inter-ensaio) foram gerados. Das 40 amostras testadas, dez foram avaliadas em duplicata durante quatro dias, por dois técnicos (ambos trabalhando no mesmo dia). O coeficiente de variação (CV (%)) coeficiente de variação foi estimado pela análise de variância, utilizando o software BioEstat19. Para isso, o log 10 dos valores de densidade ótica gerados para cada amostra foram considerados. Quanto aos critérios de aceitabilidade, o CV deve ser ≤ 20%, e a diferença de ≤ 25% entre os ensaios (RIDASCREEN® x Rotaclone®), foi aceitável.
INTERFERÊNCIA
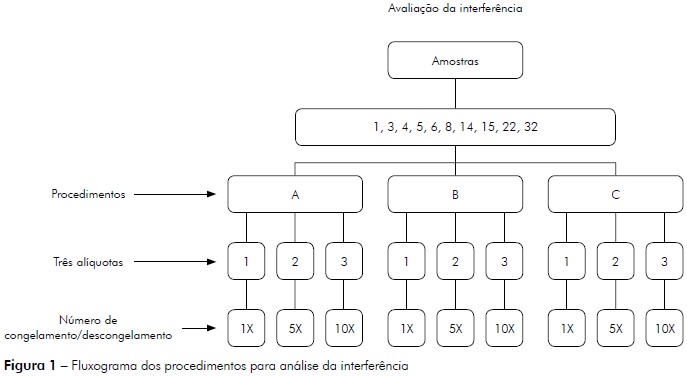
Para a avaliação da interferência foram utilizadas dez amostras de fezes (seis positivas e quatro negativas para RV-A). Cada amostra foi dividida em três alíquotas e cada alíquota foi submetida a um, cinco ou dez ciclos de congelamento (-70o C) e descongelamento a temperatura ambiente (25o C). Como cada amostra foi testada três vezes, um total de 90 alíquotas foi analisado neste experimento (Figura 1).
ESTABILIDADE DO ENSAIO
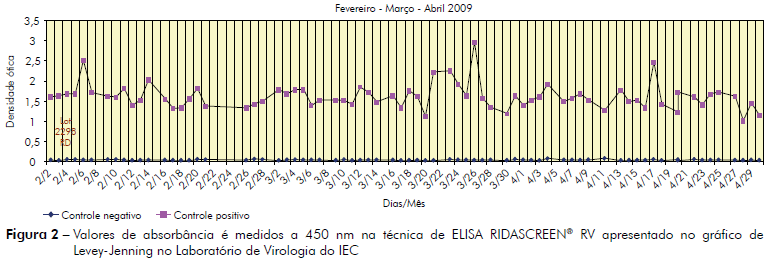
A partir de 668 ensaios positivos para RV-A testados por ELISA, foram criados gráficos de controle de qualidade para demonstrar a consistência dos controles positivos e negativos desde o início do estudo, em maio de 2008 até um ano após a implantação deste teste de validação, em maio de 2010. Os valores foram recolhidos de acordo com o lote do produto, tanto para comparação intra como inter dados. Gráficos de Levey-Jenning contendo valores diários dos controles foram construídos a cada três meses, descrevendo a distribuição das densidades óticas observadas ao longo deste período.
RESULTADOS
Dentre as 40 amostras testadas, sendo 30 positivas e dez negativas, houve uma concordância de resultados nos testes de RIDASCREEN® e Rotaclone® em 90% (36/40) das amostras. Todas as amostras negativas continuaram negativas. No entanto, dentre as 30 amostras previamente positivas, quatro tiveram resultados discrepantes, duas que eram positivas foram negativas em ambos os testes, uma foi negativa pelo teste RIDASCREEN® e positiva pelo Rotaclone® e o inverso ocorreu com mais uma amostra de resultado discrepante (Tabela 1). A sensibilidade observada foi de 90% (27/30) e a especificidade de 100% (10/10). O valor preditivo positivo (VPP) obtido foi de 1 ou 100% [30/(30+0)], enquanto que o valor preditivo negativo (VPN) foi de 0,77 ou 77% [10/(10+13)]; e a acurácia foi de 0,93 ou 93% [(30+10)/(30+3+10)].
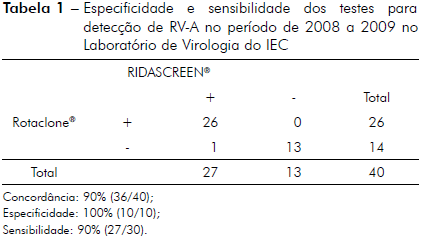
Tabela 1 - Especificidade e sensibilidade dos testes para detecção de RV-A no período de 2008 a 2009 no Laboratório de Virologia do IEC
No que se refere à avaliação da precisão, não houve variação nos resultados obtidos nesta etapa, sendo estabelecida uma relação de 100% de concordância entre as duas leituras espectrofotométricas de ambos os kits, observando-se cinco amostras positivas e cinco negativas ao longo dos quatro dias de testes realizados por dois técnicos diferentes.
Os resultados que determinam a interferência estão apresentados na tabela 2, na qual observa-se que o número de congelamentos e descongelamentos aos quais as dez amostras foram submetidas ao longo dos dias não alterou a probabilidade de serem positivas ou negativas para RV-A pela técnica de ELISA.

Tabela 2 - Resultados da avaliação de interferência do ELISA nas dez amostras analisadas por congelamento e descongelamento no Laboratório de Virologia do IEC
A avaliação da estabilidade do ensaio pelo gráfico de Levey-Jennings, no qual se reuniram as densidades óticas positivas e os controles negativos obtidos em 668 ensaios utilizando RIDASCREEN®, indicou que não houve variação significativa nos testes realizados ao longo do período de realização da validação do projeto, desde o início até 12 meses após, neste estudo de validação. Na figura 2 observa-se um período de três meses com picos na densidade ótica, o primeiro em 6 de fevereiro, o segundo em 26 de março e o terceiro em 17 de abril de 2009. No entanto, as curvas não se afastaram expressivamente da média.
DISCUSSÃO
O diagnóstico imunológico das gastrenterites, sobretudo os testes de ELISA, constitui uma das principais bases em que se apoiam os programas de controle de RV-A. Sem o diagnóstico correto, torna-se mais difícil a avaliação dos dados epidemologicos da doença. O número dos testes comerciais disponíveis é grande, tornando-se imperiosa a indicação dos mais adequados para o objetivo estabelecido.
O método ELISA possibilita a detecção precoce de infecção no período estabelecido da doença20. O ELISA detecta antígenos específicos com alto grau de sensibilidade e especificidade, sendo de execução relativamente fácil e rápida, tendo como exemplo no Brasil os testes de RIDASCREEN® e Rotaclone®. Comparações entre estes dois testes são necessárias como medida para redução de custos, considerando sempre os parâmetros de especificidade, sensibilidade e custo x benefício21.
Observa-se, no presente experimento, que o teste ELISA RIDASCREEN® apresenta um desempenho similar ao Rotaclone®. Os dados de 100% de especificidade obtidos neste estudo corroboram os observados no Instituto Paul Ehrlich (Alemanha), envolvendo 177 amostras fecais de crianças com gastrenterite, alcançado especificidade de 100%18, bem como os observados por Gautama et al22 onde foram testadas 110 amostras (56 positivas e 54 negativas). Não obstante, a sensibilidade obtida foi de 90%, sendo este valor menor que o do estudo na Alemanha, o qual apresentou sensibilidade de 98,4%. Esta menor sensibilidade pode estar associada ao fato de duas amostras previamente positivas terem sido negativas neste teste de validação, fato possivelmente atribuído à escassez de material fecal, pois no momento do sorteio aleatório não foi utilizado como critério de exclusão a quantidade disponível, tendo como resultado o sorteio de muitas fraldas ressecadas. Entretanto, a sensibilidade observada neste estudo foi maior que a observada por Gautama et al22, os quais obtiveram 82,1%.
No que se refere à avaliação da precisão entre as diferentes metodologias, os dados deste estudo demonstraram 100% de concordância entre as dez amostras avaliadas pelos dois métodos nos quatro dias de ensaios realizados por dois técnicos diferentes. Estes resultados são semelhantes aos observados nos testes de precisão da reprodutibilidade interensaio do kit de RIDASCREEN®, feito com seis amostras de referência em utilização dupla e dois ensaios por dia realizados por três técnicos diferentes ao longo de dez dias (R-Biopharm).
A interferência de fatores externos, tais como o número de congelamentos e descongelamentos aos quais foram submetidas às amostras, também não determinou impacto no que concerne à positividade ou à negatividade previamente apresentadas neste estudo. Estes resultados são diferentes dos observados em outro estudo realizado com amostras de Nova Deli (índia), onde dois ciclos extras de congelamentos e descongelamentos, geraram altos níveis de degradação dos RV, alterando a detecção destes23.
Os dados referentes à estabilidade do ensaio com registro de valores para o controle positivo e negativo, como reunidos no gráfico de Levey-Jennings, demonstram a consistência dos resultados para triagem de amostras positivas obtidas pelo estudo, o qual, ao longo de seu período de realização (maio de 2008 a maio de 2011), abrangeu mais de 12.000 amostras de crianças diarreicas, obtendo-se um total de 1.076 casos positivos para estudos posteriores, tais como os testes de genotipagem das amostras.
A escolha do método de análise baseou-se na padronização de uma técnica que permitisse a redução do tempo de analise, conferisse simplicidade e diminuísse também os custos, uma vez que o kit Rotaclone® apresenta maior valor de mercado que o RIDASCREEN®.
As análises quantitativas acima sugeridas sustentam a utilização do método RIDASCREEN®, a julgar pelo fato que o desempenho desse procedimento mostra-se comparável ao do Rotaclone®, kit universalmente reconhecido por sua elevada sensibilidade e especificidade.
CONCLUSÃO
Este estudo demonstrou que o teste RIDASCREEN® obtém resultados satisfatórios e equivalentes ao teste Rotaclone®, o qual é tido como um padrão-ouro para comparação no Brasil. Portanto, este estudo de validação confere robustez aos dados oriundos do projeto RV caso-controle que avaliou a efetividade de uma vacina hoje licenciada em mais de 40 países no mundo e há seis anos implementada no setor público brasileiro, fazendo parte do Calendário Anual de Vacinação desde março de 2006.