Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.6 n.4 Ananindeua dez. 2015
http://dx.doi.org/10.5123/S2176-62232015000400004
ARTIGO ORIGINAL | ORIGINAL ARTICLE | ARTÍCULO ORIGINAL
Detecção de metapneumovírus humano em crianças portadoras de infecções respiratórias agudas atendidas em um hospital de urgência e emergência em Belém, Estado do Pará, Brasil*
Detection of human metapneumovirus in children with acute respiratory infections treated at a hospital of emergency in Belém, Pará State, Brazil
Detección de metapneumovirus humano en niños portadores de infecciones respiratorias agudas atendidas en un hospital de urgencia y emergencia en Belém, Estado de Pará, Brasil
Orlando da Gama RodriguesI; Werther Brunow de CarvalhoII
IUniversidade do Estado do Pará, Belém, Pará, Brasil
IIUniversidade do Estado de São Paulo, São Paulo, São Paulo, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
OBJETIVO: Realizar avaliação clínica e detecção de metapneumovírus humano (MPVh) de crianças abaixo de 5 anos de idade, portadoras de infecções respiratórias agudas (IRA), com livre procura ou referenciadas a um hospital de urgência e emergência em Belém, Estado do Pará, Brasil.
MATERIAIS E MÉTODOS: Estudo longitudinal prospectivo (março de 2008 a fevereiro de 2009), avaliando 67 amostras de secreções nasofaríngeas de 67 pacientes com IRA - 29,9% com doença limitada ao sistema respiratório superior (DSRS) e 70,1% com doença do sistema respiratório inferior (DSRI) e DSRS - por meio de reação em cadeia mediada pela polimerase precedida de transcrição reversa em tempo real.
RESULTADOS: Na coorte de n = 67 crianças investigadas, foram detectados 13 casos (19,4%) positivos para MPVh. Houve maior porcentagem de identificação viral (61,5%) naqueles com DSRS associadas à DSRI, em relação aos com DSRS (38,5%).
CONCLUSÃO: Foi observado que o MPVh é um agente etiológico prevalente em 19,4% das crianças com IRA, no entanto, as manifestações clínicas avaliadas não ocorrem exclusivamente em associação com o MPVh.
Palavras-chave: Metapneumovirus; Infecções Respiratórias; Saúde da Criança.
ABSTRACT
OBJECTIVE: Performing clinical and human metapneumovirus detection (hMPV) of children under 5 years old suffering from acute respiratory infections (ARI), with free demand or referenced to an emergency care hospital in Belém, Pará State, Brazil.
MATERIALS AND METHODS: A prospective longitudinal study (from March 2008 to February 2009) evaluated 67 samples of nasopharyngeal secretions of 67 patients with ARI - 29.9% with upper respiratory tract infection (URTI) and 70.1% with lower respiratory tract infection (LRTI) and URTI - by using real time reverse transcription polymerase chain reaction assay.
RESULTS: In the cohort of n = 67 children studied, 13 positive cases were detected (19.4%) for hMPV. There was a higher percentage of samples (61.5%) in those with URTI associated with LRTI, compared to those with URTI (38.5%).
CONCLUSION: It was observed that hMPV is a prevalent etiological agent in 19.4% of children with ARI, however the clinical symptoms evaluated do not occur exclusively in association with hMPV.
Keywords: Metapneumovirus; Respiratory Tract Infections, Child Health.
RESUMEN
OBJETIVO: Realizar evaluación clínica y detección de metapneumovirus humano (MPVh) de niños menores de 5 años de edad, portadores de infecciones respiratorias agudas (IRA), con demanda libre por atención o remitidos a un hospital de urgencia y emergencia en Belém, Estado de Pará, Brasil.
MATERIALES Y MÉTODOS: Estudio longitudinal prospectivo (marzo de 2008 a febrero de 2009), evaluando 67 muestras de secreciones nasofaríngeas de 67 pacientes con IRA - 29,9% con enfermedad limitada al sistema respiratorio superior (TRS) y 70,1% con enfermedad del sistema respiratorio inferior (TRI) y TRS - por medio de reacción en cadena mediada por la polimerasa precedida de transcripción reversa en tiempo real.
RESULTADOS: En la cohorte de n = 67 niños investigados, se detectaron 13 casos (19,4%) positivos para MPVh. Hubo un mayor porcentaje de identificación viral (61,5%) en los portadores de TRS asociados al TRI, en relación a los con TRS (38,5%).
CONCLUSIÓN: Se observa que el MPVh es un agente etiológico prevalente en 19,4% de los niños con IRA, sin embargo, las manifestaciones clínicas evaluadas no suceden exclusivamente en asociación al MPVh.
Palabras clave: Metapneumovirus; Infecciones del Sistema Respiratorio; Salud del Niño.
INTRODUÇÃO
As infecções respiratórias agudas (IRA) são as causas mais frequentes de doenças no mundo, com maior incidência em crianças com idade abaixo dos cinco anos1. Desnutrição energético-proteica, prematuridade, baixo peso ao nascer, doenças com repercussão respiratória, inadequada condição socioeconômica e cultural da família, aleitamento materno, tabagismo e poluição ambiental são importantes fatores predisponentes e determinantes de IRA2. O monitoramento dos micro-organismos envolvidos na IRA e a identificação desses agentes orientam as medidas terapêuticas e preventivas, evitando o uso desnecessário de antibióticos e auxiliando no controle de infecções hospitalares3.
As IRAs causadas por vírus necessitam de diagnóstico laboratorial, pela impossibilidade do diagnóstico etiológico, realizado apenas pelo quadro clínico. Os vírus respiratórios mais frequentemente diagnosticados são influenza, parainfluenza, adenovírus, rinovírus, vírus sincicial respiratório (VSR), metapneumovírus (MPVh) e bocavírus humano4,5,6. No Brasil, vários estudos7,8,9,10 de diferentes regiões demonstram a importância dos pneumovírus como agente etiológico de IRA.
O MPVh foi descrito pela primeira vez como agente etiológico de IRA em 2001 na Holanda. Suas características são semelhantes ao efeito citopático produzido pelo VSR, com formação de sincícios característicos seguido pelo rápido rompimento das células e subsequente destacamento da placa de cultura11.
O MPVh apresenta relação genética com o pneumovírus aviário. Genoma constituído por oito genes que codificam nove proteínas, promovendo grande similaridade ao VSR. Pertence à ordem Mononegavirales, família Paramyxoviridae, subfamília Pneumovirinae e gênero Metapneumovirus12.
A epidemiologia do MPVh é complexa e dinâmica, apresenta duas linhagens (A e B) e dois subgrupos de cada linhagem com diversidade antigênica. Cepas identificadas em uma região podem ser similares às cepas encontradas em outro local, em diferentes anos13,14. A incidência mundial de MPVh varia de 1,5% a 41%5,15. No Brasil, há poucos trabalhos realizados, com citações publicadas, referindo taxa de detecção de MPVh muito variável: em Fortaleza, Estado do Ceará, 8,69%16; em Curitiba, Estado do Paraná, 6,4%17; em Porto Alegre, Estado do Rio Grande do Sul, 14,5%18; Aracaju, Estado de Sergipe, 17%19; em Campinas, 5,6%20, e em São Paulo, 4%21, Estado de São Paulo; e em Santa Maria, Estado do Rio Grande do Sul, 10,5%22.
O modo de transmissão do MPVh ocorre de maneira similar aos outros pneumovírus, pela inalação de secreções respiratórias contaminadas, objetos contaminados e manipulação23,24,25.
No Brasil, casos de infecções por MPVh na Região Norte (Região Amazônica) e Nordeste foram detectados durante o período epidêmico do VSR, apresentando uma associação com o período chuvoso. Este achado difere do padrão observado na Região Sul do Brasil, onde o pico de atividade do MPVh está associado aos meses mais frios. Em países do hemisfério norte, o MPVh circula predominantemente nos meses de inverno e primavera. No hemisfério sul, há uma grande variação na sazonalidade do vírus26,27. O MPVh acomete em pessoas de todas as faixas etárias, principalmente em menores de 5 anos. Crianças abaixo de 2 anos de idade, idosos, portadores de doenças pulmonares crônicas e imunocomprometidos representam o grupo de risco. Os acometimentos mais frequente são bronquiolite, pneumonia e bronquite16,28.
Vários estudos têm demonstrado o diagnóstico molecular como o melhor método para detecção de vírus respiratórios. Pela dificuldade de cultivo celular em relação ao MPVh, a polimerase precedida de transcrição reversa em tempo real, torna-se a técnica mais adequada (padrão ouro) para detectar e quantificar o MPVh em espécimes respiratórios5,29. O desenvolvimento de vacinas contra o MPVh encontra-se em fase experimental.
Desta forma, o objetivo deste estudo foi realizar a detecção de MPVh em crianças abaixo de 5 anos de idade, portadoras de IRA, com livre procura ou referenciadas a um hospital de urgência e emergência em Belém, Estado do Pará, Brasil, e com avaliação das manifestações clínicas apresentadas.
MÉTODOS
Estudo longitudinal prospectivo realizado em Belém (Região Amazônica), local de clima quente e úmido, onde ocorrem duas estações ao ano: uma caracterizada pela presença de chuvas abundantes, de dezembro a maio; outra, em que as chuvas são menos frequentes, de junho a novembro. No período de março de 2008 a fevereiro de 2009 foram estudadas 67 crianças atendidas por livre demanda ou referenciadas para um hospital de urgência e emergência (Hospital de Pronto Socorro Municipal Humberto Maradei Pereira), após aprovação pelo Comitê de Ética em Pesquisa do Hospital Universitário João de Barros Barreto, vinculado à Universidade Federal do Pará; e pelo Comitê de Ética em Pesquisa da Universidade Federal de São Paulo.
Os critérios de inclusão foram: Assinatura do Termo de Consentimento Livre e Esclarecido; ter idade abaixo de 5 anos; sintomatologia clínica até sete dias de duração; quadro clínico de infecção respiratória aguda com caracterização de urgência e/ou emergência (mínimo de três manifestações clínicas: febre, dor, mal estar, tosse, cansaço, esforço respiratório, cianose, alterações radiológicas de tórax).
Com a identificação e os dados clínicos de cada criança incluídos no estudo, foi coletada secreção da nasofaríngea, sendo a criança acompanhada, pelo autor da pesquisa, até a completa resolução da doença, com o objetivo de determinar a evolução clínica de cada caso pesquisado. A coleta de secreção nasofaríngea foi realizada em cama de atendimento, na sala de exame médico. O paciente foi acompanhado por dois técnicos de enfermagem do próprio hospital no momento em que se realizava a coleta.
Quanto à condição nutricional, foi utilizado o critério de Gomez, o qual se baseia no índice de peso para a idade (P/I), do percentil 50 (p50). O paciente eutrófico apresenta P/I superior a 90% do p50 e o desnutrido de primeiro grau apresenta P/I entre 76% a 90% do p5030.
Quanto às manifestações clínicas, foi considerada prostração quando a criança apresentava ao exame físico inicial: mal estar, fácies de sofrimento e irritabilidade.
O material utilizado na coleta consistiu de luvas, coletor plástico descartável de secreções (Marca Argyle DeLee Mucus Trap with Vacuum Breaker, número de catálogo 8884 - 7245 Sherwood) e bomba de aspiração (High Volume Vacuum Pressure Pump -número de catálogo xx 56.000.00).
Após a coleta, a secreção nasofaríngea acoplada ao coletor plástico foi identificada, mantida dentro da própria embalagem do coletor, devidamente fechada e acondicionada em caixa de isopor com gelo úmido e transportada ao Laboratório de Vírus Respiratórios do Instituto Evandro Chagas, em prazo não superior à 4 h. No laboratório, todo material era estocado em geladeira para processamento posterior.
EXTRAÇÃO DAS AMOSTRAS DOS TESTES
Foi utilizado o tubo eppendorf (2 mL), adicionado 560 μL de Buffer AVL/CarrierRNA e ainda 140 μL da amostra (retirados da alícota), agitado por 15 s (Vortex). O material foi incubado em temperatura ambiente por 10 min. Depois foi centrifugado brevemente para retirar bolhas da tampa, sendo adicionado 360 μL de etanol absoluto, agitado em Vortex por 15 s e novamente centrifugado brevemente. Foi aplicado, cuidadosamente, 630 μL da solução feita no eppendorf em um tubo de 2 mL com a placa de sílica, centrifugado a 8.000 rpm por 1 min à temperatura ambiente e transferido a coluna para outro tubo de 2 mL, descartando o anterior. O restante da solução do eppendorf de 630 μL foi aplicado na coluna encaixada no novo tubo, centrifugado a 8.000 rpm por 1 min à temperatura ambiente. A coluna foi novamente transferida para uma outra (tubo) de 2 mL, descartando o tubo anterior que continha o filtrado. Foi adicionado 500 μL de Buffer AW1, centrifugado a 8.000 rpm por 1 min à temperatura ambiente. A coluna foi transferida para outro tubo de 2 mL, descartando o anterior que continha o filtrado. Foi adicionado, ainda, 500 μL de Buffer AW2, transferindo a coluna para um novo tubo (2 mL), descartando o filtrado. Uma nova centrifugação foi realizada para retirar qualquer resquício de etanol, transferindo-se para outro tubo de 2 mL e acrescentando-se 60 μL de Buffer AVE. Por fim, o material foi incubado por 1 min à temperatura ambiente, centrifugado a 8.000 rpm por 1 min e estocado o RNA a -70° C.
TRANSCRIÇÃO REVERSA E REAÇÃO EM CADEIA MEDIADA PELA POLIMERASE EM TEMPO REAL (qRT-PCR)
A detecção de MPVh foi baseada na amplificação de um segmento do gene N por meio de qRT-PCR com sistema TaqMan. A técnica foi realizada utilizando-se o kit comercial SuperScriptTMOne-Step RT-PCR with Platinum TaqTM (Invitrogen Life Technologies, EUA) com oligonucleotídeos e sondas específicos (Quadro 1). As reações foram feitas com volume final de 25 μL contendo 5 μL de RNA viral, 5,1 μL de H2O, 12,5 μL de 2X Reaction Mix (0,4 mM de cada dNTP 2,4 mM de MgSO4), 0,5 μL de cada primer (50 μM) e 0,5 μL (20 μM) da sonda para hMPV, 0,5 μL (50 μM) de agente normalizador de fluorescência Rox e 0,5 μL de SSIIRT/Taqmix. As condições para amplificação da reação foram as seguintes: 48° C por 30 min, 95° C por 10 min, seguidos de 45 ciclos de 95° C por 15 s, 60° C por 30 s. Cada conjunto de amostras submetido à amplificação foi acompanhado de um controle negativo, composto por todos os reagentes da mistura e água livre de DNAse e RNAse e um controle positivo.

Quanto à análise estatística, a prevalência pontual de MPVh foi calculada usando como denominador o total de pacientes da amostra. Também foi calculado o respectivo intervalo de confiança (IC95%). As comparações das frequências do MPVh, nas variáveis qualitativas, foram realizadas pelo teste do Qui-quadrado de independência, posteriormente foi aplicado o odds ratio para medir a força da associação entre os fatores de risco e a variável de desfecho (presença do MPVh), quando correu a restrição npq < 5 que foi a comparação das variáveis dicotômicas, sendo realizado o teste exato de Fisher. Para comparar as variáveis quantitativas, foi aplicado o teste t de Student e previamente fixado o nível α = 0,05 para rejeição da hipótese nula. No processamento estatístico, foram utilizados os programas BioEstat v.5.4 e o SPSS v.16.0.
RESULTADOS
Foram avaliadas 67 crianças no período de março de 2008 a fevereiro de 2009. A principal característica socioeconômica foi a baixa renda familiar (2 ± 1,5 salários mínimos) e insatisfatória condição de moradia (70,1%). A idade variou de 10 meses (mínimo) a 5 anos (máximo), com tendência central para 24 ± 14 meses. O tempo de acometimento da doença variou de dois a seis dias, com tendência central para três ± dois dias. A tabela 1 apresenta os dados clínicos e demográficos dessas crianças.
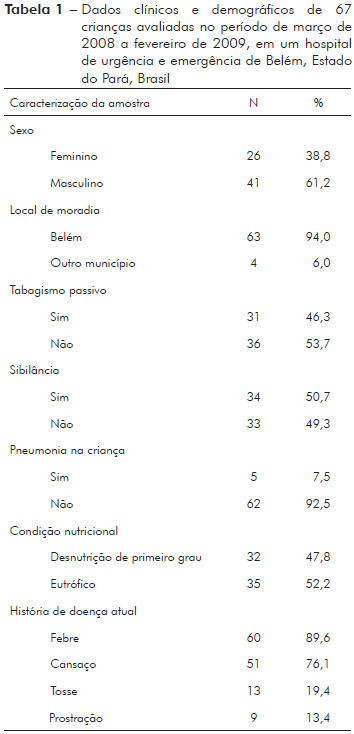
Das 67 crianças avaliadas, 13 delas (19,4%) apresentaram resultado positivo para MPVh. A tabela 2 mostra a proporção mensal e acumulada de casos positivos para MPVh. A figura 1 mostra resultados de MPVh positivos acumulados no período de março de 2008 a fevereiro de 2009. A partir da estatística descritiva, ficou notável que houve uma concentração de casos novos nos meses de março e abril de 2008. Para avaliar se nesse período houve maior incidência de MPVh, as proporções de casos positivos foram confrontadas com os dados do restante do período deste estudo (maio de 2008 a fevereiro de 2009). Para avaliar esta hipótese, foi aplicado o teste exato de Fisher com os seguintes dados: casos no bimestre (dez positivos em 26 crianças avaliadas) e casos no restante do período (três positivos em 41 crianças avaliadas). No período de março a abril de 2008, foi observado o maior crescimento de casos positivos para MPVh, nesse intervalo a proporção acumulada cresceu 35,1%, visto que em março era 18,2% e em abril passou para 53,3%.
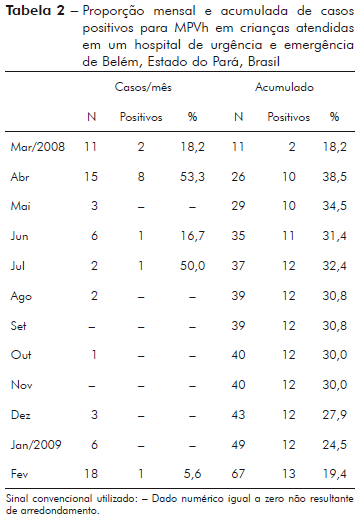
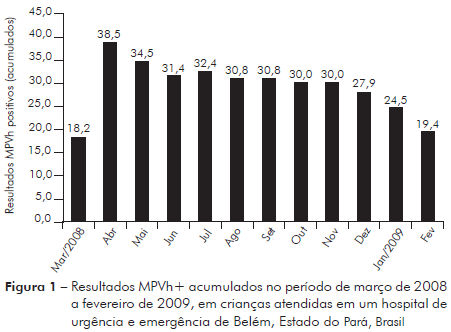
A incidência de MPVh+ foi analisada comparativamente entre dois períodos de tempo: primeiro período, de março a abril de 2008, no qual foram realizados 26 testes para MPVh; segundo período, de maio de 2008 a fevereiro de 2009, no qual foram realizados 41 testes para MPVh. A comparação dos casos ocorridos nos dois períodos de tempo, utilizando teste exato de Fisher (com p-valor = 0,0032), altamente significante, mostrou que houve maior incidência do MPVh entre os meses de março e abril de 2008 (38,5%) (Tabela 3).

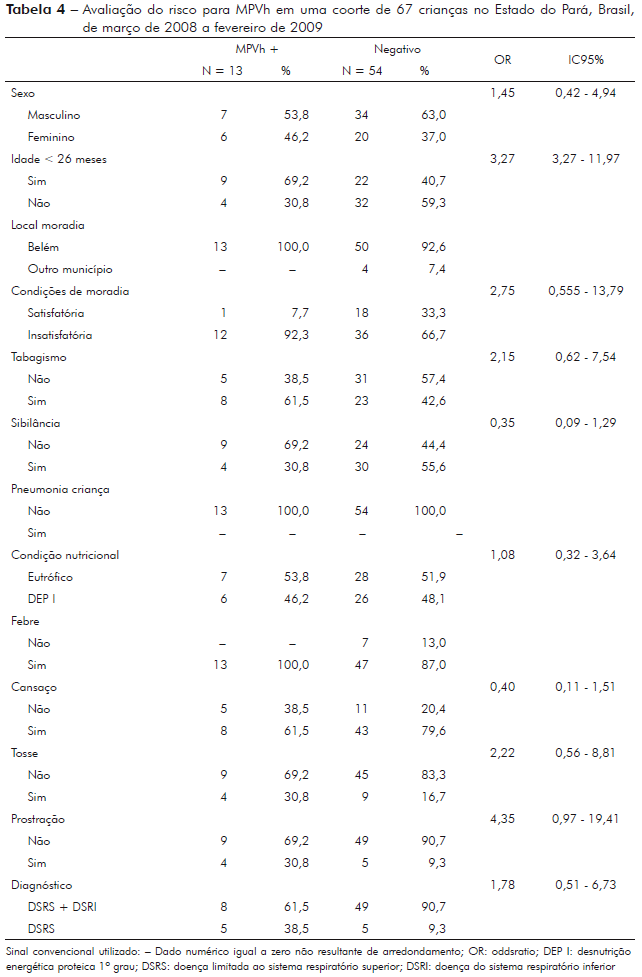
Na tabela 4 está estimada a razão de chance para condições de moradia, tabagismo, antecedente de cada uma das variáveis avaliadas para verificação da asma na família e na criança, pneumonia na criança, associação das variáveis clínicas e demográficas com condição nutricional, presença de febre, cansaço, o resultado positivo de MPVh, na qual se observa que tosse e diagnóstico não se mostraram estatisticamente sexo, dias de doença, local de moradia, renda familiar, associados ao MPVh (p > 0,05).
DISCUSSÃO
As IRA virais apresentam crescente importância quanto a morbidade e mortalidade em todo mundo, incluindo em crianças e adultos.
O MPVh e o VSR são considerados os agentes etiológicos virais mais incidentes de IRA na infância5,15,31.
No Brasil, segundo dados do Ministério da Saúde, houve redução de 61,7% da mortalidade infantil e decréscimo no total de óbitos por IRA no período de 1990 a 2010. A Região Sul com menores índices e a Região Nordeste com a maior taxa de mortalidade infantil32. O perfil desta pesquisa é inédito na Região Amazônica, com informações sobre aspectos epidemiológicos e clínicos do MPVh.
No Brasil, as Regiões Sul e Sudeste apresentam correspondência de sazonalidade aos países de clima temperado, com surtos de MPVh durante outono, inverno e primavera, enquanto as Regiões Amazônica e Nordeste predominam em períodos mais chuvosos, podendo ocorrer casos em todos os meses do ano. Neste estudo, o maior número de casos positivos para MPVh ocorreu no mês de abril de 2008, correspondendo ao mês de maior índice pluviométrico do referido ano e ao período chuvoso da Região Amazônica (dezembro a maio).
Quanto à coleta de material desta pesquisa, foram utilizados aspirados nasofaríngeos. O método de detecção utilizado foi o RT-PCR em tempo real, considerado "padrão ouro" para o diagnóstico de metapneumovírus, pois gera resultados rápidos, com maior sensibilidade e especificidade, sendo uma importante técnica molecular alternativa para o isolamento viral16,33.
VSR, influenza A e B, adenovírus e rinovírus são os mais relacionados em coinfecção com MPVh. A associação mais frequente é com o VSR, com citações de maior gravidade34.
Neste estudo, houve detecção isolada de MPVh, com impossibilidade de análise quanto à coinfecção. Houve predomínio do sexo masculino nas crianças infectadas pelo MPVh (61,2%), correspondendo a vários outros estudos17,35.
Com o advento de métodos moleculares na detecção de vírus respiratórios, o VSR e MPVh consolidam-se como os mais prevalentes, ocorrendo, principalmente, nos primeiros 2 anos de idade. O MPVh situa-se em faixa etária mais avançada que o VRS30. Com relação à idade, observou-se que a média das crianças infectadas pelo MPVh, neste estudo, foi de 24 meses, correspondendo às informações publicadas5,30.
Há várias citações de sibilância correlacionadas ao MPVh36. Neste estudo, os casos de sibilância não apresentaram significância estatística. Manifestações clínicas como corisa, febre, cefaleia, mal estar, tosse e sibilância relacionadas ao MPVh, são similares às ocorrências de outros pneumovírus, impossibilitando a determinação do agente etiológico viral, utilizando isoladamente o quadro clínico. Sintomas neurológicos, gastrointestinais, otites e outras manifestações clínicas extrarrespiratórias são relatadas em vários estudos associados a infecções por MPVh. Neste estudo, houve um caso com convulsão febril, dois casos com diarreia aguda, dois casos com artralgia e um caso com conjuntivite, todos com resultado negativo para MPVh.
Dos 67 pacientes com IRA neste estudo, 29,9% eram portadores de doença limitada ao sistema respiratório superior (DSRS) e 70,1% com doença do sistema respiratório inferior (DSRI) associados à DSRS. A otite média aguda (OMA) representa uma das complicações mais frequentes da infecção respiratória alta por MPVh. Nesta pesquisa ocorreram três casos de OMA com resultado negativo para MPVh. Em relação à DSRI ocorreram seis casos de pneumonia (8,9%) e quatro casos de bronquiolite (5,9%) com resultado negativo para MPVh.
Neste estudo, o percentual de identificação viral (MPVh) foi de 19,4%; ratificam-se relatos de estudos quanto à zonalidade na Região Amazônica e em relação aos aspectos clínicos que demonstram a idade (crianças mais velhas dentro da faixa etária de 1 mês e 5 anos) e a prostração, por meio de uma análise multivariada com (p < 0,1), como elementos do quadro clínico, com possibilidade de significância em relação à identificação de MPVh. A continuidade das pesquisas permitirá que outros aspectos sejam analisados como a gravidade dos casos associados ao pneumovírus referido, análise de coinfecções, epidemiologia molecular e diversidade genômica de MPVh circulantes10,37,38.
Notou-se que a proporção de casos de MPVh, no período de março a abril de 2008, no qual foi observado um crescimento de 35,1%, corresponde aos picos de precipitação pluviométrica (período chuvoso), conhecido como inverno amazónico39.
CONCLUSÃO
Após estudo clínico e avaliação de 67 casos de crianças com IRA, dos quais, 29,9% eram portadores de DSRS e 70,1% com DSRI associados à DSRS. Relatos de sazonalidade do MPVh neste estudo, compatíveis com pesquisas em regiões de semelhanças climáticas. O resultado de identificação viral (pelo RT-PCR em tempo real) neste estudo (19,4%), representa satisfatórias taxas de detecção de MPVh, como agente etiológico de IRA na infância, tanto em publicações internacionais e principalmente em estudos nacionais publicados. Em decorrência do número de casos da amostra e de parâmetros clínicos estudados, não foi possível estabelecer diferenças estatisticamente significativas, entre os casos com pesquisa positiva e os casos com pesquisa negativa para MPVh.
Houve maior incidência do MPVh no período chuvoso (38,5%), e redução significante de incidência (7,3%) no período não chuvoso p-valor 0,0047.
A intensificação de pesquisas em relação ao MPVh é necessária para melhor entendimento dos casos graves, da epidemiologia, caracterização genômica, amplificação de métodos de identificação viral. Faz-se necessária a divulgação por meio de estudos científicos, para conscientização dos profissionais de saúde com atuação em nível populacional, quanto às informações de vírus respiratórios habituais e vírus emergentes (bocavírus, coronavírus e MPVh), objetivando o estabelecimento de condutas terapêuticas e preventivas mais adequadas - uso racional de antimicrobianos, drogas antivirais eficientes e possibilidade futura de vacina eficaz.
AGRADECIMENTOS
A Universidade do Estado do Pará; a Wyller Alencar de Mello, Mirleide C. Santos e James L. Ferreira, do Instituto Evandro Chagas; à Norma Araujo, do Comitê de Ética em Pesquisa do Hospital Universitário João de Barros Barreto; à direção do Hospital de Pronto Socorro Municipal Humberto Maradei Pereira; e a todos os amigos e colegas que contribuíram para a concretização desta pesquisa.
REFERÊNCIAS
1 Organización Panamericana de la Salud. Situación de salud en las Américas: indicadores básicos 2007 [Internet]. Washington: OPAS; 2007 [citado 2010 abr 10]. Disponível em: http://www.paho.org/spanish/dd/ais/coredata.htm.
2 Cashat-Cruz M, Morales-Aguirre JJ, Mendoza-Azpiri M. Respiratory tract infections in children in developing countries. Semin Pediatr Infect Dis. 2005 Apr;16(2):84-92. Doi: 10.1053/j.spid.2005.12.005 [Link]
3 Monto AS. Occurrence of respiratory virus: time, place and person. Pediatr Infect Dis J. 2004 Jan;23(1 Suppl):S58-64. [Link]
4 Manoha C, Espinosa S, Aho S, Huet F, Pothier P. Epidemiological and clinical features of hMPV, RSV e RVs infections in young children. J Clin Virol. 2007 Mar;38(3):221-6. Doi: 10.1016/j.jcv.2006.12.005 [Link]
5 Debur MC. Metapneumovirus humano: diagnóstico laboratorial e estudo clinico-epidemiológico de pacientes hospitalizados e ambulatoriais na cidade de Curitiba durante os anos de 2006 a 2008 [dissertação]. Curitiba (PR): Universidade Federal do Paraná; 2010. [Link]
6 Boivin G, De Serres G, Côté S, Gilca R, Abed Y, Rochette L, et al. Human metapneumovirus infections in hospitalized children. Emerg Infect Dis. 2003 Jun;9(6):634-40. [Link]
7 Arruda NE, Hayden FG, Mcauliffe JF, Sousa MA, Mota SB, Mcauliffe MI. Acute respiratory viral infections in ambulatory children of urban northeast Brazil. J Infect Dis. 1991 Aug;164(2):252-8. Doi: 10.1093/infdis/164.2.252 [Link]
8 Alonso WJ, Viboud C, Simnsen L, Hirano EW, Daufenback LZ, Miller MA. Seasonality of influenza in Brazil: a traveling wave from the Amazon to the subtropics. Am J Epidemiol. 2007 Jun;165(12):1434-42. Doi: 10.1093/aje/kwm012 [Link]
9 Thomazelli LM, Vieira S, Leal AL, Sousa TS, Oliveira DB, Golono MA, et al. Surveillance of eight respiratory viruses in clinical samples of pediatric patients in southeast Brazil. J Pediatr. 2007 Sep-Oct;83(5):422-8.
10 Silva ER. Infecção grave do trato respiratório inferior em crianças menores de 3 anos: etiologia viral e codetecção como fatores de risco [tese na Internet]. Campinas (SP): Universidade Estadual de Campinas, Faculdade de Ciências Médicas; 2013 [citado 2015 jun 29]. Disponível em: http://www.bibliotecadigital.unicamp.br/document/?code = 000919591.
11 van den Hoogen BG, De Jong JC, Groen J, Kuiken T, De Groot R, Fouchier RAM, et al. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med. 2001 jun;7(6):719-24. Doi: 10.1038/89098 [Link]
12 van den Hoogen BG, Bestebroer TM, Osterhaus ADME, Fouchier RAM. Analysis of the genomic sequence of a human metapneumovirus. Virology. 2002 Mar;295(1):119-32. Doi:10.1006/viro.2001.1355 [Link]
13 Biacchesi S, Skiadopoulos MH, Boivin G, Hanson CT, Murphy BR, Collins PL, et al. Genetic diversity between human metapneumovirus subgroups. Virology. 2003 Oct;315(1):1-9. Doi: 10.1016/S0042-6822(03)00528-2 [Link]
14 Huck B, Scharf G, Neumann-Haefelin D, Puppe W, Weigl J, Falcone V. Novel human metapneumovirus sublineage. Emerg Infect Dis. 2006 Jan;12(1):147-50. Doi: 10.3201/eid1201.050772 [Link]
15 Mendes TMTC. Detecção de vírus implicados em infecções respiratórias e avaliação de sua diversidade em amostras clínicas [dissertação]. Lisboa: Universidade de Lisboa, Faculdade de Ciências; 2010. [Link]
16 Ribeiro JF. Perfil clínico-epidemiológico das infecções respiratórias agudas causadas por metapneumovírus humano em crianças atendidas no Hospital Infantil Albert Sabin - Fortaleza/Ceará [dissertação]. Fortaleza (CE): Universidade Federal do Ceará; 2008. [Link]
17 Debur MC, Bordingnon J, Santos CND, Vidal LR, Nogueira MB, Almeida SM, et al. Acute respiratory infection by human metapneumovirus in children in southern Brazil. J ClinVirol. 2007 May;9(1):59-62. Doi: 10.1016/j.jcv.2007.01.012 [Link]
18 Pilger DA. Detecção molecular de Bocavirus humano e Metapneumovirus humano associados à infecção respiratória aguda [tese]. Porto Alegre (RS): Universidade Federal do Rio Grande do Sul; 2009. [Link]
19 Cuevas LE, Nasser AM, Dove W, Gurgel RQ, Grensill J, Hart CA. Human metapneumovirus and respiratory syncytial virus, Brasil. Emerg Infect Dis. 2003 Dec;9(12):1626-8. Doi: 10.3201/eid0912.030522 [Link]
20 Silva LH, Spilki FR, Riccetto AG, Almeida RS, Baracat EC, Arns CW. Variant isolates of human pneumovirus subgroup B genotype 1 in Campinas, Brazil. J Clin Virol. 2008 May;42(1):78-81. Doi: 10.1016/j.jcv.2007.11.010 [Link]
21 Parmezan SN, Pasternak J, Dezene AHP, Martino MDV, Sousa AV. Estudo comparativo de detecção de metapneumovírus humano pelos métodos de PCR e imunofluorescência direta. J Bras Patol Med Lab. 2011 ago;47(4):427-30. Doi: 10.1590/S1676-24442011000400006 [Link]
22 Lozano-C J, Yanez-P L, Lapadula-A M, Lafourcade-R M, Burgos-F F, Herrada-H L, et al. Infección por metapneumovirus humano en niños hospitalizados por una enfermedad respiratoria aguda grave: descripción clínico-epidemiológica. Rev Chil Enf Respir. 2009;25(4):211-7. Doi: 10.4067/S0717-73482009000400002 [Link]
23 Esper F, Boucher D, Weibel C, Martinello RA, Kahn JS. Human metapneumovirus infection in the United States: clinical manifestations associated with a newly emerging respiratory infection in children. Pediatrics. 2003 Jun;111(6):1407-10. [Link]
24 Chano F, Rousseau C, Laferrière C, Couillard M, Charest H. Epidemiological survey of human metapneumovirus infection in a large pediatric tertiary care center. J Clin Microbiol. 2005 Nov;43(11):5520-5. Doi: 10.1128/JCM.43.11.5520-5525.2005 [Link]
25 von Linstow ML, Eugen-Olsen J, Koch A, Winther TN, Westh H, Hogh B. Excretion patterns of human metapneumovirus and respiratory syncytial virus among young children. Eur J Med Res. 2006 Aug;11(8):329-35. [Link]
26 Williams JV, Wang CK, Yang C, Tollefson SJ, House FS, Heck JM, et al. The role of human metapneumovirus in upper respiratory tract infections in children: a 20-year experience. J Infect Dis. 2006 Feb;193(3):387-95. Doi: 10.1086/499274 [Link]
27 Sloots TP, Mackay IM, Bialasiewicz S, Jacob KC, Mcqueen E, Harnett GB, et al. Human metapneumovirus, Australia, 2001-2004. Emerg Infect Dis. 2006 Aug;12(8):1263-6. Doi: 10.3201/eid1208.051239 [Link]
28 Wolf DG, Greenberg D, Shemer-Avni Y, Givon-Lavi N, Bar-Ziv J, Dagan K. Association of human metapneumovirus with radiologically diagnosed community-acquired alveolar pneumonia in young children. J Pediatr. 2010 Jan;156(1):115-20. Doi: 10.1016/j.jpeds.2009.07.014 [Link]
29 van den Hoogen BG. Respiratory tract infection due to human metapneumovirus among elderly patients. Clin Infect Dis. 2007 May;44(9):1159-60. Doi: 10.1086/513295 [Link]
30 Marcondes E, Vaz FAC, Ramos JLA, Okay Y, organizadores. Pediatria básica. 9. ed. Tomo II; Pediatria clínica geral. São Paulo: Sarvier; 2003.
31 Kaida A, Kubo H, Goto K, Shiomi M, Kohdera U, Iritani N. Co-infection of human metapneumovirus with adenovirus or respiratory syncytial virus among children in Japan. Microbiol Immunol. 2007 Jul;51(7):679-83. Doi: 10.1111/j.1348-0421.2007.tb03956.x [Link]
32 Ministério da Saúde (BR). Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Departamento de Ciência e Tecnologia. Síntese de evidências para políticas de saúde: mortalidade perinatal [Internet]. Brasília: Ministério da Saúde; 2012 [citado 2015 jul 30]. (Série B. Textos básicos de saúde). Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/sintese_evidencias_mortalidade_perinatal.pdf.
33 Castillo-Segovia M. Detección de metapneumovirus humano mediante RT-PCR en niños menores de 5 años con infección respiratoria aguda. Mayo -Septiembre de 2009. Instituto Nacional de Higiene y Medicina Tropical "Leopoldo Izquieta Pérez". Med Pre. 2013 sep;3(1):20-4.
34 Okada T, Matsubara K, Matsushima T, Kamiyama O, Chiba N, Hamano K, et al. Analysis of clinical features of community-acquired pneumonia caused by pediatric respiratory sincicial virus and human metapneumovirus. Kansenshogaku Zasshi. 2010 Jan;84(1):42-7. [Link]
35 Reina J, Ferres F, Alcoceba E, Mena A, De Gopegui ER, Figuerola J. Comparison of different cell lines and incubation times in the isolation by the shell vial culture of human metapneumovirus from pediatric respiratory samples. J Clin Virol. 2007 Sep;40(1):46-9. Doi: 10.1016/j.jcv.2007.06.006 [Link]
36 Mullins JA, Erdman DD, Weinberg GA, Edwards K, Hall CB, Walker FJ, et al. Human metapneumovirus infection among children hospitalized with acute respiratory illness. Emerg Infect Dis. 2004 Apr;10(4):700-5. [Link]
37 Antunes H, Rodrigues H, Silva N, Ferreira C, Carvalho F, Ramalho H, et al. Etiology of bronchiolitis in a hospitalized pediatric population: prospective multicenter study. J Clin Virol. 2010 Jun;48(2):134-6. Doi: 10.1016/j.jcv.2010.03.002 [Link]
38 Huang CG, Tsao KC, Lin TY, Huang YC, Lee LA, Chen TH, et al. Estimates of individual exposed to human metapneumovirus in a community-based Taiwanese population in 1999. Arch Virol. 2010 Mar;155(3):343-50. Doi: 10.1007/s00705-010-0596-1 [Link]
39 Rodrigues JBR, Sá LDA, Ruivo MLP, Costa ACL, Silva RB, Moura QL, et al. Variabilidade quantitativa de população microbiana associada às condições microclimáticas observadas em solo de floresta tropical úmida. Rev Bras Meteorol. 2011 dez;26(4):629-38. Doi: 10.1590/S0102-77862011000400012 [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Orlando da Gama Rodrigues
Rua Dr. Silva Rosado, 763. Bairro: Canudos
CEP: 66070-510 Belém-Pará-Brasil
Tel.: +55 (91) 3274-8783 / 99982-9495
E-mail: mogr@terra.com.br
Recebido em / Received / Recibido en: 14/11/2014
Aceito em / Accepted / Aceito en: 3/8/2015
*Artigo resultado de tese apresentada por Orlando da Gama Rodrigues ao Programa de Pós-graduação em Ciências da Universidade Federal de São Paulo, sob orientação do prof. dr. Werther Brunow de Carvalho, para obtenção do título de Doutor em Medicina, em 2011, São Paulo, Brasil.












 Curriculum ScienTI
Curriculum ScienTI
