Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.6 n.4 Ananindeua dez. 2015
http://dx.doi.org/10.5123/S2176-62232015000400008
RELATO DE CASO | CASE REPORT | RELATO DE CASO
Investigação sorológica, molecular e anatomopatológica para leptospirose em ovinos (Ovis aries) procedentes de um biotério de criação
Serological, molecular and pathological investigation for leptospirosis in ovines (Ovis aries) coming from a vivarium creation
Investigación serológica, molecular y anatomopatológica para leptospirosis en ovinos (Ovis aries) procedentes de un bioterio de cría
Liliane Almeida CarneiroI; Márcia de Nazaré Miranda BahiaII; Washington Luiz Assunção PereiraIII; Hilma Lúcia Tavares DiasIV; Ana Roberta Fusco da CostaV
ICentro Nacional de Primatas, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IISeção de Criação e Produção de Animais de Laboratório, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
IIILaboratório de Investigação e Diagnóstico de Enfermidades Animal, Universidade Federal Rural da Amazônia, Belém, Pará, Brasil
IVLaboratório de Investigação e Diagnóstico de Enfermidades Animal, Universidade Federal do Pará, Belém, Pará, Brasil
VSeção de Bacteriologia e Micologia, Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
Endereço para correspondência
Correspondence
Dirección para correspondencia
RESUMO
O presente trabalho relata um surto de leptospirose ocorrido no plantel de ovinos criados com finalidade de fornecimento de sangue aos laboratórios para produção de meios de cultivos e de testes de fixação de complemento. Foram realizadas análises sorológica, molecular e histopatológica. A análise sorológica foi realizada em 12 amostras utilizando o teste de soroaglutinação microscópica com ponto de corte 100, para os sorovares Leptospira Bataviae, L. Javanica, L. Panama, L. Hebdomadis, L. Castellonis, L. Icterohaemorrhagiae, L. Pyrogenes, L. Cynopteri, L. Serjoe, L. Australis, L. Wolffi, L. Copenhageni, L. Autumnalis, L. Pomona e L. Tarassovi. O exame anatomopatológico foi realizado somente em um dos animais, o qual foi encontrado morto e as análises moleculares foram realizadas no sangue e na urina utilizando a técnica do qPCR. Foram reagentes ao diagnóstico sorológico 50% dos animais, sendo identificados os sorovares L. Copenhageni (1/100 e 1/200), L. Castellonis (1/200 e 1/200), L. Icterohaemorrhagiae (1/200) e L. Cynopteri (1/200). O animal necropsiado apresentou hemorragia, icterícia e hemoglobinúria. A análise molecular demonstrou três animais positivos em amostras de sangue e dois animais positivos em amostras de urina, não havendo positividade concomitante para um mesmo animal. A identificação dos sorovares Icterohaemorrhagiae e Copenhageni sugere a necessidade de estudos, visando o isolamento do agente na região e a caracterização de sua patogenicidade, visto que no Brasil estes são os principais agentes etiológicos dos casos de leptospirose em humanos.
Palavras-chave: Leptospira; Ovinos; Biotério.
ABSTRACT
The current paper reports an outbreak of leptospirosis in sheep production created with the purpose of blood supply to laboratories for production of growth medium and complement fixation test. Serological, molecular and histopathological analyses were performed. Serologic analysis was performed on 12 samples using the microscopic agglutination test with cutoff point of 100 for the serovars: Leptospira Bataviae, L. Javanica, L. Panama, L. Hebdomadis, L. Castellonis, L. Icterohaemorrhagiae, L. Pyrogenes, L. Cynopteri, L. Serjoe, L. Australis, L. Wolffi, L. Copenhageni, L. Autumnalis, L. Pomona e L. Tarassovi. Anatomopathological examination was performed on only one animal, which was found dead and molecular analyzes were performed in its blood and urine using the qPCR technique. 50% of those animals were reagents to the serological diagnosis, being identified the serovars: L. Copenhageni (1/100 e 1/200), L. Castellonis (1/200 e 1/200), L. Icterohaemorrhagiae (1/200) e L. Cynopteri (1/200). The necropsied animal presented bleeding, jaundice and hemoglobinuria. Molecular analysis showed three positive animals in blood samples and two positive animals in urine samples, with no concomitant positivity for each animal. The identification of Icterohaemorrhagiae and Copenhageni serovars suggests the need for studies aiming the agent isolation in the Brazilian Amazon Region and characterization of its pathogenicity since in Brazil these are the main etiologic agents of leptospirosis cases in humans.
Keywords: Leptospira; Sheep; Vivarium.
RESUMEN
El presente trabajo relata un brote de leptospirosis que tuvo lugar en el plantel de ovinos criados con la finalidad de proveer sangre a los laboratorios para producir medios de cultivos y de pruebas de fijación de complemento. Se realizaron análisis serológico, molecular e histopatológico. El análisis serológico se hizo en 12 muestras utilizando la prueba de seroaglutinación microscópica con punto de corte 100, para los serovares Leptospira Bataviae, L. Javanica, L. Panama, L. Hebdomadis, L. Castellonis, L. Icterohaemorrhagiae, L. Pyrogenes, L. Cynopteri, L. Serjoe, L. Australis, L. Wolffi, L. Copenhageni, L. Autumnalis, L. Pomona y L. Tarassovi. El examen anatomopatológico se realizó en solamente uno de los animales, el cual fue hallado muerto y los análisis moleculares se hicieron en sangre y orina utilizando la técnica de PCR. Fueron reactivos al diagnóstico serológico 50% de los animales, siendo identificados los serovares L. Copenhageni (1/100 y 1/200), L. Castellonis (1/200 y 1/200), L. Icterohaemorrhagiae (1/200) y L. Cynopteri (1/200). En la necropsia el animal presentó hemorragia, ictericia y hemoglobinuria. El análisis molecular demostró tres animales positivos en muestras de sangre y dos animales positivos en muestras de orina, no surgió positividad concomitante para un mismo animal. La identificación de los serovares Icterohaemorrhagiae y Copenhageni sugiere la necesidad de estudios, con el objetivo de aislar el agente en la región y la caracterización de su patogenicidad, teniendo en vista que en Brasil estos son los principales agentes etiológicos de los casos de leptospirosis en humanos.
Palabras clave: Leptospira; Ovinos; Bioterio.
INTRODUÇÃO
A leptospirose é uma antropozoonose causada por bactérias do gênero Leptospira spp., que possui ocorrência em áreas urbanas e rurais. É uma doença que acomete o homem e a grande maioria dos animais domésticos e selvagens. Atualmente são conhecidas 14 espécies patogênicas, sendo a mais importante L. interrogans1. São mantidas na natureza principalmente nos mamíferos, embora já tenham sido isoladas de répteis, anfíbios, peixes, pássaros e invertebrados. Estes animais podem se tornar portadores das leptospiras, albergando-as no aparelho urinário e eliminando-as pela urina para o meio ambiente, constituindo fonte de infecção para animais suscetíveis2. Os principais reservatórios são os animais sinantrópicos domésticos e selvagens como Rattus norvegicus (ratazana ou rato de esgoto), Rattus rattus (rato de telhado ou rato preto) e Mus musculus (camundongo ou catita). Além de outros reservatórios de importância como os caninos, suínos, bovinos, equinos, ovinos e caprinos3. Segundo Ellis4, uma grande quantidade de informação tem sido publicada a respeito da doença em bovinos; porém pouco se sabe sobre a leptospirose nos pequenos ruminantes.
Os animais domésticos menos suscetíveis são os ovinos, no entanto, sofrem com a infecção das leptospiras, com evolução assintomática, em muitos casos, podendo, às vezes, ocorrerem surtos da doença com abortamento e até morte5.
Santa Rosa e Castro6 relataram pela primeira vez, no Brasil, a infecção por Leptospira sp. em ovinos no Estado de São Paulo, onde foi encontrada uma prevalência de 34%.
Diferentes métodos laboratoriais podem confirmar o diagnóstico, seja baseado na detecção de anticorpos, ou por métodos que revelam a presença do microrganismo ou do seu ácido nucleico7,8,9. A Organização Mundial da Saúde (OMS) considera o teste de soroaglutinação microscópica (SAM) com antígenos vivos como padrão ouro para o diagnóstico da leptospirose10. A Reação em Cadeia da Polimerase (PCR) permite amplificar quantidades mínimas de DNA de Leptospira spp. em diversos tipos de amostras biológicas9,11. Alguns casos de leptospirose clinicamente aparentes em ovinos têm sido associados principalmente às sorovariedades Pomona12, Ballum, Grippotyphosa, Icterohaemorrhagiae, Sejroe13 e Hardjo4.
O único que pode utilizar tecidos formolizados é o exame histopatológico (renais, placentários, pulmonares, hepáticos em casos de aborto), possuindo como desvantagem uma baixa sensibilidade e incapacidade de detectar a sorovariedade infectante14.
O presente estudo relata um surto de leptospirose ocorrido no plantel de ovinos, criados com finalidade de fornecimento de sangue aos laboratórios para produção de meios de cultivos e de testes de fixação de complemento.
MATERIAIS E MÉTODOS
O estudo (parecer CEUA/IEC n° 001/2014) relata a ocorrência de surto de leptospirose na criação de ovinos do biotério da Seção de Criação e Produção de Animais de Laboratório do Instituto Evandro Chagas (IEC), órgão vinculado à Secretaria de Vigilância em Saúde do Ministério da Saúde (MS). A criação ficava na proximidade de uma área de mata preservada e possuía em seu entorno uma área residencial, o que facilitou a atração de roedores, tanto silvestres quanto sinantrópicos, devido à disponibilidade de restos alimentares na área de criação.
Somente após a morte de um exemplar dos ovinos e de um abortamento no mês anterior ao óbito resolveu-se proceder às investigações clínicas e laboratoriais sobre a causa mortis e do abortamento dos animais, no entanto os outros exemplares eram clinicamente assintomáticos.
Os espécimes clínicos avaliados incluíram amostras de sangue (n = 12) e urina (n = 9) dos 13 animais suspeitos. O diagnóstico da enfermidade foi realizado por meio de análise sorológica, molecular e histopatológica; o teste de Soroaglutinação Microscópica (SAM) foi realizado conforme as recomendações do MS e da OMS3,11. As amostras foram testadas com diluição variando de 1:100 até 1:6.400 e foram utilizados os seguintes sorovares para a prova de SAM: Australis, Autumnalis, Bataviae, Castellonis, Copenhageni, Cynopteri, Hebdomadis, Icterohaemorrhagiae, Javanica, Panama, Pomona, Pyrogenes, Sejroe, Tarassovi e Wolffi.
O DNA das diferentes amostras foi extraído com o kit comercial QIAamp® DNA Mini Kits (QIAGEN, Austrália), de acordo com as instruções do fabricante. Alíquotas de 200 μL de água ultrapura foram usadas como controles negativos em cada procedimento de extração de DNA. Os ensaios de PCR quantitativa em tempo real (qPCR) foram realizados de acordo com Stoddard et al15, com algumas modificações. A detecção de leptospiras foi realizada pelo gene lipL32, presente apenas em espécies patogênicas, para amplificação do fragmento lipL32 (242 pb) foram utilizados iniciadores LipL32-45F (5'-AAGCATTACCGCTTGTGGTG-3') e LipL32-286R (5'-GAACTCCCATTTCAGCGATT-3'), em conjunto com a sonda de hidrólise LipL32-189P (5'-FAM-AAAGCCAGGACAAGCGCCG-MGB-3'). As amplificações foram realizadas no equipamento 7500 Real-Time PCR System (Applied Biosystems®), utilizando o sistema TaqMan® PCR Master Mix (Applied Biosystems®). As reações foram executadas em duplicata para testar a reprodutibilidade do teste. Um controle negativo (água) e um positivo (L. Icterohaemorrhagiae) foram incluídos em todas as corridas de amplificação.
O exame anatomopatológico pós-morte foi realizado somente em um único animal, o qual foi encontrado morto, procedendo com o registro descritivo e documentação cadavérica. Após ser necropsiado, o cadáver foi acomodado em saco plástico adequado e encaminhado para incineração. Devido ao seu estado de autólise post-mortem não foram colhidas amostras biológicas para realização de exames complementares.
RESULTADOS
De 13 animais testados, cinco (38,4%) foram positivos por meio do qPCR utilizando amostras de sangue e urina e seis animais dos 12 testados pela SAM (50%) reagiram para um ou mais sorovares da Leptospira spp. Dentre os animais soro reagentes, o sorovar Castellonis foi o mais frequente com três soros reagentes (1/200 - 25%), seguido pelo Copenhageni com dois soros reagentes (1/100 e 1/200 - 16,6%) e um soro reagente ao sorovar Icterohaemorrhagiae (1/200 - 8,3%) e um reagente ao sorovar Cynopteri (1/200 - 8,3%).
Um animal apresentou sororreatividade a dois sorovares, Castellonis (1/200) e Cynopteri (1/200). A análise molecular detectou três animais positivos em amostras de sangue (23%) e dois animais positivos em amostras de urina (22,2%), não havendo positividade concomitante em um mesmo animal entre os espécimes clínicos (sangue e urina) segundo a análise molecular (Tabelas 1 e 2).
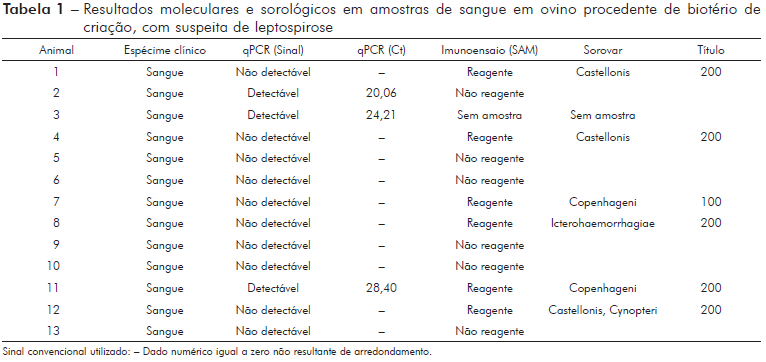
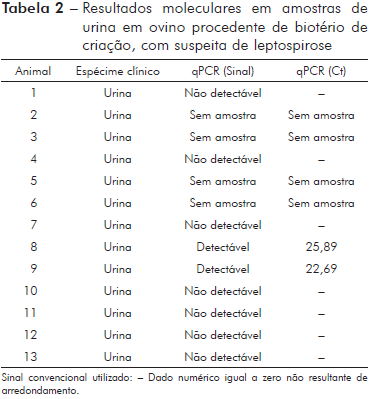
Para o qPCR tivemos uma amostra (Animal 2) que apresentou "threshold cycle" (Ct) 20,06, porém ao SAM foi não reagente, uma segunda amostra (Animal 3) que apresentou Ct 24,21, porém a amostra encaminhada estava hemolisada e não foi possível realizar a SAM e uma terceira amostra (Animal 11) que apresentou Ct 28,40 e resultado ao SAM o soro reagente ao sorovar Copenhageni (1/200) (Tabela 3).

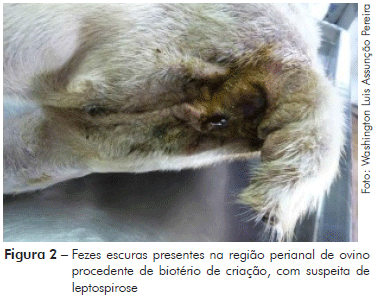
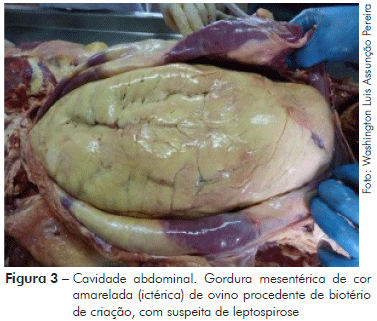
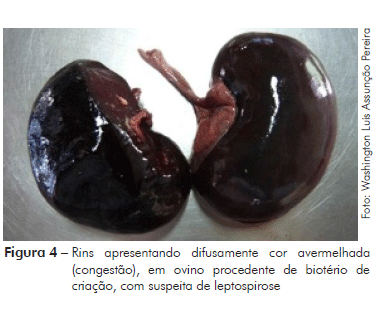
No exame anatomopatológico pós-morte, observou-se que o animal apresentava boa condição corporal, além de sangramento nasal bilateral (Figura 1), sangue fluindo pela cavidade nasal e fezes com sangue no orifício anal (Figura 2). No exame interno, iniciado a partir da incisão mento-pubiana e rabatimento da pele, foi evidenciado edema na região dorsal. A gordura do subcutâneo mostrou-se de coloração amarelada (ictérica) (Figura 3). Na abertura da cavidade torácica evidenciou-se pequena quantidade de líquido de aspecto translúcido; no coração observou-se hemorragias epicárdicas, já com embebição hemolítica (post-mortem). Na abertura da cavidade abdominal, o omento também possuía uma coloração amarelada (icterícia); o fígado estava bastante autolisado com coloração amarelo-acastanhado; o baço mostrou leve aumento de tamanho (esplenomegalia) e os rins uma coloração mais escurecida (congestão) (Figura 4). A bexiga apresentava baixo volume urinário com coloração escurecida (aspecto marrom escuro).

DISCUSSÃO
Os ovinos podem ser portadores e eliminadores da bactéria na urina por um tempo prolongado. Essa eliminação pode constituir um problema zoonótico para todos que entrarem em contato com o animal16,17,18. A leptospirose é um problema ocupacional, pois pesquisas de isolamentos que foram conduzidas em diversos países têm demonstrado a importância dos ovinos na epidemiologia da doença, principalmente em relação à saúde pública7,16.
Existem pesquisadores que apontam possíveis resistências dos ovinos à doença5,19, porém outros relatam surtos de leptospirose aguda com perdas significativas, especialmente em animais jovens, caracterizados por febre alta, hemoglobinúria, anemia hemolítica, icterícia, hematúria e, em alguns casos, morte12,18,20.
Houve a identificação dos sorovares Copenhageni e Icterohaemorrhagiae, que são os principais agentes etiológicos dos casos de leptospirose em humanos no Brasil, confirmando o papel do rato doméstico como o principal reservatório, uma vez que o Rattus rattus e o Rattus norvegicus são os reservatórios mais comuns desses sorovares3, destacando desta maneira a importância dos programas de controle de roedores junto à area de criação. Alguns inquéritos sorológicos realizados no Brasil encontraram esses dois sorovares como um dos mais frequentes9,21,22,23,24,25,26.
O predomínio da reatividade ao sorovar Castellonis concorda com citações de outros autores27 e demonstra que também foi um dos mais frequentes em ovinos5,16,28,29.
Há escassas informações na literatura sobre a prevalência do sorovar Cynopteri em ovinos. Este sorovar foi identificado infectando ovinos de fazendas em outros países, como Portugal, nas Ilhas Antilhas, Itália e Sudão5,30,31,32,33. No Brasil, Carvalho24, detectou o sorovar em um estudo realizado durante abate em feiras livres no Município de Teresina, Estado do Piauí. No Estado do Pará pouco se conhece sobre a soroprevalência da leptospirose em ovinos.
Diferentemente de outros autores1,18,34,35,36 que afirmam que a leptospira sorovar Hardjo é uma das mais prevalentes nos plantéis e ou rebanho de ovinos, não houve a identificação deste neste estudo, mostrando que o diagnóstico de sorovares infectantes para ovinos pode variar dependendo da região.
As respostas sorológicas que foram observadas, podem significar exposição natural à infecção, visto que a vacinação não é preconizada na criação de ovinos utilizados em pesquisa biomédica.
As diferenças e os resultados encontrados em outros trabalhos podem ser atribuídos a fatores metodológicos como ponto de corte, modalidade de teste e coleção de antígenos empregados, todavia não se pode excluir a hipótese do aumento da disseminação de um determinado sorovar na dependência de fatores ambientais ligados ao manejo e a movimentação de animais21.
Um grande número de artigos publicados demonstra a utilidade da PCR em tempo real relacionada à área microbiológica37. A PCR em tempo real é uma metodologia atrativa na substituição da cultura convencional e dos ensaios baseados em antígenos, devido sua elevada sensibilidade e especificidade, associada a um curto tempo para a liberação dos resultados e facilidade de realização da técnica. Além disso, é uma técnica capaz de quantificar o gene alvo produzido a cada ciclo.
Mesmo com apenas uma amostra com detecção do Ct e não reagente no SAM, percebemos que há uma vantagem do qPCR em relação ao SAM, não havendo necessidade de soroconversão (título de 1:100 ou mais) para que a leptospirose possa ser diagnosticada. Esta detecção precoce é extremamente importante para que medidas de controle sejam providenciadas.
São necessários o isolamento e identificação dos sorovares circulantes nos rebanhos e/ou plantéis, objetivando não somente avaliar sua adaptação e interação com as condições de manejo e ambiente, mas também para definir quais sorovares é mais prevalente em determinada região, investigar a patogenicidade e decidir a incorporação destes nas vacinas nacionais.
Com relação aos achados de necropsia têm-se as alterações macroscópicas que incluem graus variáveis de icterícia, hemorragia e anemia, além da presença de sangue na urina. Em alguns animais, os rins podem estar aumentados e com hemorragias petequiais na sua superfície10. Este fato ocorre devido à preferência que as leptospiras têm pelos rins, nos quais provocam lesões severas. Nas lesões renais túbulo-intersticiais são consideradas as alterações patológicas básicas da doença35, no entanto, no presente estudo, não foi possível realizar a análise histopatológica dos tecidos, devido ao avançado estado autolisado dos mesmos.
CONCLUSÃO
Constatou-se que na criação 50% de animais eram reagentes à SAM, com a identificação dos sorovares Icterohaemorrhagiae e Copenhageni, o que sugere a necessidade de estudos visando o isolamento do agente na região e a caracterização de sua patogenicidade, uma vez que no Brasil estes são os principais agentes etiológicos dos casos de leptospirose em humanos.
A criação de animais de produção utilizados em pesquisa biomédica deve obedecer às recomendações de criação de animais de laboratório, para evitar entrada de animais invasores transmissores de patógenos como leptospiras. Sendo assim, optou-se pela eutanásia de todo o plantel.
REFERÊNCIAS
1 Oliveira SV, Arsky MLNS, Caldas ER Reservatórios animais da leptospirose: uma revisão bibliográfica. Rev Saude Santa Maria. 2013 jan-jun;39(1):9-20. [Link]
2 Vasconcellos SA, Marvulo MFV, Paula CD, Ferreira RM, Morais ZM, Delbem ACB, et al. Detection of Leptospira in two free living populations of capybaras (Hydrochaeris hydrochaeris) from São Paulo State, Brazil. In: Proceedings 3rd Scientifica Meetings International Lepospirosis Society; 2002 Oct 28-30; Los Angeles: ILS; 2002; 62 p.
3 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Guia de vigilância epidemiológica [Internet]. 7. ed. Brasília: Ministério da Saúde; 2009 [citado 2014 jul 10]. Caderno 8: leptospirose; p. 15. Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/guia_vigilancia_epidemiologica_7ed.pdf.
4 Ellis WA. Leptospirosis as a cause of reproductive failure. Vet Clin North Am Food Anim Pract. 1994 Nov;10(3):463-78.
5 Ciceroni L, Lombardo D, Rinto A, Ciarrocchi S, Simeoni J. Prevalence of antibodies to Leptospira serovars in sheep and goats in Alto Adige, South Tyrol. J Vet Med. 2000 Apr;47(3):217-23. Doi: 10.1046/j.1439-0450.2000.00333.x [Link]
6 Santa Rosa CA, Castro AFR. Presença de aglutininas anti-leptospiras em soros de ovinos e caprinos no estado de São Paulo. Arq Inst Biol Sao Paulo. 1963;30:93-8.
7 Faine S, Adler B, Bolin C, Perolat P. Leptospira and leptospirosis. 2nd. ed. Melbourne: Medisci; 1999. 272 p.
8 Levett PN. Leptospirosis. Clin Microbiol Rev. 2001 Apr.14(2):296-326. Doi: 10.1128/CMR.14.2.296-326.2001 [Link]
9 Higino SSS, Azevedo SS, Alves CJ, Figueiredo SM, Silva MLCR, Batista CSA. Frequência de leptospirose em ovinos abatidos no município de Patos, Paraíba. Arq Ins Biol. 2010 jul-set;77(3):525-7. [Link]
10 World Health Organization. Human leptospirosis: guidance for diagnosis, surveillance and control. Geneva: WHO; 2003. 122 p. [Link]
11 Bal AE, Gravekamp C, Hartskeerl RA, Meza BJ, Kurver H, Terpstra WJ. Detection of leptospirosis in urine by PCR for early diagnosis of leptospirosis. J Clin Microbiol. 1994 Aug;32(8):1894-8. [Link]
12 Davidson JN, Hirsh DC. Leptospirosis in lambs. J Am Vet Med Assoc. 1980 Jan;176(2):124-5.
13 Leon-Vizcaino L, Hermoso MM, Garrido F. Incidence of abortions caused by leptospirosis in sheep and goats in Spain. Comp Immunol Microbiol Infect Dis. 1987;10(2):149-53. Doi: 10.1016/0147-9571(87)90009-9 [Link]
14 Grooms DL, Bolin CA. Diagnosis of fetal loss caused by bovine viral diarrhea virus and Leptospira spp. Vet Clin North Am Food Anim Pract. 2005 Jul;21(2):463-72. Doi: 10.1016/j.cvfa.2005.02.010 [Link]
15 Stoddard RA, Gee JE, Wilkins PP, McCaustland K, Hoffmaster AR. Detection of pathogenic Leptospira spp. through TaqMan polymerase chain reaction targeting the LipL32 gene. Diagn Microbiol Infect Dis. 2009 Jul;64(3):247-55. Doi: 10.1016/j.diagmicrobio.2009.03.014 [Link]
16 Azevedo SS, Alves CJ, Andrade JSL, Batista CSA, Clementino IJ, Santos FA. Occurrence of anti-Leptospira aglutinins in sheep of the Rio Grande do Norte State, Brazil. Rev Bras Cienc Vet. 2004;11(3):167-70.
17 Melo LSS, Castro MBC, Leite RC, Moreira CM, Melo CB. Principais aspectos da infecção por Leptospira sp em ovinos. Cienc Rural. 2010 mai;40(5):1235-41. Doi: 10.1590/S0103-84782010005000072 [Link]
18 Salaberry SRS, Castro V, Nassar AFC, Castro JR, Guimarães EC, Ribeiro AMCL, et al. Seroprevalence and risk factors of antibodies against Leptospira spp. in ovines from Uberlândia municipality, Minas Gerais state, Brazil. Braz J Microbiol. 2011 Oct-Dec;42(4):1427-33. Doi: 10.1590/S1517-838220110004000026 [Link]
19 Hathaway SC. Leptospirosis in New Zealand: an ecological view. N Z Vet J. 1981 Jul;29(7):109-12. Doi: 10.1080/00480169.1981.34815 [Link]
20 Vermut JJ, West DM, Cooke MM, Alley MR, Collins-Emerson J. Observations on three outbreaks of Leptospira interrogans serovar pomona infection in lambs. N Z Vet J. 1994 Aug;42(4):133-6. [Link]
21 Favero ACM, Rinheiro SR, Vasconcelos SA, Moraes ZM, Ferreira F, Ferreira Neto JS. Sorovares de leptospiras predominantes em exames sorológicos de bubalinos, ovinos, caprinos, equinos, suínos e cães de diversos estados brasileiros. Cienc Rural. 2002;32(4):613-9. [Link]
22 Araújo Neto JO, Alves CJ, Azevedo SS, Silva MLCR, Batista CSA. Soroprevalência da leptospirose em caprinos da microrregião do Seridó Oriental, Estado do Rio Grande do Norte, Brasil, e pesquisa de fatores de risco. Braz J Vet Res Anim Sci. 2010;47(2):150-5. Doi: 10.1590/S1413-95962010000200007 [Link]
23 Escócio C, Genovez ME, Castro V, Riatti RM, Gabriel FHL, Chiebao DR, et al. Influência das condições ambientais na transmissão da leptospirose entre criação de ovinos e bovinos da região de Sorocaba, SP. Arq Inst Biol. 2010 jul-set;77(3):371-9. [Link]
24 Carvalho SM. Avaliação das alterações em rim, fígado e pulmões de ovinos infectados por leptospiras [tese] Teresina (PI): Universidade Federal do Piauí; 2012. 74 p.
25 Santos PJ, Lima-Ribeiro AMC, Oliveira PR, Santos MP, Ferreira Junior A, Medeiros AA, et al. Seroprevalence and risk factors for Leptospirosis in goats in Uberlândia, Minas Gerais, Brazil. Trop Anim Health Prod. 2012 Jan;44(1):101-6. Doi: 10.1007/s11250-011-9894-1 [Link]
26 Silva RC, Costa VM, Shimabukuro FH, Richine-Pereira VB, Menozzi BD, Langoni H. Frequency of Leptospira spp. in sheep from Brazilian slaughterhouses and its association with epidemiological variables. Pesq Vet Bras. 2012 Mar;32(3):194-8. Doi: 10.1590/S0100-736X2012000300002 [Link]
27 Barbante P, Shimabukuro FH, Langoni H, Richini-Pereira VB, Lucheisi SB. Leptospira spp. infection in sheep herds in southeast Brazil. J Venom Anim Toxins Incl Trop Dis. 2014 Jun;20:20. Doi: 10.1186/1678-9199-20-20 [Link]
28 Caldas EM, Viegas EA, Viegas SARA, Reis RS, Santos MS. Aglutininas antileptospira em hemo-soros de animais domésticos no Estado da Bahia. Arq Esc Med Vet UFBA. 1993;16(1):49-59.
29 Langoni H, Marinho M, Baldoni S, Silva AV, Cabral KG, Silva ED. Pesquisa de aglutininas antileptospíricas em soros de ovinos no estado de São Paulo, Brasil, utilizando provas de macroaglutinação em placa e soroaglutinação microscópica. Rev Bras Med Vet. 1995;17:264-8.
30 Sebek Z, Sixl W, Reinthaler F, Abdel ON, Stunzer D, Schneeweiss W, et al. Leptospirosis in the Melut district- upper Nile province (south Sudan)-an overview. Georgr Med Suppl. 1989;5:161-78.
31 Sebek Z, Sixl W, Reinthaler F, Valová M, Schneeweiss W, Stunzner D, et al. Results of serological examination for leptospirosis of domestic and wild animals in the Upper Nile province (Sudan). J Hyg Epidemiol Microbiol Immunol. 1989;33(3):337-45.
32 Levett PN, Whitington CU, Camus E. Serological survey of leptospirosis in livestock animals in the Lesser Antilles. Ann N Y Acad Sci. 1996 Jul;791:369-77. Doi: 10.1111/j.1749-6632.1996.tb53544.x [Link]
33 Rocha T. A review of leptospirosis in farm animals in Portugal. Rev Sci Tech. 1998 Dec;17(3):699-712. [Link]
34 Ribeiro SCA, Bisnoto DP, Oliveira PR. Prevalência da leptospirose em fêmeas reprodutoras bovinas do município de Uberlândia, MG. Vet Noticias. 2000;6(1):69-75.
35 Hermann GP, Lage AP, Moreira EC, Haddad JPA, Resende JR, Rodrigues RO, et al. Soroprevalência de aglutininas anti-Leptospíra spp. em ovinos nas Messoregiões Sudeste e Sudoeste do Estado Rio Grande do Sul, Brasil. Cienc Rural. 2004 mar-abr;34(2):443-8. Doi: 10.1590/S0103-84782004000200017 [Link]
36 Aguiar DM, Cavalcante GT, Vasconcellos SA, Souza GO, Labruna MB, Carmargo LMA, et al. Anticorpos anti-Leptospira spp. em ovinos do município de Monte Negro, Estado de Rondônia. Arq Inst Biol. 2010 jul-set;77(3):529-32. [Link]
37 Espy MJ, Uhl JR, Sloan LM, Buckwalter SP, Jones MF, Vetter EA, et al. Real-time PCR in clinical microbiology: applications for routine laboratory testing. Clin Microbiol Rev. 2006 Jan;19(1):165-256. Doi: 10.1128/CMR.19.1.165-256.2006 [Link]
 Correspondência / Correspondence / Correspondencia:
Correspondência / Correspondence / Correspondencia:
Liliane Almeida Carneiro
Instituto Evandro Chagas/SVS/MS
Rodovia BR 316 km 7, s/n. Bairro: Levilândia
CEP: 67030-000 Ananindeua-Pará-Brasil
Tel.: +55 (91) 3213-0469
E-mail: lilianecarneiro@iec.pa.gov.br
Recebido em / Received / Recibido en: 27/11/2014
Aceito em / Accepted / Aceito en: 3/12/2015