Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude v.7 n.4 Ananindeua dez. 2016
http://dx.doi.org/10.5123/s2176-62232016000400004
ARTÍCULO ORIGINAL
Alteración masticatoria, ambiente enriquecido y envejecimiento: estudios estereológicos de CA1 del hipocampo de ratones albinos suizos*
3Laboratório de Investigações em Neurodegeneração e Infecção, Hospital Universitário João de Barros Barreto, Instituto de Ciências Biológicas, Universidade Federal do Pará, Belém, Pará, Brasil
4Centro Universitário do Estado do Pará, CESUPA, Belém, Pará, Brasil
OBJETIVOS:
Con el objeto de investigar los efectos de la alteración de la actividad masticatoria sobre la población celular, se evaluaron las consecuencias de la dieta de molido grueso sobre la cantidad de astrocitos en CA1 (Cuerno de Amón 1) del hipocampo. Además, se consideraron los impactos de la dieta y las posibles alteraciones asociadas al ambiente enriquecido y a los procesos neuropatológicos que pueden surgir durante el envejecimiento.
MATERIALES Y MÉTODOS:
Ratones hembras de la variedad albina suiza se dividieron en ventanas temporales de 6, 12 y 18 meses. Esos animales, distribuidos en grupos, recibieron ración en pellet (PE) o molido grueso (MG), siendo criados en ambiente enriquecido o estándar. Completadas las edades, se procesa material encefálico para inmunohistoquímica de la proteína fibrilar acídica de la glia. Con el auxilio del fraccionador óptico, se cuantificaron los astrocitos en CA1, destacándose variaciones entre sus camadas.
RESULTADOS:
El ambiente estándar indujo modificaciones laminares en diferentes modelos en todas las camadas, identificando aumentos y reducciones en el número de astrocitos (grupos PE, en el Stratum lacunosum-moleculare; y MG, en todas las camadas). En el ambiente enriquecido, se notaron modificaciones significativas solamente en la camada piramidal (entre las edades de 6 y 12 meses y de 6 y 18 meses, con reducción en el número).
CONCLUSIÓN:
Las diferencias encontradas serían dependientes de la dieta, de la edad y del envejecimiento, sugiriendo que la astrocitosis en ratones adultos jóvenes estaría relacionada a mecanismos neuroprotectores y que la privación masticatoria en esa edad influiría negativamente esa acción. Además, los astrocitos en el envejecimiento estarían involucrados en procesos proinflamatorios cuando asociados a una condición de alteración de la masticación y el enriquecimiento ambiental suministraría neuroprotección a los efectos maléficos del envejecimiento y de la privación masticatoria.
Palabras-clave: Masticación; Envejecimiento; Astrocitos; Neurodegeneración
INTRODUCCIÓN
Con el aumento de la expectativa de vida, se ha constatado un significativo aumento de la población de adultos mayores, bien como un incremento en la prevalencia de demencias y enfermedades neurodegenerativas1,2,3. El aumento de esa parcela de la población con edad superior a 65 años refuerza la necesidad de una comprensión minuciosa a respecto del proceso de envejecimiento y de sus alteraciones y consecuencias.
Aoki et al4 afirmaron que la neurogénesis que sucede en el giro dentado del hipocampo, una importante región para la memoria y el aprendizaje en roedores y en humanos, está reglamentada por algunos factores, como exposición a un ambiente enriquecido, actividad física, envejecimiento y estrés. La formación hipocampal, que desempeña un papel fundamental en la memoria espacial, es muy sensible al proceso de envejecimiento, siendo una de las primeras regiones del cerebro a evidenciar cambios morfológicos, fisiológicos y neuroquímicos con el avance de la edad. Bases de pruebas de aprendizaje en ratones sin los dientes molares mostraron que la disfunción oclusal podría estar involucrada en el proceso de degeneración asociada a la demencia senil5.
Por otra parte, se describe que el flujo sanguíneo cerebral, en varias regiones del cerebro, es afectado por la masticación, y que los astrocitos pueden desarrollar un papel clave en la regulación de ese flujo6,7,8,9,10,11,12. La regulación de flujo sanguíneo cerebral se hace a través del calcio (Ca2+) astrocítico responsables por ondas de señalización que pueden inducir tanto a dilatación como a constricción de las arteríolas por medio de su concentración12. Los astrocitos son células extremamente numerosas, siendo afectados en varias situaciones neuropatológicas, incluyendo el envejecimiento, la neurodegeneración crónica y la infección. Esas condiciones adversas comprometerían de la misma manera la función sináptica por estar relacionadas a eventos de plasticidad sináptica debido a la liberación de glutamato en áreas críticas para la consolidación de la memoria, como en las regiones hipocampales de CA1 y CA3 (Asta de Amón 1 y 3) y en el giro dentado13,14,15. Por esos motivos, es evidente que los astrocitos son imprescindibles para la función cerebral normal, y, por lo tanto son esenciales las investigaciones acerca de posibles cambios en su número, distribución y forma.
En estudios previos, por ejemplo, el desempeño en el laberinto acuático de Morris disminuyó en ratones jóvenes y viejos mantenidos en ambiente estándar y privados de actividad masticatoria desde el 21° día postnatal, y esto se asoció con la astrocitosis en la capa polimórfica del giro dentado en los individuos más viejos16.
Con respecto a la estimulación del medio ambiente, en un estudio con la misma variedad propuesta aquí (ratones albinos suizos), se concluyó que a largo plazo, el enriquecimiento ambiental fue capaz de influir en el número de astrocitos de diferentes capas del giro dentado, así como en el rendimiento de estos animales en las pruebas de comportamiento que evaluaron la
memoria espacial y la memoria similar a la episódica; esto demuestra los efectos del medio ambiente y del envejecimiento sobre la plasticidad glial, efectos también sometidos a investigación en el trabajo presentado17.
Basado en lo anterior, el presente estudio se propuso, con el auxilio de ensayos inmunohistoquímicos y con el método del fraccionador óptico, a evaluar comparativamente las consecuencias de la dieta de molido grueso y del medio ambiente en la cantidad de astrocitos en la región de CA1 del hipocampo y sus laminaciones.
MATERIALES Y MÉTODOS
Todos los procedimientos experimentales del presente trabajo siguieron los principios recomendados por la publicación Principles of Laboratory Animal Care da National Institutes of Health. Para investigar la influencia de la dieta, del medio ambiente y la edad, se utilizaron hembras adultas jóvenes y viejas de ratones de la variedad albinos suizos, cortesía del Instituto Evandro Chagas y alojados en el bioterio del Laboratorio de Investigación en Neurodegeneración e Infección del Hospital Universitario João de Barros Barreto. Los procedimientos fueron revisados y aprobados por el Comité de Ética para Experimentación Animal de la Universidad Federal de Pará (CEPAE/UFPA Nº BIO004-09).
Los animales se distribuyeron para formar grupos de edades de 6 meses (6M), 12 meses (12M) y 18 meses (18M), alojados en condiciones empobrecidas (ambiente patrón - AP) o enriquecidas (ambiente enriquecido - AE), y alimentados poco después del destete por dos tipos diferentes de alimentación. El grupo control recibió alimentación en pellet (PE), y el grupo experimental tuvo restricción masticatoria, con harinas de molido grueso y tamizadas (MG). Los sujetos tuvieron acceso libre a comida y agua, y es de destacar que no había diferencias nutricionales entre los alimentos ofrecidos. Aún así, se mantuvo el control de peso quincenal de los animales. De esa manera se generaron, en estas condiciones, seis grupos (Cuadros1 y 2).

Cuadro 1 - Número de animales para cada grupo criado en AP, según la ventana temporal y el tipo de alimento ofertado
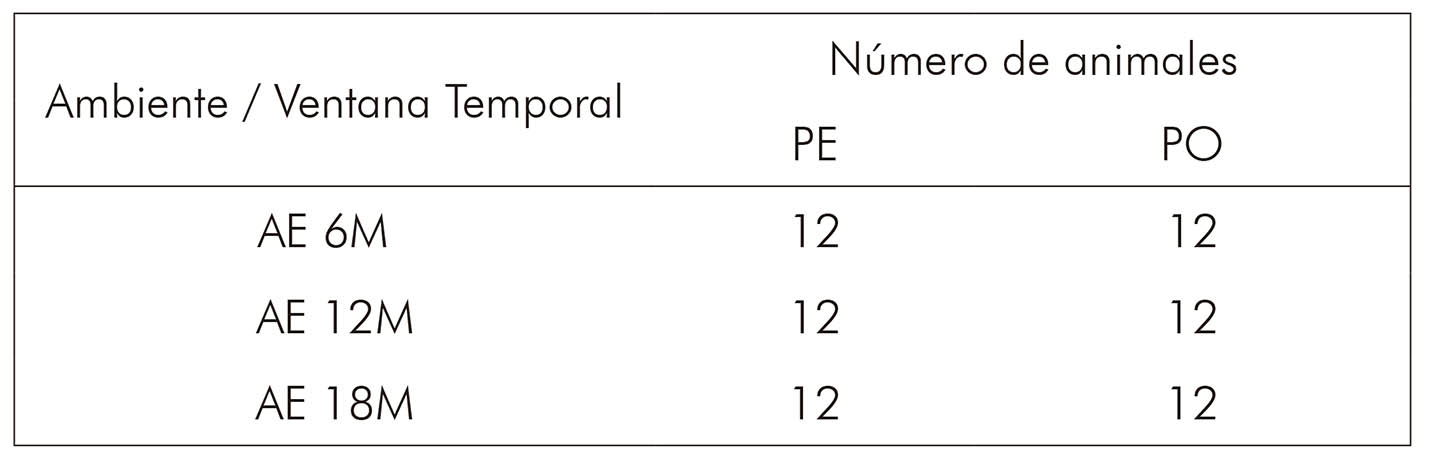
Cuadro 2 - Número de animales para cada grupo criado en AE, según la ventana temporal y el tipo de alimento ofertado
Los animales del AP fueron alojados en jaulas de plástico de dimensiones 32x39x16,5 cm y cubiertas con una rejilla metálica, que alberga seis ratones. Los grupos alojados en AE estaban inseridos en un espacio de 50x50x50 cm, con dos pisos, equipados con puentes de plástico, ruedas para correr, juguetes y túneles hechos de plástico, lo que permite el ejercicio voluntario durante todo el período. El ambiente sufría cambios semanales, fueran alteraciones en la posición de los objetos o incluso cambiarlos. Cada jaula alojaba 12 ratones. Todas las jaulas se mantuvieron en una habitación a temperatura controlada (23 ± 1º C) y ciclos de luz-oscuridad de 12 h (período de luz de 6-18 horas, período oscuro, 18-6 h).
Al final de cada ventana de tiempo de observación, los animales recibieron dosis letal y anestésico fueron perfundidos con fijadores de aldehído después de la eliminación previa de la sangre circulante con solución salina. Sus cerebros se retiraron y se cortan en vibratome, recogida, en una serie anatómica ordenado, secuencial para el posterior inmunomarcado de proteína ácida fibrilar glial (GFAP). Una de cada seis secciones con espesor constante de 60 µm, se seleccionaron para la muestra de inmunomarcado, usando el anticuerpo monoclonal GFAP (ratón anti- GFAP MAB360, Chemicon Int., EE.UU.). También se usa para tinción de contraste con violeta al 1% Cresil para definir las diapositivas CA1 y establecer los límites de los cuerpos celulares de astrocitos.
A seguir, se realizaron análisis estereológicos para estimar el número de los astrocitos con el programa especializado Stereo Investigator® (MBF Bioscience, Williston, VT, EE.UU.). La distribución laminar de CA1 se definió tomando como referencia la camada piramidal. Esta visualización se justifica por el "empacotamiento" de las células en comparación con las células piramidales de CA3. Por lo tanto, se nota en CA1 una camada piramidal más estrecha, pero más densa18,19. Después de definir el contorno de la camada piramidal en CA1, se proyectaban, paralelamente a la misma, las otras camadas de la región, teniendo en cuenta también las diferencias morfológicas de los astrocitos entre estas capas.
Se obtuvo el número total de astrocitos como una función de probabilidad estimada basado en el espesor de las secciones, en el área de la caja de conteo y en el área de interés muestral. La ecuación matemática que relaciona estas variables entre sí y permite estimar el número total de objetos de interés se define por
En esta ecuación, N es el número total de los astrocitos; ∑Q es el número de astrocitos identificados por el experimentador; ssf es la fracción del número de secciones del muestreo; asf es la fracción del muestreo; y tsf es la fracción muestral de la espesura de la sección. En este ensayo, adoptamos la matriz muestral
en los ejes XY de 80x80 μm, zona de guarda 2 μm y altura de la caja de conteo de 7 μm.
Los grupos se sometieron a ensayos de normalidad, para identificar las posibles desviaciones y el análisis estadístico paramétrico evaluó el grado de significación de los resultados, utilizando el análisis descriptivo (datos cuantitativos) de la varianza (ANOVA) para tres criterios, seguido de la posprueba de Tukey. El nivel de significación para las diferencias estadísticas se estableció en α <0,05.
RESULTADOS
CA1 Y SUS CAMADAS
Las fotomicrografías de los astrocitos se ilustran en la figura 1. Entre ellas, la de interés y objeto de este estudio: la región de CA1 del hipocampo y sus laminaciones (Stratum lacunosum-moleculare, Stratum radiatum, Stratum oriens y Stratum pyramidale). Utilizando los principios del fraccionador óptico, aplicados a la región de CA1 en las secciones inmunomarcadas, se estimó el número total de astrocitos de esa región para todos los grupos formados.
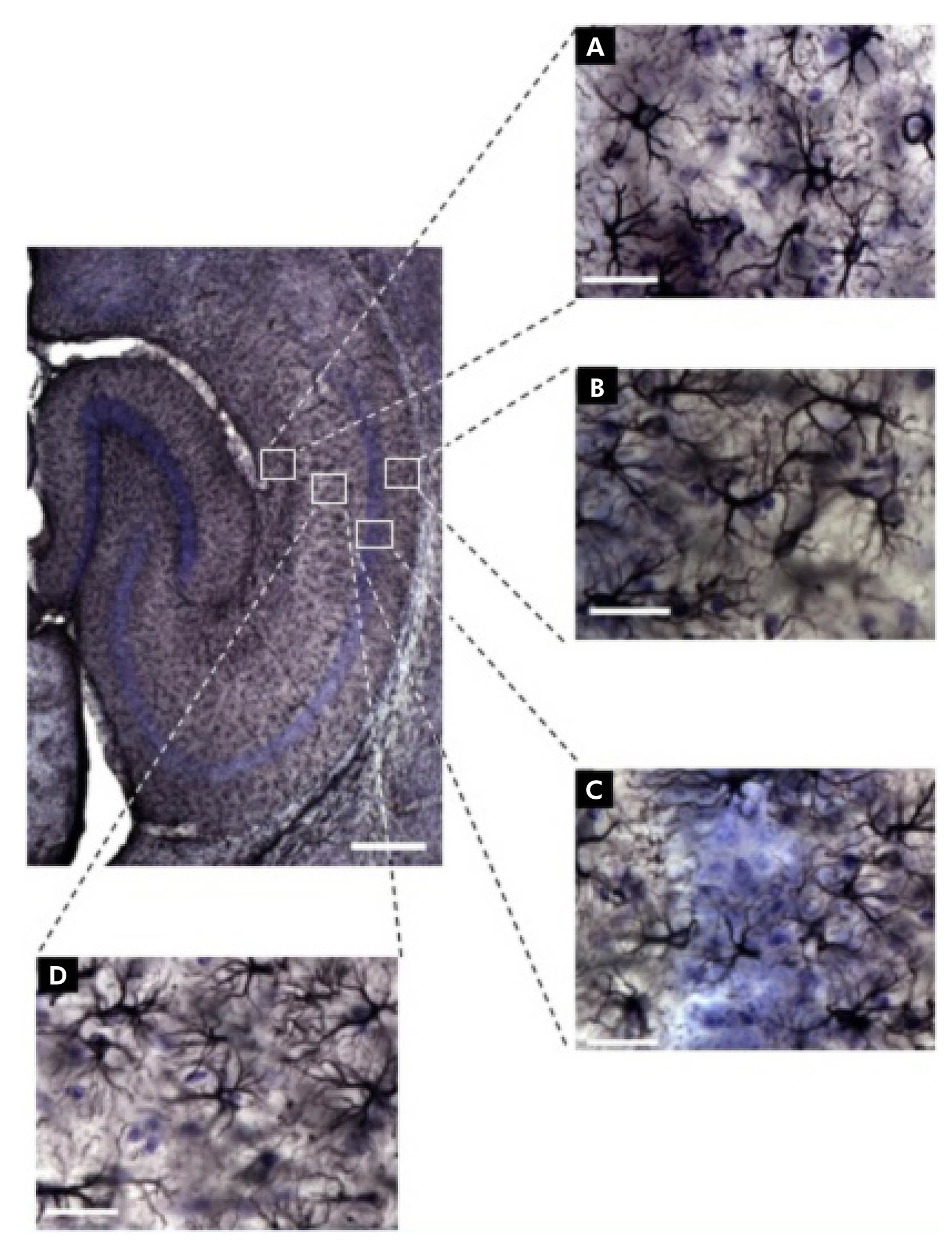
A: Stratum lacunosum-moleculare de CA1; B: Stratum oriens de CA1; C: Stratum pyramidale de CA1; D: Stratum radiatum de CA1. Escalas: bajo aumento = 250 μm, gran aumento = 25 μm.
Figura 1 - Fotomicrografías de sección horizontal del hipocampo inmunomarcado para GFAP, ilustrando los objetos (astrocitos) y las regiones (camadas) de interés del ratón albino suizo. Hay diferencias en la morfología de los astrocitos en cada camada
AMBIENTE ESTÁNDAR: NÚMERO TOTAL DE ASTROCITOS Y CUANTIFICACIONES POR CAMADAS
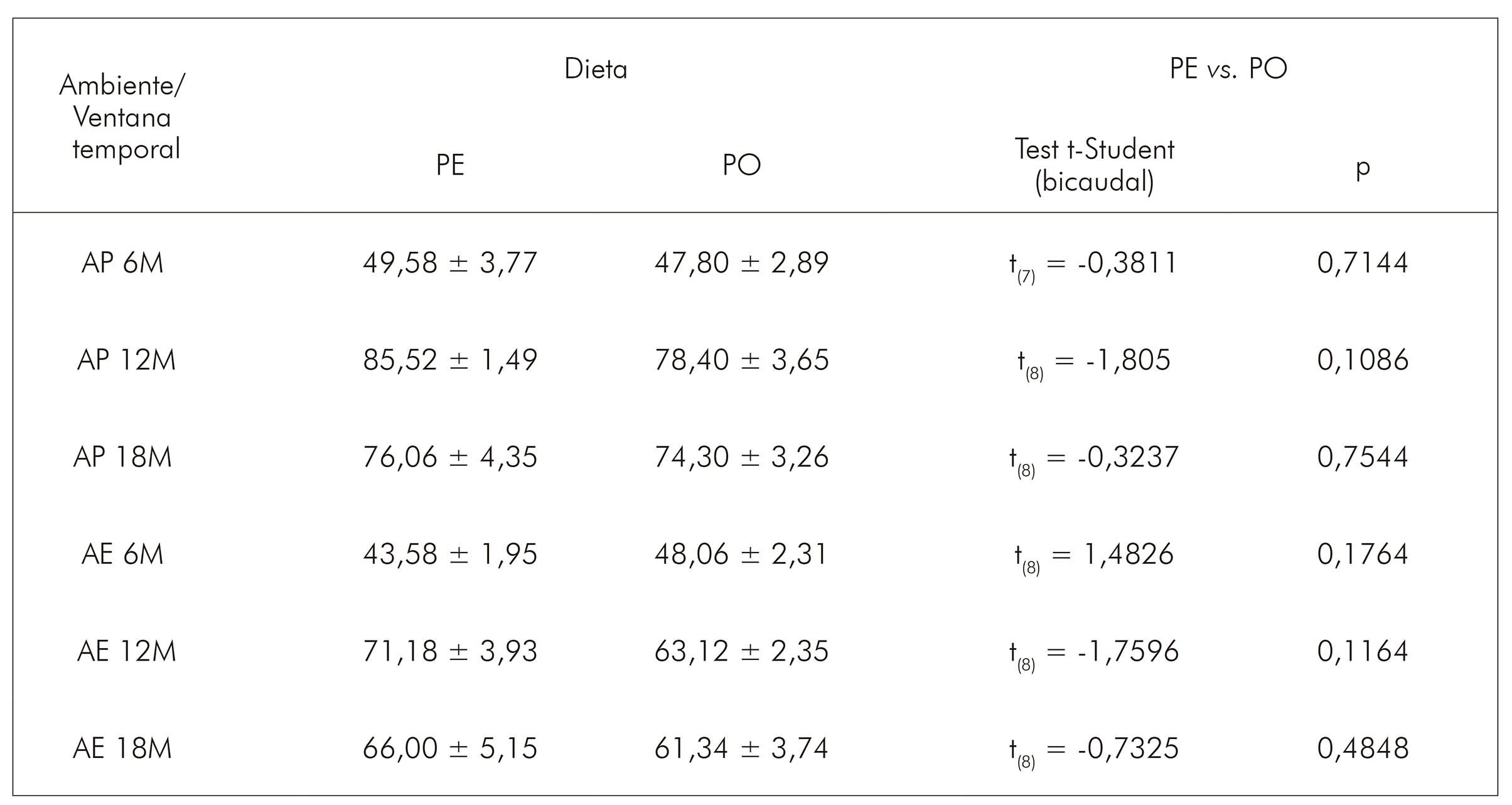
La estimación del número total de astrocitos en CA1 de los animales que vivieron en AP reveló que el envejecimiento impuso al grupo PE una reducción de la población astrocitaria. Los grupos de 12M (28309 ± 392,41; media ± error estándar) y de 18M (28217 ± 2198,96) revelaron un número menor de células cuando comparados al grupo joven (6M = 31143 ± 1885,53) (Figura 2). En contrapartida, en el grupo MG, se evidenció un aumento en el número de astrocitos en el grupo de 12M en relación al de 6M (12M = 34921 ± 2590,57 vs. 6M = 25442 ± 1572,66), siendo esa diferencia significante (p < 0,05). En el de 18M, hubo una discreta disminución (31901 ± 2287,60; no significante) en la cantidad de astrocitos.
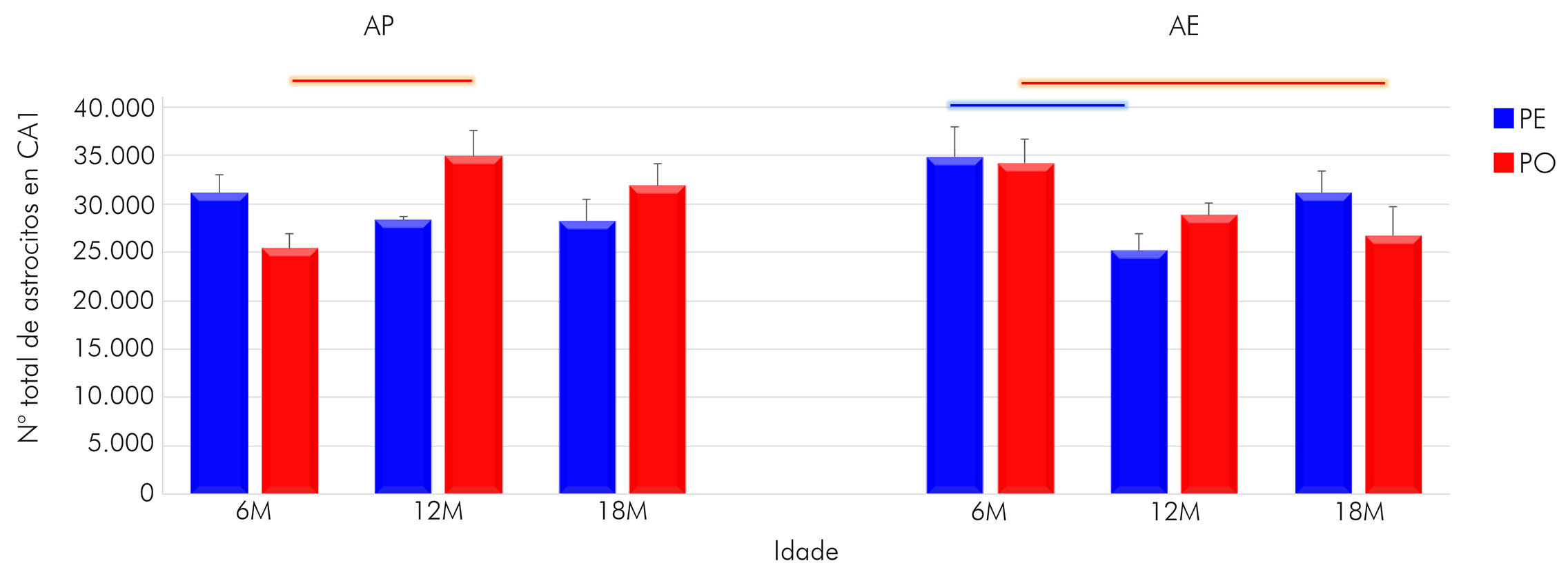
Barras conectoras: p < 0,05, de color azul para grupo PE y de color rojo para grupo PO, en diferentes edades, pero en un mismo régimen de dieta y ambiente.
Figura 2 - Representación gráfica del número total de astrocitos en CA1 del hipocampo para los animales con 6M, 12M y 18M, criados en AP y AE y alimentados con PE y PO (promedio del número de astrocitos y error estándar)
Aliado a eso, se encontraron diferencias importantes entre los dos grupos de dietas a los 12M (PE vs. MG, p < 0,05), bien como un efecto del AE sobre los animales que recibieron MG todavía jóvenes (6M: MG AP = 25442 ± 1572,66 vs. MG AE: 34198 ± 2449,65), siendo que el AE impuso un aumento en la cantidad de astrocitos. Sobre eso, de la misma forma que había sido visto en el AP, hubo una reducción en la cantidad de astrocitos de los 6M a los 12M en el grupo PE (6M = 34841 ± 3091,54 vs. 12M = 25176 ± 1770,57), bien como de los 6M a los 18M en el grupo MG (6M = 34198 ± 2449,65 vs. 18M = 26752 ± 2897,62). De ese modo, los resultados sugieren que tanto la actividad masticatoria como el envejecimiento afectan el número de astrocitos en CA1, incluyendo la interacción entre esas variables (F(2,36) = 4,22; p < 0,022), así como la interacción de (F(2,36)= 3,45, p < 0,042); y en la capa oriens (Figura 3B) es la interacción entre las tres variables que induce las alteraciones encontradas (F(2,36) = 7,24, p < 0,002).
En las capas piramidales y radiatum, la AE fue factor importante en el proceso, ya que en la primera capa, se vio que sólo el medio ambiente (F(1,36) = 4,29, p < 0,04) o su asociación con el envejecimiento (F(2,36) = 33.6, p < 0,000001) mostraron diferencias significativas en el número de astrocitos (Figura 3C). Esta última asociación también se encontró en la capa radiatum (F(2,36)= 8,92, p < 0.00071), bien como en la edad con actividad masticatoria (F(2,36) = 4,94, p < 0,01) (Figura 3D).
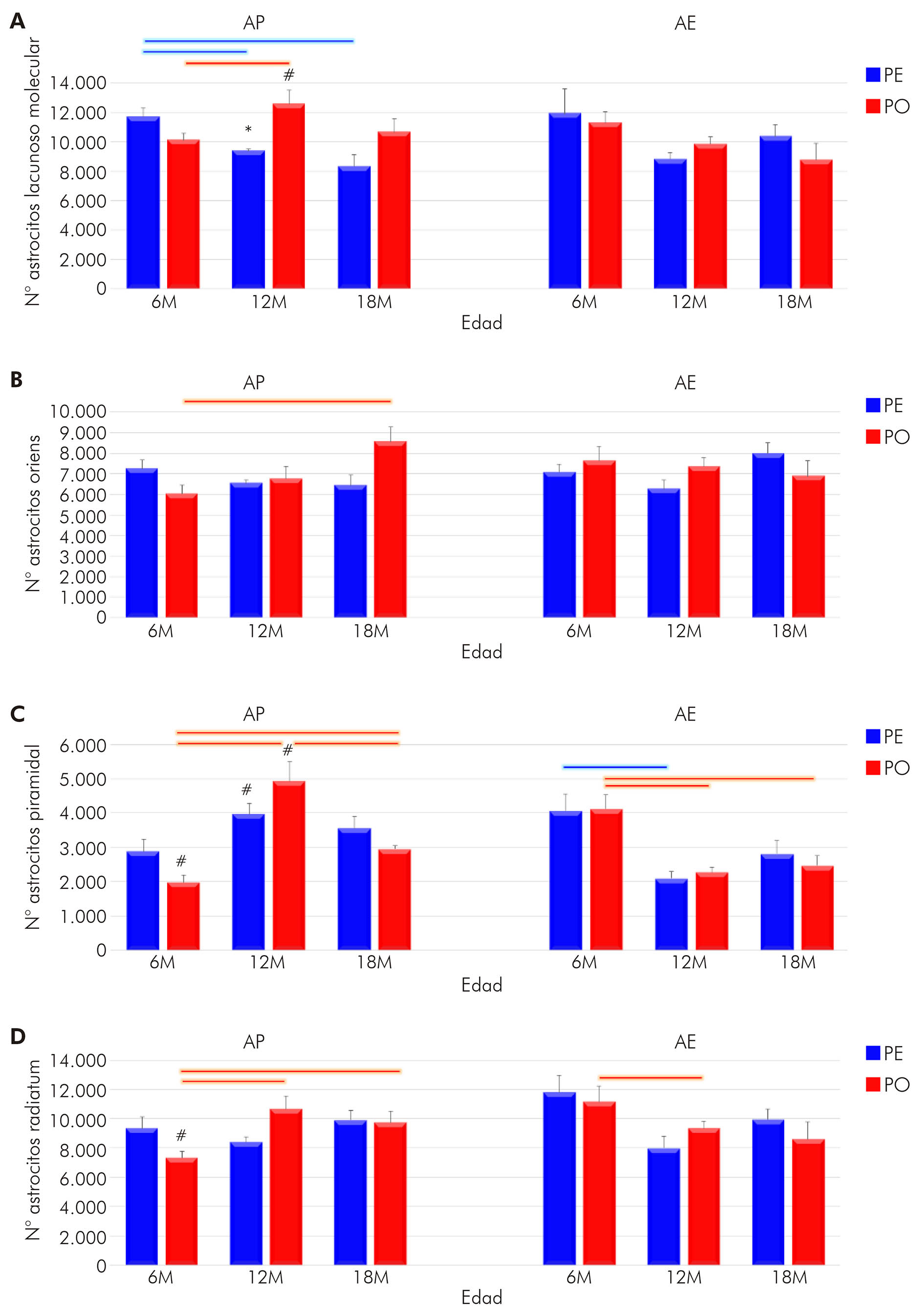
A: Número de astrocitos en la camada lacunoso-molecular de CA1; B: Número de astrocitos en la camada oriens de CA1; C: Número de astrocitos en la camada piramidal de CA1; D: Número de astrocitos en la camada radiatum de CA1; *: p < 0,05 en la comparación entre dietas para una misma edad y ambiente; #: p < 0,05 en la comparación entre ambientes, con la misma edad y régimen de dieta; Barras conectoras: p < 0,05, de color azul para grupo PE y, de color rojo para grupo PO, en diferentes edades, pero en un mismo régimen de dieta y ambiente.
Figura 3 - Representación gráfica del número de astrocitos en CA1 del hipocampo y sus laminaciones para los animales con 6M, 12M y 18M criados en AE y alimentados con PE y PO (promedio del número de astrocitos y error estándar)
CONTROL DE PESO DE LOS GRUPOS EXPERIMENTALES
Se realizó el control de ganancia de peso ponderal de los animales, una vez que estaban siendo utilizadas raciones diferentes (aunque tuvieran el mismo valor nutritivo). El control de peso fue quincenal y no se observaron diferencias significativas, comparando grupos de dietas diferentes. En el cuadro 3, se presentan el promedio de peso en el día de la perfusión de los animales (final de la ventana temporal) y los valores estadísticos de la comparación entre las dietas.
DISCUSIÓN
Los astrocitos de CA1 se investigaron sobre posibles cambios en su distribución laminar en correlación a las alteraciones masticatorias de largo plazo, envejecimiento y enriquecimiento ambiental en hembras adultas de ratones suizos albinos de 6M, 12M y 18M. Para cuantificar los cambios, se aplicó el fraccionador óptico, un método estereológico de gran precisión que combina las propiedades del disector óptico y del fraccionador, y que ha sido usado en
una variedad de estudios para determinar el número de células en numerosas regiones cerebrales. El fraccionador óptico no es afectado por los cambios histológicos, retracción o expansión impuestas por posibles procesos patológicos, un tema de particular importancia cuando se estudia el envejecimiento y otras enfermedades que afectan el volumen cerebral. Se halló un efecto diferencial del régimen masticatorio, del envejecimiento y del enriquecimiento ambiental sobre la astrogénesis laminar de CA1 en las diferentes edades. Se identificó, además, que las diferencias impuestas por la dieta y por la edad fueron contrabalanceadas por el enriquecimiento ambiental en todos los estratos de CA1, aunque no en el Stratum pyramidale y en el Stratum radiatum.
Los astrocitos hipocampales demuestran ser particularmente sensibles al envejecimiento20,21,22 y ser afectados por desequilibrios masticatorios23,24,25 y cambios ambientales26. Los estudios anteriores usando GFAP revelaron que la exodoncia de los molares acentúa la hipertrofia de los astrocitos y su densidad, y que cuanto más duradera es la condición sin muelas, mayores son esos efectos27. Ninguno de los estudios previos midió, sin embargo, la influencia del enriquecimiento ambiental sobre tales cambios, siendo el presente trabajo la primera iniciativa en ese sentido. Con base en ensayos estereológicos, se documentó también, en hembras adultas de ratones suizos albinos, a los 6M, 12M y 18M, que la distribución laminar de los astrocitos de CA1 es especialmente susceptible a seis o más meses de privación masticatoria, bien como al envejecimiento, y que el AE reduce esa susceptibilidad. Así, el presente trabajo es una descripción basada en método estereológico, sin sesgo de como la distribución laminar y el número de astrocitos en CA1 cambian con la reducción
de la actividad masticatoria, el envejecimiento y el ambiente.
Entre los hallazgos presentados, está el hecho de que el número de astrocitos, en el Stratum pyramidale, a los 18M, en AE en el grupo PO, ser reducido cuando comparado a los animales de 6M bajo el mismo régimen masticatorio. Aunque no haya una explicación conclusiva para ese hecho, se sugiere que, como el factor neurotrófico BDNF (brain derived neurotrophic factor) contribuye para la regulación de la astrogénesis, los niveles reducidos de BDNF, asociados al envejecimiento y a la restricción masticatoria, pueden contribuir a la disminución del número de astrocitos28. En contraposición, se sugiere también que la astrocitosis, observada en el Stratum oriens a los 18M, no depende de BDNF, pero sí es parte de la respuesta inflamatoria asociada al proceso de envejecimiento29. Permanecen por ser investigados, no obstante, los posibles mecanismos moleculares que tornan la astrogénesis laminar diferencialmente sensible a la restricción masticatoria o a los efectos combinados de los desequilibrios masticatorios y del envejecimiento. En ese sentido, el efecto más dramático de reducción de la astrogénesis sucedió en el Stratum pyramidale de CA1 en los animales de 12M y que se extendió a los animales de 18M, incluyendo todos los regímenes de dieta, sobre todo el MG. En todos los otros estratos de CA1, el AE mostró reducción en los cambios impuestas por el régimen masticatorio, tornando os grupos bajo diferentes regímenes de dieta indistinguibles unos de otros.
Un intenso inmunomarcado para GFAP, próximo de las arterias de la fisura hipocampal encontrada en el presente trabajo, sugirió un papel para los astrocitos de esa camada en la regulación del flujo sanguíneo cerebral de CA1 y del giro dentado. Realmente, existe evidencia de que los astrocitos están involucrados en el control neurovascular11. Por el hecho de que los astrocitos contribuyen al flujo sanguíneo local en el hipocampo, se documentó una reducción del inmunomarcado para GFAP en los animales viejos, independiente del régimen de dieta impuesto, siendo posible predecir que el flujo sanguíneo hipocampal puede estar alterado a los 18M. Esa disminución en el inmunomarcado para GFAP puede ser secundaria a una reducción de la actividad neural inducida por la edad en la vía de proyección temporoamónica del ratón30,31. No obstante, como la atrofia astrocítica en los animales sometidos a la MG se mostró más severa que la observada en los animales con PE, una interpretación alternativa es que el envejecimiento y la MG pueden contribuir para el agravamiento de la reducción del flujo sanguíneo. Como no se realizó una correlación entre la densidad de los procesos inmunomarcados para GFAP y la función astrocítica, ese tema importante permanece por ser investigado.
Considerando los animales criados en AE y todas sus camadas de CA1, no se encontró diferencia entre los grupos AE/PE vs. AE/MG en las tres ventanas temporales. En contraste con ese resultado, los
animales del AP mostraron diferencias significativas en esas comparaciones. Además, a los 6M, sobre todo en el grupo AE/MG, lo que se vio en todas las camadas, fue una cantidad de astrocitos superior al grupo AP/MG. El enriquecimiento ambiental, asociado ahora al envejecimiento, no consiguió detener la reducción de la cantidad de astrocitos, ya que los grupos AE/MG de 12M y 18M no se distinguieron de los grupos AE/PE de 12M y 18M.
Delante de esos resultados, se sugiere que la astrocitosis a los 6M reuniría un mayor número de astrocitos con propiedades neuroprotectoras, y la privación masticatoria, en esa edad, impediría que el astrocito ofrezca el soporte estructural necesario a las neuronas para el desempeño de las funciones cerebrales normales32.
Se piensa también en la posibilidad de que la cantidad de astrocitos en el envejecimiento esté relacionada a mecanismos proinflamatorios, y, por lo tanto, cuando el envejecimiento esté asociado a una condición de privación masticatoria, la interacción redundará en disminución de funciones cognitivas. Almeida et al16, al someter ratones viejos de AP a pruebas de memoria espacial, concluyeron que los animales no privados de la actividad masticatoria presentaron mejor desempeño que los privados, y, al extender su análisis a ratones jóvenes y adultos, obtuvieron los mismos resultados; Mendes33 identificó la posibilidad de que la masticación imprimiera un efecto positivo sobre el funcionamiento hipocampal, destacando, así, la importancia de adoptar medidas que eviten la reducción de la actividad masticatoria, o, aún, de promover la rehabilitación de la misma; siendo todas esas alternativas de bajo costo para retardar o recuperar déficits cognitivos no deseables.
Como un todo, los resultados sugieren que una disminución en la actividad masticatoria y el envejecimiento puedan estar interactuando y contribuyendo para promover efectos laminares diferenciales en la astrogénesis de CA1, y que el AE parece minimizar los efectos de la diferencia en la actividad masticatoria, que además están bajo las influencias del envejecimiento.
CONCLUSIÓN
El análisis cuantitativo estereológico de la distribución laminar de los astrocitos de CA1, empleando el fraccionador óptico, reveló que alteraciones masticatorias impuestas por el régimen MG afectan el número de astrocitos de forma distinta en las diferentes camadas, sugiriendo ser un hecho dependiente de la edad.
Con excepción del Stratum pyramidale de CA1, el AE muestra contraponerse a las alteraciones laminares impuestas por el régimen de reducción masticatoria y envejecimiento a todos los otros estratos.
REFERENCIAS
1 Fridman C, Gregório SP, Dias Neto E, Ojopi EPB. Alterações genéticas na doença de Alzheimer. Rev Psiquiatr Clin. 2004;31(1):19-25. Doi: 10.1590/S0101-60832004000100004 [Link] [ Links ]
2 Lopes MA, Bottino CMC. Prevalência de demência em diversas regiões do mundo: análise dos estudos epidemiológicos em 1994 a 2000. Arq Neuro-Psiquiatr. 2002 mar;60(1):61-9. Doi: 10.1590/S0004-282X2002000100012 [Link] [ Links ]
3 Terasawa H, Hirai T, Ninomiya T, Ikeda Y, Ishijima T, Yajima T, et al. Influence of tooth-loss and concomitant masticatory alterations on cholinergic neurons in rats: immunohistochemical and biochemical studies. Neurosci Res. 2002 Aug;43(4):373-9. Doi: 10.1016/S0168-0102(02)00063-9 [Link] [ Links ]
4 Aoki H, Kimoto K, Hori N, Toyoda M. Cell proliferation in the dentate gyrus of rat hippocampus as inhibited by soft diet feeding. Gerontology. 2005 Nov-Dec;51(6):369-74. Doi: 10.1159/000088700 [Link] [ Links ]
5 Watanabe K, Ozono S, Nishiyama K, Saito S, Tonosaki K, Fujita M, et al. The molarless condition in aged SAMP8 mice attenuates hippocampal Fos induction linked to water maze performance. Behav Brain Res. 2002 Jan;128(1):19-25. Doi: 10.1016/S0166-4328(01)00268-6 [Link] [ Links ]
6 Onozuka M, Fujita M, Watanabe K, Hirano Y, Niwa M, Nishiyama K, et al. Mapping brain region activity during chewing: a functional magnetic resonance imaging study. J Dent Res. 2002 Nov;81(11):743-6. Doi: 10.1177/154405910208101104 [Link] [ Links ]
7 Sesay M, Tanaka A, Ueno Y, Lecaroz P, Beaufort DG. Assessment of regional cerebral blood flow by xenon-enhanced computed tomography during mastication in humans. Keio J Med. 2000 Feb;49 Suppl 1:A125-8. [Link] [ Links ]
8 HasegawaY, Ono T, Sakagami J, Hori K, Maeda Y, Hamasaki T, et al. Influence of voluntary control of masticatory side and rhythm on cerebral hemodynamics. Clin Oral Investig. 2011 Feb;15(1):113-8. Doi: 10.1007/s00784-009-0338-5 [Link] [ Links ]
9 Figley CR, Stroman PW. The role(s) of astrocytes and astrocyte activity in neurometabolism, neurovascular coupling, and the production of functional neuroimaging signals. Eur J Neurosci. 2011 Feb;33(4):577-88. Doi: 10.1111/j.1460-9568.2010.07584.x [Link] [ Links ]
10 Lecrux C, Toussay X, Kocharyan A, Fernandes P, Neupane S, Levesque M, et al. Pyramidal neurons are "neurogenic hubs" in the neurovascular coupling response to whisker stimulation. J Neurosci. 2011 Jul;31(27):9836-47. Doi: 10.1523/JNEUROSCI.4943-10.2011 [Link] [ Links ]
11 Kuga N, Sasaki T, Takahara Y, Matsuki N, Ikegaya Y. Large-scale calcium waves traveling through astrocytic networks in vivo. J Neurosci. 2011 Feb;31(7):2607-14. Doi: 10.1523/JNEUROSCI.5319-10.2011 [Link] [ Links ]
12 Girouard H, Bonev AD, Hannah RM, Meredith A, Aldrich RW, Nelson MT. Astrocytic endfoot Ca2+ and BK channels determine both arteriolar dilation and constriction. Proc Natl Acad Sci USA. 2010 Feb;107(8):3811-6. Doi: 10.1073/pnas.0914722107 [Link] [ Links ]
13 Lee CJ, Mannaioni G, Yuan H, Woo DH, Gingrich MB, Traynelis SF. Astrocytic control of synaptic NMDA receptors. J Physiol. 2007 Jun;581(Pt 3):1057-81. Doi: 10.1113/jphysiol.2007.130377 [Link] [ Links ]
14 Perea G, Araque A. Astrocytes potentiate transmitter release at single hippocampal synapses. Science. 2007 Aug;317(5841):1083-6. Doi: 10.1126/science.1144640 [Link] [ Links ]
15 Pollak DD, Herkner K, Hoeger H, Lubec G. Behavioral testing upregulates pCaMKII, BDNF, PSD-95 and egr-1 in hippocampus of FVB/N mice. Behav Brain Res. 2005 Aug;163(1):128-35. Doi: 10.1016/j.bbr.2005.04.010 [Link] [ Links ]
16 Almeida MNF, Mendes FCCS, Felício APG, Falsoni M, Andrade MLF, Bento-Torres J, et al. Spatial memory decline after masticatory deprivation and aging is associated with altered laminar distribution of CA1 astrocytes. BMC Neurosci. 2012 Feb; 13:23. Doi: 10.1186/1471-2202-13-23 [Link] [ Links ]
17 Diniz DG, Foro CA, Rego CM, Gloria DA, Oliveira FR, Paes JM, et al. Environmental impoverishment and aging alter object recognition, spatial learning, and dentate gyrus astrocytes. Eur J Neurosci. 2010 Aug;32(3):509-19. Doi: 10.1111/j.1460-9568.2010.07296.x [Link] [ Links ]
18 Bruckner G, Grosche J, Hartlage-Rübsamen M, Schmidt S, Schachner M. Region and lamina-specific distribution of extracellular matrix proteoglycans, hyaluronan and tenascin-R in the mouse hippocampal formation. J Chem Neuroanat. 2003 Aug;26(1):37-50. Doi: 10.1016/S0891-0618(03)00036-X [Link] [ Links ]
19 Long JM, Kalehua AN, Muth NJ, Calhoun ME, Jucker M, Hengemihle JM, et al. Stereological analysis of astrocyte and microglia in aging mouse hippocampus. Neurobiol Aging. 1998 Sep-Oct;19(5):497-503. Doi: 10.1016/S0197-4580(98)00088-8 [Link] [ Links ]
20 Landfield PW, Rose G, Sandles L, Wohlstadter TC, Lynch G. Patterns of astroglial hypertrophy and neuronal degeneration in the hippocampus of ages, memory-deficient rats. J Gerontol. 1977 Jan;32(1):3-12. Doi: 10.1093/geronj/32.1.3 [Link] [ Links ]
21 Lindsey JD, Landfield PW, Lynch G. Early onset and topographical distribution of hypertrophied astrocytes in hippocampus of aging rats: a quantitative study. J Gerontol. 1979;34(5):661-71. Doi: 10.1093/geronj/34.5.661 [Link] [ Links ]
22 Wu Y, Zhang AQ, Yew DT. Age related changes of various markers of astrocytes in senescence-accelerated mice hippocampus. Neurochem Int. 2005 Jun;46(7):565-74. Doi: 10.1016/j.neuint.2005.01.002 [Link] [ Links ]
23 Kato T, Usami T, Noda Y, Hasegawa M, Ueda M, Nabeshima T. The effect of the loss of molar teeth on spatial memory and acetylcholine release from the parietal cortex in aged rats. Behav Brain Res. 1997 Feb;83(1-2):239-42. Doi: 10.1016/S0166-4328(97)86078-0 [Link] [ Links ]
24 Kubo KY, Iwaku F, Watanabe K, Fujita M, Onozuka M. Molarless-induced changes of spines in hippocampal region of SAMP8 mice. Brain Res. 2005 Sep;1057(1-2):191-5. Doi: 10.1016/j.brainres.2005.07.038 [Link] [ Links ]
25 Yamamoto T, Hirayama A. Effects of soft-diet feeding on synaptic density in the hippocampus and parietal cortex of senescence-accelerated mice. Brain Res. 2001 Jun;902(2):255-63. Doi: 10.1016/S0006-8993(01)02410-6 [Link] [ Links ]
26 Viola GG, Rodrigues L, Américo JC, Hansel G, Vargas RS, Biasibetti R, et al. Morphological changes in hippocampal astrocytes induced by environmental enrichment in mice. Brain Res. 2009 Jun;1274:47-54. Doi: 10.1016/j.brainres.2009.04.007 [Link] [ Links ]
27 Watanabe K, Tonosaki K, Kawase T, Karasawa N, Nagatsu I, Fujita M, et al. Evidence for involvement of dysfunctional teeth in the senile process in the hippocampus of SAMP8 mice. Exp Gerontol. 2001 Feb;36(2):283-95. Doi: 10.1016/S0531-5565(00)00216-3 [Link] [ Links ]
28 Mao L, Wang JQ. Adult neural stem/progenitor cells in neurodegenerative repair. Acta Physiol Sinica. 2003 Jun;55(3):233-44. [Link] [ Links ]
29 Godbout JP, Johnson RW. Age and neuroinflammation: a lifetime of psychoneuroimmune consequences. Neurol Clin. 2006 Aug;24(3):521-38. Doi: 10.1016/j.ncl.2006.03.010 [Link] [ Links ]
30 Van Groen T, Miettinen P, Kadish I. The entorhinal cortex of the mouse: organization of the projection to the hippocampal formation. Hippocampus. 2003;13(1):133-49. Doi: 10.1002/hipo.10037 [Link] [ Links ]
31 Bartesaghi R, Gessi T. Activation of perforant path neurons to field CA1 by hippocampal projections. Hippocampus. 2003 Jan;13(2):235-49. Doi: 10.1002/hipo.10074 [Link] [ Links ]
32 Haynes DE, organizador. Neurociência fundamental para aplicações básica e clínicas. 3. ed. Rio de Janeiro: Elsevier; 2006. 653 p. [ Links ]
33 Mendes FCCS. Enriched environment and masticatory activity rehabilitation recover spatial memory decline in aged mice. BMC Neurosci. 2013 Jun;14:63. Doi: 10.1186/1471-2202-14-63 [Link[ [ Links ]
*Artículo presentado en el V Congreso HUJBB, promovido por el Hospital Universitario João de Barros Barreto y Universidad Federal de Pará, realizado de 12 a 14 de agosto de 2015 en la Ciudad de Belém, Estado de Pará, Brasil. Los Editores agradecen la colaboración del HUJBB/UFPA y por haber elegido a la Revista Pan-Amazônica de Saúde para publicación de los excelentes trabajos presentados al evento.
APOYO FINANCIERO Fondo de Amparo a la Investigación del Estado de Pará (FAPESPA - nº otorgado 136/2008) y Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq - nº proceso 475677/2008-0). Alteração mastigatória, ambiente enriquecido e envelhecimento: estudos estereológicos de CA1 do hipocampo de camundongos suíços albinos
Se refiere al doi: 10.5123/S2176-62232016000400004, publicado originalmente en portugués. Traducido por: Lota Moncada
Cómo citar este artículo / How to cite this article: Mendes FCCS, Felício APG, Diniz CWP, Sosthenes MCK. Alteración masticatoria, ambiente enriquecido y envejecimiento: estudios estereológicos de CA1 del hipocampo de ratones albinos suizos. Rev Pan-Amaz Saude. 2016 oct-dic;7(4):1-10. Doi: http://dx.doi.org/10.5123/S2176-62232016000400004
Recibido: 04 de Enero de 2016; Aprobado: 09 de Agosto de 2016











 texto em
texto em