INTRODUÇÃO
Com a elevação da expectativa de vida, tem-se constatado um aumento significativo da população de idosos, assim como um acréscimo na prevalência de demências e doenças neurodegenerativas1,2,3. O aumento dessa parcela da população acima de 65 anos de idade reforça a necessidade de uma compreensão minuciosa a respeito do processo de envelhecimento e de suas alterações e consequências.
Aoki et al4 afirmaram que a neurogênese que ocorre no giro denteado do hipocampo, uma importante região para a memória e aprendizado em roedores e em humanos, é regulada por alguns fatores, como exposição a um ambiente enriquecido, atividade física, envelhecimento e estresse. A formação hipocampal, que desempenha um papel fundamental na memória espacial, é muito sensível ao processo de envelhecimento, sendo uma das primeiras regiões do cérebro a evidenciar mudanças morfológicas, fisiológicas e neuroquímicas com o avanço da idade. Bases de testes de aprendizagem em ratos sem os dentes molares mostraram que a disfunção oclusal poderia estar envolvida no processo de degeneração associada à demência senil5.
Por outro lado, foi descrito que o fluxo sanguíneo cerebral, em várias regiões do cérebro, é afetado pela mastigação, e que os astrócitos podem desenvolver papel chave na regulação desse fluxo6,7,8,9,10,11,12. A regulação do fluxo sanguíneo cerebral é feita por meio do cálcio (Ca2+) astrocítico responsável por ondas de sinalização que podem induzir tanto a dilatação quanto a constrição das arteríolas por meio de sua concentração12. Os astrócitos são células extremamente numerosas, sendo afetados em várias situações neuropatológicas, incluindo o envelhecimento, a neurodegeneração crônica e a infecção. Essas condições adversas comprometeriam igualmente a função sináptica por estarem relacionadas a eventos de plasticidade sináptica por conta da liberação de glutamato em áreas críticas para a consolidação da memória, como nas regiões hipocampais de CA1 e CA3 (Corno de Ammon 1 e 3) e no giro denteado13,14,15. Por essas razões, é evidente que os astrócitos são imprescindíveis para a função cerebral normal, e, portanto, investigações acerca de possíveis mudanças em seu número, distribuição e forma são essenciais.
Em estudos anteriores, por exemplo, o desempenho no labirinto aquático de Morris diminuiu em camundongos jovens e velhos mantidos em ambiente padrão e privados da atividade mastigatória desde o 21º dia pós-natal, e isso foi associado à astrocitose na camada polimórfica do giro denteado nos indivíduos velhos16.
Com relação à estimulação ambiental, em estudo realizado com a mesma variedade aqui proposta (camundongos suíços albinos), concluiu-se que, em longo prazo, o enriquecimento ambiental foi capaz de influenciar no número de astrócitos de diferentes camadas do giro denteado, bem como no desempenho desses animais em testes comportamentais que avaliavam a memória espacial e a memória semelhante à episódica; isso demonstrou, os efeitos do ambiente e do envelhecimento sobre a plasticidade glial, efeitos esses submetidos também à investigação no trabalho apresentado17.
Com base no exposto, o presente trabalho se propôs, com o auxílio de ensaios imunohistoquímicos e com o método do fracionador óptico, a avaliar comparativamente as consequências da dieta farelada e do ambiente sobre a quantidade de astrócitos na região de CA1 do hipocampo e suas laminações.
MATERIAIS E MÉTODOS
Todos os procedimentos experimentais do presente trabalho seguiram os princípios recomendados pela publicação Principles of Laboratory Animal Care da National Institutes of Health. Para investigar a influência da dieta, do ambiente e da idade, utilizaram-se fêmeas adultas jovens e idosas de camundongos da variedade albina suíça, gentilmente cedidas pelo Instituto Evandro Chagas e alojadas no biotério do Laboratório de Investigações em Neurodegeneração e Infecção do Hospital Universitário João de Barros Barreto. Os procedimentos foram examinados e autorizados pelo Comitê de Ética para Experimentação Animal da Universidade Federal do Pará (CEPAE/UFPA No. BIO004-09).
Os animais foram distribuídos para a formação dos grupos de idades de 6 meses (6M), 12 meses (12M) e 18 meses (18M), alojados em condições empobrecidas (ambiente padrão - AP) ou enriquecidas (ambiente enriquecido - AE), sendo alimentados, logo após o desmame, por dois diferentes tipos de ração. O grupo controle recebeu alimentação sob a forma de ração peletizada (PE), e o grupo experimental sofreu restrição mastigatória, sendo oferecida ração farelada e peneirada (PO). Os sujeitos tiveram acesso livre à água e comida, e vale destacar que não havia diferenças nutricionais entre as rações ofertadas. Ainda assim, realizou-se controle de peso quinzenal dos animais. Dessa forma, foram gerados, nessas condições, seis grupos (Quadros 1 e 2).

Quadro 1 - Número de animais para cada grupo criado em AP, segundo a janela temporal e o tipo de ração ofertada
Quadro 2 - Número de animais para cada grupo criado em AE, segundo a janela temporal e o tipo de ração ofertada
Os animais do AP foram alojados em gaiolas plásticas de dimensões 32x39x16,5 cm e cobertas por uma grade de metal, abrigando seis camundongos. Os grupos alojados em AE estavam inseridos em um espaço de 50x50x50 cm, com dois andares equipados com pontes de plástico, rodas de correr, brinquedos e túneis feitos de plástico, permitindo o exercício voluntário ao longo de todo o período. O ambiente sofria modificações semanalmente, seja com alteração na posição dos objetos ou mesmo troca desses. Cada gaiola abrigou 12 camundongos. Todas as gaiolas permaneceram em uma sala sob temperatura controlada (23 ± 1º C) e ciclos claro-escuro de 12 h (período claro, 6-18 h; período escuro, 18-6 h).
Ao final de cada janela temporal de observação, os animais receberam dose anestésica letal e foram perfundidos com fixadores aldeídicos depois de prévia remoção do sangue circulante com solução salina. Seus cérebros foram removidos e cortados em vibrátomo, recolhendo-se, de forma ordenada, séries anatômicas sequenciais para imunomarcação subsequente da proteína ácida fibrilar glial (GFAP). Uma a cada seis secções, com espessura constante de 60 μm, foi selecionada para compor a amostra a ser imunomarcada, empregando-se anticorpo monoclonal para GFAP (mouse anti-GFAP MAB360, Chemicon Int., EUA). Utilizou-se também a contracoloração com Cresil violeta a 1% para definir as lâminas de CA1 e estabelecer os limites dos corpos celulares dos astrócitos.
Assim, em sequência, foram realizadas análises estereológicas para a estimativa do número de astrócitos com o programa especializado Stereo Investigator® (MBF Bioscience, Williston, VT, EUA). A distribuição laminar de CA1 foi definida tomando-se como referência a camada piramidal. Essa visualização é justificada pelo "empacotamento" dessas células se comparadas às células piramidais de CA3. Portanto, nota-se em CA1 uma camada piramidal mais estreita, porém mais densa18,19. Após a definição do contorno de camada piramidal em CA1, projetavam-se, paralelamente a ela, as outras camadas da região, considerando, ainda, as diferenças morfológicas dos astrócitos entre essas camadas.
O número total de astrócitos foi obtido como uma função da probabilidade estimada com base na espessura das secções, na área da caixa de contagem e na área de interesse amostral. A equação matemática que relaciona essas variáveis entre si e permite estimativa do número total de objetos de interesse é definida por:
Nessa equação, N é o número total de astrócitos; ∑Q é o número de astrócitos identificados pelo experimentador; ssf é a fração amostral do número de secções; asf é a fração amostral; da área amostral; e tsf é a fração amostral da espessura da secção. Neste ensaio, adotou-se matriz amostral nos eixos XY de 80x80 μm, zona de guarda de 2 μm e altura da caixa de contagem de 7 μm.
Os grupos foram submetidos a testes de normalidade, para identificação dos possíveis desvios, e a análise estatística paramétrica avaliou o grau de significância dos resultados, empregando-se a análise descritiva (dados quantitativos), de variância (ANOVA) para três critérios, seguido do pós-teste de Tukey. O nível de significância para diferenças estatísticas foi definido em α < 0,05.
RESULTADOS
CA1 E SUAS CAMADAS
Fotomicrografias dos astrócitos estão ilustradas na figura 1. Dentre elas, a de interesse e objeto deste estudo: a região de CA1 do hipocampo e suas laminações (Stratum lacunosum-moleculare, Stratum radiatum, Stratum oriens e Stratum pyramidale). Utilizando os princípios do fracionador óptico, aplicados à região de CA1 nas secções imunomarcadas, estimou-se o número total de astrócitos dessa região para todos os grupos formados.
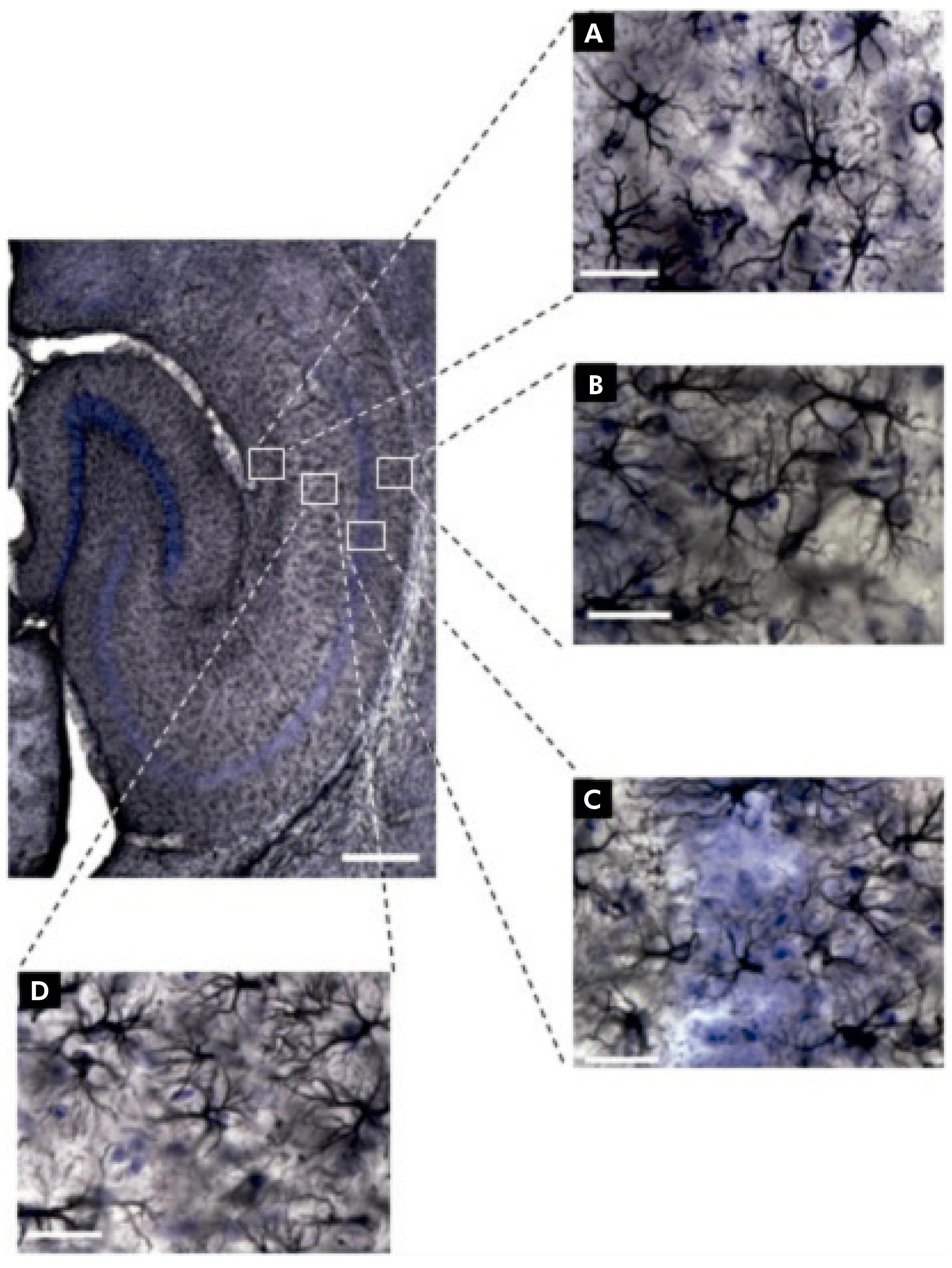
A: Stratum lacunosum-moleculare de CA1; B: Stratum oriens de CA1; C: Stratum pyramidale de CA1; D: Stratum radiatum de CA1. Escalas: baixo aumento = 250 μm, grande aumento = 25 μm.
Figura 1 - Fotomicrografias de secção horizontal do hipocampo imunomarcada para GFAP, ilustrando os objetos (astrócitos) e as regiões (camadas) de interesse do camundongo albino suíço. Há diferenças na morfologia dos astrócitos em cada camada
AMBIENTE PADRÃO: NÚMERO TOTAL DE ASTRÓCITOS E QUANTIFICAÇÕES POR CAMADAS
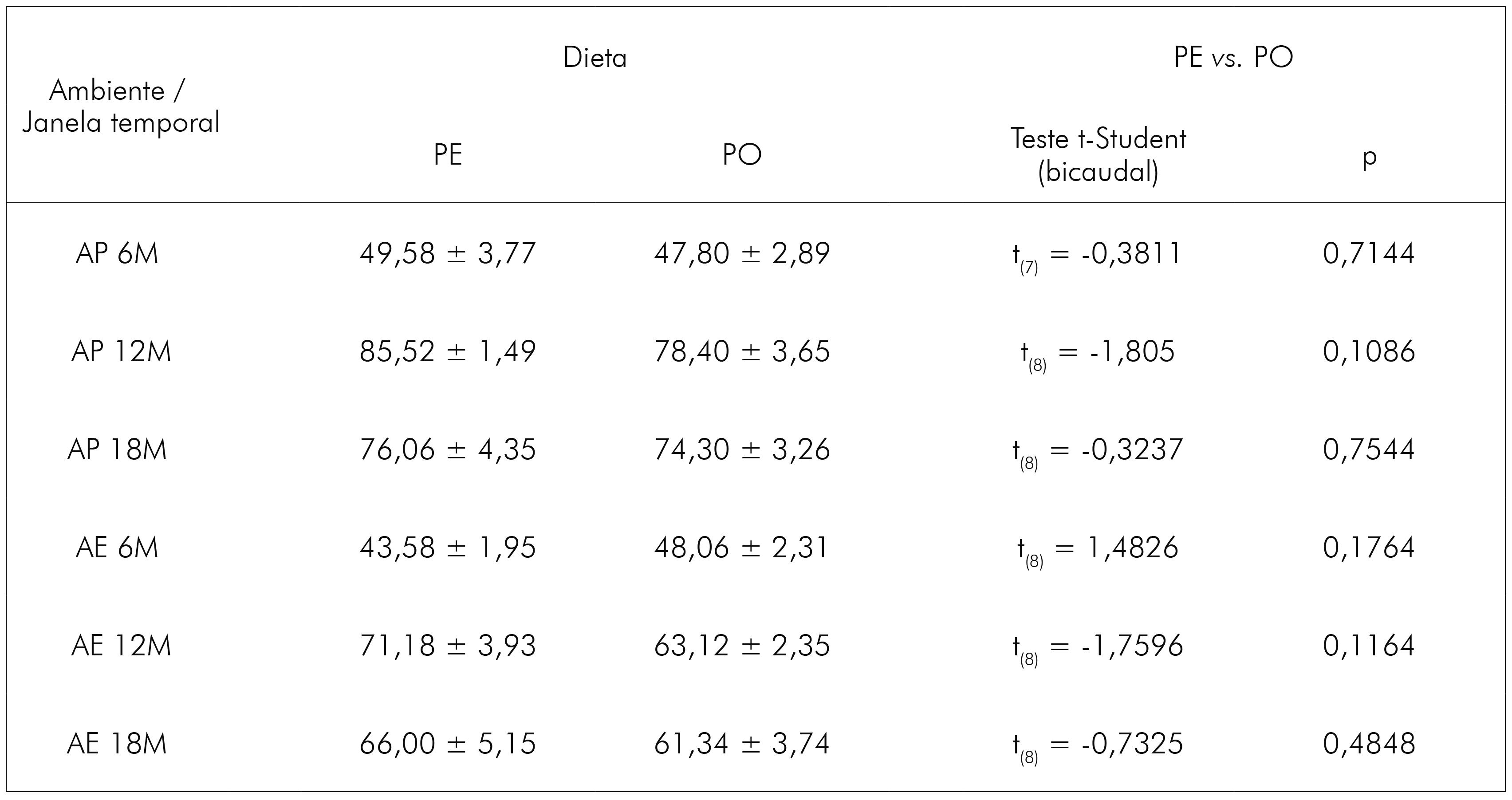
A estimativa do número total de astrócitos em CA1 dos animais que viveram em AP revelou que o envelhecimento impôs ao grupo PE uma redução da população astrocitária. Os grupos de 12M (28309 ± 392,41; média ± erro padrão) e de 18M (28217 ± 2198,96) revelaram um número menor de células se comparados ao grupo jovem (6M = 31143 ± 1885,53) (Figura 2). Em contrapartida, no grupo PO, evidenciou-se um aumento no número de astrócitos no grupo de 12M em relação ao de 6M (12M = 34921 ± 2590,57 vs. 6M = 25442 ± 1572,66), sendo essa diferença significante (p < 0,05). No de 18M, ocorreu discreto declínio (31901 ± 2287,60; não significante) na quantidade de astrócitos.
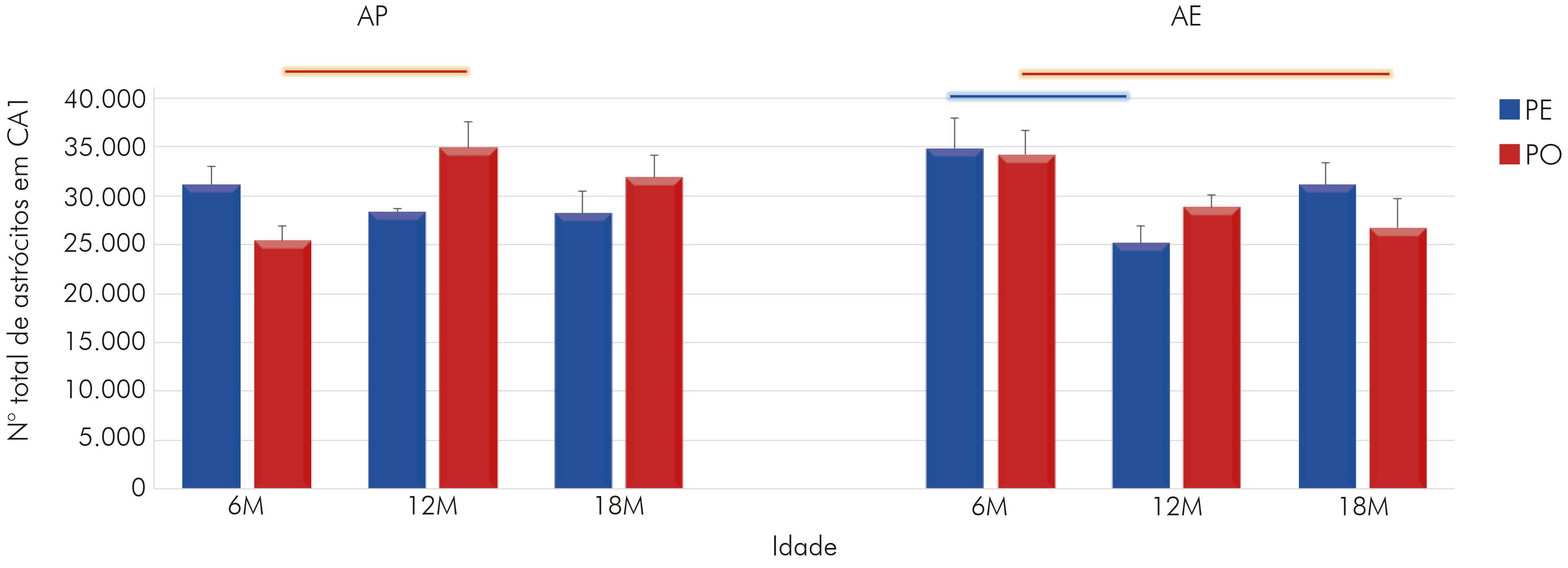
Barras conectoras: p < 0,05, na cor azul para grupo PE e na cor vermelha para grupo PO, em diferentes idades, mas em mesmo regime de dieta e ambiente.
Figura 2 - Representação gráfica do número total de astrócitos em CA1 do hipocampo para os animais com 6M, 12M e 18M, criados em AP e AE e alimentados com PE e PO (média do número de astrócitos e erro padrão)
Aliado a isso, foram encontradas diferenças importantes entre os dois grupos de dietas aos 12M (PE vs. PO, p < 0,05), assim como um efeito do AE sobre os animais que receberam PO ainda jovens (6M: PO AP = 25442 ± 1572,66 vs. PO AE: 34198 ± 2449,65), sendo que o AE impôs aumento na quantidade de astrócitos. Sobre isso, da mesma forma que fora visto no AP, houve uma redução na quantidade de astrócitos dos 6M aos 12M no grupo PE (6M = 34841 ± 3091,54 vs. 12M = 25176 ± 1770,57), assim como dos 6M aos 18M no grupo PO (6M = 34198 ± 2449,65 vs. 18M = 26752 ± 2897,62). Desse modo, os resultados sugerem que tanto a atividade mastigatória quanto o envelhecimento afetam o número de astrócitos em CA1, incluindo a interação entre essas variáveis (F(2,36) = 4,22; p < 0,022), assim como a interação da idade com o ambiente (F(2,36) = 7,24; p < 0,022).
AP E AE: ESTIMATIVA DA DISTRIBUIÇÃO LAMINAR DE ASTRÓCITOS EM CA1 DO HIPOCAMPO NAS DIFERENTES JANELAS TEMPORAIS
Identificou-se que o número total de astrócitos de CA1 do hipocampo, para os animais criados nos dois ambientes (AE e AP) e alimentados com PE e PO nas diferentes idades, apresentou, em alguns casos, diferenças estatísticas significantes p < 0,05.
Quando analisada a distribuição laminar (Figura 3), observa-se que as variáveis estudadas (atividade mastigatória, idade e ambiente) tiveram influência, cada uma, de forma particular: na lacunoso-molecular (Figura 3A), idade (F(2,36) = 4,00; p < 0,027) e sua interação com atividade mastigatória são significantes (F(2,36) = 3,45; p < 0,042); e, na camada oriens (Figura 3B), é a interação entre as três variáveis que induz às modificações encontradas (F(2,36) = 7,24; p < 0,002).
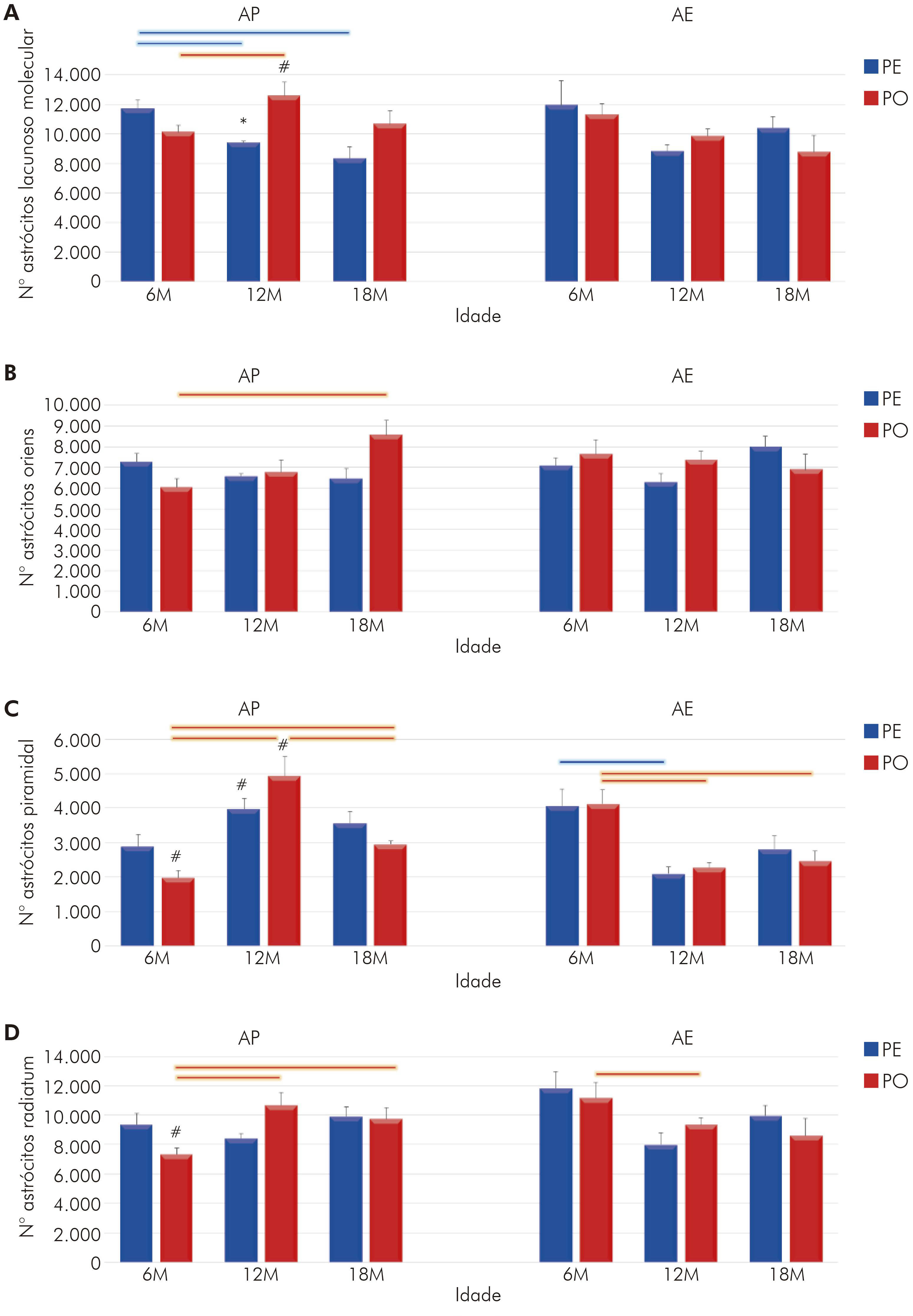
A: Número de astrócitos na camada lacunosomolecular de CA1; B: Número de astrócitos na camada oriens de CA1; C: Número de astrócitos na camada piramidal de CA1; D: Número de astrócitos na camada radiatum de CA1; *: p < 0,05 na comparação entre dietas de mesma idade e ambiente; #: p < 0,05 na comparação entre ambientes, com mesma idade e regime de dieta; Barras conectoras: p < 0,05, na cor azul para grupo PE e, na cor vermelha, para grupo PO, em diferentes idades, mas em mesmo regime de dieta e ambiente.
Figura 3 - Representação gráfica do número de astrócitos em CA1 do hipocampo e suas laminações para os animais com 6M, 12M e 18M criados em AE e alimentados com PE e PO (média do número de astrócitos e erro padrão)
Nas camadas piramidal e radiatum, o AE foi o elemento importante no processo, pois, na primeira camada, foi visto que somente o ambiente (F(1,36) = 4,29; p < 0,04) ou a sua associação ao envelhecimento (F(2,36) = 33,6; p < 0,000001) apresentou diferenças significantes na quantidade de astrócitos (Figura 3C). Essa última associação também foi encontrada na camada radiatum (F(2,36) = 8,92; p < 0,00071), assim como da idade com a atividade mastigatória (F(2,36) = 4,94; p < 0,01) (Figura 3 D).
CONTROLE DE PESO DOS GRUPOS EXPERIMENTAIS
Foi realizado o controle de ganho ponderal dos animais, uma vez que estavam sendo utilizadas rações diferentes (embora possuíssem mesmo valor nutritivo). O controle de peso foi quinzenal e não foram observadas diferenças significativas, comparando-se grupos de dietas diferentes. No quadro 3, apresentam-se a média de peso no dia da perfusão dos animais (final da janela temporal) e os valores estatísticos da comparação entre as dietas.
DISCUSSÃO
Os astrócitos de CA1 foram investigados acerca de possíveis mudanças em sua distribuição laminar em correlação às alterações mastigatórias de longo prazo, envelhecimento e enriquecimento ambiental em fêmeas adultas de camundongos suíços albinos de 6M, 12M e 18M. Para quantificar as mudanças, foi aplicado o fracionador óptico, um método estereológico de grande precisão que combina as propriedades do dissector óptico e do fracionador, e que tem sido usado em uma variedade de estudos para determinar o número de células em numerosas regiões cerebrais. O fracionador óptico não é afetado pelas mudanças histológicas, retração ou expansão impostas por possíveis processos patológicos, uma questão de particular importância quando se estuda o envelhecimento e outras doenças que afetam o volume cerebral. Encontrou-se um efeito diferencial do regime mastigatório, do envelhecimento e do enriquecimento ambiental sobre a astrogênese laminar de CA1 nas diferentes idades. Identificou-se, ainda, que as diferenças impostas pela dieta e pela idade foram contrabalançadas pelo enriquecimento ambiental em todos os estratos de CA1, mas não no Stratum pyramidale e no Stratum radiatum.
Os astrócitos hipocampais demonstram ser particularmente sensíveis ao envelhecimento20,21,22 e ser afetados por desequilíbrios mastigatórios23,24,25 e mudanças ambientais26. Os estudos anteriores empregando GFAP revelaram que a exodontia dos molares acentua a hipertrofia dos astrócitos e sua densidade, e que quanto mais duradoura é a condição sem molar, maiores são esses efeitos27. Nenhum dos estudos prévios mediu, entretanto, a influência do enriquecimento ambiental sobre tais mudanças, sendo o presente trabalho a primeira iniciativa nesse sentido. Com base em ensaios estereológicos, documentou-se também, em fêmeas adultas de camundongo suíço albino, aos 6M, 12M e 18M, que a distribuição laminar dos astrócitos de CA1 é especialmente suscetível a seis ou mais meses de privação mastigatória, assim como ao envelhecimento, e que o AE reduz essa suscetibilidade. Assim, o presente trabalho é uma descrição baseada em método estereológico, sem viés de como a distribuição laminar e o número de astrócitos em CA1 mudam com a redução da atividade mastigatória, o envelhecimento e o ambiente.
Dentre os achados apresentados, está o fato de o número de astrócitos, no Stratum pyramidale, aos 18M, em AE no grupo PO, ser reduzido quando comparado aos animais de 6M sob o mesmo regime mastigatório. Embora não se tenha explicação conclusiva para esse fato, sugere-se que, como o fator neurotrófico BDNF (brain derived neurotrophic factor) contribui para a regulação da astrogênese, os níveis reduzidos de BDNF, associados ao envelhecimento e à restrição mastigatória, possam contribuir para o decréscimo no número de astrócitos28. Em contraposição, sugere-se também que a astrocitose, observada no Stratum oriens aos 18M, não é dependente de BDNF, mas sim parte da resposta inflamatória associada ao processo de envelhecimento29. Permanecem por serem investigados, entretanto, os possíveis mecanismos moleculares que tornam a astrogênese laminar diferencialmente sensível à restrição mastigatória ou aos efeitos combinados dos desequilíbrios mastigatórios e do envelhecimento. Nesse sentido, o efeito mais dramático de redução da astrogênese ocorreu no Stratum pyramidale de CA1 nos animais de 12M e que se estendeu aos animais de 18M, incluindo todos os regimes de dieta, sobretudo o PO. Em todos os outros estratos de CA1, o AE mostrou redução nas mudanças impostas pelo regime mastigatório, tornando os grupos sob diferentes regimes de dieta indistinguíveis uns dos outros.
Uma intensa imunomarcação para GFAP, próxima das artérias da fissura hipocampal encontrada no presente trabalho, sugeriu um papel para os astrócitos dessa camada na regulação do fluxo sanguíneo cerebral de CA1 e do giro denteado. Realmente, existe evidência de que os astrócitos estão envolvidos no controle neurovascular11. Pelo fato de os astrócitos contribuírem para o fluxo sanguíneo local no hipocampo, documentou-se uma redução da imunomarcação para GFAP nos animais velhos, independentemente do regime de dieta imposto, sendo possível predizer que o fluxo sanguíneo hipocampal pode estar alterado aos 18M. Esse decréscimo na imunomarcação para GFAP pode ser secundário a uma redução da atividade neural induzida pela idade na via de projeção temporoamônica do camundongo30,31. Entretanto, como a atrofia astrocítica nos animais submetidos à PO mostrou-se mais severa do que aquela observada nos animais com PE, uma interpretação alternativa é que o envelhecimento e a PO podem contribuir para o agravamento da redução do fluxo sanguíneo. Como não foi realizada uma correlação entre a densidade dos processos imunomarcados para GFAP e a função astrocítica, essa questão importante permanece por ser investigada.
Considerando-se os animais criados em AE e todas as suas camadas de CA1, não foi encontrada diferença entre os grupos AE/PE vs. AE/PO nas três janelas temporais. Em contraste com esse resultado, os animais do AP mostraram diferenças significativas nessas comparações. Além disso, aos 6M, sobretudo no grupo AE/PO, o que se viu, em todas as camadas, foi uma quantidade de astrócitos superior ao grupo AP/PO. O enriquecimento ambiental, associado agora ao envelhecimento, não conseguiu deter a redução da quantidade de astrócitos, pois os grupos AE/PO de 12M e 18M não se distinguiram dos grupos AE/PE de 12M e 18M.
Diante desses resultados, sugere-se que a astrocitose aos 6M reuniria maior número de astrócitos com propriedades neuroprotetoras, e a privação mastigatória, nessa idade, impediria que o astrócito ofereça o suporte estrutural necessário aos neurônios para o desempenho das funções cerebrais normais32.
Cogita-se também a possibilidade de que a quantidade de astrócitos no envelhecimento esteja relacionada a mecanismos pró-inflamatórios, e, portanto, quando o envelhecimento estiver associado a uma condição de privação mastigatória, a interação redundará em declínio de funções cognitivas. Almeida et al16, ao submeterem camundongos velhos de AP a testes de memória espacial, concluíram que os animais não privados da atividade mastigatória apresentaram melhor performance que os privados, e, ao estenderem sua análise para camundongos jovens e adultos, obtiveram os mesmos resultados; Mendes33 identificou a possibilidade da mastigação imprimir efeito positivo sobre o funcionamento hipocampal, destacando, assim, a importância de adotar medidas que evitem a redução da atividade mastigatória, ou, ainda, de promover a reabilitação da mesma; sendo todas essas alternativas de baixo custo para retardar ou recuperar déficits cognitivos indesejáveis.
Como um todo, os resultados sugerem que um decréscimo na atividade mastigatória e o envelhecimento possam estar interagindo e contribuindo para promover efeitos laminares diferenciais na astrogênese de CA1, e que o AE parece minimizar os efeitos da diferença na atividade mastigatória, que ainda estão sujeitos às influências do envelhecimento.
CONCLUSÃO
A análise quantitativa estereológica da distribuição laminar dos astrócitos de CA1, empregando o fracionador óptico, revelou que alterações mastigatórias impostas pelo regime PO afetam o número de astrócitos de forma distinta nas diferentes camadas, sugerindo ser esse fato dependente da idade.
Com exceção do Stratum pyramidale de CA1, o AE mostra se contrapor às alterações laminares impostas pelo regime de redução mastigatória e envelhecimento a todos os outros estratos.











 texto em
texto em