INTRODUÇÃO
O perfil populacional vem apresentando mudanças no cenário mundial e, nesse, é revelado um aumento da proporção de idosos no Brasil a partir da década de 19801. O envelhecimento crescente aumentou a vulnerabilidade e a incidência de processos neurodegenerativos e demenciais, assim como de distúrbios psicológicos, incluindo-se os transtornos de ansiedade.
Em estudos experimentais anteriores em modelo murino, identificou-se a influência de fatores ambientais, idade e atividade mastigatória, que reduzem ou agravam o declínio cognitivo senil2. A reabilitação, no entanto, parece recuperar esses danos, sobretudo na presença de um ambiente rico em estímulos cognitivos3. Essas observações foram confirmadas por outros autores que identificaram mudanças estruturais/funcionais associadas ao envelhecimento4, a um ambiente pouco estimulante5, ou à desarmonia oclusal6,7, que, agindo de forma combinada ou isolada, podem promover maiores ou menores deficits cognitivos.
A mastigação, quando alterada em seu padrão de atividade, pode desencadear o acúmulo de proteína β-amiloide por meio da sinalização mediada por glicocorticoide8, sendo essa alteração associada a alterações comportamentais, cognitivas e até mesmo na capacidade exploratória.
No que se refere à ansiedade, essa tem sido associada a um estado de conflito ou incerteza e surge quando existe a concorrência entre duas opções simultâneas e o indivíduo deve fazer uma escolha entre elas9,10. Sob situações de estresse, a produção hipofisária de hormônio adrenocorticotrófico induz o córtex da adrenal a secretar corticosterona, sendo, então, o hipocampo uma área-alvo, onde as alterações induzidas promovem redução do aprendizado e memória hipocampo-dependentes11. Encontrou-se ainda uma dissociação da função hipocampal ao longo de sua extensão septotemporal12,13, onde lesões no hipocampo ventral, mas não do dorsal, reduziram o comportamento sugestivo de ansiedade, avaliado segundo o paradigma do labirinto em cruz elevado (LCE)14,15.
Desse modo, no presente trabalho, investigou-se a hipótese de que o envelhecimento, o ambiente empobrecido e a redução da atividade mastigatória, agindo em conjunto, induziriam a um maior nível de comportamento semelhante ao ansioso.
MATERIAIS E MÉTODOS
Neste estudo, foram utilizados camundongos suíços albinos fêmeas, manipulados segundo os Principles of Laboratory Animal Care da National Institutes of Health nas instalações do Laboratório de Investigações em Neurodegeneração e Infecção, no Hospital Universitário João de Barros Barreto da Universidade Federal do Pará, com parecer e aprovação do Comitê de Ética em Pesquisa com Animais de Experimentação (CEPAE/UFPA nº BIO004-009).
Os animais foram distribuídos em grupos de idades de 6 meses, considerado animal jovem; 12 meses, animal adulto; e 18 meses, animal velho, admitindo-se que o tempo de vida do camundongo é de 2 anos, conforme Brown-Borge et al16. Eles foram alojados em condições empobrecidas (ambiente padrão - AP) ou enriquecidas (ambiente enriquecido - AE).
Em todas as janelas temporais (6, 12 e 18 meses), os efeitos da atividade mastigatória foram medidos a partir da imposição de um de três regimes de dieta: dieta sólida tipo pellet (hard diet - HD); dieta em pellet seguida por uma dieta em pó, farelada (soft diet - HD/SD); ou dieta peletizada seguida de pó e novamente de pellet (HD/SD/HD), com intervalos de tempo iguais em cada regime. A reposição era feita em dias alternados, conforme se detectava o consumo pelos animais, acompanhada da higienização das gaiolas. Ressalta-se que a dieta em pó era distribuída em dispositivo adequado para facilitar a ingestão e evitar o desperdício, assim como contaminação por dejetos orgânicos (Figura 1). A identificação da sequência temporal dos regimes de dieta está apresentada na figura 2.
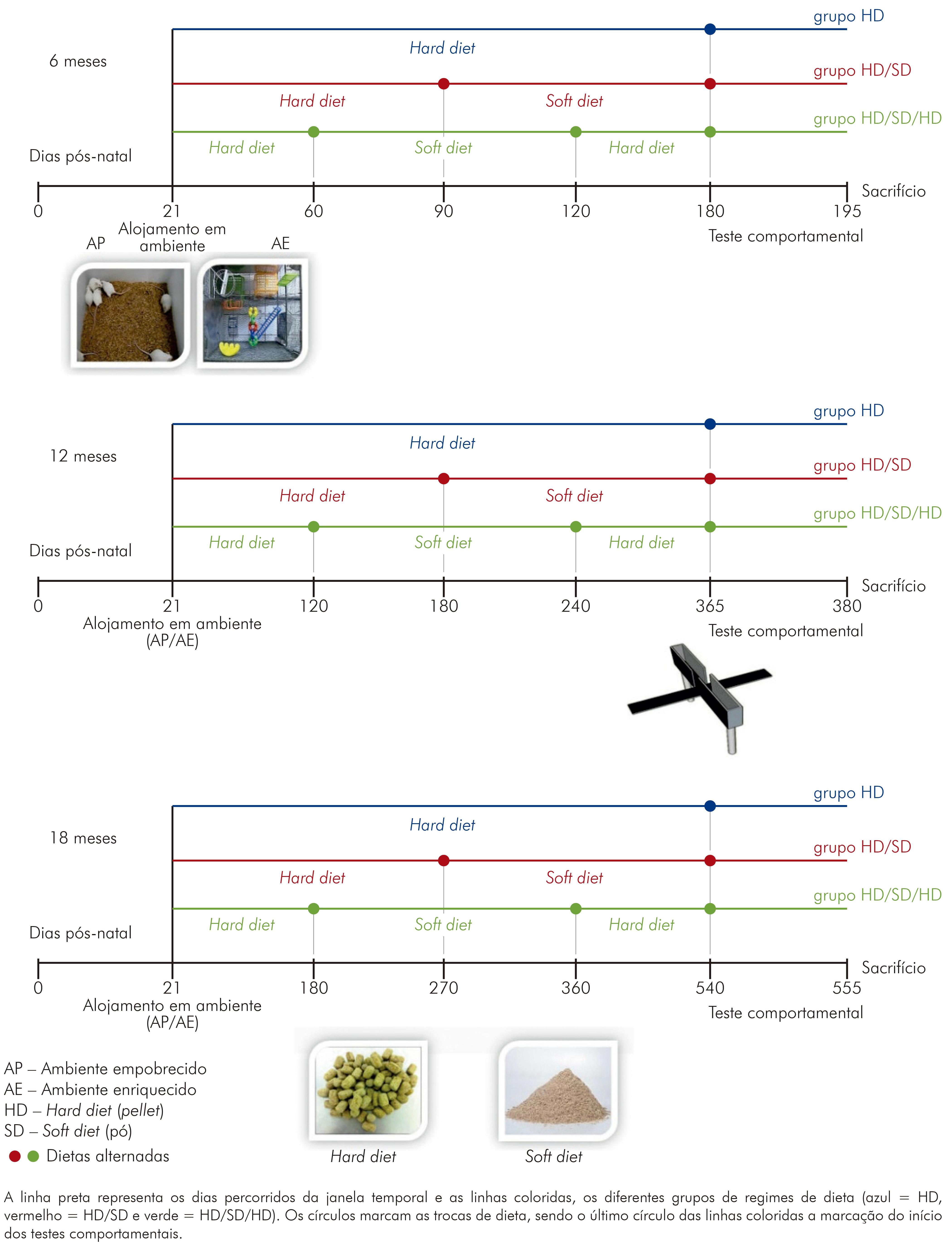
Figura 2 - Sequência temporal de eventos de atividade mastigatória para os grupos em suas janelas temporais de 6, 12 e 18 meses
Os animais do ambiente padrão foram alojados em gaiolas plásticas de dimensões 32x39x16,5 cm e cobertas por uma grade de metal, abrigando seis camundongos. Os grupos alojados em condições enriquecidas foram mantidos em um espaço de 50x50x50 cm, com dois andares, equipados com pontes, rodas de correr, brinquedos e túneis, permitindo o exercício voluntário ao longo de todo o período. O ambiente sofria modificações semanalmente, com alteração na posição dos objetos e substituição semanal de, pelo menos, um para garantir novidade ao ambiente. Cada gaiola abrigou 12 camundongos e todas permaneceram em uma sala com temperatura controlada (23 ± 1º C) e ciclos claro-escuro de 12 h (período claro, 6-18 h; período escuro, 18-6 h). Durante todo o período de formação dos grupos, os animais eram pesados mensalmente.
Todos os grupos formados foram avaliados quanto à atividade exploratória e condições de deambulação no teste de campo aberto (open field), que foi realizado por meio de uma caixa com dimensões de 30x30x40 cm, revestida com fórmica cinza e fundo preto. Cada animal permaneceu 5 min dentro da caixa, sendo gentilmente introduzido no centro da arena no início do teste. Com o auxílio do programa de análise ANY-maze Video Tracking System (Stoelting Co.), o assoalho da caixa foi dividido virtualmente em nove quadrantes de mesma área (10x10 cm), os quais foram tomados como parâmetro para extração de dados, como o número de cruzamento de linhas, e, assim, avaliar a atividade exploratória.
Além disso, em cada janela temporal, os animais foram submetidos ao teste do Labirinto em Cruz Elevado (LCE), constituído por dois braços abertos e dois fechados (35x5 cm) colocados em posições opostas e uma plataforma central (5x5 cm)15. Os braços fechados têm paredes de 17 cm de altura, enquanto os braços abertos não têm paredes. O assoalho do labirinto ficava a 75 cm do chão. O animal era colocado na plataforma central do LCE com permissão para que explorasse o ambiente por um período de 5 min. As variáveis que foram utilizadas para análise nesse teste foram o tempo de permanência e a distância percorrida nos braços abertos e fechados.
Assim como o teste de campo aberto, o LCE também foi filmado por meio de webcam e as imagens do comportamento processadas com o uso do software ANY-maze Video Tracking System (Stoelting Co.). No LCE, estimou-se para cada animal um índice de comportamento semelhante ao ansioso, baseado no contraste entre os tempos despendidos ou as distâncias percorridas nos braços abertos e fechados: C = (Fechado - Aberto) / (Fechado + Aberto). Os valores positivos indicavam que a quantidade de tempo gasto ou distância percorrida foram maiores nos braços fechados, comparados aos braços abertos. O índice de contraste foi aplicado para normalizar os dados, minimizando as diferenças na atividade locomotora.
Para a análise estatística, foram utilizados sete animais por grupo experimental, considerando-se processo de morte natural (N inicial de 12 animais) e ser esse um valor válido para extrair resultados significativos, conforme Baykara et al17.
A seguir, os grupos foram submetidos a testes de normalidade para identificação dos possíveis desvios, e a análise estatística paramétrica avaliou o grau de significância dos resultados, empregando-se a análise descritiva (dados quantitativos), de variância (ANOVA) para três critérios, seguido do pós-teste de Tukey. O nível de significância para diferenças estatísticas foi definido em α < 0,05.
RESULTADOS
CURVA DE PESO
No decorrer da formação dos grupos experimentais, os animais foram pesados mensalmente. Na análise da curva de peso, evidenciou-se que não houve diferenças significativas entre os grupos, o que corrobora a igualdade nutricional entre as dietas; a diferença se restringe à forma de apresentação da ração.
Os valores exatos de média e erro padrão, para cada grupo experimental, relacionados ao peso final dos animais, estão representados no Quadro 1.
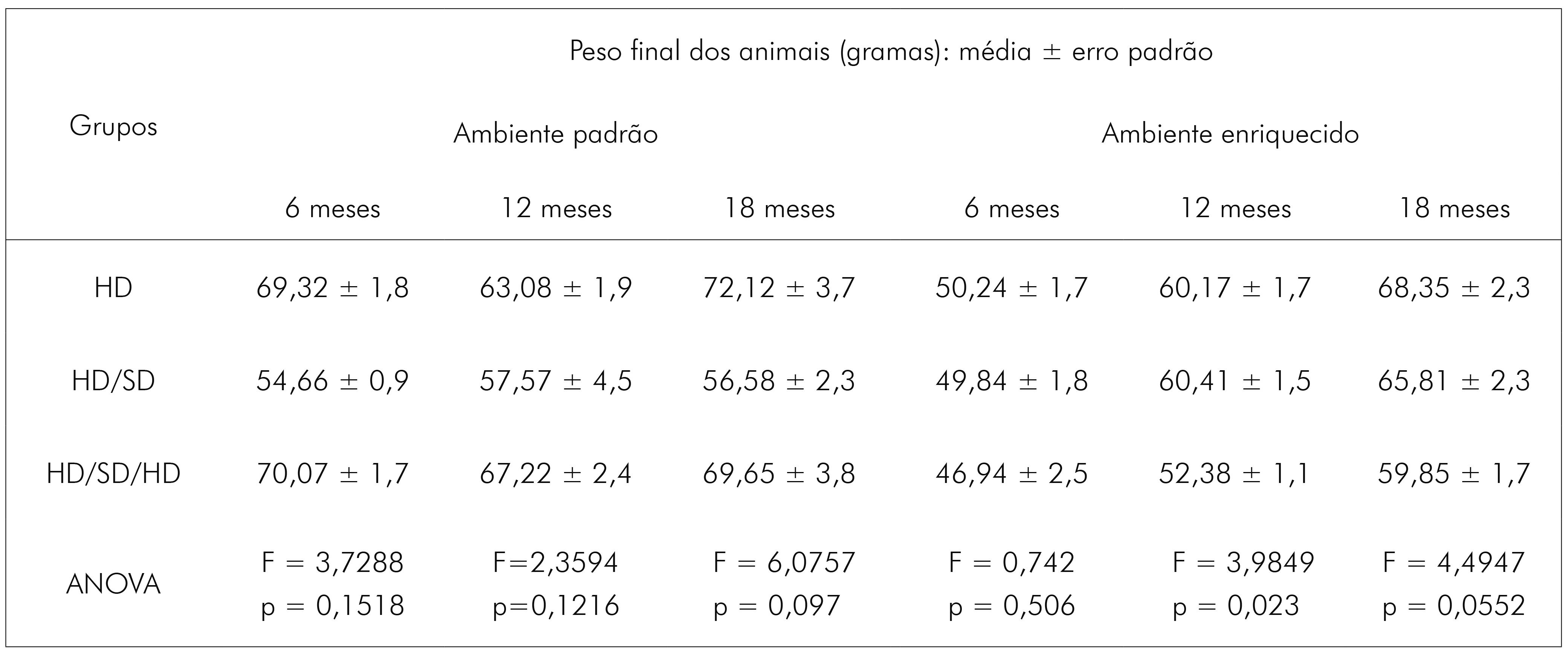
Quadro 1 - Média de peso dos animais, apresentada em gramas. Média e respectivos valores de erro padrão com base no peso dos animais para os grupos experimentais de 6, 12 e 18 meses de idade, nos diferentes regimes de dieta (HD, HD/SD ou HD/SD/HD) e ambientes (padrão ou enriquecido). Valores de significância obtidos na análise de variância (ANOVA) de um critério (valores de F e de p), na comparação de grupos com mesma idade e ambiente, porém diferente dieta
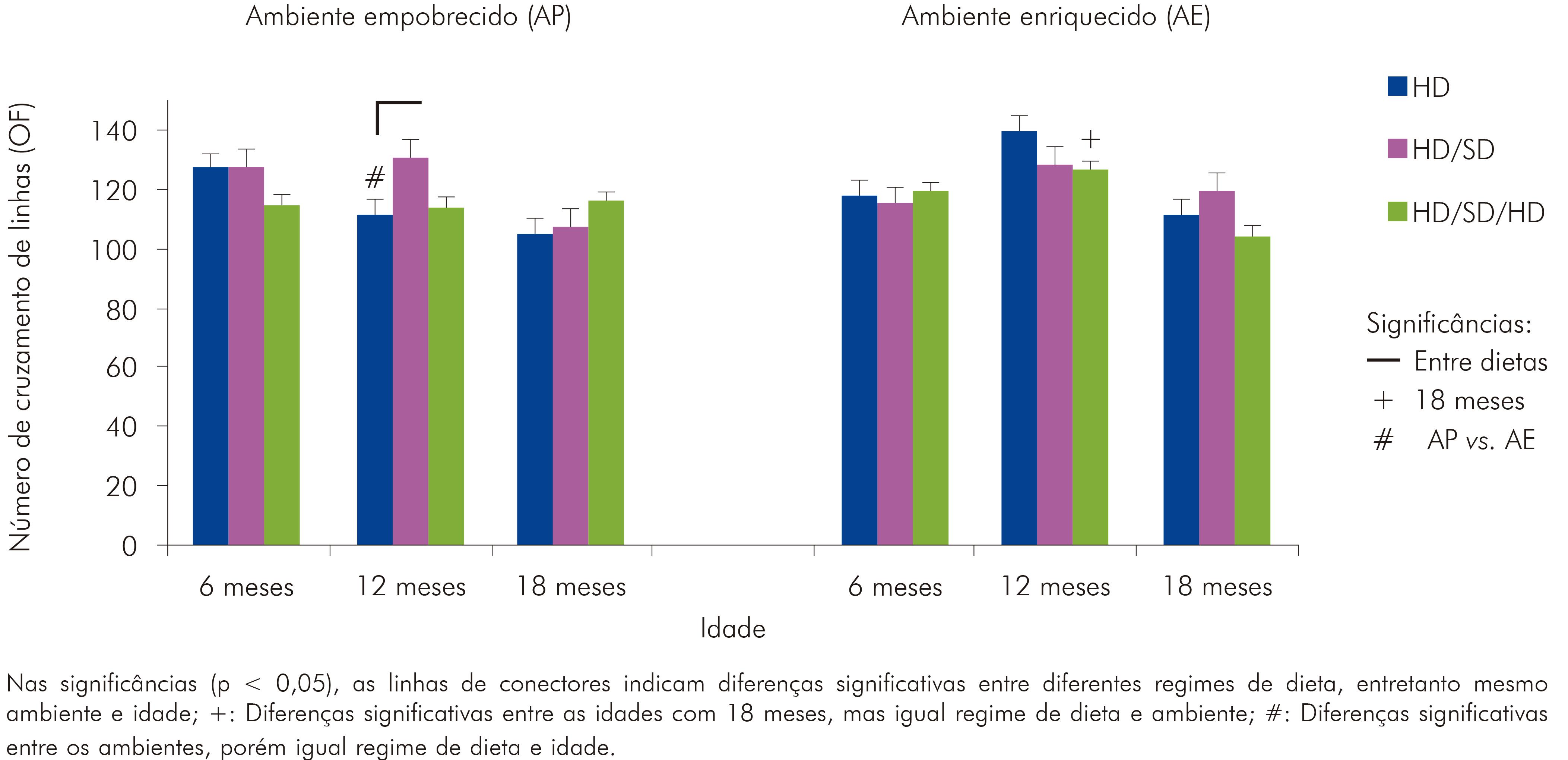
CRUZAMENTO DE LINHAS - CAMPO ABERTO
Ao analisar o cruzamento de linhas durante exploração do campo aberto, evidenciou-se que havia condições comuns de deambulação entre os grupos, sem diferenças significativas em análise de variância (um critério) (Figura 3).
Quando realizada a análise de variância de três critérios, encontrou-se que o ambiente (F(1,108) = 0,74; p < 0,391232) e a dieta (F(2,10) = 0,818; p < 0,444020) não influenciaram significativamente o padrão de exploração dos animais no campo aberto. Entretanto, o fator idade (F(2,108) = 5,36; p < 0,006008) influenciou significativamente. Porém, a interação das variáveis ambiente, idade e dieta não revelaram resultados expressivos.
Os valores exatos de média e erro padrão para cada grupo experimental, relacionados ao número de cruzamento de linhas, estão representados no quadro 2.

Quadro 2 - Número de cruzamento de linhas em tempo total do teste de campo aberto. Média do número de cruzamento de linhas e respectivos valores de erro padrão para os grupos experimentais de 6, 12 e 18 meses de idade nos diferentes regimes de dieta (HD, HD/SD ou HD/SD/HD) e ambientes (padrão ou enriquecido)
ANÁLISE DO TEMPO DE PERMANÊNCIA NO BRAÇO FECHADO DO APARATO - LCE
Ao analisar o tempo total de exploração do teste, na relação entre braço aberto e braço fechado, evidenciou-se que a influência da alteração mastigatória foi marcante na janela temporal de 18 meses do ambiente padrão (Figura 4).
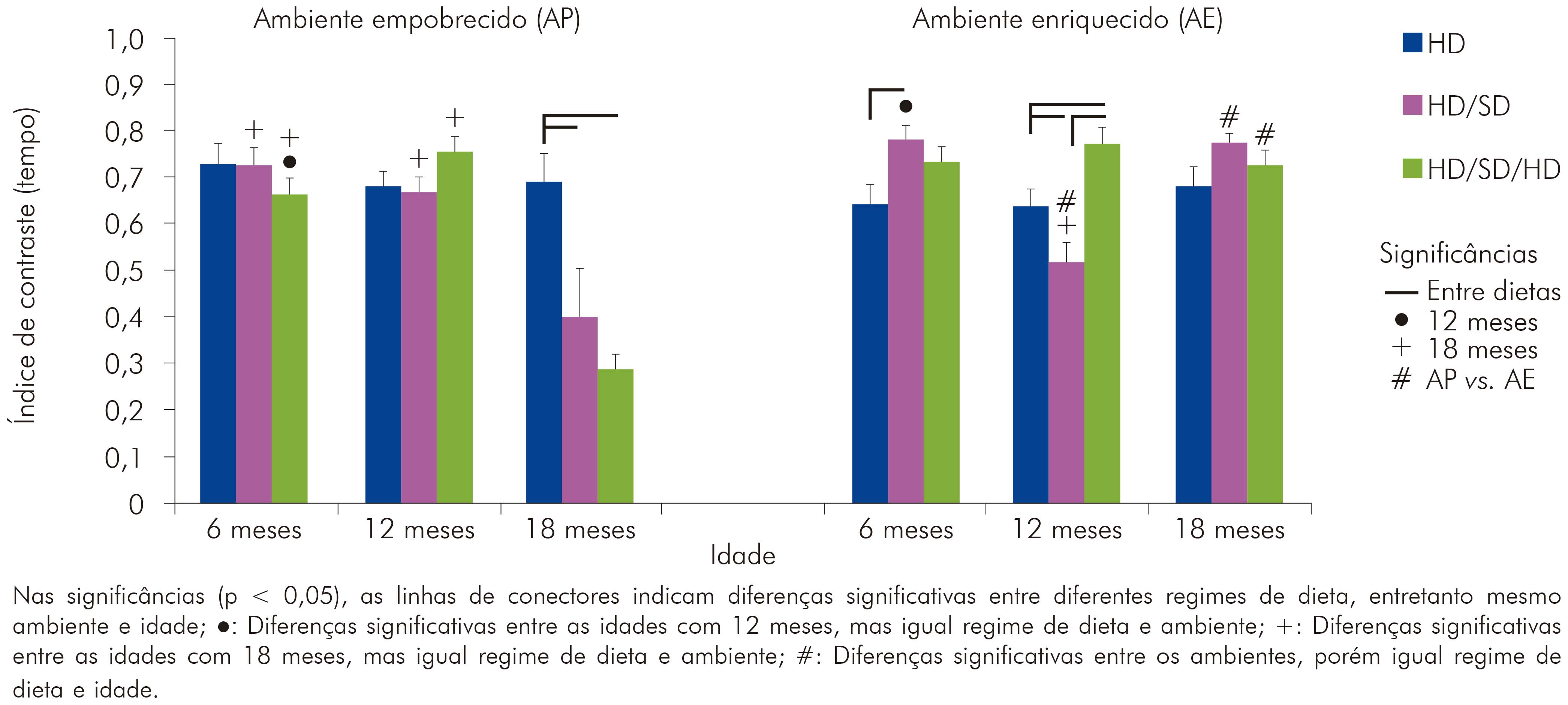
Figura 4 - Representação gráfica dos valores do índice sugestivo de ansiedade, aplicados para o teste LCE com base no tempo gasto nos braços fechado e aberto, com o tempo total de teste
A análise three-way revelou que o ambiente (F(1,108) = 13,0; p < 0,00046) e a idade (F(2,10) = 11,8; p < 0,000023) influenciaram significativamente o padrão de exploração dos animais no LCE. Essas duas variáveis interagiram com a alteração mastigatória, mudando os níveis de comportamento semelhante ao ansioso (F(4,108) = 4,83; p < 0,01). A combinação duas a duas das variáveis testadas também revelou interações significativas e isso incluiu ambiente e idade (F(2,108) = 23,8; p < 0,000001), ambiente e dieta (F(2,10) = 10,1; p < 0,000103) e idade e dieta (F(4,10) = 8,64; p < 0,000004). Os valores exatos de média e erro padrão, para cada grupo experimental, relacionados ao índice de contraste com base no tempo, estão representados no quadro 3.
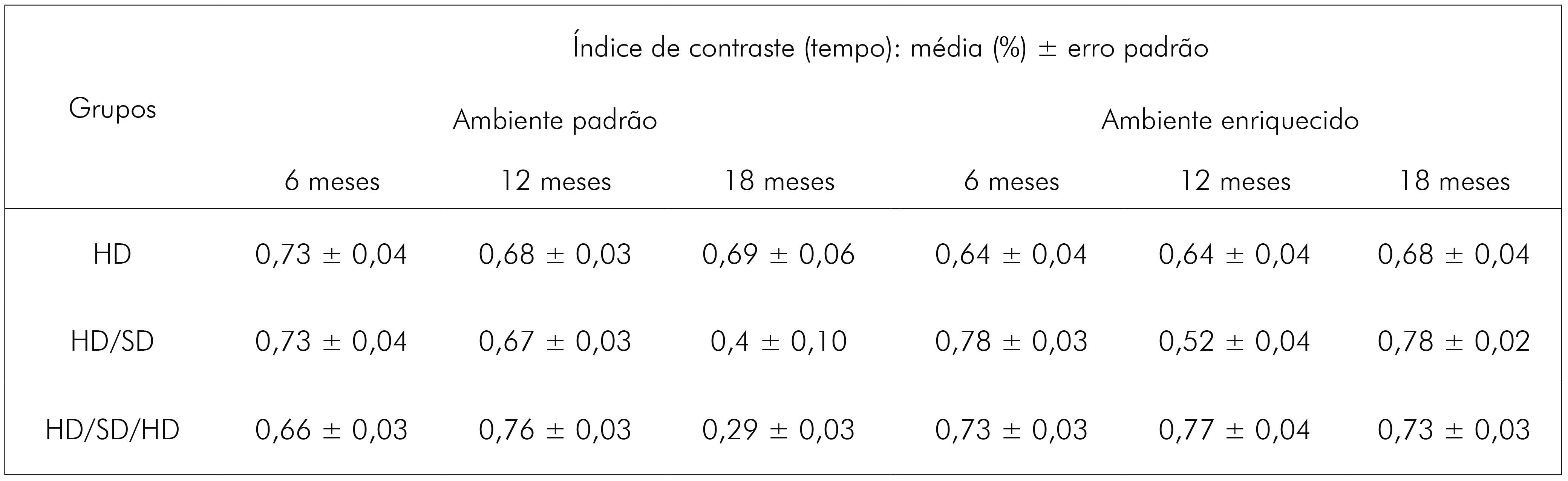
Quadro 3 - Índice de contraste para o tempo gasto (medido em segundos) nos braços do LCE. Média do índice de contraste em valores percentuais e respectivos valores de erro padrão, com base no parâmetro tempo gasto nos braços do labirinto para os grupos experimentais de 6, 12 e 18 meses de idade, nos diferentes regimes de dieta (HD, HD/SD ou HD/SD/HD) e ambientes (padrão ou enriquecido)
ANÁLISE DA DISTÂNCIA PERCORRIDA DURANTE O TESTE LCE
No estudo da variável distância (Figura 5), observa-se, nas janelas temporais de 6 e 12 meses, em ambos os ambientes, uma relação direta entre o tempo dispendido no braço fechado e a distância percorrida.

Figura 5 - Representação gráfica dos valores do índice sugestivo de ansiedade, aplicados para o teste LCE, com base na distância percorrida nos braços fechado e aberto, com o tempo total de teste
Os valores exatos de média e erro padrão, para cada grupo experimental, relacionados ao índice de contraste com base na distância, estão representados no quadro 4.
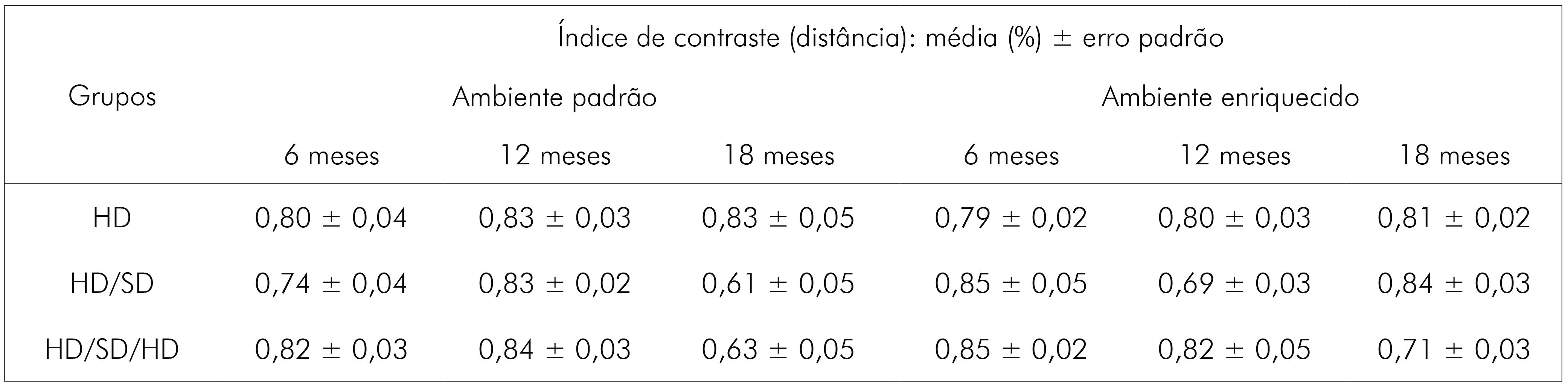
Quadro 4 - Índice de contraste para a distância percorrida (medida em metros) nos braços do LCE. Média do índice de contraste em valores percentuais e respectivos valores de erro padrão, com base no parâmetro distância percorrida nas zonas da arena de campo aberto para os grupos experimentais de 6, 12 e 18 meses de idade, nos diferentes regimes de dieta (HD, HD/SD ou HD/SD/HD) e ambientes (padrão ou enriquecido)
DISCUSSÃO
A ansiedade é definida como uma antecipação emocional a uma situação aversiva, ou seja, é primariamente uma resposta a um perigo potencial evoluindo enquanto resposta comportamental no sentido de evitá-lo9. Distingue-se do medo pelo fato deste estar relacionado a uma ameaça real e bem definida de perigo. A ansiedade, portanto, estaria associada a um estado de conflito ou incerteza e surge quando existe a concorrência entre duas opções simultâneas e o indivíduo tem que fazer uma escolha entre elas9,10.
As causas que podem levar um indivíduo a esses estados conflitantes e alterados de humor são inúmeras, e o seu estudo, a partir de modelos animais, tem buscado responder a três questões: quais sistemas neuronais estão envolvidos nas emoções; como esses sistemas funcionam quando alterados; e como essas condições patológicas podem ser modeladas18. As análises expostas contribuem para esse corpo de dados, indicando a interação entre atividade mastigatória, idade e ambiente sob o comportamento sugestivo de ansiedade.
O LCE, pautando-se no paradigma da agorafobia, sugere que níveis mais altos de ansiedade estariam associados a um aumento do tempo de permanência no braço fechado do aparato19. Neste experimento, objetiva-se a revelação de que a imposição de modificações do padrão de atividade mastigatória, seja pela sua redução ou pela sua reabilitação, interfere no padrão comportamental dos animais.
Nesse contexto, estudos prévios apontaram que o ato de roer atenuaria uma variedade de índices fisiológicos de estresse em ratos, tais como o aumento de atividade do eixo hipotálamo-hipófise-adrenal e a participação de catecolaminas centrais20,21. Em concordância, há relatos de um aumento seletivo na imunorreatividade para c-Fos no córtex pré-frontal de ratos que optaram por mastigar de forma espontânea durante exposição ao estresse22, sinalizando uma maior ativação mesocortical no ato de mastigar.
Estudos utilizando neuroimagem, em particular a ressonância magnética funcional, são apontados como importantes ferramentas para se investigar a fenomenologia dos transtornos de ansiedade. Nesses casos, a amígdala tem se mostrado hiperativa em vários trabalhos23,24, mas não em outros25,26. A região ventral do córtex pré-frontal, incluindo o córtex pré-frontal ventrolateral e o córtex cingulado anterior, também mostraram padrões anormais de ativação24,25,27. Essas áreas têm sido destaque em pesquisas sobre regulação e modulação das emoções em populações saudáveis, e especula-se, afinal, que o córtex pré-frontal e giro do cíngulo modulariam essas respostas, enquanto que a amígdala hiperativa seria observada somente nos casos de ansiedade elevada28. Além disso, o emprego da ressonância magnética funcional revelou perda associada ao envelhecimento da reatividade da amígdala e, em contraposição, uma atividade amplificada no córtex pré-frontal em resposta a estímulos nocivos29,30,31,32,33. Isso poderia explicar o fato dos animais velhos de ambiente empobrecido apresentarem redução de comportamento semelhante ao ansioso em comparação com os adultos jovens.
Quanto ao envelhecimento, é bem documentado que ele está associado ao declínio das funções cognitivas e também às mudanças emocionais. Percebe-se que camundongos velhos, de ambiente empobrecido e que sofreram alteração da atividade mastigatória, apresentaram redução do tempo de permanência no braço fechado em relação aos animais jovens. Dessa forma, mudanças no estado ansioso e relacionadas à idade parecem ter origem multifatorial34, justificando possivelmente os controversos achados na literatura, sobretudo em modelos experimentais, onde resultados parecem ser dependentes também dos testes e procedimentos experimentais aplicados.
Nesse contexto, utilizando camundongos machos C57BL6/J jovens (com 7 e 14 semanas de vida) criados em AP e submetidos a dieta com ração farelada, Nose-Ishibashi et al35 concluíram, em teste de campo aberto, que uma dieta habitual com ração em pó pode afetar a capacidade de resposta a novos ambientes, gerando, inclusive, possível dificuldade desses animais de se adaptarem aos novos ambientes.
No presente estudo, almejou-se elucidar a influência que a idade, a alteração mastigatória e o ambiente exercem no comportamento sugestivo de ansiedade. Ao seguir o protocolo de trabalhos realizados previamente em pesquisas do Laboratório, optou-se pela utilização de camundongos fêmea, não objetivando, nesse caso, realizar a comparação entre machos e fêmeas. Essa opção deve-se à reconhecida influência hormonal e sua capacidade de promover alterações celulares, em particular de astrócitos. Mouton et al36 concluíram que fêmeas senis da variedade C57BI6J apresentaram 18,3% mais astrócitos que fêmeas jovens e 32% mais que machos de idades correspondentes. Dessa forma, é razoável supor que possa haver diferenças também no comportamento. Neste trabalho, foram utilizadas somente fêmeas e considera-se que elas, mesmo as mais senis, estavam sob o mesmo estado hormonal, acreditando-se, assim, que as variáveis contribuintes para os achados comportamentais foram a alteração da mastigação ou o ambiente.
Muitos estudos que investigam os efeitos da estimulação ambiental sobre comportamentos semelhantes à ansiedade são controversos. Há estudos que apontam que o exercício diminuiria os sintomas de depressão e ansiedade37,38,39, ao passo que outros sugerem que ele seria ansiogênico39,40,41. Essa aparente inconsistência pode ser em parte atribuída ao tipo de teste de ansiedade aplicado num caso e noutro, assim como a espécie e a variedade do animal utilizada no experimento.
No que se refere à análise da distância percorrida, essa é útil para investigar o tempo associado à imobilidade. Constatada a contribuição significativa do tempo imóvel para o tempo total no braço fechado, é possível sugerir, por exemplo, que há acomodação do animal ao teste e isso pode representar desinteresse em explorar o ambiente. O experimento acima relatado, entretanto, não se enquadra nesse caso.
De modo geral, os animais sob alteração mastigatória apresentaram diferenças significativas nos índices de contraste em comparação com os animais controles (HD), sugerindo que a mastigação induziria modificação no padrão de permanência no braço fechado.
O enriquecimento ambiental poderia ter a sua influência interpretada como indutor de estresse, e a renovação contínua do meio, pela substituição ou deslocamento dos brinquedos, poderia ser comparável a exposições repetidas ao estresse leve42. Isso, de forma crônica, poderia tornar os animais velhos, de ambiente enriquecido, mais vulneráveis43.
Finalmente, a transição demográfica colabora para a incidência de processos neurodegenerativos e transtornos de comportamento. Transtorno de ansiedade generalizada correlaciona-se com um pior estado de saúde geral e comorbidades comuns ao envelhecimento44. Diante disso, modelos murinos almejam identificar as mudanças funcionais e estruturais, a fim de correlacioná-las com as alterações de comportamento. Desse modo, por mais que haja limitação na transposição de resultados nas diferentes espécies citadas, o presente estudo indicou que variáveis, como a estimulação ambiental e a alteração da atividade mastigatória, podem ser contribuintes nesses processos de alterações comportamentais.
CONCLUSÃO
A partir da interação entre condições de envelhecimento, alteração da atividade mastigatória e estimulação somatomotora e visuoespacial, investigaram-se as possíveis alterações de comportamento sugestivo de ansiedade. A alteração da atividade mastigatória influencia o padrão de permanência no braço fechado, e a estimulação ambiental acentua os seus efeitos, privilegiando a preferência pelo braço fechado como sugestão de um estado ansioso nos animais jovens e senis e com alterações do padrão da atividade mastigatória. Mecanismos celulares e moleculares permanecem por serem investigados.











 texto em
texto em