INTRODUÇÃO
O arbovírus Ilheus (VILH) é um flavivírus (família Flaviviridae, gênero Flavivirus) de grande importância para a saúde pública no Brasil, por estar relacionado a casos de encefalites em humanos, sendo o arbovírus encefalitogênico o mais distribuído no País, em particular na Amazônia brasileira. Entretanto, a doença em humanos é observada esporadicamente, embora o quadro clínico varie desde infecções assintomáticas até encefalite, a maioria dos casos é classificada como uma doença febril1.
Após o isolamento original do VILH que foi obtido a partir de um lote misto de mosquitos Aedes spp. e Psorophora spp., capturados em Ilhéus, Estado da Bahia, em 19442, esse vírus tem sido isolado sistematicamente em diferentes países da América do Sul e Central, especialmente no Brasil e Trinidad; bem como de diversas espécies de animais silvestres e artrópodes vetores, principalmente de Psorophora ferox, mas também, de modo esporádico, isolado de seres humanos3,4.
A prevalência de anticorpos para o VILH é amplamente distribuída em muitos países tropicais das Américas, entretanto epidemias não têm sido relatadas, provavelmente porque o principal vetor, P. ferox, apresenta hábitos silvestres. Populações humanas apresentam imunidade para o VILH, com taxas variando de 3,4% até 36%, sendo importante ressaltar o elevado percentual de positividade encontrado em áreas onde o vírus tem sido isolado. O número de casos clínicos com diagnóstico específico confirmado, no entanto, é baixo, em contraste com a alta prevalência de anticorpos para esse vírus, sugerindo que a maioria das infecções pode ser branda ou inaparente5.
Um estudo, realizado no Instituto Adolfo Lutz do Estado de São Paulo, relatou o isolamento do VILH e a detecção de anticorpos específicos em aves residentes, migratórias e de cativeiro, em saguis e quatis, comprovando a circulação desse agente no Parque Ecológico do Tietê, Estado de São Paulo. O comportamento migratório de aves silvestres pode determinar a introdução do vírus em outras regiões. Ao se observar a patogenicidade para o homem e a confirmação da circulação desse agente viral em área urbana, frequentada para atividade de lazer e de educação, o risco de ocorrência de infecção na população humana não pode ser descartado6, podendo ser considerado como um vírus potencialmente emergente.
Com os avanços na virologia moderna, foi possível observar que a infecção persistente viral ocorre comumente entre os flavivírus. Para um vírus causar infecção persistente ele deve diminuir ativamente a resposta imune antiviral do hospedeiro, por isso um importante efeito da replicação viral persistente está na desordem da homeostase normal do hospedeiro, causando a doença sem destruir a célula infectada7.
Em estudo experimental, Siirin et al8 demonstraram que hamsters adultos, infectados com vírus da encefalite Saint Louis (VESL), apresentaram infecção viral na urina por um período de tempo prolongado, despistando uma robusta resposta imune. Esses achados foram muito similares às descrições anteriores sobre infecções crônicas pelo vírus do Nilo Ocidental (VWN)9,10.
Sabe-se que outros flavivírus têm sido envolvidos com a infecção persistente in vitro, in vivo e em relatos clínicos. Desse modo, o objetivo deste trabalho foi investigar a possível ocorrência de infecção persistente in vivo do VILH, utilizando hamsters dourados jovens (Mesocricetus auratus) como modelo experimental.
MATERIAIS E MÉTODOS
Para este estudo, foi selecionado o VILH (BE H 7445), proveniente do acervo da Seção de Arbovirologia e Febres Hemorrágicas (SAARB) do Instituto Evandro Chagas (IEC). Essa amostra foi equivalente a quarta passagem em camundongos albinos suíços recém-nascidos, apresentando título de 9,6 DL50/0,02 mL.
Foram obtidos, do biotério do IEC, 45 hamsters dourados, fêmeas, de 2 a 3 semanas. A utilização desses animais foi aprovada pelo Comitê de Ética em Pesquisas com Animais do IEC.
A suspensão do VILH inoculada nos hamsters foi preparada a partir de cérebros de camundongos albinos suíços recém-nascidos, infectados com a amostra viral, macerados em solução salina tamponada (PBS), pH 7,4, contendo albumina bovina 0,75% e antibióticos. A suspensão foi inoculada em 30 hamsters pela via intraperitoneal, contendo aproximadamente 102/0,1 mL unidades formadoras de placas preparadas em células VERO (células de rim de macaco verde africano), e 15 animais não inoculados formaram o grupo controle negativo. Três hamsters (dois infectados com a amostra viral e um do grupo controle) foram anestesiados a cada 24 h, por um período de sete dias e em intervalos de 15 dias, durante quatro meses (120 dias pós-inoculação - d.p.i.), sendo coletados sangue, urina, fígado, baço, rins, pulmões, coração e cérebro. As alíquotas de sangue, soro e urina foram armazenadas à temperatura de -70º C para estudos sobre a viremia, detecção de antígenos e/ou anticorpos. As vísceras e cérebro foram separados em duas partes, uma destinada à detecção de antígenos por imunofluorescência indireta (IFI) e titulação viral nos tecidos, sendo conservada à temperatura de -70º C; e outra para realização de estudo histopatológico e imunohistoquímico, sendo então fixada em solução de formalina tamponada a 10%.
Anticorpos específicos para o VILH foram detectados nos soros de hamsters coletados durante a cinética experimental, por meio do teste de inibição da hemaglutinacão (IH)11,12. O antígeno usado foi preparado a partir de cérebros de camundongos albinos suíços recém-nascidos, infectados com o VILH pelo método de extração sucrose-acetona13. Os soros de hamsters foram testados por IH com diluições seriadas de duas vezes de 1:20 a 1:5.120 contra quatro unidades hemaglutinantes do antígeno do VILH.
Os fragmentos de órgãos, sangue, soro e urina foram inoculados em células VERO, como descrito por Lennette14. Os inóculos foram preparados a partir de fragmentos de órgãos macerados, sendo realizada uma suspensão na proporção de 1:10 em PBS, pH 7,4, contendo albumina bovina 0,75% e antibióticos. A suspensão foi centrifugada a 8.000 rpm durante 10 min a 4º C. O sobrenadante foi inoculado na proporção 1:100 em meio de manutenção. Os sangues, soros e urinas foram inoculados diretamente no meio de manutenção na proporção final de 1:50. Os espécimes inoculados foram observados diariamente em microscópio invertido (Olympus, modelo CK-2, Japão) para detecção de efeito citopático. A confirmação da infecção viral foi feita pelo teste de IFI de acordo com a técnica descrita por Tesh15.
A quantificação viral foi determinada a partir de sangue, fragmentos de cérebro e fígado coletados durante a cinética das infecções experimentais (três meses pós-inoculação para o VILH). Os resultados foram obtidos pela técnica transcrição reversa seguida de reação em cadeia mediada pela polimerase em tempo real (qRT-PCR), utilizando o aparelho 7500 Real-Time PCR System (Applied Biosystem, Foster City, Califórnia, EUA). Após a extração do RNA viral das amostras em estudo com Trizol LS (Invitrogen, Carlsbad, Califórnia, EUA), a reação foi realizada com o kit SuperScript III Platinium SYBR Green One-Step qRT-PCR (Invitrogen). Foi preparada uma reação final de 25 µL, contendo: 0,5 µL de SuperScript III RT Platinium Taq Mix, 0,2 µM de cada iniciador específico para o VILH que foram desenvolvidos para este estudo, ILHV/NS5R (5' - TGT ACC CAA GTT TCT GGA GT - 3') e ILHV/NS5F (5' - TTC TTG GAA TTT GAA GCA TT - 3'), 12,5 µL de 2x SYBR Green e 5 µL de RNA extraído das amostras em questão. A amplificação foi realizada seguindo as etapas: (i) transcriptase reversa (RT) a 50º C por 3 min; (ii) desnaturação a 95º C por 5 min; (iii) PCR em 40 ciclos, cada um contendo desnaturação a 95º C por 15 s, anelamento a 55º C por 1 min e extensão a 72º C por 30 s. Com a temperatura dos amplicons específicos entre 79,8º C e -82,0º C.
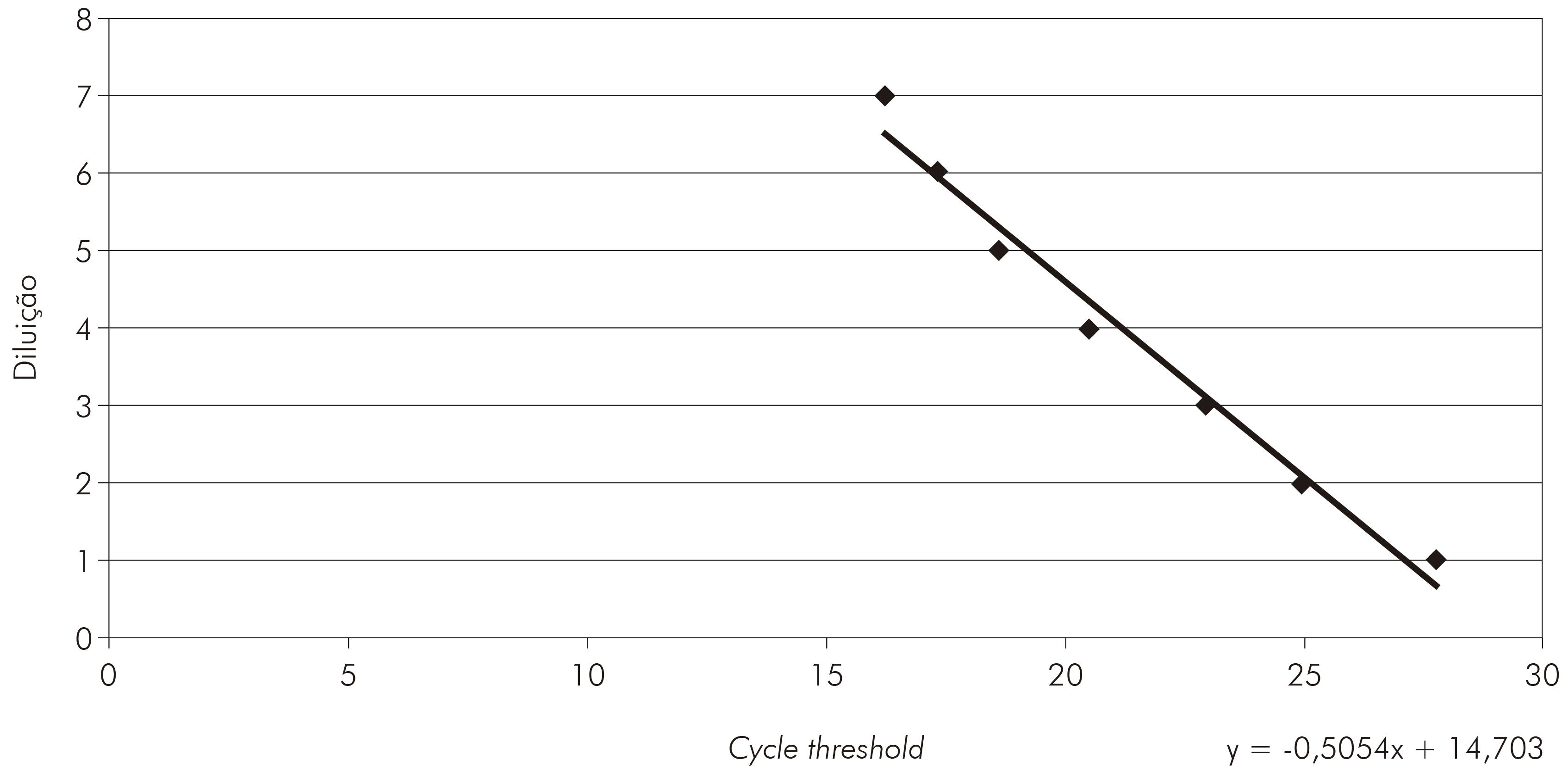
Análises dos resultados de qRT-PCR foram realizadas por meio da curva padrão. Para obtenção dessa curva, o controle positivo do VILH foi previamente titulado por plaqueamento em células VERO, como descrito por Kuno16, para determinar o título que foi utilizado como referência para a diluição do RNA viral extraído do vírus controle. Em cada diluição, foi realizada a qRT-PCR para a construção da curva padrão e dessa foi retirada a equação para titulação da carga viral em unidades formadoras de placas por mL (PFU/mL).
Após a fixação em formalina, os fragmentos de vísceras (fígado, baço, rins, pulmões e coração) e tecido nervoso dos hamsters dourados passaram por banhos com concentrações crescentes de álcool, iniciando com álcool a 70%, progredindo até o etanol absoluto (100%); posteriormente, foram realizadas duas passagens em xilol à temperatura ambiente, seguida da imersão em dois banhos de parafina a 60° C. Por fim, a inclusão e formatação de blocos de parafina que, depois de resfriados, foram seccionados utilizando micrótomo rotativo (Jung Histocut 820, Leica), para obtenção de cortes de 5 µm de espessura, que foram corados pela técnica de hematoxilina-eosina (HE)17 e pelo sistema da peroxidase para os procedimentos de imuno-histoquímica (IHQ), de acordo com o protocolo descrito por Carvalho et al18.
RESULTADOS
Os 30 hamsters inoculados com a suspensão do VILH e os 15 hamsters utilizados como controle negativo permaneceram ativos e não apresentaram sinais de doenças durante a cinética experimental.
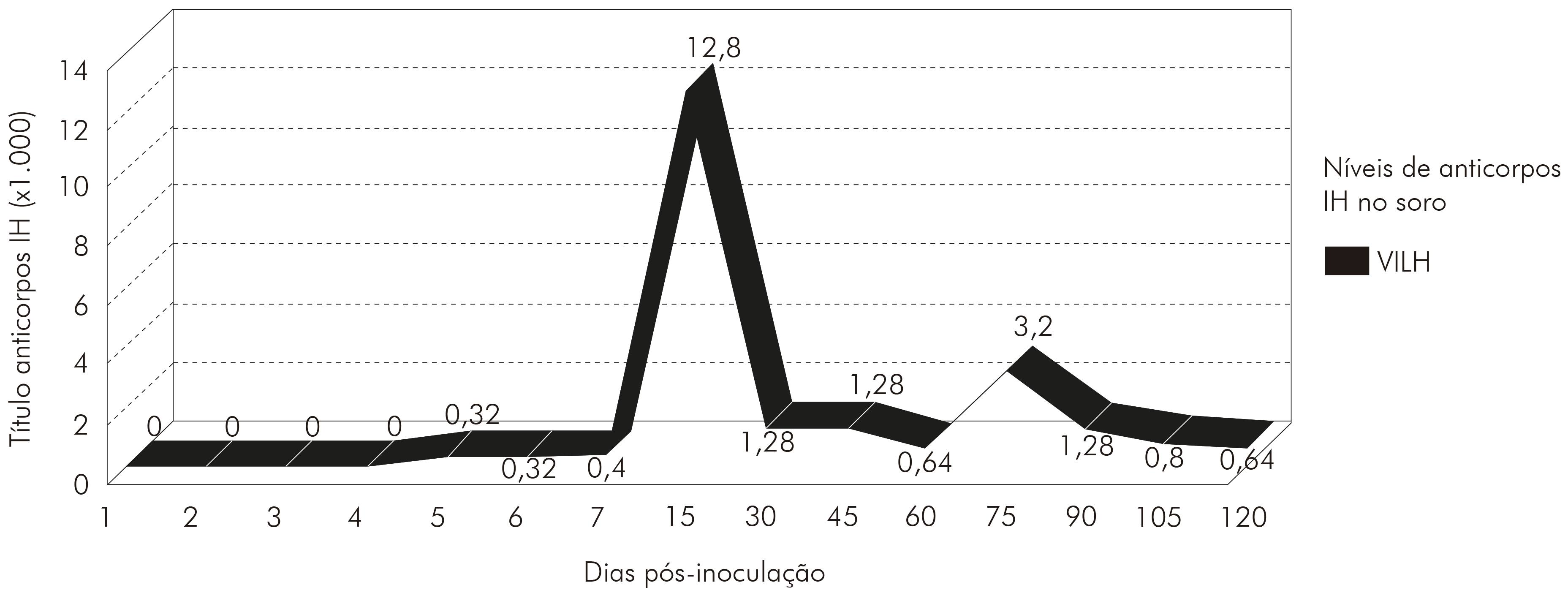
Os soros coletados durante a cinética apresentaram anticorpos IH a partir do quinto d.p.i. (1:320), com títulos crescentes até o título máximo (1:12.800), detectados no 15º d.p.i. para o VILH. Após esse evento, os anticorpos diminuíram até 45 d.p.i., permanecendo, sem muita alteração, no título de anticorpos até o final do experimento (quatro meses pós-inoculação). A cinética de anticorpos IH obtidos estão demonstrados na figura 1.
Todas as amostras coletadas, durante a cinética com o VILH, com 1 d.p.i. em hamsters e inoculadas em células VERO, apresentaram antígenos para o vírus. Não foram observados antígenos do VILH nos sobrenadantes de células infectadas com urina, coletados com dois e três d.p.i. em hamsters. Os sobrenadantes de células inoculadas com amostras de sangue, soro e urina, coletados em quatro d.p.i. com VILH em hamsters, foram negativos para detecção de antígeno viral. Foi possível observar antígenos do VILH nos sobrenadantes de células inoculadas com amostras de rim, baço, pulmão, coração, cérebro e urina coletados com cinco e seis d.p.i. em hamsters infectados. Os sobrenadantes de células infectadas com rim, baço, pulmão, coração e cérebro, coletados com sete d.p.i. em hamsters, durante a cinética do VILH, apresentaram resultado positivo para o soro homólogo do mesmo. A amostra de cérebro, coletada com 15 d.p.i. com VILH em hamster, e inoculada em sobrenadantes de célula foi a única a apresentar antígenos para o VILH. Todos os materiais biológicos, entre 30 e 120 d.p.i. com VILH em hamsters infectados, apresentaram resultado negativo para detecção de sobrenadantes de células; e também mostraram efeito citopático em células VERO, que foi caracterizado por destruição da monocamada celular devido à morte das células (Tabela 1).
Tabela 1 - Título do VILH, conforme a porcentagem de antígenos virais observado
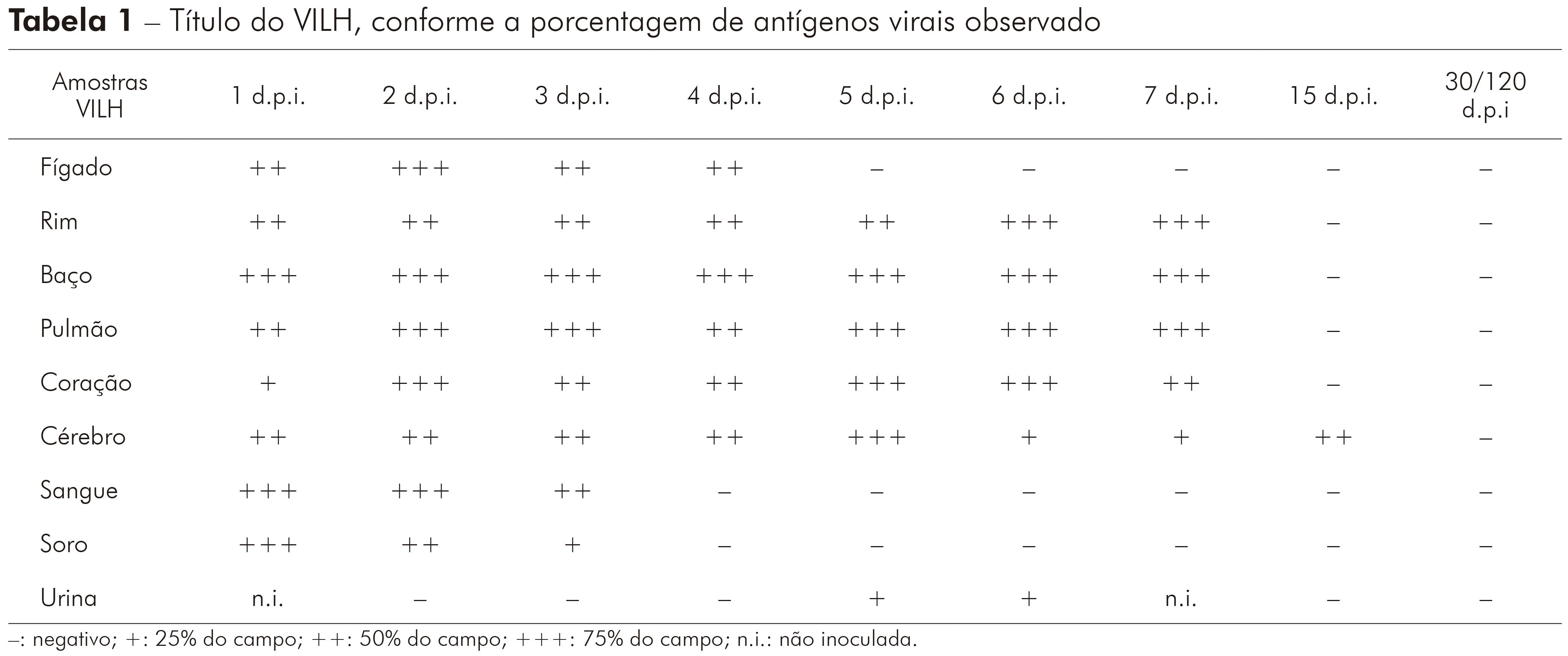
-: negativo; +: 25% do campo; ++: 50% do campo; +++: 75% do campo; n.i.: não inoculada.
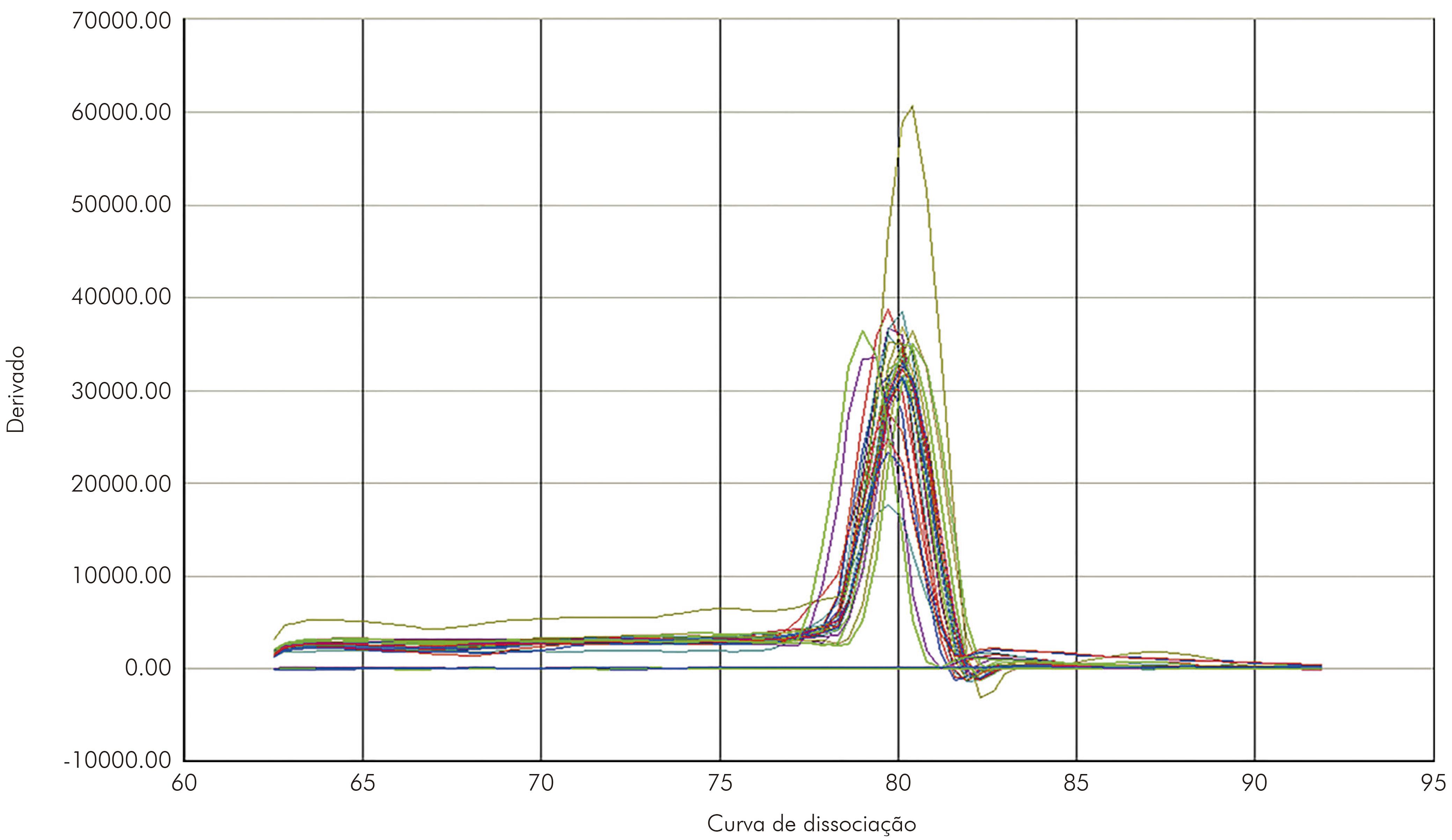
A qRT-PCR mostrou-se altamente específica para o VILH. Na curva de dissociação os amplicons específicos mostraram temperatura entre 79,8º C e -82,0º C (Figura 2). As cepas mostraram um cycle threshold de 16,20 a 27,78 para o VILH (Figura 3).
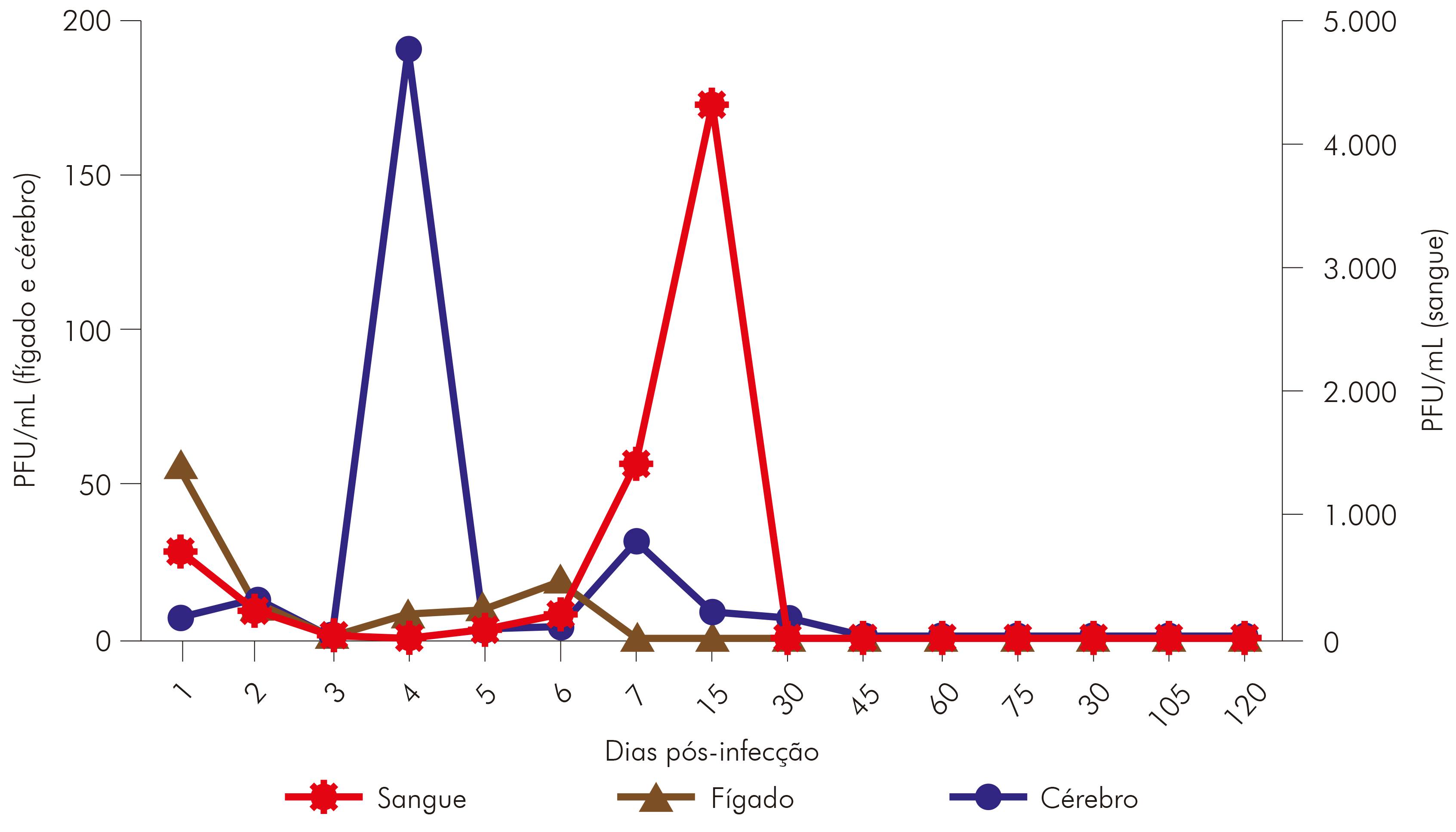
As amostras de fígado coletadas durante a cinética do VILH apresentaram detecção do genoma viral a partir do primeiro d.p.i., sendo nesse dia detectado o título máximo. Após o segundo d.p.i. até o sexto d.p.i., não houve muita alteração na quantificação viral, que desapareceu após o sétimo d.p.i. Nas amostras de cérebro coletadas dos animais infectados com o VILH, foi observada carga viral a partir do primeiro d.p.i., sendo o título máximo detectado no quarto d.p.i.; a partir do quinto d.p.i., a carga viral detectada diminuiu e permaneceu sem muitas alterações até 30 d.p.i. A viremia no sangue foi detectada por qRT-PCR a partir do primeiro d.p.i. em hamsters, e a carga viral máxima foi observada no segundo d.p.i. e, após esse evento, houve uma diminuição no título viral, permanecendo com pouca alteração até 15 d.p.i. (Figura 4).
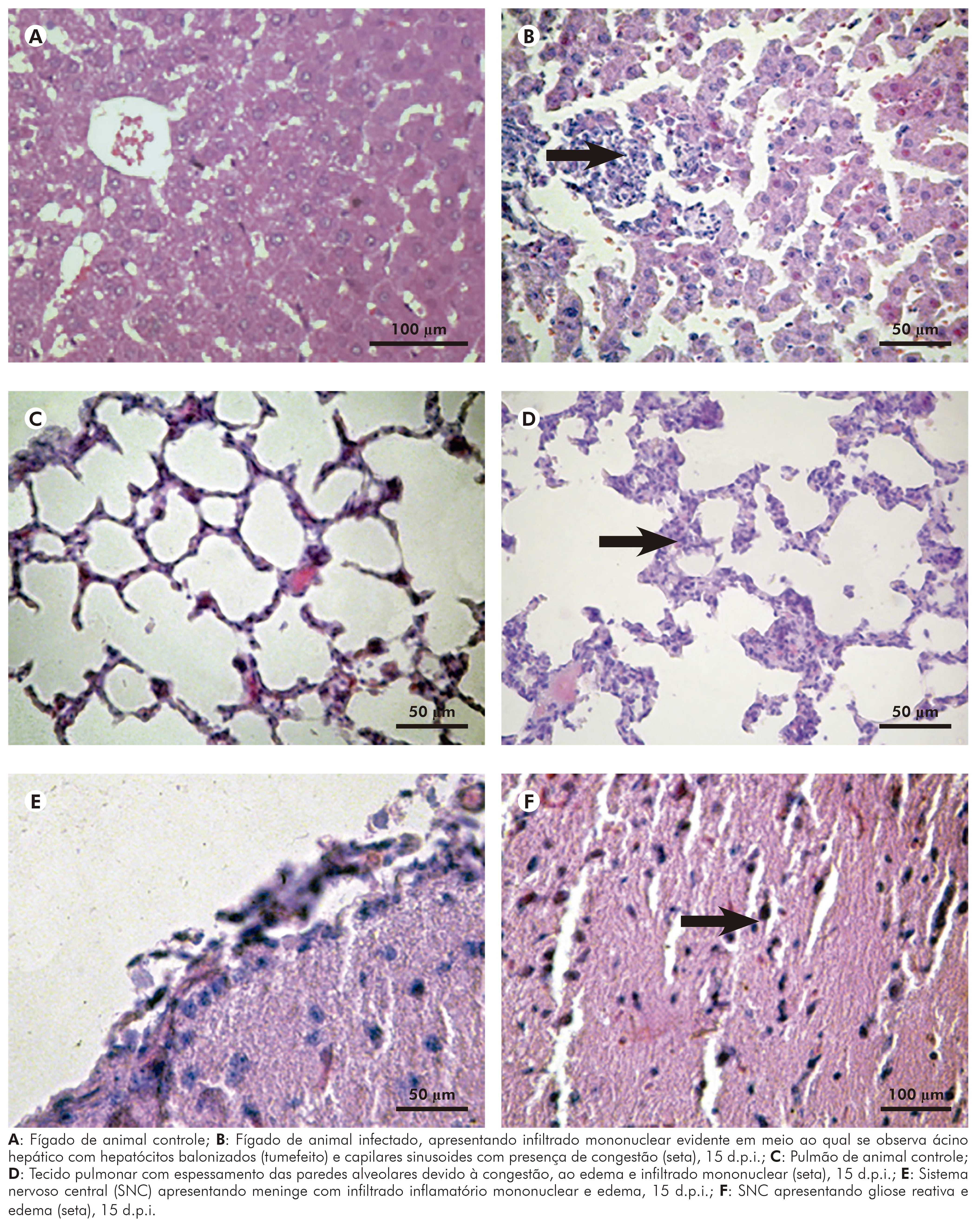
Na infecção pelo VILH em Mesocricetus auratus, as lesões teciduais foram mais evidentes no fígado, pulmão, rim e cérebro, embora tenham sido observadas pequenas alterações no coração e baço, caracterizadas por edema acompanhado por infiltrado mononuclear entre os espaços que permeiam os miocardiócitos; e hiperplasia do baço, dando um aspecto reacional.
As seções histológicas de fígado (Figura 5B) inoculado com o VILH mostraram tumefação celular e frequentes hepatócitos necrosados ou apoptóticos, com espaços porta, mostrando moderado infiltrado de linfócitos, plasmócitos e macrófagos, não se observando alterações de veia, artéria e canalículo biliar. Não houve evidências de colestase e, tampouco, predileção por área específica de Rapaport. Além disso, o ácino mostrou hipertrofia de células de Kupffer. Alterações regenerativas foram observadas a partir do sexto d.p.i. e se estenderam até o 30º d.p.i., e foram, principalmente, representadas por regeneração do tipo dupla placa. As alterações observadas no parênquima hepático sofreram considerável diminuição após o 15º d.p.i. e atenuaram-se consideravelmente até o 30º d.p.i., inclusive em algumas áreas desapareceu completamente.
O fígado dos hamsters infectados pelo VILH demonstrou presença de antígeno viral (Figura 6A) revelado pela imuno-histoquímica e foi intensa no período do primeiro ao 15º d.p.i., com pico no sétimo dia, decaindo a partir daí até o 30º d.p.i., com desaparecimento quase que completo do antígeno viral no 30º d.p.i.
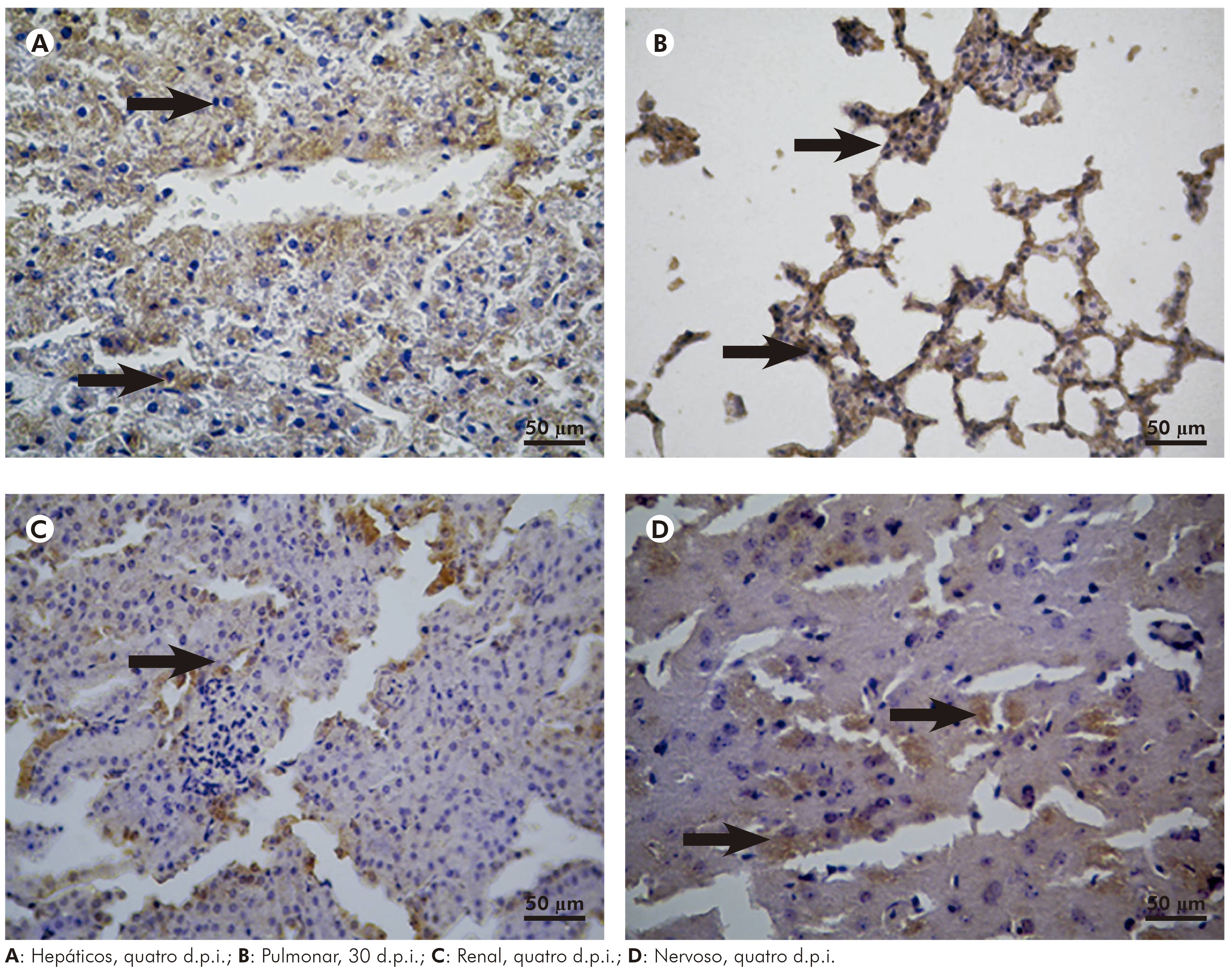
Figura 6 - Fotomicrografia da análise imuno-histoquímica de órgãos de hamsters dourados infectados com o VILH, mostrando resultado positivo por meio da marcação acastanhada (seta) nos tecidos
No pulmão inoculado com o VILH, foi observada congestão de tabiques alveolares e espessamento dos mesmos à custa de edema, congestão e infiltrado mononuclear, com áreas de franca pneumonite e focos de necrose discreta (Figura 5D). Esse quadro teve seu pico entre o quinto e sexto d.p.i., mantendo-se até cerca de 15 d.p.i., melhorando substancialmente entre 15 e 30 d.p.i.
O antígeno viral foi identificado no parênquima pulmonar dos animais infectados pelos VILH (Figura 6B), teve quantitativamente o mesmo comportamento observado no fígado, com presença de maior intensidade de imunomarcação até 15 d.p.i., decaindo daí em diante e praticamente desaparecendo com 30 d.p.i.
No rim dos animais infectados pelo VILH, observou-se congestão glomerular associada à edema e focos de necrose tubular e este relacionado a leve infiltrado de linfócitos e plasmócitos que se distribuíam principalmente no interstício do parênquima renal. As alterações tiveram pico no sexto d.p.i. e mantiveram-se até o 15º d.p.i., melhorando a partir daí e se mantendo discretas até o 30º d.p.i.
No rim, a imunomarcação para antígenos virais do VILH (Figura 6C) mostrou positividade franca do parênquima, com pico no sétimo d.p.i.; essa imunomarcação manteve-se em intensidade até o 15º d.p.i., a partir de então decaiu de intensidade e desapareceu quase por completo no 30º d.p.i.
No cérebro dos hamsters infectados pelo VILH, foram observados congestão e infiltrado mononuclear ao nível das meninges associados à edema intraparenquimatoso, que se caracteriza pela presença de vacuolização ao redor dos corpos neuronais e gliose cerebral (Figuras 5E e 5F). Essas alterações sofreram seu pico máximo entre o quarto e sexto d.p.i., e mantiveram-se até o 15º d.p.i., atenuando entre o 16º e 30º d.p.i. Ressalta-se que alterações mínimas foram observadas no 30º d.p.i.
A marcação de imuno-histoquímica para o antígeno viral no SNC dos hamsters infectados pelo VILH mostrou positividade no parênquima cerebral (Figura 6D) e a intensidade de antígenos foi mais proeminente entre o primeiro e sexto d.p.i., persistindo em níveis baixos do 15º d.p.i. em diante.
DISCUSSÃO
Os resultados demonstraram que os hamsters jovens são bons modelos experimentais para a infecção pelo VILH e, que além de infecção aguda, demonstram suscetibilidade para infecção persistente.
Os hamsters infectados com o VILH desenvolveram viremia por três d.p.i., detectados nos sobrenadantes de cultivo de células infectadas com sangue pela técnica de IFI. Anticorpos IH foram identificados no soro dos animais infectados a partir do quinto d.p.i., que coincidiu com o desaparecimento de vírus no sangue. Esse evento também foi observado por Tesh et al10 em um estudo sobre infecção persistente pelo VWN em hamsters, que igualmente não detectaram viremia nesses animais após o aparecimento de anticorpos IH. Isso provavelmente se deve à presença dos anticorpos neutralizantes que se fixam ao vírus, formando imunocomplexos, não permitindo a entrada do mesmo em novas células, evitando a replicação viral, que em seguida são eliminadas do organismo pelos mecanismos de defesa imune.
Embora todos os sobrenadantes de células infectados com órgãos, sangue, soro e urina tenham mostrado a presença de partículas virais viáveis, mediante o isolamento, confirmando a infecção e a replicação viral, por meio da positividade dos testes de IFI, não foi observada persistência viral nas células VERO por essa técnica. Ressalta-se, entretanto, que a cultura direta dos órgãos infectados provavelmente não foi a melhor estratégia para observar persistência viral. Essa evidência também foi detectada por Xiao et al19 e Siirin et al8 em estudos com VWN e VESL, respectivamente, pois é sabido que, no momento da maceração dos fragmentos de órgãos, ocorre liberação de vírus intracelular, os quais podem entrar em contato com anticorpos presentes no sangue e fluidos intersticiais dos tecidos, reduzindo, dessa forma, a sensibilidade desse método de estudo para demonstração de persistência viral. Esses autores sugerem que a técnica de cocultivo é a mais apropriada para demonstração de persistência viral por flavivírus, pois a lavagem do tecido com tripsina-EDTA, que ocorre durante o preparo do espécime, presumidamente, elimina muitos ou todos os anticorpos neutralizantes, sem destruir o vírus intracelular, o qual seria subsequentemente liberado e amplificado no cocultivo com a monocamada de célula VERO9.
A urina tem mostrado ser um bom espécime clínico para isolar flavivírus e também para demonstrar a persistência viral em cultura direta de células VERO8,9,10. Neste experimento, conseguiu-se isolar o vírus a partir da urina, o que mostra que a urina dos animais contaminados é infecciosa. Ressalta-se, no entanto, que, nos estudos nos quais foi demonstrada uma boa resposta de isolamento do vírus, a urina foi diluída em PBS antes da inoculação em célula VERO. Neste estudo, a urina foi inoculada diretamente em uma proporção final de 1:50 em células VERO, sendo que sua toxicidade pode ter influenciado nos resultados obtidos. No teste de qRT-PCR, foi possível detectar vírus na urina, mesmo em concentração muito pequena. Foram selecionadas as três últimas amostras possíveis de serem coletadas durante a cinética experimental com o VILH (15, 30 e 75 d.p.i.), obtendo resultado positivo para 30 d.p.i., com título de 0,9 PFU/mL (dados não mostrados).
Nas amostras testadas pela técnica de qRT-PCR (sangue, fígado e cérebro), apenas o cérebro apresentou persistência viral. Apesar da qRT-PCR ser mais sensível, quando comparada com os resultados obtidos por IFI que detectou antígenos virais por, no máximo, 15 d.p.i. nas amostras de sobrenadantes de células infectadas do cérebro coletadas durante a cinética (Tabela 1), não foi possível observar persistência viral por qRT-PCR por mais de 30 d.p.i. no cérebro, bem como persistência viral no sangue e fígado dos hamsters infectados com VILH.
O título extremamente elevado de anticorpos IH, observado durante o experimento, com o pico máximo (1:12.800) no 15 d.p.i., possivelmente explica a eliminação total do VILH após 30 d.p.i., inclusive por qRT-PCR. Um dado que fortalece essa relação é o estudo de persistência viral por vírus Rocio (VROC), no qual foi utilizado o mesmo desenho experimental que demonstrou anticorpos IH com título máximo 10 vezes menor que o observado neste estudo, sendo possível detectar o VROC por três meses no cérebro, fígado e sangue por qRT-PCR20.
O VILH foi capaz de produzir em hamsters alterações patológicas e expressão de antígenos virais nas amostras de fígado, rim, pulmão e cérebro, coletados durante a cinética por até quatro meses. Observou-se que o VILH promoveu infecções pantrópicas de caráter inflamatório, causando lesões histológicas no SNC, fígado, rim, baço, pulmão e coração. A intensidade e amplitude das lesões teciduais variaram entre os diferentes órgãos acometidos, sendo observado que as lesões foram mais evidentes no SNC; seguido pelo fígado, as quais também foram evidenciadas pelos ensaios de IHQ e qRT-PCR. Essas observações corroboram o estudo sobre patogenicidade do VILH em hamster jovens, realizado por Azevedo21.
As lesões intensas no SNC, seja no parênquima cerebral, com lesões neuronais, ou na meninge, resultando em meningite com infiltrado inflamatório persistindo por quatro meses, evidenciaram novamente o neurotropismo e a capacidade do VILH de causar encefalite nos hamsters. Alguns autores consideram que o que poderia facilitar a persistência do vírus no cérebro seria a infecção neuronal. Neurônios maduros são mais resistentes à indução de apoptose e, possivelmente, essa resistência seria mediada pela expressão neuronal de inibidores de apoptose, como bcl-2, bcl-x e mcl-1, que poderia ser considerada um mecanismo de preservação dessa não renovável população de células. Essas células são deficientes em constituintes celulares necessários para apresentar antígenos que serão reconhecidos pelas células T citotóxicas, ou seja, são deficientes na expressão de moléculas do complexo principal de histocompatibilidade de classe I22.
O fato de alguns resultados nos ensaios de IHQ terem apresentado positividade por mais tempo quando comparados à técnica de qRT-PCR (amostras de fígado e cérebro infectados pelo VILH), pode estar relacionado à qRT-PCR detectar somente o genoma do vírus, enquanto a IHQ detecta qualquer proteína viral, podendo ter ocorrido, de alguma forma, degradação do RNA, resultando em qRT-PCR negativo, mas permanecendo proteínas virais detectáveis por IHQ. Ressalta-se que alguns vírus recuperados de cérebro de animais têm sofrido atenuação da neurovirulência, indicando a seleção para variantes genéticas e/ou partículas virais defeituosas, que podem inibir a produção de vírus infeccioso23.
Em fragmentos de baço e coração inoculados com o VILH, apesar de se ter observado replicação viral dos mesmos em células VERO e a ocorrência de alterações teciduais, não se conseguiu demonstrar a presença de antígenos virais por IHQ. Isso pode sugerir que a replicação viral em células VERO, assim como as lesões teciduais encontradas podem ser decorrentes da passagem do vírus por esses órgãos por meio do sangue, e que seria necessário a técnica de cocultivo de células VERO para demonstrar a infecção viral persistente, ou ainda a utilização da técnica de qRT-PCR, como demonstrado para o cérebro.
O estudo histopatológico apresentou alterações de caráter inflamatório no rim para o vírus em estudo. Esse resultado aliado à detecção de antígenos virais no rim e RNA viral por qRT-PCR na urina, por no mínimo 30 d.p.i., em hamsters, sugerem o rim como um órgão envolvido na resistência da infecção por flavivírus, corroborando os achados de Siirin et al8 que observaram, nesses mesmos animais em estudo de infecção persistente por VESL, a ocorrência de alterações nos tecidos renais e infecção pelo VESL na urina por um prolongado período.
CONCLUSÃO
Os resultados com o VILH, juntamente com os obtidos em outros estudos, sugerem que infecções persistentes podem ocorrer com uma variedade de flavivírus em vertebrados e que a persistência desses não é um fenômeno tão incomum. Entretanto, são necessários estudos adicionais para determinar como exatamente a infecção persistente pelo flavivírus VILH se estabelece, incluindo a via de introdução no SNC, as células que possibilitam a infecção no SNC, os grupos celulares envolvidos na expressão da infecção e na resposta imune protetora, dentre muitos outros aspectos da patogenia.












 Curriculum ScienTI
Curriculum ScienTI