INTRODUÇÃO
O citomegalovírus humano (HCMV) é um agente ubíquo, que acomete pessoas de todas as classes sociais de diferentes raças e faixas etárias, sendo altamente prevalente principalmente em populações dos continentes sul-americano e africano. De acordo com Pannuti1, as mais altas prevalências estão relacionadas a fatores socioeconômicos e culturais das populações, acometendo mais indivíduos de baixa renda, dadas as condições de educação, higiene e saneamento básico.
A infecção pode ocorrer tanto por vias naturais como iatrogênicas e a aquisição do vírus inicia desde a infância, aumentando proporcionalmente com a idade1,2. O vírus é considerado uma das principais causas de infecção congênita e perinatal, enquanto que no período pós-natal é grave para indivíduos com imunodeficiência3,4,5,6,7,8,9,10.
Após a primeira infecção, o HCMV pode permanecer no organismo indefinidamente e ser ativado, ocasionando novos episódios de infecção, sendo essa forma muito comum em indivíduos imunodeficientes6,11,12,13,14,15,16,17. Todos os fatores, acima relacionados, convergem para elevar sua prevalência nos diversos grupos populacionais de diferentes estratos da sociedade e regiões geográficas; assim, é importante conhecer a epidemiologia viral do HCMV e os fatores que contribuem para aumentar sua endemicidade de tal forma que medidas de controles sejam aplicadas para monitorar a cadeia de transmissão do vírus.
TRANSMISSÃO
O HCMV é um importante agente infeccioso causador de diversas patologias que podem cursar tanto de forma sintomática quanto assintomática, disseminada ou em órgão específico17.
A infecção viral pode ocorrer em diferentes períodos de vida do indivíduo, estando relacionada a fatores socioeconômicos e culturais, além da presença do agente em diversos fluidos orgânicos, os quais conjuntamente contribuem para elevar a endemicidade e disseminação do vírus1,4,18,19.
A transmissão viral pode ocorrer por vias naturais ou iatrogênicas1,2, sendo que as vias naturais mais comuns estão relacionadas ao contato íntimo e repetitivo da pessoa sadia com secreções do doente. Nesse caso, familiares, profissionais de saúde e cuidadores infantis ou pré-escolares ficam mais propensos a adquirir o vírus.
As crianças são consideradas importantes na cadeia de transmissão viral, pois excretam o vírus pela urina e saliva por tempo indeterminado7,20. Enquanto que, na fase adulta, os jovens são os principais transmissores da doença, pois a via sexual passa a ser a principal forma de transmissão horizontal21,22.
A precocidade na aquisição do vírus também está relacionada à transmissão durante a gestação, chamada de vertical ou pré-natal. Essa forma de infecção desenvolve-se por meio da placenta7,23,24, ocasionando a infecção do feto. Se a transmissão materno-fetal ocorrer por infecção primária materna, a infecção congênita tem grandes possibilidades de causar graves prejuízos para o feto em desenvolvimento, principalmente, se acontecer no primeiro trimestre de gravidez25.
Nos casos mais graves da infecção fetal, a criança pode apresentar surdez neurosensorial, hidrocefalia, calcificações intracranianas, prematuridade, microcefalia, tamanho pequeno para a idade gestacional e outros. Se a infecção no feto ocorrer por reativação da cepa endógena materna, então os prejuízos para a criança serão minimizados pela ação dos anticorpos maternos anti-HCMV da primoinfecção7,24.
Por outro lado, quando a criança não é afetada na fase do desenvolvimento uterino, ela poderá adquirir o vírus durante a passagem pelo canal do parto ou nas primeiras mamadas, sendo denominada de transmissão perinatal por vias iatrogênicas1,7,8.
Outra forma de transmissão iatrogênica é dada pelo compartilhamento de seringas e agulhas no uso de drogas injetáveis, utilização de instrumentos na colocação de piercings e tatuagens, além de transfusão sanguínea, transplantes de órgãos e processos de diálises1,26,27,28,29.
O vírus pode permanecer no organismo indefinidamente após a primeira infecção e, em determinadas situações de baixa imunidade do hospedeiro, o HCMV pode ser ativado do seu estado de latência e causar infecções recorrentes15,16,30. A infecção recorrente é um tipo de infecção secundária ocasionada por reativação da cepa endógena ou cepa exógena, quando há transmissão por via iatrogênica. Esse mecanismo de infecção é comum em indivíduos submetidos a determinados procedimentos terapêuticos e cirúrgicos, ocasionando manifestações clínicas importantes por comprometer diversos sistemas do organismo18,31,32,33,34.
DISTRIBUIÇÃO MUNDIAL
Os dados soroepidemiológicos de diferentes regiões do mundo demonstram que a infecção pelo HCMV é frequente em comunidades de baixo nível socioeconômico. Esses dados também indicam que existe uma relação proporcionalmente inversa entre a suscetibilidade e o status socioeconômico, ou seja, grupos populacionais com nível socioeconômico elevado apresentam maior suscetibilidade e, consequentemente, menor imunidade ao vírus, ao passo que indivíduos de baixo poder aquisitivo apresentam maior imunidade e menor suscetibilidade à doença5,35,36.
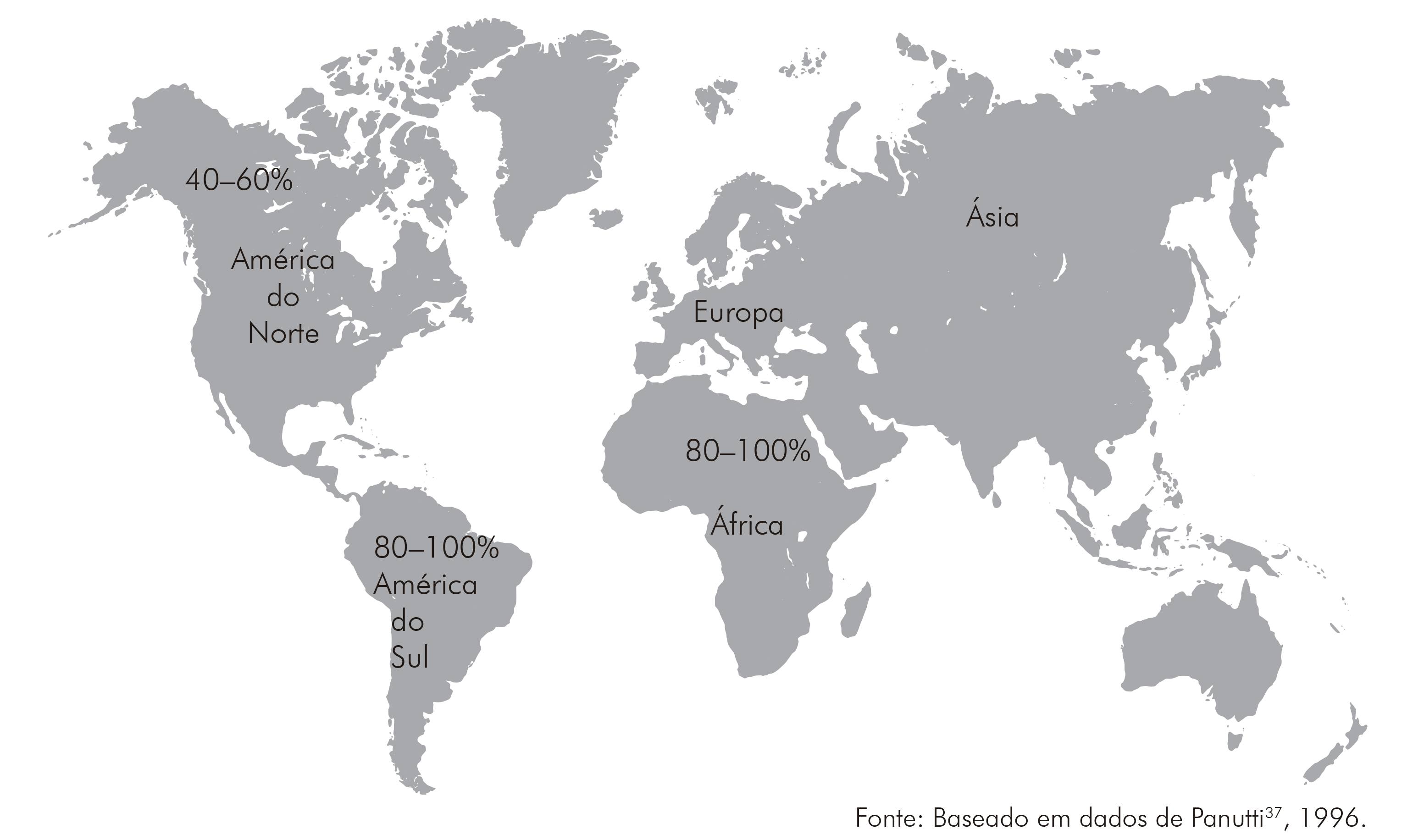
As maiores taxas de soroprevalência para o HCMV ocorrem em populações procedentes de países em desenvolvimento, cujos índices variam entre 80-100%, e em populações de países desenvolvidos entre 40-60%1,29,37,38. A elevada frequência de anticorpos na população economicamente menos favorecida está relacionada aos maus hábitos de higiene, às péssimas condições de saneamento básico, à moradia e à educação das populações2. Certamente que o conjunto desses fatores, associados à biologia viral e à deficiência imunológica, contribuem para a manutenção do perfil epidemiológico do vírus na população.
Os índices de infecção congênita em diferentes populações do mundo foram estimados entre 0,2% e 3,2%3,4,19,20,39,40,41, sendo que Lanzieri et al42 demonstraram, em uma revisão epidemiológica sistemática de dados obtidos de vários estudos realizados, entre o período de 1978 a 2011, que as taxas de infecção congênita por HCMV em populações de países em desenvolvimento variam entre 0,6% e 6,1%.
Um amplo estudo conduzido em Portugal sobre a frequência de anticorpos anti-HCMV, realizado em 2.143 amostras, demonstrou que 77% dos indivíduos estudados já haviam sido infectados pelo HCMV e, aproximadamente, 66% da amostra era da faixa etária de 2 a 4 anos, confirmando a aquisição da infecção pelo HCMV nos primeiros anos de vida43. Outros estudos comprovaram que a prevalência de anticorpos anti-HCMV inicia na infância e aumenta proporcionalmente com a idade, tendo maior predomínio de anticorpos após os 25 anos, estando esse aumento relacionado ao início da atividade sexual do indivíduo44.
Apesar da variação nas taxas de soroprevalência em populações dos diferentes continentes, elas não estão relacionadas à distribuição geográfica, mas ao nível socioeconômico1, como demonstrado na figura 1.
Nos Estados Unidos, aproximadamente 60% dos indivíduos acima de 6 anos de idade são infectados pelo HCMV. De acordo com Staras et al45, essa estimativa é compatível com os índices de soroprevalência em populações da Inglaterra e Alemanha, sendo superior ao observado no Canadá, e inferior ao registrado na Índia, Israel, Chile, Peru e Arábia Saudita.
Um estudo soroepidemiológico realizado na Palestina demonstrou elevada frequência de anticorpos IgG anti-HCMV em mais de 88% entre crianças, grávidas e recém-nascidos hospitalizados. A infecção por HCMV demonstrada na pesquisa de anticorpos IgM foi positiva em 11,5% das gestantes, 11,7% nas crianças e em 2% em recém-nascidos hospitalizados46.
Foram registrados elevados índices de soroprevalência de anticorpos para o HCMV em mulheres de diversos países africanos, como 87% em Gambia, 97,2% em Benin e 96% no Egito. No Sudão, foram registrados 72,2% de anticorpos em gestantes, sendo que nos países do sudeste africano são encontradas as maiores frequências de anticorpos para o HCMV47. Os percentuais sobre a soroprevalência de anticorpos relacionados ao continente euro-asiático ainda não foram estabelecidos como os de outros continentes, por essa razão não estão representados na figura 1.
ESTIMATIVA DE PREVALÊNCIA NO BRASIL
A maioria dos dados sobre a prevalência do HCMV tem origem em estudos conduzidos por grupos de pesquisadores da Região Sudeste. Embora no Brasil poucos registros tenham sido feitos a cerca da situação soroepidemiológica do HCMV, alguns trabalhos têm documentado que a idade média de aquisição do vírus no período pós-natal pode estar compreendida entre 5 meses e 18 anos de idade e que as mulheres em idade fértil são as mais vulneráveis à primoinfecção48.
Numa ampla análise realizada em 1.045 amostras de doadores de sangue do Estado de Santa Catarina, constatou-se que a prevalência de anticorpos IgG para o HCMV era de 96,45% e de 2,3% para anticorpos IgM, sugestivo de infecção recente49. A taxa de soroprevalência foi tão elevada quanto em outros grupos de regiões geográficas de países em desenvolvimento.
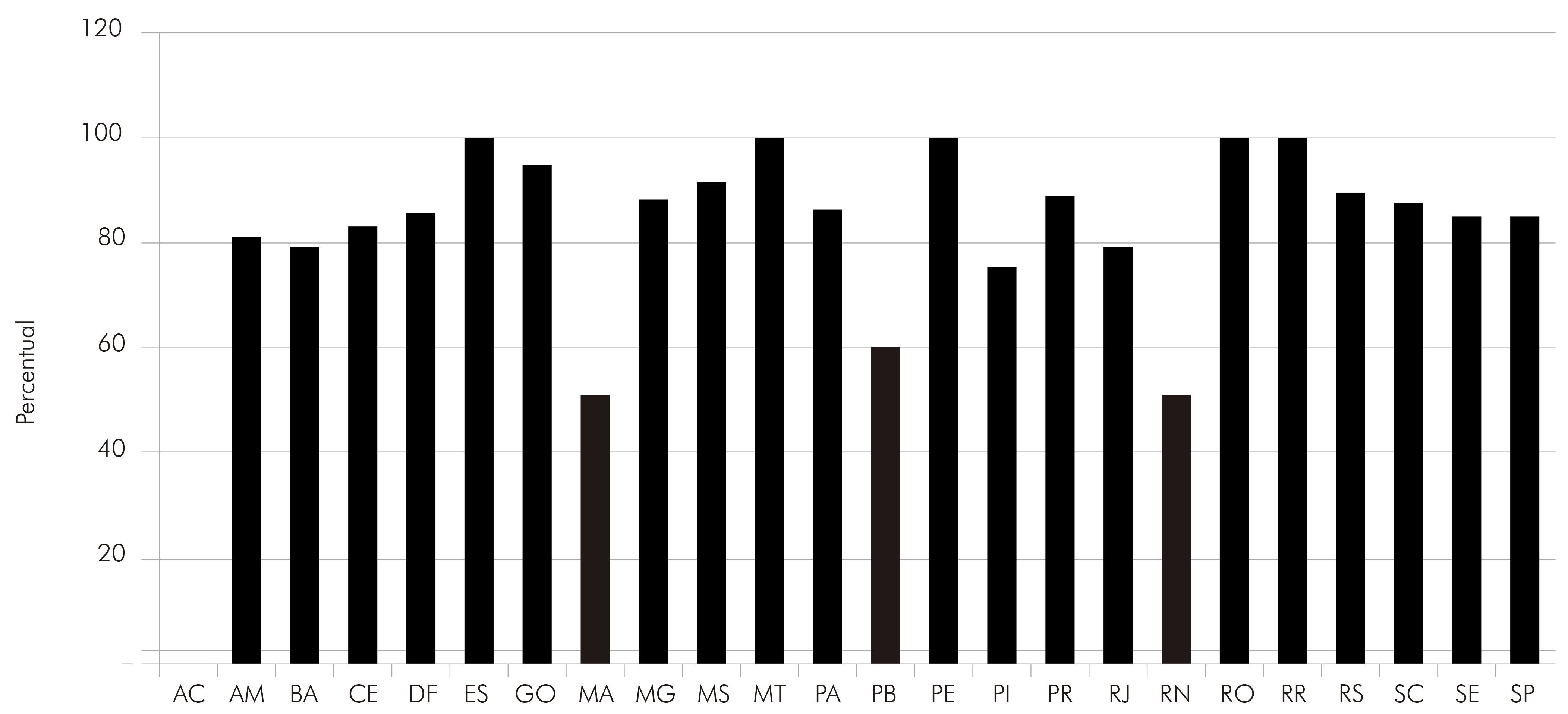
Serra et al50 compilaram dados de soroprevalência de anticorpos anti-HCMV de 4.620 amostras de gestantes e puérperas do Rio de Janeiro, São Paulo e de outros Estados brasileiros, sendo investigados anticorpos IgG e IgM anti-HCMV. Os índices de soroprevalência foram variáveis entre 50% e 100% nos diferentes Estados, e de acordo com os autores, os índices não deveriam refletir a realidade epidemiológica do vírus na análise, devido à diferença no tamanho amostral de cada Estado.
Por outro lado, quando esses dados são estratificados por tamanho amostral, percebe-se que, tanto em pequeno número de amostras quanto no elevado tamanho amostral, as frequências são elevadas em todos os casos.
O total de amostras procedentes de mulheres do Rio de Janeiro e de São Paulo estava compreendido entre 1.400 e 1.500 amostras, sendo esses valores bastante representativos para uma análise em um grupo específico. As frequências de anticorpos foram de 78,7% para as amostras do Rio de Janeiro e de 84,8%, para amostras de São Paulo. Nos Estados da Bahia, Distrito Federal, Minas Gerais, Santa Catarina e Rio Grande do Sul, o tamanho amostral variou de 95 a 150 amostras, sendo a menor frequência observada no Estado da Bahia, com 78%; e a maior, com 88% no Rio Grande do Sul. Os cinco Estados que apresentaram frequência igual a 100% foram: Espírito Santo, Mato Grosso, Pernambuco, Rondônia e Roraima, sendo que o tamanho amostral não foi representativo abaixo de 10 amostras (Figura 2). No Estado do Acre, a frequência foi igual a zero, em função de ter sido obtida apenas uma amostra e com sorologia negativa.
Na Região Norte do Brasil, Cidade de Belém, Estado do Pará, alguns trabalhados têm sido publicados estimando a soroprevalência e os índices de infecção do HCMV em diferentes grupos de indivíduos e faixas etárias.
Na década de 1990, Weirich20 utilizou dois métodos laboratoriais diferentes para avaliar índices de infecção congênita por HCMV, sendo observada variação nas taxas de infecção correspondentes a 2,1% pelo método sorológico e a 3,2% por isolamento viral. Também foi observado que 90,2% das puérperas possuíam anticorpos de infecção pregressa e menos de 1% apresentava infecção ativa por HCMV.
Estudos realizados por Silva et al15, em 2007, sobre a infecção por HCMV em pacientes pré e pós-transplante renal por métodos sorológico e molecular, constataram aumento na soroprevalência e nos índices de infecção após transplante do enxerto. No período pré-transplante, a frequência de anticorpos era de 78,5% e de 100% após o transplante, enquanto os índices de infecção ativa, antes do enxerto, eram de 7,1%, passando para 14,5% depois do transplante. Esses dados demonstram o fato de que a relação R-/D+ foi o fator crítico para o desenvolvimento da doença nesse grupo de pacientes. No mesmo ano, Medeiros et al28 realizaram a pesquisa viral para o HCMV em amostras sanguíneas, por métodos moleculares, em um grupo de 115 doadores de sangue da Fundação Centro de Hemoterapia e Hematologia do Pará, observando que 57% eram portadores do HCMV. Esses dados corroboram os achados de Silva et al15 quanto à relação R/D e reforçam a dificuldade de se ter doadores soronegativos para o HCMV.
Em 2011, Silva et al9 realizaram análises em pacientes de Belém com diferentes quadros de imunodeficiência e demonstraram que a prevalência de anticorpos para o HCMV era de 87% e o de infecção, de 13%. Outro estudo realizado por Silva et al51 sobre a distribuição de anticorpos anti-HCMV, em mulheres gestantes e em idade fértil da faixa etária de 14 a 29 anos, do Município de Juruti, Estado do Pará, demonstrou elevados índices de soroprevalência correspondentes a 87,8% e a 82,3%, respectivamente. Nesse estudo, não houve detecção de anticorpos de infecção aguda.
Dados mais recentes, publicados por Silva et al52, demonstraram que a soroprevalência em um grupo de 241 pacientes, vivendo com HIV/aids, era de aproximadamente 100% e somente 2,1% apresentavam infecção aguda pelo método sorológico; porém, na análise por métodos moleculares, mais de 50% dos pacientes apresentaram infecção ativa com carga viral >1.000 cópias/mL. Esses dados demonstram que os índices de infecção por HCMV são subestimados em decorrência do método utilizado, principalmente na ausência de manifestações clínicas.
Diante do cenário soroepidemiológico demonstrado nesta revisão, há a necessidade de estudos que visem à introdução de medidas profiláticas, como a vacina, para que haja mudança no perfil soroepidemiológico do vírus, principalmente nas populações economicamente menos favorecidas, onde as taxas de soroprevalência são elevadas.
CONCLUSÃO
Por meio do perfil soroepidemiológico do vírus, constata-se que não foi estabelecida uma taxa de soroprevalência do HCMV no Brasil; isso se deve, provavelmente, ao fato de que existem poucos dados publicados sobre o assunto. Embora os dados de Serra et al50 não devam ser considerados como representativos, em função do tamanho amostral, foi notório que, tanto no tamanho amostral baixo quanto alto, a soroprevalência, em sua maioria, era acima de 75%, o que é consideravelmente próximo dos valores de soroprevalência em países em desenvolvimento, ou seja, o HCMV é bastante prevalente e esse fato favorece sua transmissão.
É indiscutível que fatores, como a relação sexual desprotegida, multiplicidade de parceiros, a relação receptor-doador de órgãos, transfusões sanguíneas, entre outros, são críticos e contribuem para a transmissão da doença. Todos eles somados à endemicidade e aos fatores socioeconômicos das populações, principalmente aquelas de países em desenvolvimento, mantêm o perfil soroepidemiológico do vírus como um dos mais prevalentes no mundo.
É fundamental a realização de estudos de prevalência mais abrangentes que possam determinar os índices regionais de infecção por HCMV no Brasil, considerando-se, principalmente, fatores socioeconômicos e culturais próprios de cada região, assim como as características biológica epidemiológica desse agente e sua importância na saúde humana.
É importante a introdução de métodos moleculares como instrumento de análise para avaliar a magnitude da infecção e o caráter endêmico do vírus, pois, com esses métodos, é possível detectar índices de infecção ativa mesmo na ausência de sinais e sintomas clínicos e na presença de anticorpos de alta avidez.
Diante desse panorama, é necessária a introdução de medidas educativas e de saneamento básico, enquanto não são introduzidas medidas profiláticas eficazes, como a vacina, para que haja mudança no perfil epidemiológico da infecção, principalmente nas populações de baixa renda.