Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6223versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.8 no.2 Ananindeua jun. 2017
http://dx.doi.org/10.5123/s2176-62232017000200002
ARTÍCULO ORIGINAL
Influencia de la infección por Plasmodium vivax en los marcadores hematológicos y hepáticos en pacientes de un municipio de la Región Amazónica brasileña
1Universidade do Estado do Amazonas, Programa de Pós-Graduação em Medicina Tropical, Manaus, Amazonas, Brasil
2Fundação de Medicina Tropical Dr. Heitor Vieira Dourado, Manaus, Amazonas, Brasil
3Fundação Hospitalar de Hematologia e Hemoterapia do Amazonas, Departamento de Ensino e Pesquisa, Manaus, Amazonas, Brasil
4Universidade do Estado do Amazonas, Especialização em Enfermagem em Infectologia, Manaus, Amazonas, Brasil
5Universidade Federal do Amazonas, Instituto de Ciências Biológicas, Programa de Pós-Graduação em Imunologia Básica e Aplicada, Manaus, Amazonas, Brasil
OBJETIVO:
Evaluar las principales alteraciones hematológicas y de los marcadores hepáticos (AST y ALT) en pacientes infectados con Plasmodium vivax atendidos en el Instituto de Medicina Tropical de Coari, estado de Amazonas, Brasil.
MATERIALES Y MÉTODOS:
Se recolectaron muestras de 77 pacientes infectados con P. vivax y de 58 individuos control. El hemograma completo y los dosajes de alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST) se realizaron en la Fundación Hospitalaria de Hematología y Hemoterapia de Amazonas. Los análisis estadísticos se hicieron en el software GraphPad Prism v5.0.
RESULTADOS:
Se observó que la mayor parte de los pacientes, durante la colecta, presentó como quejas mialgia (92%), debilidad (87%), disnea (84%), escalofríos (75%) y fiebre (69%), además de haber tenido un aumento en las concentraciones de las enzimas hepáticas AST y ALT. En relación a las características hematológicas, se observaron leucopenia, plaquetopenia y disminución significativa en la concentración de la hemoglobina globular promedio y en el volumen globular promedio.
CONCLUSIÓN:
Los resultados sugieren que la presencia de esas alteraciones hematológicas y el aumento en la carga parasitaria no influyeron en el aparecimiento de casos graves de la enfermedad; pero, alteraciones en las concentraciones de AST y ALT pueden indicar comprometimiento hepático. Además, las redes de interacciones entre los componentes evaluados en la infección por P. vivax pueden utilizarse como herramienta de pronóstico en estudios futuros.
INTRODUCCIÓN
La malaria es causada por el protozoario del género Plasmodium sp., con cinco especies que infectan al hombre: Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale y Plasmodium knowlesi1,2,3. Tiene un proceso patogénico diferenciado, que se inicia luego de la inoculación del parásito en la corriente sanguínea por el insecto vector4,5. Es considerada un grande problema de salud pública en más de 100 países, siendo la enfermedad parasitaria de regiones tropicales y subtropicales que más problemas sociales y económicos causa en el mundo6,7,8.
Según estimativas de la Organización Mundial de Salud, cerca de 3,3 mil millones de personas (40% de la población mundial) residen en áreas de riesgo de transmisión de malaria. De ese contingente, aproximadamente 214 millones de personas fueron infectadas el año 2015, con 438.000 muertes7. En Brasil, cerca de 140.000 casos fueron informados, representando un 41,7% de los casos en las Américas. La Región Amazónica contribuye con cerca de 99,8% de las notificaciones, y la principal especia causadora de la malaria es el P. vivax (83,7% de los casos)9,10,11.
El ciclo sanguíneo ocurre de forma rápida, remodelando la estructura de las células infectadas y haciéndolas más rígidas12,13. Las alteraciones hematológicas, principalmente en la malaria grave, pueden tener un impacto negativo en la patogénesis de la enfermedad, alterando el pronóstico del huésped/paciente. Las principales alteraciones observadas en los individuos con malaria pueden ser la anemia grave, los trastornos de la coagulación, la trombocitopenia prominente y los cambios numéricos o funcionales de los leucocitos involucrando al bazo14.
El aumento de las enzimas hepáticas en la infección por P. vivax es sugestivo de comprometimiento hepático15. El relato de aumento, principalmente de las transaminasas alanina aminotransferasa (ALT) y aspartato aminotransferasa (AST), pueden evidenciar la necrosis de los hepatocitos durante el ciclo inicial de la infección en el huésped humano16,17.
Así, este estudio tuvo como objetivo evaluar las principales alteraciones hematológicas y de los marcadores hepáticos (AST y ALT) en pacientes diagnosticados con malaria vivax atendidos en el Instituto de Medicina Tropical de Coari (IMTC), estado de Amazonas, Brasil.
MATERIALES Y MÉTODOS
POBLACIÓN DEL ESTUDIO
El estudio se realizó en el IMTC (Instituto de Medicina Tropical de Coari, vinculado a la Secretaría Municipal de Salud de Coari y a la Fundación de Medicina Tropical Dr. Heitor Vieira Dourado). La población del estudio abarcó a adultos de ambos sexos, con edades variando entre 18 y 65 años. Los datos epidemiológicos y clínicos se obtuvieron por cuestionario estructurado, en el período de febrero a julio de 2012.
ASPECTOS ÉTICOS
Este estudio fue aprobado por el Comité de Ética en Investigación de la Fundación Hospitalaria de Hematología y Hemoterapia de Amazonas (Hemoam) el 31 de octubre de 2011, con el protocolo CAEE N° 0014.0.112.000-11, de acuerdo con la Resolución No466/12 del Consejo Nacional de Salud para investigaciones involucrando a seres humanos.
MUESTREO
La muestra estuvo compuestas por 77 pacientes con cuadro de malaria aguda no grave, causada por P. vivax, atendidos en el IMTC; y 58 individuos encuadrados en el grupo control (GC), elegidos aleatoriamente, con análisis de plasmodios negativo, con edad entre 18 y 65 años. Los pacientes e individuos del GC fueron negativos para los virus de la hepatitis B, la hepatitis C y el HIV por pruebas serológicas (inmunoensayo quimioluminiscente automatizado - ARCHITECT i2000SR Plus, Abbott Diagnostics), en el Laboratorio de Serología de la Hemoam.
DIAGNÓSTICO Y CONTEO DE LA PARASITEMIA
El diagnóstico de la malaria de los pacientes infectados con P. vivax se realizó con la prueba de la gota gruesa de sangre, como recomendado por el Ministerio de Salud18. La monoinfección por P. vivax se confirmó por la reacción en cadena de la polimerasa vía transcriptasa reversa (RT-PCR)19. La parasitemia se estimó por análisis semicuantitativo, con resultados expresados en: +/2 (40-60/100 parásitos por campo); + (1 parásito/campo); ++ (2-20 parásitos/campo); +++ (21-200 parásitos/campo); y ++++ (+200 parásitos/campo). Con los datos en cruces, la parasitemia en milímetro cúbico puede estimarse conforme descrito por el Ministerio de Salud18: +/2 = 200-300 parásitos, + = 301-500 parásitos; ++ = 501-10.000 parásitos; +++ = 10.001-100.000 parásitos; ++++ = 100.000 o más parásitos.
EVALUACIÓN CLÍNICA DE LOS PACIENTES
Los pacientes incluidos fueron evaluados, luego del diagnóstico, por enfermero y/o médico del IMTC. Los resultados obtenidos en la anamnesis y en el examen físico fueron insertados en el cuestionario propio del estudio.
PRUEBAS HEMATOLÓGICAS
Para la evaluación hematológica se realizó el recuento global de los leucocitos (GB), las células rojas (GR), las plaquetas (PLAQ), la determinación del hematocrito (HT), la dosificación de hemoglobina (HB) y los índices hematimétricos en el contador hematológico ABX Micros 60 (HORIBA).
PRUEBAS BIOQUÍMICAS - TRANSAMINASAS (AST Y ALT)
Los dopajes de las concentraciones de las transaminasas (AST y ALT) se realizaron con los kits Aspartato Aminotransferasa AEROSET c8000 (Abbott Laboratories) y Alanina Aminotransferasa AEROSET c8000 (Abbott Laboratories), con método automatizado utilizando equipamiento ARCHITECT c8000 System Clinical Biochemistry Analyzer (Abbott Diagnostics).
ANÁLISIS ESTADÍSTICOS Y REDES DE INTERACCIONES
Los análisis estadísticos de los datos se realizaron con el software GraphPad Prism v5.0 (San Diego, California, EE.UU.). Inicialmente se realizaron pruebas para verificar la normalidad de los datos a través de la prueba de Shapiro-Wilk. Todos los datos presentaron una distribución no paramétrica y, por lo tanto, los análisis comparativos de los valores entre dos o tres grupos de datos se hicieron con la prueba de Mann-Whitney o Kruskal-Wallis, respectivamente. La significación estadística se definió en ambos casos en p < 0,05.
La elaboración de las redes (networks) y la demostración de las interacciones complejas entre los parámetros evaluados se realizó a partir de la asociación de estos marcadores en cada grupo clínico. Se realizó la prueba de correlación de Spearman para evaluar la correlación significativa entre el valor absoluto y las concentraciones de los componentes, con la ayuda del software estadístico. Con los datos generados después del análisis de correlación, se realizó la construcción de las redes con el software Cytoscape v3.3.1 (Cytoscape Consortium San Diego, California, EE.UU.) La forma y el espesor de las líneas se ajustaron para representar los tipos de correlaciones existentes (positivas o negativas), además de la intensidad de estas correlaciones.
RESULTADOS
CARACTERÍSTICAS EPIDEMIOLÓGICAS, PARASITARIAS Y CLÍNICAS DE LOS PACIENTES DIAGNOSTICADOS COM MALARIA VIVAX
El promedio de edad fue superior en el grupo de pacientes (37,06 ± 14,32) en relación al GC (29,41 ± 8,45) (p = 0,003). Con relación al género, se observó predominio del sexo masculino (69%) en los pacientes con malaria, notándose lo inverso en el GC, en donde se observó mayor predominancia del sexo femenino (67%) (p < 0,0001). Se observó que la mayoría (51%) de los individuos relató haber tenido entre dos y cinco reinfecciones (Tabla 1). La parasitemia de +/2 e ++ fue observada en más de dos tercios de los pacientes (74%) con sintomatología básica de malaria. La mialgia fue la queja más frecuente entre los pacientes (92%), siguiendo la astenia (97%), cefalea (84%), escalofríos (75%) y fiebre (69%) al momento de la colecta (Tabla 2).
Tabla 1 - Datos epidemiológicos de los pacientes con malaria vivax y GC atendidos en el IMTC, estado de Amazonas, Brasil, en el período de febrero a julio de 2012
| Características demográficas y epidemiológicas | Grupo control (N = 58) | Pacientes con P. vivax (N = 77) |
|---|---|---|
| Masculino/femenino | 19/39 | 53/24 |
| Edad (promedio ± DP) | 29,41 ± 8,45 | 37,06 ± 14,32 |
| Número de episodios previos de malaria | - | 5,57 ± 6,77 (1-40) |
| Número de infecciones | ||
| Primoinfectado | - | 15 (19%) |
| <5 infecciones | - | 39 (51%) |
| >5 infecciones | - | 23 (30%) |
DP: Desvío estándar.
Tabla 2 - Características parasitarias y parámetros clínicos de los pacientes con malaria vivax y GC atendidos en el IMTC, estado de Amazonas, Brasil, en el período de febrero a julio de 2012
| Características parasitarias | Pacientes con P. vivax (N = 77) | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Parasitemia | Parásitos/mm3 | N | % | |||||||||||||||||
| 200-300 | +/2 | 20 | 26 | |||||||||||||||||
| 301-500 | + | 18 | 23 | |||||||||||||||||
| 501-10.000 | ++ | 37 | 48 | |||||||||||||||||
| 10.000-100.000 | +++ | 2 | 3 | |||||||||||||||||
| Parámetros clínicos | ||||||||||||||||||||
| N | % | |||||||||||||||||||
| Fiebre durante la colecta sanguínea | 52 | 69 | ||||||||||||||||||
| Mialgia en los últimos tres días | 71 | 92 | ||||||||||||||||||
| Disnea los últimos tres días | 64 | 84 | ||||||||||||||||||
| Escalofríos los últimos tres días | 58 | 75 | ||||||||||||||||||
| Debilidad los últimos tres días | 67 | 87 | ||||||||||||||||||
ALTERACIONES HEMATOLÓGICAS Y HEPÁTICAS (AST Y ALT) EN PACIENTES INFECTADOS POR Plasmodium vivax
Como sumarizado en la tabla 3, en los pacientes con malaria vivax, se observó disminución significativa de la GB, de la concentración de hemoglobina corpuscular promedio (MCHC), del volumen corpuscular medio (VCM), de PLAQ y de la variación en el tamaño de las plaquetas (PDW), además del aumento significativo del volumen plaquetario medio (VPM). Además, el análisis de los marcadores hepáticos demostró aumento significativo de la transaminasa AST (p = 0,0093), siendo significativamente superior en el grupo de pacientes con malaria vivax cuando comparado al GC. No se observó significado estadístico en los niveles de ALT entre los grupos estudiados.
Tabla 3 - Características hematológicas y hepáticas de los pacientes con malaria vivax y GC atendidos en el IMTC, estado de Amazonas, Brasil, en el período de febrero a julio de 2012
| Características | Grupo control (N= 58) | Pacientes con P. vivax (N = 77) | p* |
|---|---|---|---|
| Hematológicas (media ± DP) | |||
| HT (%) | 38,81 ± 4,93 | 38,43 ± 5,54 | 0,8224 |
| HB, niveles g/dL | 13,13 ± 1,66 | 13,11 ± 1,87 | 0,9982 |
| GB (unid. x 103/mm3) | 5,97 ± 1,66 | 4,54 ± 1,47 | < 0,0001 |
| GV (unid. x 106/mm3) | 4,12 ± 0,64 | 4,15 ± 0,60 | 0,5754 |
| VCM (fL) | 94,47 ± 7,16 | 89,09 ± 19,24 | 0,0272 |
| HCM (pg) | 31,96 ± 2,76 | 31,78 ± 2,96 | 0,3571 |
| CHCM (g/dL) | 33,73 ± 1,13 | 34,19 ± 1,16 | 0,0373 |
| RDW (%) | 13,99 ± 1,92 | 13,66 ± 2,40 | 0,9486 |
| PLAQ (unid. x 106/mm3) | 237,30 ± 84,04 | 118,30 ± 58,71 | < 0,0001 |
| VPM (fL) | 7,37 ± 2,24 | 8,44 ± 2,42 | 0,0007 |
| PDW (%) | 14,30 ± 2,31 | 13,41 ± 2,32 | 0,0111 |
| Hepáticas (promedio ± DP) | |||
| AST (U/L) | 20,14 ± 8,84 | 55,27 ± 252,40 | 0,0093 |
| ALT (U/L) | 20,66 ± 15,18 | 42,87 ± 167,50 | 0,4493 |
*Test no paramétrico Mann-Whitney; DE: Desvío estándar; HT: Hematocrito; HB: Hemoglobina; GB: Glóbulos blancos; GR: Glóbulos rojos; VCM: Volumen corpuscular medio; CMH: Concentración media de hemoglobina; CHCM: Concentración de hemoglobina corpuscular media; RDW: Variación en el tamaño de las hematíes; PLAQ: Plaquetas; VPM: Volumen plaquetario medio; PDW: Variación en el tamaño de las plaquetas; AST: Aspartato aminotransferasa; ALT: Alanina aminotransferasa.
ASPECTOS HEMATOLÓGICOS Y HEPÁTICOS (AST Y ALT) EN LOS SUBGRUPOS CLÍNICOS DE PACIENTES COM MALARIA VIVAX
Las alteraciones hematológicas y de los marcadores hepáticos (AST y ALT) fueron analizadas también en los subgrupos de pacientes con malaria vivax. Inicialmente, los pacientes fueron separados en grupos, de acuerdo con la parasitemia (baja [+/2 e +] y alta [++ e +++]) y el número de infecciones (primoinfectado, ≤5 infecciones y >5 infecciones). En relación a la parasitemia, se observó una disminución significativa de HT, HB y GR en los pacientes con alta carga parasitaria. Se comprobó un aumento significativo (p = 0,0197) en la variación del PDW de los pacientes primoinfectados en relación a los individuos con más de una infección (Tabla 4).
Tabla 4 - Características hematológicas y hepáticas de los subgrupos clínicos de pacientes con malaria vivax atendidos en el IMTC, estado de Amazonas, Brasil, en el período de febrero a julio de 2012
| Características | Pacientes con P. vivax | ||||||
|---|---|---|---|---|---|---|---|
| Parasitemia | Número de infecciones | ||||||
| Baja (N = 38) | Alta (N = 39) | p* | Primoinfectado (N = 15) | ≤5 infecciones (N = 27) | >5 infecciones (N = 35) | p† | |
| Hematológicas (promedio ± DP) | |||||||
| HT (%) | 40,52 ± 4,86 | 36,39 ± 5,46 | 0,0026 | 38,97 ± 6,33 | 38,72 ± 5,58 | 37,97 ± 5,29 | 0,7978 |
| HB, niveles g/dL | 13,80 ± 1,71 | 12,44 ± 1,79 | 0,0037 | 13,37 ± 1,94 | 13,21 ± 2,04 | 12,93 ± 1,73 | 0,7162 |
| GB (unid. x 103/mm3) | 4,57 ± 1,58 | 4,52 ± 1,37 | 0,5785 | 4,43 ± 1,55 | 4,39 ± 1,43 | 4,72 ± 1,49 | 0,6034 |
| GV (unid. x 106/mm3) | 4,31 ± 0,57 | 4,00 ± 0,60 | 0,0354 | 4,20 ± 0,67 | 4,11 ± 0,64 | 4,15 ± 0,56 | 0,8707 |
| VCM (fL) | 94,61 ± 9,09 | 91,46 ± 8,37 | 0,1517 | 93,60 ± 9,66 | 94,56 ± 9,57 | 91,57 ± 7,83 | 0,3754 |
| HCM (pg) | 32,21 ± 2,95 | 31,36 ± 2,96 | 0,1718 | 32,16 ± 3,37 | 32,36 ± 3,36 | 31,19 ± 2,39 | 0,4005 |
| CHCM (g/dL) | 34,12 ± 1,01 | 34,26 ± 1,31 | 0,3035 | 34,37 ± 1,02 | 34,19 ± 1,36 | 34,12 ± 1,09 | 0,8094 |
| RDW (%) | 13,66 ± 1,20 | 13,66 ± 1,59 | 0,5645 | 13,49 ± 1,04 | 13,48 ± 0,96 | 13,88 ± 1,78 | 0,7625 |
| PLAQ (unid. x 106/mm3) | 126,1 ± 57,75 | 110,7 ± 59,39 | 0,3010 | 100,3 ± 48,47 | 128,9 ± 64,02 | 117,8 ± 58,06 | 0,4619 |
| VPM (fL) | 8,41 ± 2,40 | 8,46 ± 2,46 | 0,7099 | 8,79 ± 2,67 | 8,34 ± 2,26 | 8,36 ± 2,48 | 0,7625 |
| PDW (%) | 13,34 ± 2,06 | 12,52 ± 4,24 | 0,5711 | 15,19 ± 2,59 | 12,54 ± 2,91 | 13,08 ± 2,01 | 0,0197 |
| Bioquímicas (promedio ± DP) | |||||||
| AST (U/L) | 86,87 ± 358,6 | 24,49 ± 12,98 | 0,5851 | 31,47 ± 16,06 | 23,19 ± 9,80 | 90,23 ± 374,0 | 0,2635 |
| ALT (U/L) | 65,74 ± 237,4 | 20,59 ± 14,29 | 0,7868 | 33,07 ± 32,81 | 18,41 ± 11,21 | 65,94 ± 247,2 | 0,4252 |
* Test no paramétrico Mann-Whitney; † Test no paramétrico Kruskal-Wallis; HT: Hematocrito; HB: Hemoglobina; GB: Glóbulos blancos; GR: Glóbulos rojos; VCM: Volumen corpuscular medio; CMH: Concentración media de hemoglobina; CHCM: Concentración de hemoglobina corpuscular media; RDW: Variación en el tamaño de las hematíes; PLAQ: Plaquetas; VPM: Volumen plaquetario medio; PDW: Variación en el tamaño de las plaquetas; AST: Aspartato aminotransferasa; ALT: Alanina aminotransferasa.
INTERACCIONES ENTRE LOS MARCADORES HEMATOLÓGICOS Y HEPÁTICOS (AST Y ALT) EN LA MALARIA VIVAX
Los individuos no infectados presentaron una red con varias interacciones entre los marcadores hematológicos y hepáticos (AST y ALT) evaluados. El hematocrito, la hemoglobina y los glóbulos rojos estaban fuertemente asociados, mientras que hubo una fuerte correlación entre el VCM y la MCHC, además del ALT y del AST. Los demás marcadores se correlacionaron de forma moderada y débil, con la presencia de correlaciones negativas entre PLAQ, VPM, PDW, GB, VCM y variación en el tamaño de los hematíes (RDW) en el GC (Figura 1A). Cuando se observaron los datos de correlación de los pacientes con malaria vivax, se notó la pérdida de correlaciones moderadas entre los marcadores y la ausencia de interacción del PDW con los demás componentes analizados. Además, el grupo infectado con P. vivax presentó aumento en las interacciones GB, GR, HB, VCM y PLAQ (Figura 1B).
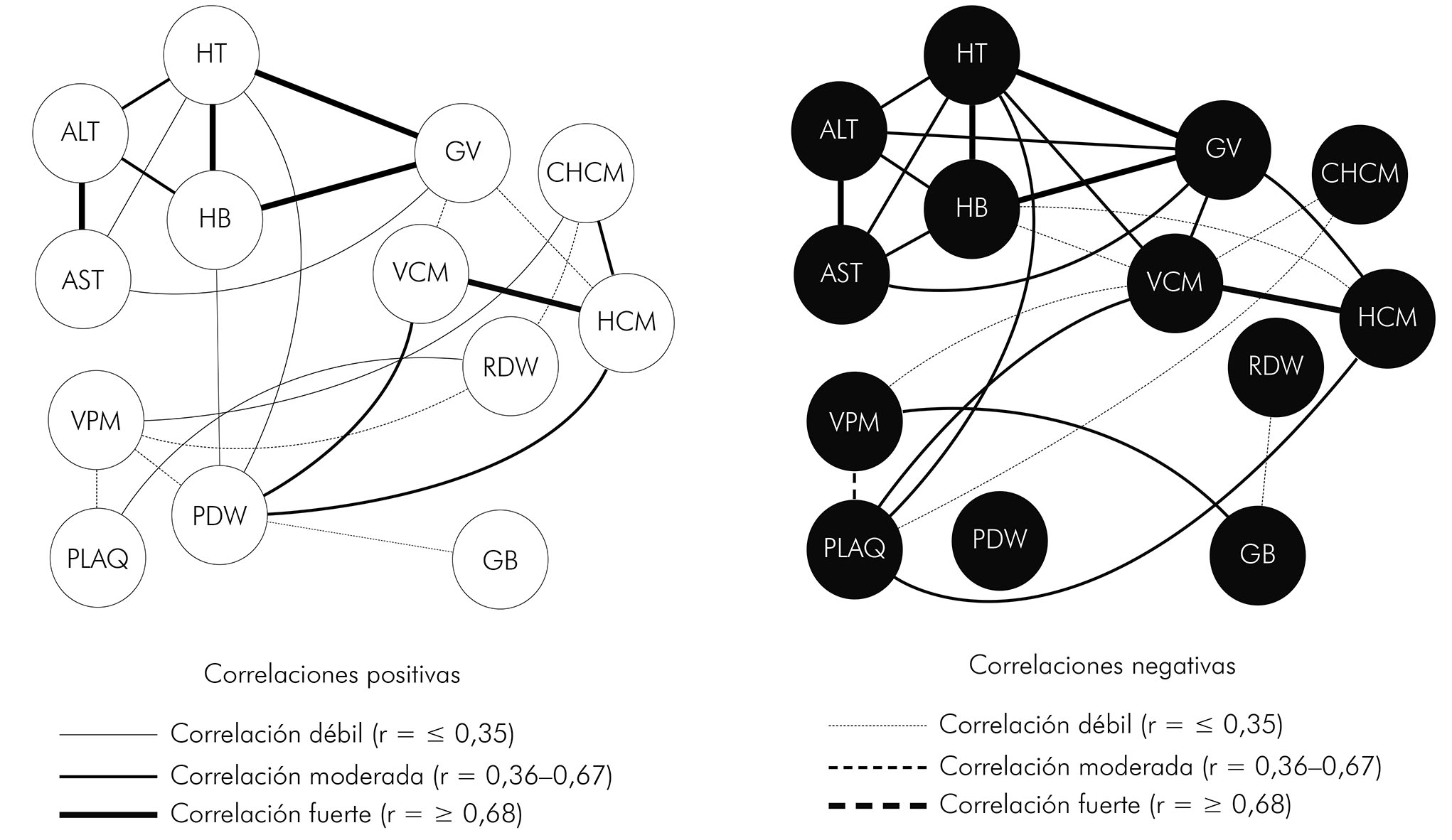
Los componentes hematológicos (HT: Hematocrito; HB: Hemoglobina; GB: Glóbulos blancos; GR: Glóbulos rojos; VCM: Volumen corpuscular medio; CMH: Concentración media de hemoglobina; CHCM: Concentración de hemoglobina corpuscular media; RDW: Variación en el tamaño de los hematíes; PLAQ: Plaquetas; VPM: Volumen plaquetario medio; PDW: Variación en el tamaño de las plaquetas) y hepáticos (AST: Aspartato aminotransferasa; ALT: Alanina aminotransferasa) fueron analizados en sangre total y suero de pacientes infectados con P. vivax e individuos control sin la enfermedad. Cada línea de ligación representa una correlación significativa entre un par de marcadores. Las líneas continuas representan correlaciones positivas, mientras las líneas punteadas representan correlaciones negativas (p < 0,05). El grado de significancia se representa por la espesura de la línea. Las correlaciones se obtuvieron por medio del test de Spearman; los valores de "r" y "p" fueron utilizados para clasificar las conexiones como débil (r ≤ 0,35, p < 0,05), moderada (r = 0,36-0,67, p = 0,001) o forte (r ≥ 0,68, p < 0,0001). La ausencia de la línea indica la no existencia de correlación.
Figura 1 - Redes de interacciones entre los marcadores hematológicos y hepáticos en el grupo control y pacientes con P. vivax atendidos en el IMTC, estado de Amazonas, Brasil, en el período de febrero a julio de 2012
DISCUSIÓN
La malaria es una enfermedad febril aguda, con proceso patogénico diferenciado y relacionado a los factores biológicos del parásito y del huésped. En este trabajo, se describieron las alteraciones clínicas, hematológicas y hepáticas (AST y ALT) causadas por la infección por P. vivax en pacientes diagnosticados con malaria y que no habían iniciado el tratamiento recomendado por el Ministerio de Salud.
La sintomatología básica de la malaria fue observada en los pacientes estudiados, y las quejas más frecuentes fueron mialgia, debilidad, cefalea, escalofrío y fiebre. Para Costa et al.20, los signos y síntomas de la malaria están constituidos principalmente por una tríada clásica compuesta por fiebre-escalofrío-cefalea. Sin embargo, Rosas21 alertó sobre la familiaridad de estos síntomas con otras enfermedades febriles, como el dengue, la fiebre Chikungunya y la fiebre por Zika virus. En el estudio de Franklin et al.22, realizado en la ciudad de Manaus, estado de Amazonas, se observó que los pacientes infectados con P. vivax fueron acometidos principalmente por fiebre, mialgia, escalofrío y cefalea, lo que corrobora con los hallazgos del presente estudio, con excepción de fiebre y cefalea, que fueron poco reportadas. A pesar de que los pacientes incluidos en este estudio no presentan sintomatología de malaria grave, estudios recientes han asociado la infección por P. vivax con casos graves y complicaciones en la malaria9,23,24.
Los cuadros anémicos son comunes en pacientes con malaria grave ocasionada por P. vivax. En general, los valores de HT, HB y GR están disminuidos en estos individuos17,23,25. En algunos casos, los pacientes son sometidos a transfusión de concentrados de hematíes debido a la gravedad de la anemia26. Aunque la literatura indique los procesos anémicos en la malaria, en este estudio, el GR, el HT, la HB y los índices hematimétricos presentaron valores similares entre los grupos estudiados, con excepción del VCM, que fue menor en el grupo de pacientes con malaria vivax. El cuantitativo similar de estos componentes entre los grupos puede sugerir el mantenimiento de las interacciones estudiadas. Los valores de HT, HB y del número de eritrocitos fueron menores sólo en los individuos con alta carga parasitaria, lo que ya es conocido y descrito en la literatura17,23. Se sabe que el aumento de la carga parasitaria puede acarrear disminución en el número de GR, debido a la ruptura de esas células durante los ciclos asexuados, al secuestro de hematíes infectados por el bazo y a la formación de rosetas27,28,29.
Los valores de GB fueron menores en el grupo de pacientes con malaria. Los datos de la literatura describen la reducción en el cuantitativo de GB en pacientes con malaria30,31. Sin embargo, en individuos con malaria grave infectados con P. vivax, se observó un aumento en el número de leucocitos26. En el estudio de Tangpukdee et al.32, se expuso que los GB fueron menores que los GR en individuos con P. vivax, con aproximación de los valores normales observados en el grupo no infectado, después del tratamiento, lo que viene contra los datos observados en este estudio. La disminución de los GB se observa al inicio de la infección, con leucocitosis transitoria durante los paroxismos febriles de la malaria, estando relacionada con la carga parasitaria33,34.
La trombocitopenia se describió en las muestras de pacientes con malaria en el presente estudio, con disminución del VPM y aumento de la PDW, incluso en el grupo de pacientes primoinfectados. La plaquetopenia es común en la patogénesis de la malaria, principalmente en la infección por P. vivax17,35. Los pacientes infectados con P. vivax, en general, presentan una disminución en el número de PLAQ, debido a la activación de la cascada de coagulación, además de los procesos inflamatorios inherentes a la enfermedad24,36. Este descenso en el cuantitativo de PLAQ y en la PDW, asociado al aumento del VPM, pueden explicar el aumento de las correlaciones en el análisis de red entre los componentes asociados a las PLAQ, con pérdida de interacción de la PDW con los demás marcadores hematológicos y hepáticos estudiados.
Los datos de este estudio sugieren además un compromiso hepático en estos pacientes, con aumento de las enzimas hepáticas AST y ALT. Datos similares fueron observados por Onyesom y Onyemakonor15 y Elbadawi et al.37, que describieron el aumento de las enzimas en pacientes de Nigeria y en mujeres embarazadas de Sudán infectadas con P. falciparum. El relato de aumento de las transaminasas AST y ALT se observó en pacientes con P. vivax, evidenciando la necrosis de los hepatocitos durante la infección16,17. Los estudios previos realizados con pacientes con malaria grave en la Fundación de Medicina Tropical del Amazonas y del Hospital São Gabriel, en el estado de Rondônia, describieron aumento de AST y ALT, corroborando los resultados del presente estudio23,26,38. Es importante destacar que, a pesar del aumento en las transaminasas AST y ALT en el grupo de pacientes con malaria vivax, no se observó aumento en las interacciones de esos marcadores con los componentes hematológicos, lo que excluye de esa forma esos componentes como potenciales biomarcadores de la infección y del agravamiento de la enfermedad.
CONCLUSIÓN
Los resultados demostraron que formas diferentes de abordaje de los marcadores hematológicos y hepáticos pueden ser útiles para la evaluación de los pacientes. Además, reforzaron que la ganancia y/o pérdida de interacción entre los componentes evaluados en la infección por P. vivax pueden ser utilizados como herramienta de pronóstico en estudios futuros; mientras la disminución en los valores de HT, HB y GB en los individuos con alta parasitemia evidenciaron la utilización de esos marcadores como instrumento para el acompañamiento de la evolución del cuadro clínico y de formas graves de la malaria vivax.
AGRADECIMIENTOS
Al IMTC y a la Hemoam, por el auxilio en el reclutamiento de los pacientes y colaboración en la realización de los exámenes de laboratorio.
REFERENCIAS
1 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância Epidemiológica. Ações de controle da Malária: manual para profissionais de Saúde na Atenção Básica. Brasília: Ministério da Saúde; 2006. 52 p. (Série A. Normas e manuais técnicos). [Link] [ Links ]
2 Cox-Singh J, Davis TME, Lee K-S, Shamsul SSG, Matusop A, Ratnam S, et al. Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening. Clin Infect Dis. 2008 Jan;46(2):165-71. Doi: 10.1086/524888 [Link] [ Links ]
3 Crawley J, Chu C, Mtove G, Nosten F. Malaria in children. Lancet. 2010 Apr;375(9724):1468-81. Doi: 10.1016/S0140-6736(10)60447-3 [Link] [ Links ]
4 Miller LH, Baruch DI, Marsh K, Doumbo OK. The pathogenic basis of malaria. Nature. 2002 Feb;415(6872):673-9. Doi: 10.1038/415673a [Link] [ Links ]
5 Schofield L, Grau GE. Immunological processes in malaria pathogenesis. Nat Rev Immunol. 2005 Sep;5(9):722-35. Doi: 10.1038/nri1686 [Link] [ Links ]
6 Greenwood BM, Fidock DA, Kyle DE, Kappe SHI, Alonso PL, Collins FH, et al. Malaria: progress, perils, and prospects for eradication. J Clin Invest. 2008 Apr;118(4):1266-76. Doi: 10.1172/JCI33996 [Link] [ Links ]
7 World Health Organization. World Malaria Report. Geneva: WHO; 2015. [Link] [ Links ]
8 Parise EV. Malária grave em Palmas, Estado do Tocantins: relato de caso. Rev Soc Bras Med Trop. 2009 jul-ago;42(4):463-8. Doi: 10.1590/S0037-86822009000400021 [Link] [ Links ]
9 Oliveira-Ferreira J, Lacerda MVG, Brasil P, Ladislau JLB, Tauil PL, Daniel-Ribeiro CT. Malaria in Brazil: an overview. Malar J. 2010 Apr; 9:115. Doi: 10.1186/1475-2875-9-115 [Link] [ Links ]
10 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Situação epidemiológica da malária no Brasil, 2012 e 2013. Bol Epidemiol. 2015;46(43):1-5. [Link] [ Links ]
11 Sampaio VS, Siqueira AM, Alecrim MGC, Mourão MPG, Marchesini PB, Albuquerque BC, et al. Malaria in the State of Amazonas: a typical Brazilian tropical disease influenced by waves of economic development. Rev Soc Bras Med Trop. 2015 Jun;48 Suppl 1:4-11. Doi: 10.1590/0037-8682-0275-2014 [Link] [ Links ]
12 Cowman AF, Berry D, Baum J. The cellular and molecular basis for malaria parasite invasion of the human red blood cell. J Cell Biol. 2012 Sep;198(6):961-71. Doi: 10.1083/jcb.201206112 [Link] [ Links ]
13 Prudêncio M, Mota MM, Mendes AM. A toolbox to study liver stage malaria. Trends Parasitol. 2011 Dec;27(12):565-74. Doi: 10.1016/j.pt.2011.09.004 [Link] [ Links ]
14 Akinosoglou KS, Solomou EE, Gogos CA. Malaria: a haematological disease. Hematology. 2012 Mar;17(2):106-14. Doi: 10.1179/102453312X13221316477336 [Link] [ Links ]
15 Onyesom I, Onyemakonor N. Levels of parasitaemia and changes in some liver enzymes among malarial infected patients in Edo-Delta Region of Nigeria. Curr Res J Biol Sci. 2011 Mar;3(2):78-81. [Link] [ Links ]
16 Kochar DK, Singh P, Agarwal P, Kochar SK, Pokharna R, Sareen PK. Malarial hepatitis. J Assoc Physicians India. 2003 Nov;51:1069-72. [Link] [ Links ]
17 Lacerda MVG, Mourão MPG, Alexandre MAA, Siqueira AM, Magalhães BML, Martinez-Espinosa FE, et al. Understanding the clinical spectrum of complicated Plasmodium vivax malaria: a systematic review on the contributions of the Brazilian literature. Malar J. 2012 Jan;11:12. Doi: 10.1186/1475-2875-11-12 [Link] [ Links ]
18 Ministério da Saúde (BR). Secretaria de Vigilância Epidemiológica. Manual de diagnóstico laboratorial da malária. Brasília: Ministério da Saúde; 2005. [Link] [ Links ]
19 Perandin F, Manca N, Calderaro A, Piccolo G, Galati L, Ricci L, et al. Development of a real-time PCR assay for detection of Plasmodium falciparum, Plasmodium vivax, and Plasmodium ovale for routine clinical diagnosis. J Clin Microbiol. 2004 Mar;42(3):1214-9. Doi: 10.1128/JCM.42.3.1214-1219.2004 [Link] [ Links ]
20 Costa AP, Bressan CS, Pedro RS, Valls-de-Souza R, Silva S, Souza PR, et al. Diagnóstico tardio de malária em área endêmica de dengue na extra-Amazônia Brasileira: experiência recente de uma unidade sentinela no estado do Rio de Janeiro. Rev Soc Bras Med Trop. 2010 set-out;43(5):571-4. Doi: 10.1590/S0037-86822010000500020 [Link] [ Links ]
21 Rosas MJ. Prevenção da malária. Rev Port Clin Geral. 2003;19(3):263-6. [Link] [ Links ]
22 Franklin BS, Vitorino BLF, Coelho HC, Menezes-Neto A, Santos MLS, Campos FMF, et al. Plasma circulating nucleic acids levels increase according to the morbidity of Plasmodium vivax malaria. PLoS One. 2011 Jan;6(5):e19842. Doi: 10.1371/journal.pone.0019842 [Link] [ Links ]
23 Andrade BB, Reis-Filho A, Souza-Neto SM, Clarêncio J, Camargo LMA, Barral A, et al. Severe Plasmodium vivax malaria exhibits marked inflammatory imbalance. Malar J. 2010 Jan;9:13. Doi: 10.1186/1475-2875-9-13 [Link] [ Links ]
24 Lacerda MVG, Mourão MPG, Coelho HCC, Santos JB. Thrombocytopenia in malaria: who cares? Mem Inst Oswaldo Cruz. 2011 Aug;106 Suppl 1:52-63. Doi: 10.1590/S0074-02762011000900007 [Link] [ Links ]
25 Fernandes AAM, Carvalho LJM, Zanini GM, Ventura AMRS, Souza JM, Cotias PM, et al. Similar cytokine responses and degrees of anemia in patients with Plasmodium falciparum and Plasmodium vivax infections in the Brazilian Amazon region. Clin Vaccine Immunol. 2008 Apr;15(4):650-8. Doi: 10.1128/CVI.00475-07 [Link] [ Links ]
26 Alexandre MA, Ferreira CO, Siqueira AM, Magalhães BL, Mourão MPG, Lacerda MV, et al. Severe Plasmodium vivax malaria, Brazilian Amazon. Emerg Infect Dis. 2010 Oct;16(10): 1611-4. Doi: 10.3201/eid1610.100685 [Link] [ Links ]
27 Miller LH, Ackerman HC, Su X, Wellems TE. Malaria biology and disease pathogenesis: insights for new treatments. Nat Med. 2013 Feb;19(2): 156-67. Doi: 10.1038/nm.3073 [Link] [ Links ]
28 Lacerda MVG, Fragoso SCP, Alecrim MGC, Alexandre MAA, Magalhães BML, Siqueira AM, et al. Postmortem characterization of patients with clinical diagnosis of Plasmodium vivax malaria: to what extent does this parasite kill? Clin Infect Dis. 2012 Oct;55(8):e67-74. Doi: 10.1093/cid/cis615 [Link] [ Links ]
29 Carvalho BO, Lopes SCP, Nogueira PA, Orlandi PP, Bargieri DY, Blanco YC, et al. On the cytoadhesion of Plasmodium vivax-infected erythrocytes. J Infect Dis. 2010 Aug;202(4): 638-47. Doi: 10.1086/654815 [Link] [ Links ]
30 Rodríguez-Morales AJ, Sánchez E, Arria M, Vargas M, Piccolo C, Colina R, et al. White blood cell counts in Plasmodium vivax malaria. J Infect Dis. 2005 Nov;192(9):1675-6. Doi: 10.1086/496993 [Link] [ Links ]
31 Tchinda GG, Atashili J, Achidi EA, Kamga HL, Njunda AL, Ndumbe PM. Impact of malaria on hematological parameters in people living with HIV/AIDS attending the Laquintinie Hospital in Douala, Cameroon. PLoS One. 2012 Jul;7(7):e40553. Doi: 10.1371/journal.pone.0040553 [Link] [ Links ]
32 Tangpukdee N, Yew H-S, Krudsood S, Punyapradit N, Somwong W, Looareesuwan S, et al. Dynamic changes in white blood cell counts in uncomplicated Plasmodium falciparum and P. vivax malaria. Parasitol Int. 2008 Dec;57(4):490-4. Doi: 10.1016/j.parint.2008.06.005 [Link] [ Links ]
33 McKenzie FE, Prudhomme WA, Magill AJ, Forney JR, Permpanich B, Lucas C, et al. White blood cell counts and malaria. J Infect Dis. 2005 Jul;192(2): 323-30. Doi: 10.1086/431152 [Link] [ Links ]
34 Kotepui M, Phunphuech B, Phiwklam N, Chupeerach C, Duangmano S. Effect of malarial infection on haematological parameters in population near Thailand-Myanmar border. Malar J. 2014 Jun;13:218. Doi: 10.1186/1475-2875-13-218 [Link] [ Links ]
35 Kochar DK, Das A, Kochar A, Middha S, Acharya J, Tanwar GS, et al. Thrombocytopenia in Plasmodium falciparum, Plasmodium vivax and mixed infection malaria: a study from Bikaner (Northwestern India). Platelets. 2010 Nov;21(8): 623-7. Doi: 10.3109/09537104.2010.505308 [Link] [ Links ]
36 Francischetti IMB, Seydel KB, Monteiro RQ. Blood coagulation, inflammation, and malaria. Microcirculation. 2008 Feb;15(2):81-107. Doi: 10.1080/10739680701451516 [Link] [ Links ]
37 Elbadawi NEE, Mohamed MI, Elzaki H, Ounsa MAAGE, Mohamed EY, Ibrahim EK. The effect of malaria on biochemical liver function parameters in Sudanese pregnant women. J Physiobiochem Metab. 2012 Sep;1:2. Doi: 10.4172/2324-8793.1000101 [Link] [ Links ]
38 Mendonça VRR, Queiroz ATL, Lopes FM, Andrade BB, Barral-Netto M. Networking the host immune response in Plasmodium vivax malaria. Malar J. 2013 Jan;12:69. Doi: 10.1186/1475-2875-12-69 [Link] [ Links ]
APOYO FINANCIERO Fundación de Amparo a la Investigación del Estado de Amazonas (Fapeam) y Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq).
3Se refiere al doi: 10.5123/S2176-62232017000200002, publicado originalmente en portugués. Traducido por: Lota Moncada
Cómo citar este artículo / How to cite this article: Costa AG, Tarragô AM, Garcia NP, Pimentel JPD, Neves WLL, Melo GZS, et al. Influencia de la infección por Plasmodium vivax en los marcadores hematológicos y hepáticos en pacientes de un municipio de la Región Amazónica brasileña. Rev Pan-Amaz Saude. 2017 abr-jun;8(2):1-9. Doi: http://dx.doi.org/10.5123/S2176-62232017000200002
Recibido: 15 de Agosto de 2016; Aprobado: 09 de Diciembre de 2016











 texto en
texto en 


