INTRODUÇÃO
A malária é causada pelo protozoário do gênero Plasmodium sp., com cinco espécies que infectam o homem: Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale e Plasmodium knowlesi1,2,3. Possui processo patogênico diferenciado, que se inicia após a inoculação do parasito na corrente sanguínea pelo inseto vetor4,5. É considerada como um grave problema de saúde pública em mais de 100 países, sendo a doença parasitária de regiões tropicais e subtropicais que mais causa problemas sociais e econômicos no mundo6,7,8.
Segundo estimativas da Organização Mundial da Saúde, cerca de 3,3 bilhões de pessoas (40% da população mundial) residem em áreas de risco de transmissão da malária. Desse contingente, aproximadamente 214 milhões de pessoas foram infectadas no ano de 2015, com 438.000 mortes7. No Brasil, cerca de 140.000 casos foram notificados, representando 41,7% dos casos nas Américas. A Região Amazônica contribui com cerca de 99,8% das notificações, e a principal espécie causadora da malária é o P. vivax (83,7% dos casos)9,10,11.
O ciclo sanguíneo ocorre de forma rápida, remodelando a estrutura das células infectadas e tornando-as mais rígidas12,13. Alterações hematológicas, principalmente na malária grave, podem ter um impacto negativo na patogênese da doença, podendo alterar o prognóstico do hospedeiro/paciente. As principais alterações observadas nos indivíduos com malária podem ser a anemia grave, os distúrbios da coagulação, a trombocitopenia proeminente e as alterações numéricas ou funcionais de leucócitos com envolvimento do baço14.
O aumento das enzimas hepáticas na infecção por P. vivax é sugestivo de comprometimento hepático15. O relato de aumento, principalmente das transaminases alanina aminotransferase (ALT) e aspartato aminotransferase (AST), podem evidenciar a necrose dos hepatócitos durante o ciclo inicial da infecção no hospedeiro humano16,17.
Assim, este estudo teve por objetivo avaliar as principais alterações hematológicas e dos marcadores hepáticos (AST e ALT) em pacientes diagnosticados com malária vivax atendidos no Instituto de Medicina Tropical de Coari (IMTC), estado do Amazonas, Brasil.
MATERIAIS E MÉTODOS
POPULAÇÃO DO ESTUDO
O estudo foi realizado no IMTC (vinculado à Secretaria Municipal de Saúde de Coari e à Fundação de Medicina Tropical Dr. Heitor Vieira Dourado). A população de estudo compreendeu adultos, de ambos os sexos, com idade variando entre 18 e 65 anos. Os dados epidemiológicos e clínicos foram obtidos por meio de questionário estruturado, no período de fevereiro a julho de 2012.
ASPECTOS ÉTICOS
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Fundação Hospitalar de Hematologia e Hemoterapia do Amazonas (Hemoam) em 31 de outubro de 2011, com o protocolo CAEE n° 0014.0.112.000-11, estando de acordo com a Resolução no 466/12 do Conselho Nacional de Saúde para pesquisas envolvendo seres humanos.
AMOSTRAGEM
A amostra foi composta por 77 pacientes com quadro de malária aguda não grave, causada por P. vivax, atendidos no IMTC; e 58 indivíduos enquadrados no grupo controle (GC), escolhidos ao acaso, com pesquisa de plasmódios negativa, com idade entre 18 e 65 anos. Os pacientes e indivíduos do GC foram negativos para os vírus da hepatite B, da hepatite C e HIV por testes sorológicos (imunoensaio quimioluminescente automatizado - ARCHITECT i2000SR Plus, Abbott Diagnostics), no Laboratório de Sorologia da Hemoam.
DIAGNÓSTICO E CONTAGEM DA PARASITEMIA
O diagnóstico da malária dos pacientes infectados com P. vivax foi realizado pelo exame da gota espessa de sangue, como recomendado pelo Ministério da Saúde18. A monoinfecção por P. vivax foi confirmada por reação em cadeia da polimerase via transcriptase reversa (RT-PCR)19. A parasitemia foi estimada pela análise semiquantitativa, com os resultados expressos em: +/2 (40-60/100 parasitos por campo); + (1 parasito/campo); ++ (2-20 parasitos/campo); +++ (21-200 parasitos/campo); e ++++ (+200 parasitas/campo). Com os dados em cruzes, a parasitemia em milímetro cúbico pode ser estimada conforme descrito pelo Ministério da Saúde18: +/2 = 200-300 parasitos, + = 301-500 parasitos; ++ = 501-10.000 parasitos; +++ = 10.001-100.000 parasitos; ++++ = 100.000 ou mais parasitos.
AVALIAÇÃO CLÍNICA DOS PACIENTES
Os pacientes incluídos foram avaliados, após o diagnóstico por enfermeiro e/ou médico do IMTC. Os resultados obtidos na anamnese e no exame físico foram inseridos no questionário próprio do estudo.
TESTES HEMATOLÓGICOS
Para a avaliação hematológica, foi realizada a contagem global dos leucócitos (GB), células vermelhas (GV), das plaquetas (PLAQ), determinação do hematócrito (HT), dosagem de hemoglobina (HB) e índices hematimétricos em contador hematológico ABX Micros 60 (HORIBA).
TESTES BIOQUÍMICOS - TRANSAMINASES (AST E ALT)
As dosagens das concentrações das transaminases (AST e ALT) foram realizadas com os kits Aspartate Aminotransferase AEROSET c8000 (Abbott Laboratories) e Alanine Aminotransferase AEROSET c8000 (Abbott Laboratories), com método automatizado utilizando equipamento ARCHITECT c8000 System Clinical Biochemistry Analyzer (Abbott Diagnostics).
ANÁLISES ESTATÍSTICAS E REDES DE INTERAÇÕES
As análises estatísticas dos dados foram realizadas com o software GraphPad Prism v5.0 (San Diego, Califórnia, EUA). Inicialmente foram realizados testes para verificar a normalidade dos dados por intermédio do teste de Shapiro-Wilk. Todos os dados apresentaram uma distribuição não paramétrica, e, portanto, as análises comparativas dos valores entre dois ou três grupos de dados foram realizadas com o teste de Mann-Whitney ou Kruskal-Wallis, respectivamente. A significância estatística foi definida em ambos os casos em p < 0,05.
A elaboração das redes (networks) e demonstração das interações complexas entre os parâmetros avaliados foi realizada a partir da associação desses marcadores em cada grupo clínico. Foi realizado o teste de correlação de Spearman para avaliar a correlação significativa entre o valor absoluto e as concentrações dos componentes, com o auxílio do software estatístico. Com os dados gerados após a análise de correlação, foi realizada a construção das redes com o software Cytoscape v3.3.1 (Cytoscape Consortium San Diego, Califórnia, EUA). A forma e a espessura das linhas foram ajustadas para representar os tipos de correlações existentes (positivas ou negativas), além da intensidade dessas correlações.
RESULTADOS
CARACTERÍSTICAS EPIDEMIOLÓGICAS, PARASITÁRIAS E CLÍNICAS DOS PACIENTES DIAGNOSTICADOS COM MALÁRIA VIVAX
A média de idade foi maior no grupo de pacientes (37,06 ± 14,32) em relação ao GC (29,41 ± 8,45) (p = 0,003). Quanto ao gênero, foi observado predomínio do sexo masculino (69%) nos pacientes com malária, sendo notado o inverso no GC, onde foi observada maior predominância do sexo feminino (67%) (p < 0,0001). Observou-se que a maioria (51%) dos indivíduos relatou ter tido entre duas e cinco reinfecções (Tabela 1). A parasitemia de +/2 e ++ foi observada em mais de dois terços dos pacientes (74%) com sintomatologia básica da malária. Mialgia foi a queixa mais frequente entre os pacientes (92%), seguindo-se de astenia (97%), cefaleia (84%), calafrios (75%) e febre (69%) no momento da coleta (Tabela 2).
Tabela 1 - Dados epidemiológicos dos pacientes com malária vivax e grupo controle atendidos no IMTC, estado do Amazonas, Brasil, no período de fevereiro a julho de 2012
| Características demográficas e epidemiológicas | Grupo controle (N = 58) | Pacientes com P. vivax (N = 77) |
|---|---|---|
| Masculino/Feminino | 19/39 | 53/24 |
| Idade (média ± DP) | 29,41 ± 8,45 | 37,06 ± 14,32 |
| Número de episódios prévios de malária | - | 5,57 ± 6,77 (1-40) |
| Número de infecções | ||
| Primoinfectado | - | 15 (19%) |
| <5 infecções | - | 39 (51%) |
| >5 infecções | - | 23 (30%) |
DP: Desvio padrão.
Tabela 2 - Características parasitológicas e parâmetros clínicos dos pacientes com malária vivax e grupo controle atendidos no IMTC, estado do Amazonas, Brasil, no período de fevereiro a julho de 2012
| Características parasitológicas | Pacientes com P. vivax (N = 77) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Parasitemia | Parasitas/mm3 | N | % | ||||||||||
| 200-300 | +/2 | 20 | 26 | ||||||||||
| 301-500 | + | 18 | 23 | ||||||||||
| 501-10.000 | ++ | 37 | 48 | ||||||||||
| 10.000-100.000 | +++ | 2 | 3 | ||||||||||
| Parâmetros clínicos | |||||||||||||
| N | % | ||||||||||||
| Febre durante a coleta sanguínea | 52 | 69 | |||||||||||
| Mialgia nos últimos três dias | 71 | 92 | |||||||||||
| Dispneia nos últimos três dias | 64 | 84 | |||||||||||
| Calafrio nos últimos três dias | 58 | 75 | |||||||||||
| Fraqueza nos últimos três dias | 67 | 87 | |||||||||||
ALTERAÇÕES HEMATOLÓGICAS E HEPÁTICAS (AST E ALT) EM PACIENTES INFECTADOS POR Plasmodium vivax
Como sumarizado na tabela 3, nos pacientes com malária vivax, observou-se diminuição significativa da GB, da concentração de hemoglobina corpuscular média (MCHC), do volume corpuscular médio (VCM), de PLAQ e da variação no tamanho das plaquetas (PDW), além do aumento significativo do volume plaquetário médio (VPM). Ademais, a análise dos marcadores hepáticos demonstrou aumento significativo da transaminase AST (p = 0,0093), sendo significativamente maior no grupo de pacientes com malária vivax quando comparado ao GC. Não foi observada significância estatística nos níveis de ALT entre os grupos estudados.
Tabela 3 - Características hematológicas e hepáticas dos pacientes com malária vivax e grupo controle atendidos no IMTC, estado do Amazonas, Brasil, no período de fevereiro a julho de 2012
| Características | Grupo controle (N= 58) | Pacientes com P. vivax (N = 77) | p* |
|---|---|---|---|
| Hematológicas (média ± DP) | |||
| HT (%) | 38,81 ± 4,93 | 38,43 ± 5,54 | 0,8224 |
| HB, níveis g/dL | 13,13 ± 1,66 | 13,11 ± 1,87 | 0,9982 |
| GB (unid. x 103/mm3) | 5,97 ± 1,66 | 4,54 ± 1,47 | < 0,0001 |
| GV (unid. x 106/mm3) | 4,12 ± 0,64 | 4,15 ± 0,60 | 0,5754 |
| VCM (fL) | 94,47 ± 7,16 | 89,09 ± 19,24 | 0,0272 |
| HCM (pg) | 31,96 ± 2,76 | 31,78 ± 2,96 | 0,3571 |
| CHCM (g/dL) | 33,73 ± 1,13 | 34,19 ± 1,16 | 0,0373 |
| RDW (%) | 13,99 ± 1,92 | 13,66 ± 2,40 | 0,9486 |
| PLAQ (unid. x 106/mm3) | 237,30 ± 84,04 | 118,30 ± 58,71 | < 0,0001 |
| VPM (fL) | 7,37 ± 2,24 | 8,44 ± 2,42 | 0,0007 |
| PDW (%) | 14,30 ± 2,31 | 13,41 ± 2,32 | 0,0111 |
| Hepáticas (média ± DP) | |||
| AST (U/L) | 20,14 ± 8,84 | 55,27 ± 252,40 | 0,0093 |
| ALT (U/L) | 20,66 ± 15,18 | 42,87 ± 167,50 | 0,4493 |
* Teste não paramétrico Mann-Whitney; DP: Desvio padrão; HT: Hematócrito; HB: Hemoglobina; GB: Glóbulos brancos; GV: Glóbulos vermelhos; VCM: Volume corpuscular médio; CMH: Concentração média de hemoglobina; CHCM: Concentração de hemoglobina corpuscular média; RDW: Variação no tamanho das hemácias; PLAQ: Plaquetas; VPM: Volume plaquetário médio; PDW: Variação no tamanho das plaquetas; AST: Aspartato aminotransferase; ALT: Alanina aminotransferase.
ASPECTOS HEMATOLÓGICOS E HEPÁTICOS (AST E ALT) NOS SUBGRUPOS CLÍNICOS DE PACIENTES COM MALÁRIA VIVAX
As alterações hematológicas e dos marcadores hepáticos (AST e ALT) foram analisadas ainda nos subgrupos de pacientes com malária vivax. Inicialmente, os pacientes foram separados em grupos, de acordo com a parasitemia (baixa e alta ) e o número de infecções (primoinfectado, ≤5 infecções e >5 infecções). Em relação à parasitemia, observou-se diminuição significativa de HT, HB e GV nos pacientes com alta carga parasitária. Verificou-se um aumento significativo (p = 0,0197) na variação do PDW dos pacientes primoinfectados em relação aos indivíduos com mais de uma infecção (Tabela 4).
Tabela 4 Características hematológicas e hepáticas dos subgrupos clínicos de pacientes com P. vivax atendidos no IMTC, estado do Amazonas, Brasil, no período de fevereiro a julho de 2012
| Características | Pacientes com P. vivax | ||||||
|---|---|---|---|---|---|---|---|
| Parasitemia | Número de infecções | ||||||
| Baixa (N = 38) | Alta (N = 39) | p* | Primoinfectado (N = 15) | ≤5 infecções (N = 27) | >5 infecções (N = 35) | p† | |
| Hematológicas (média ± DP) | |||||||
| HT (%) | 40,52 ± 4,86 | 36,39 ± 5,46 | 0,0026 | 38,97 ± 6,33 | 38,72 ± 5,58 | 37,97 ± 5,29 | 0,7978 |
| HB, níveis g/dL | 13,80 ± 1,71 | 12,44 ± 1,79 | 0,0037 | 13,37 ± 1,94 | 13,21 ± 2,04 | 12,93 ± 1,73 | 0,7162 |
| GB (unid. x 103/mm3) | 4,57 ± 1,58 | 4,52 ± 1,37 | 0,5785 | 4,43 ± 1,55 | 4,39 ± 1,43 | 4,72 ± 1,49 | 0,6034 |
| GV (unid. x 106/mm3) | 4,31 ± 0,57 | 4,00 ± 0,60 | 0,0354 | 4,20 ± 0,67 | 4,11 ± 0,64 | 4,15 ± 0,56 | 0,8707 |
| VCM (fL) | 94,61 ± 9,09 | 91,46 ± 8,37 | 0,1517 | 93,60 ± 9,66 | 94,56 ± 9,57 | 91,57 ± 7,83 | 0,3754 |
| HCM (pg) | 32,21 ± 2,95 | 31,36 ± 2,96 | 0,1718 | 32,16 ± 3,37 | 32,36 ± 3,36 | 31,19 ± 2,39 | 0,4005 |
| CHCM (g/dL) | 34,12 ± 1,01 | 34,26 ± 1,31 | 0,3035 | 34,37 ± 1,02 | 34,19 ± 1,36 | 34,12 ± 1,09 | 0,8094 |
| RDW (%) | 13,66 ± 1,20 | 13,66 ± 1,59 | 0,5645 | 13,49 ± 1,04 | 13,48 ± 0,96 | 13,88 ± 1,78 | 0,7625 |
| PLAQ (unid. x 106/mm3) | 126,1 ± 57,75 | 110,7 ± 59,39 | 0,3010 | 100,3 ± 48,47 | 128,9 ± 64,02 | 117,8 ± 58,06 | 0,4619 |
| VPM (fL) | 8,41 ± 2,40 | 8,46 ± 2,46 | 0,7099 | 8,79 ± 2,67 | 8,34 ± 2,26 | 8,36 ± 2,48 | 0,7625 |
| PDW (%) | 13,34 ± 2,06 | 12,52 ± 4,24 | 0,5711 | 15,19 ± 2,59 | 12,54 ± 2,91 | 13,08 ± 2,01 | 0,0197 |
| Bioquímicas (média ± DP) | |||||||
| AST (U/L) | 86,87 ± 358,6 | 24,49 ± 12,98 | 0,5851 | 31,47 ± 16,06 | 23,19 ± 9,80 | 90,23 ± 374,0 | 0,2635 |
| ALT (U/L) | 65,74 ± 237,4 | 20,59 ± 14,29 | 0,7868 | 33,07 ± 32,81 | 18,41 ± 11,21 | 65,94 ± 247,2 | 0,4252 |
*Teste não paramétrico Mann-Whitney; † Teste não paramétrico Kruskal-Wallis; DP: Desvio padrão; HT: Hematócrito; HB: Hemoglobina; GB: Glóbulos brancos; GV: Glóbulos vermelhos; VCM: Volume corpuscular médio; CMH: Concentração média de hemoglobina; CHCM: concentração de hemoglobina corpuscular média; RDW: Variação no tamanho das hemácias; PLAQ: Plaquetas; VPM: Volume plaquetário médio; PDW: Variação no tamanho das plaquetas; AST: Aspartato aminotransferase; ALT: Alanina aminotransferase.
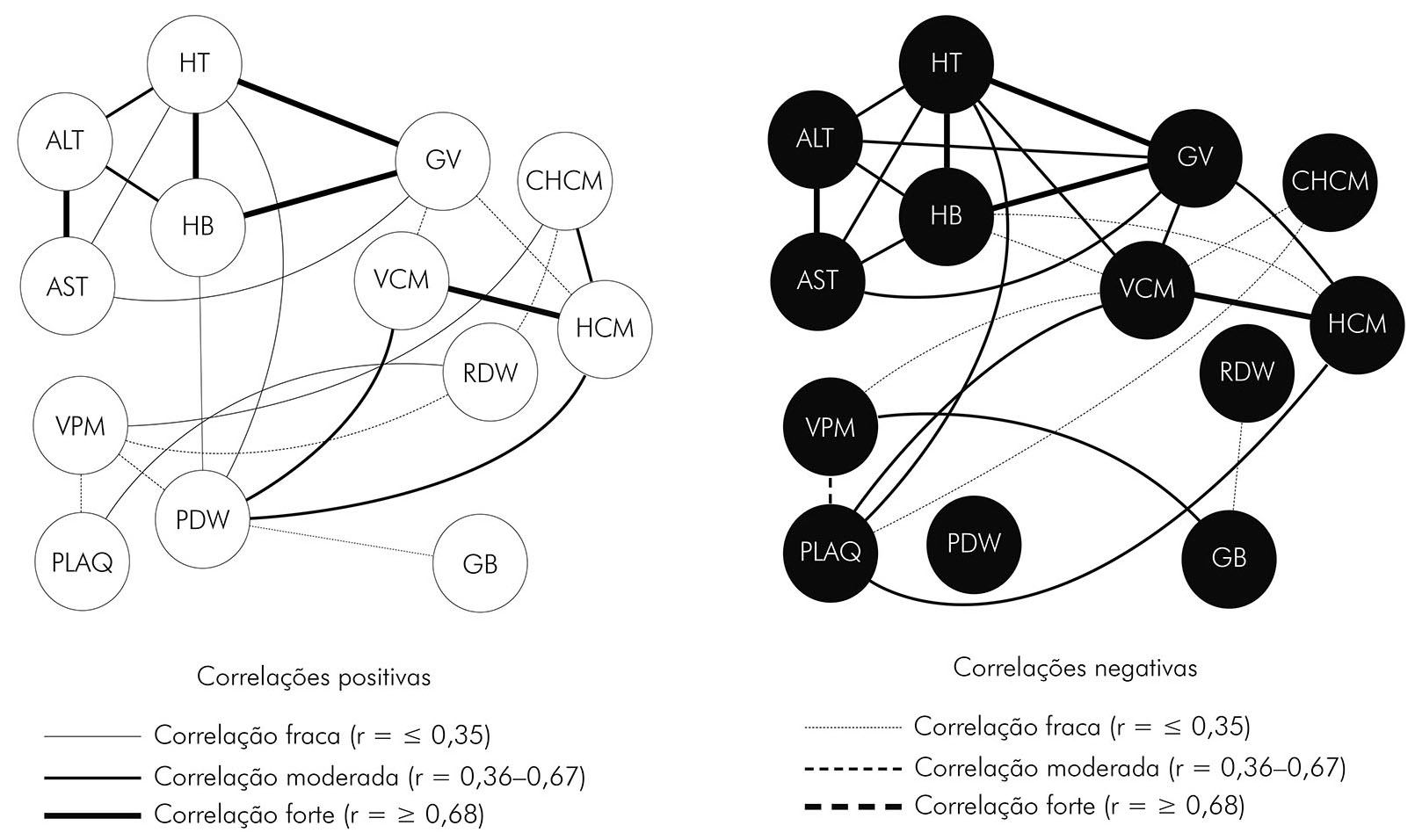
INTERAÇÕES ENTRE OS MARCADORES HEMATOLÓGICOS E HEPÁTICOS (AST E ALT) NA MALÁRIA VIVAX
Os indivíduos não infectados apresentaram uma rede com várias interações entre os marcadores hematológicos e hepáticos (AST e ALT) avaliados. O hematócrito, a hemoglobina e os glóbulos vermelhos estavam fortemente associados, enquanto que houve correlação forte entre o VCM e a MCHC, além do ALT e do AST. Os demais marcadores se correlacionaram de forma moderada e fraca, com a presença de correlações negativas entre PLAQ, VPM, PDW, GB, VCM e variação no tamanho das hemácias (RDW) no GC (Figura 1A). Quando observados os dados de correlação dos pacientes com malária vivax, notou-se a perda de correlações moderadas entre os marcadores e a ausência de interação do PDW com os demais componentes analisados. Além disso, o grupo infectado com P. vivax apresentou aumento nas interações GB, GV, HB, VCM e PLAQ (Figura 1 B).
DISCUSSÃO
A malária é uma doença febril aguda, com processo patogênico diferenciado e relacionado aos fatores biológicos do parasito e do hospedeiro. Neste trabalho, foram descritas as alterações clínicas, hematológicas e hepáticas (AST e ALT) causadas pela infecção por P. vivax em pacientes diagnosticados com malária e que não haviam iniciado o tratamento recomendado pelo Ministério da Saúde.
A sintomatologia básica da malária foi observada nos pacientes estudados, sendo as queixas mais frequentes mialgia, fraqueza, cefaleia, calafrio e febre. Para Costa et al.20, os sinais e sintomas da malária são constituídos, principalmente, por uma tríade clássica composta por febre-calafrio-cefaleia. No entanto, Rosas21 alertou para a familiaridade desses sintomas com outras doenças febris, como dengue, febre de Chikungunya e febre por Zika vírus. No estudo de Franklin et al.22, realizado na cidade de Manaus, estado do Amazonas, foi observado que os pacientes infectados com P. vivax foram acometidos principalmente por febre, mialgia, calafrio e cefaleia, o que corrobora com os achados do presente estudo, com exceção de febre e cefaleia, que foram pouco relatadas. Apesar de os pacientes incluídos nesse estudo não apresentarem sintomatologia da malária grave, estudos recentes têm associado a infecção por P. vivax com casos graves e complicações na malária9,23,24.
Quadros anêmicos são comuns em pacientes com malária grave ocasionada por P. vivax. Em geral, os valores de HT, HB e GV estão diminuídos nesses indivíduos17,23,25. Em alguns casos, os pacientes são submetidos à transfusão de concentrados de hemácias devido à gravidade da anemia26. Embora a literatura indique os processos anêmicos na malária, neste estudo, o GV, o HT, a HB e os índices hematimétricos apresentaram valores similares entre os grupos estudados, com exceção do VCM, que foi menor no grupo de pacientes com malária vivax. O quantitativo similar desses componentes entre os grupos pode sugerir a manutenção das interações estudadas. Os valores de HT, HB e do número de eritrócitos foram menores apenas nos indivíduos com alta carga parasitária, o que já é conhecido e descrito na literatura17,23. Sabe-se que o aumento da carga parasitária pode acarretar diminuição no número de GV, devido à ruptura dessas células durante os ciclos assexuados, ao sequestro de hemácias infectadas pelo baço e à formação de rosetas27,28,29.
Os valores de GB foram menores no grupo de pacientes com malária. Dados da literatura descreveram a redução no quantitativo de GB em pacientes com malária30,31. No entanto, em indivíduos com malária grave infectados com P. vivax, foi observado aumento no número de leucócitos26. No estudo de Tangpukdee et al.32, foi exposto ainda que GB foi menor que GV em indivíduos com P. vivax, com aproximação dos valores normais observados no grupo não infectado, após o tratamento, o que vem de encontro aos dados observados neste estudo. A diminuição dos GB é observada no início da infecção, com leucocitose transitória durante os paroxismos febris da malária, estando relacionada à carga parasitária33,34.
A trombocitopenia foi descrita nas amostras de pacientes com malária no presente estudo, com diminuição do VPM e aumento da PDW, inclusive no grupo de pacientes primoinfectados. A plaquetopenia é comum na patogênese da malária, principalmente na infecção por P. vivax17,35. Pacientes infectados com P. vivax, em geral, apresentam diminuição no número de PLAQ, devido à ativação da cascata de coagulação, além dos processos inflamatórios inerentes à doença24,36. Esse decréscimo no quantitativo de PLAQ e na PDW, associado ao aumento do VPM, podem explicar o aumento das correlações na análise de rede entre os componentes associados às PLAQ, com perda de interação da PDW com os demais marcadores hematológicos e hepáticos estudados.
Os dados deste estudo sugerem ainda comprometimento hepático nesses pacientes, com aumento das enzimas hepáticas AST e ALT. Dados similares foram observados por Onyesom e Onyemakonor15 e Elbadawi et al.37, que descreveram o aumento das enzimas em pacientes da Nigéria e em mulheres grávidas do Sudão infectados com P. falciparum. O relato de aumento das transaminases AST e ALT foi observado em pacientes com P. vivax, evidenciando a necrose dos hepatócitos durante a infecção16,17. Estudos prévios realizados com pacientes com malária grave na Fundação de Medicina Tropical do Amazonas e do Hospital São Gabriel, no estado de Rondônia, descreveram aumento de AST e ALT, corroborando com os resultados do presente estudo23,26,38. Vale ressaltar que, apesar do aumento nas transaminases AST e ALT no grupo de pacientes com malária vivax, não foi observado aumento nas interações desses marcadores com os componentes hematológicos, o que exclui, dessa forma, esses componentes como potenciais biomarcadores da infecção e do agravamento da doença.
CONCLUSÃO
Os resultados demonstraram que formas diferentes de abordagem dos marcadores hematológicos e hepáticos podem ser úteis para a avaliação dos pacientes. Além disso, reforçaram que o ganho e/ou perda de interação entre os componentes avaliados na infecção por P. vivax podem ser utilizados como ferramenta de prognóstico em estudos futuros; enquanto a diminuição nos valores de HT, HB e GB nos indivíduos com alta parasitemia evidenciaram a utilização desses marcadores como instrumento para o acompanhamento da evolução do quadro clínico e de formas graves da malária vivax.











 texto em
texto em