INTRODUÇÃO
A hepatite B somente foi reconhecida há cerca de 130 anos, com os primeiros registros realizados durante uma investigação de casos de icterícia pós-vacinação antivariólica em trabalhadores do estaleiro de Bremen, na Alemanha1. O vírus da hepatite B (VHB) pertence à família Hepadnaviridae, gênero Orthohepadnavirus, espécie Hepatitis B virus2.
A infecção oculta pelo vírus da hepatite B (IOB) foi descrita no final da década de 1970, revelando a importância da presença do anti-HBc como indicador de infecção pelo VHB e levantando a hipótese de que indivíduos com títulos elevados de anti-HBc poderiam transmitir a infecção3.
O diagnóstico da IOB é eminentemente sorológico e virológico, observando-se, de forma constante, o baixo nível do VHB-DNA, geralmente em torno de 103 cópias/mL no soro, quando comparado ao nível de 104 cópias/mL encontrado nos portadores assintomáticos e de 108 cópias/mL nos portadores de hepatite crônica4,5.
Em um workshop internacional sobre IOB realizado em Taormina, na Itália, especialistas fizeram recomendações, entre as quais se destacou a definição de IOB como a presença do VHB-DNA no fígado (com ou sem a detecção do VHB-DNA no soro) de indivíduos HBsAg- por testes convencionais6.
Permanecem controversos os resultados de vários estudos sobre a relação entre a IOB e o retardo no clareamento do HBsAg; enquanto alguns estudos demonstram um impacto benéfico do clareamento do HBsAg, outros sugerem elevada incidência na progressão da doença e no desenvolvimento de complicações7,8,9,10,11.
A resposta imune do hospedeiro para a infecção pelo VHB pode ser anulada por imunossupressores ou por agentes citotóxicos, proporcionando replicação viral e progressão da doença. A reativação da hepatite crônica B ou mesmo o surgimento de falência hepática fulminante foi relatada em pacientes com IOB submetidos à terapia citotóxica, a transplante autólogo de células-tronco, transplante alogênico de medula óssea, linfoma, anemia aplástica ou leucemia12,13,14,15,16,17,18.
A associação entre o VHB e o carcinoma hepatocelular (CHC) está bem estabelecida, entretanto, permanece controverso se a IOB também estaria implicada no surgimento do CHC - prevalência variável da IOB em pacientes com CHC tem sido relatada na Ásia, no Japão e nos EUA19,20,21,22.
Pelo mecanismo de transmissão similar, a coinfecção VHB e vírus da hepatite C (VHC) é uma apresentação clínica comum, com alta prevalência do anti-VHC, mais associada ao anti-HBc positivo (anti-HBc+) do que ao HBsAg positivo (HBsAg+), ficando indefinido o impacto clínico da coinfecção VHC/IOB4.
A avaliação do papel da IOB em pacientes com hepatite crônica com elevação de alanina aminotransferase (ALT) detectou o VHB-DNA em 13,3% dos pacientes com ALT normal ou ligeiramente elevada, enquanto que, com a elevação de ALT (≥ 5 vezes valores normais), o VHB-DNA foi detectado em 63,3% dos pacientes, o que indica que a prevalência de IOB seria mais alta em pacientes positivos para o VHC do que em negativos23.
O vírus da hepatite D (VHD), único representante do gênero Deltavirus, é um vírus defectivo, que necessita da presença do VHB para provocar infecção in vivo. Em uma comunidade ameríndia da Argentina, foram identificadas, entre 46 amostras não reagentes para o VHD por ELISA, três que eram VHD-RNA+ por nested reação em cadeia da polimerase (PCR) via transcriptase reversa (RT) - RT-nested PCR. As amostras eram anti-HBc+ isolado e duas delas foram identificadas como IOB, evidenciando que a infecção pelo VHD pode ocorrer entre indivíduos com IOB24.
Sabe-se que o HIV altera a história natural da infecção pelo VHB. Na infecção aguda pelo VHB em pacientes portadores do HIV, as chances de esses se tornarem portadores crônicos do VHB são de cinco a seis vezes maiores do que para as pessoas com resultado negativo para HIV. Pacientes coinfectados com HIV e VHB progridem mais rapidamente para o estágio final da doença hepática, e os diferentes genótipos do VHB podem ter um impacto distinto na progressão da doença25.
Na análise de 191 amostras de soro de pacientes belgas coinfectados HIV/VHB, com anti-HBc+, 65,3% apresentavam "infecção evidente" e 34,7%, "infecção oculta". Foram detectados os genótipos A (69,6%), E, D, C e G. O genótipo A foi observado em todos os pacientes do grupo clínico e de etnias variadas, e o genótipo E, em pacientes africanos26.
Estudos comprovaram a existência de alta prevalência da IOB entre dialisados, entretanto a prevalência de IOB entre receptores de transplante renal é controversa27,28,29,30,31,32. A análise de 752 amostras HBsAg-, para identificar IOB em hemodialisados de cinco clínicas de Recife, estado de Pernambuco, Brasil, encontrou soroprevalência de 5,7% para o anti-HBc total+ isolado, e a IOB foi identificada em 1,5% das amostras examinadas. O genótipo A foi detectado em 33,3% das amostras e o D em 66,7%, não sendo observada nenhuma mutação33. O estudo de 207 pacientes HBsAg-, receptores de transplante de rim, do estado do Rio de Janeiro, encontrou 1,0% com VHB-DNA positivo, indicando presença de IOB34.
Em 2014, um estudo realizado para determinar a frequência de IOB entre coinfectados por HIV/VHB, com anti-HBc+, doadores de sangue em Medellín, Norte da Colômbia Ocidental, e caracterizar os genótipos virais e mutações, relatou que o HBsAg utilizado na triagem em bancos de sangue reduziu o risco de transmissão de VHB por transfusão; entretanto, a descoberta de IOB entre doadores de sangue tornou imperativa a melhora na segurança da doação. Nesse estudo, foram analisadas 302 amostras de soro HBsAg-/anti-HBc+; a análise por PCR do genoma do VHB identificou seis amostras (1,98%) como IOB, todas do subgenótipo F335.
Uma pesquisa sobre IOB realizada com doadores de dois bancos de sangue, na Nigéria, identificou, entre 429 indivíduos, 17,0% com IOB. A carga viral foi de < 50 cópias/mL na IOB e predominou o genótipo E. Concluiu-se que a grande incidência da IOB era relevante em áreas de alta endemicidade e um problema geral para a segurança da doação de sangue, pela elevada prevalência detectada36.
É de conhecimento geral que os usuários de drogas ilícitas apresentam risco aumentado de infecção pelo VHB. Um estudo desenvolvido para investigar o perfil soroepidemiológico e molecular da infecção pelo VHB nesses indivíduos, na Região Centro-Oeste do Brasil, analisou 1.002 usuários que utilizavam drogas injetáveis (UDI) e não injetáveis (UDNI). A prevalência global da infecção pelo VHB foi de 15,0%, sendo que 20,7% pertenciam ao grupo de UDI e 14,0% ao de UDNI. O índice de IOB foi de 3,6% entre usuários anti-HBc+, mostrando a presença de IOB e a necessidade de se investigar os casos HBsAg-, para controle da infecção entre esses usuários37.
Localizado na região oeste do estado do Pará, à margem direita do Rio Amazonas, fazendo parte da Mesorregião do Baixo Amazonas e da Microrregião de Óbidos, o município de Juruti, com população estimada em 52.179 habitantes pelo Instituto Brasileiro de Geografia e Estatística38 para 2016, vem sendo submetido, desde 2005, à exploração de reserva de bauxita, a qual acarretou grande migração populacional para o município. Pela possibilidade do surgimento ou do aumento da frequência de doenças influenciadas por essa exploração, particularmente quanto às hepatites virais, foi desenvolvido, entre 2007 e 2010, um projeto de pesquisa em Juruti, o qual, entre outras investigações, desenvolveu um estudo para definir a prevalência das infecções pelos vírus das hepatites. Nesse estudo foram coletadas, nos dois primeiros anos, 1.630 amostras de soro de pessoas da demanda hospitalar municipal, as quais foram submetidas à análise dos marcadores sorológicos das hepatites A, B, C e D, por técnicas imunoenzimáticas, tendo havido prevalência de 1,4% de indivíduos com perfil de infecção pregressa ou atual pelo VHB (anti-HBc total+ isolado)39.
A Amazônia Ocidental é uma das regiões no mundo com alta prevalência da hepatite B, e poucos são os estudos desenvolvidos sobre a IOB nessa região. A detecção de indivíduos com sorologia anti-HBc total+ isolado indicou a necessidade de se conhecer a prevalência desse achado em populações amazônicas, como é o caso de Juruti. Isso poderá contribuir para a detecção, o entendimento da evolução e o prognóstico dos portadores dessa doença, principalmente porque as drogas atualmente utilizadas pelo sistema público de saúde do Brasil ainda são ineficazes para o tratamento da hepatite B, havendo a perspectiva de que, nos próximos anos, novas drogas venham a compor o arsenal para seu tratamento.
Este estudo objetivou investigar a ocorrência de IOB na população do município de Juruti. De forma específica, objetivou-se definir a soroprevalência da infecção pelo VHB; determinar a frequência de IOB; descrever as características demográficas dos portadores do VHB e dos portadores de IOB; determinar a carga viral e os genótipos em portadores do VHB-DNA/HBsAg+ selecionados; determinar a carga viral e os genótipos em portadores do VHB-DNA/anti-HBc total+ isolado; comparar os genótipos das amostras anti-HBc total+ isolado com as amostras HBsAg+, identificando os genótipos circulantes na população examinada; identificar mutações na estrutura do HBsAg que permitam o escape e a não detecção pelos testes imunoenzimáticos; e detectar a presença de coinfecção da IOB com o HIV, o VHC e o VHD.
MATERIAIS E MÉTODOS
Estudo descritivo, transversal, retrospectivo, desenvolvido entre março de 2012 e abril de 2015, com amostras de soro coletadas durante a execução de projeto sobre hepatites virais no município de Juruti, oeste do estado do Pará, Brasil, pela Seção de Hepatologia (SAHEP) do Instituto Evandro Chagas (IEC), o qual foi realizado entre fevereiro de 2007 e novembro de 2010.
Foram incluídas, no presente estudo, amostras de indivíduos com sorologia HBsAg+ e anti-HBc total+ isolado, selecionadas a partir do referido projeto, de forma aleatória, totalizando 3.991 amostras.
Na SAHEP, por técnicas imunoenzimáticas, foram realizados testes sorológicos para as hepatites B (HBsAg, anti-HBc total e anti-HBs) e C (anti-VHC) nas 3.991 amostras, utilizando-se kits comerciais dos laboratórios bioMérieux® (Marcy-l'Etoile, França) e ORTHO® (New Jersey, EUA), respectivamente.
Nas amostras HBsAg+ e anti-HBc total+ isolado, foram pesquisados, por técnica imunoenzimática, os marcadores sorológicos anti-HBc IgM (bioMérieux®, Marcy-l'Étoile, França); HBeAg (Bio-RAD®, Marnes-la-Coquette, França); anti-HBe (RADIM®, Pomezia, Itália) e anti-VHD (bioMérieux®, Marcy-l'Étoile, França). Foram considerados duvidosos os testes que apresentaram densidade óptica situada 20,0% para cima ou para baixo do limite de cut-off.
Nas amostras anti-HBc total+ isolado, também foram realizados, na Seção de Virologia do IEC, os testes sorológicos para o anti-HIV 1/2 SYM (Symbiosys®, São Paulo, Brasil). Todos os testes foram executados e interpretados conforme as indicações dos fabricantes.
Os testes de biologia molecular para o VHB foram realizados na SAHEP/IEC. Todas as amostras HBsAg+ e anti-HBc total+ isolado foram submetidas à quantificação da carga viral por PCR em tempo real, utilizando-se o sistema automatizado Abbott m24sp/m2000rt com o kit Abbott RealTime HBV® (Abbott Laboratories, Chicago, EUA), que apresenta linearidade de 10 UI/mL a 1.000.000.000 UI/mL.
As amostras que apresentaram carga viral de VHB detectáveis foram submetidas à amplificação por nested PCR de um fragmento de 734 pares de base (pb) dos genes que codificam a polimerase viral e o HBsAg, utilizando-se os iniciadores e condições de PCR40,41.
O sequenciamento foi realizado utilizando-se o kit BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems, Carlsbad, EUA) no sequenciador automático ABI 3500 (Applied Biosystems, Carlsbad, EUA), sendo utilizados os iniciadores FHBS2, RHBS2 5'- GCC ARG AGA AAC GGR CTG AGG CCC - 3', 5'LAM5 5'-TGC RYY TGT ATT CCC ATC CCA TC - 3' e RADE2M.
As sequências obtidas foram editadas e alinhadas no programa Geneious v8.1.3, juntamente com sequências dos diferentes genótipos e subgenótipos do VHB disponíveis no GenBank. O cladograma foi construído usando-se o método neighbor-joining42 Kimura 2-parâmetros no programa MEGA v6.06.
Para identificação de mutações que levassem ao escape na detecção dos testes imunoenzimáticos, fez-se a dedução de aminoácidos a partir do sequenciamento de nucleotídeos da região S/Pol, utilizando-se o programa Geneious v8.1.3. As sequências obtidas foram alinhadas com sequências de VHB do tipo "selvagem" e analisadas visualmente para detecção de mutações na região MHR no gene S, compreendendo os aminoácidos 100 a 169. Também foram pesquisadas mutações no gene que codifica a polimerase viral e analisados os aminoácidos que fazem parte dos domínios funcionais da transcriptase reversa (domínios A-E).
As amostras positivas para anti-VHC foram submetidas à quantificação da carga viral, utilizando-se o kit Abbott RealTime HCV® (Abbott Laboratories, Des Plaines, EUA) no sistema automatizado Abbott m24sp/m2000rt. Nos casos positivos pela PCR em tempo real, foi realizado heminested PCR de um fragmento de 382 pares de base (PB) do gene que codifica a NS5B para identificação do genótipo do VHC, utilizando-se os iniciadores e condições de PCR43,44.
Amostras excedentes foram armazenadas em freezer a -70 ºC, as quais integram o Biorrepositório do referido estudo.
Os dados da Ficha Preliminar de Inquérito de Saúde e os resultados sorológicos foram armazenados em base de dados da SAHEP/IEC (Hepatoware). Foi determinada a distribuição espacial dos casos detectados, com base em medidas epidemiológicas que incluíram o cálculo de frequências para casos prevalentes e a relação com o perfil epidemiológico dos casos (sexo, idade, estado civil, procedência; se era vacinado contra o VHB, se teve hepatite, e quais os sintomas e sinais). As análises estatísticas foram conduzidas empregando-se os softwares Epi InfoTM v7 e BioEstat v5.045. Foi utilizado o teste de significância estatística (teste exato de Fisher do programa Epi InfoTM v7, com nível de significância de 5% e intervalo de confiança - IC de 95%), para se analisar as diferenças entre os grupos, e o aplicativo Microsoft Excel, para as representações gráficas. As amostras foram testadas sob a hipótese de nulidade (H0) de que a infecção oculta pelo VHB não ocorre no município de Juruti; e sob a hipótese alternativa (H1) de que a infecção oculta pelo VHB ocorre no Município.
Baseado na Resolução CNS nº 466/2012 da Comissão Nacional de Ética em Pesquisa46, este projeto foi aprovado em 31 de março de 2011, pelo Comitê de Ética em Pesquisa Envolvendo Seres Humanos do IEC, com parecer de aprovação nº 010/2011 (CAAE: 0038.0.072.000-10).
RESULTADOS
Foram selecionadas 3.991 amostras de soro de indivíduos de Juruti, no período de fevereiro de 2007 a novembro de 2010, coletadas na sede do Município, no Hospital Francisco Barros (75,2%; 3.001/3.991); na Comunidade Café Torrado (5,8%; 230/3.991); na localidade Jauari (1,0%; 42/3.991); na Comunidade Nova Galileia (2,8%; 110/3.991); em Vila Muirapinima (7,7%; 307/3.991); e na invasão, às margens do Lago Jará (7,5%; 301/3.991), .
Observou-se uma frequência de 62,7% (2.501/ 3.991) para indivíduos do sexo feminino. A média de idade da população foi de 27,6 ± 18,7 anos (variação de 5 meses a 89 anos) e a mediana, de 25 anos de idade. A maior concentração de participantes estava na sede do Município; a maior e a menor frequência de indivíduos foram encontradas na faixa etária de 20 a 29 anos (20,8%; 832/3.991) e entre os menores de 1 ano de idade (0,3%; 10/3.991), respectivamente.
Foi identificada prevalência de 0,5% (21/3.991; IC 95% 0,39-0,61) para HBsAg+; 8,3% (332/3.991; IC 95% 5,33-11,26) para anti-HBc total+/anti-HBs+; 1,1% (43/3.991; IC 95% 0,79-1,41) para anti-HBc total+ isolado; e 33,6% (1.339/3.991; IC 95% 31,07-36,13) apresentaram resposta vacinal contra o VHB (anti-HBs+ isolado). O perfil sorológico vacinal, até os 29 anos de idade, se mostrou em 47,8% (1.135/2.375), conforme se pode visualizar na tabela 1.
Tabela 1 - Soroprevalência de HBsAg+, anti-HBc total+/anti-HBs+, anti-HBc+ isolado e anti-HBs+ isolado, por faixa etária, em Juruti, estado do Pará, Brasil, de fevereiro de 2007 a novembro de 2010
| Faixa etária (anos) | População examinada | HBsAg+ | Anti-HBc total+/ anti-HBs+ | Anti-HBc total+ isolado | Anti-HBs+ isolado | Suscetíveis | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | N | % | N | % | N | % | |
| < 1 | 10 | 0,3 | − | − | 1 | 10,0 | − | − | 4 | 40,0 | 5 | 50,0 |
| 1 - 4 | 317 | 7,9 | − | − | 2 | 0,6 | − | − | 197 | 62,2 | 118 | 37,2 |
| 5 - 9 | 488 | 12,2 | − | − | 2 | 0,4 | 1 | 0,2 | 271 | 55,6 | 214 | 43,8 |
| 10 - 19 | 728 | 18,2 | 2 | 0,3 | 7 | 1,0 | 4 | 0,5 | 418 | 57,4 | 297 | 40,8 |
| 20 - 29 | 832 | 20,8 | 3 | 0,4 | 34 | 4,1 | 3 | 0,4 | 245 | 29,4 | 547 | 65,7 |
| 30 - 39 | 618 | 15,5 | 5 | 0,8 | 69 | 11,2 | 3 | 0,5 | 103 | 16,7 | 438 | 70,8 |
| 40 - 49 | 393 | 9,9 | 5 | 1,3 | 60 | 15,3 | 6 | 1,5 | 37 | 9,4 | 285 | 72,5 |
| 50 - 59 | 331 | 8,3 | 3 | 0,9 | 74 | 22,4 | 8 | 2,4 | 32 | 9,7 | 214 | 64,6 |
| ≥ 60 | 274 | 6,9 | 3 | 1,1 | 83 | 30,3 | 18 | 6,6 | 32 | 11,7 | 138 | 50,3 |
| Total | 3.991 | 100,0 | 21 | 0,5 | 332 | 8,3 | 43 | 1,1 | 1.339 | 33,6 | 2.256 | 56,5 |
N: População examinada; Sinal convencional utilizado: − dado numérico igual a zero, não resultante de arredondamento; HBsAg+: portador do VHB; Anti-HBc total+/anti-HBs+: perfil de infecção pregressa pelo VHB; Anti-HBs+ isolado: perfil compatível com proteção vacinal; Anti-HBc total+ isolado: perfil compatível com infecção pregressa ou atual pelo VHB.
Verificou-se que, entre os indivíduos HBsAg+, não foram encontradas amostras positivas para o anti-HBc IgM, o anti-VHC ou o anti-HD. Os testes de biologia molecular identificaram que 66,7% (14/21) dos indivíduos apresentavam PCR VHB-DNA qualitativo+.
O teste de carga viral realizado nas 14 amostras HBsAg+ variou entre < 55 UI/mL e > 38.000 UI/mL. Em 13 dessas amostras, foi possível realizar a genotipagem do VHB, com a detecção em 69,2% (9/13) do genótipo A, subgenótipo A1, e do genótipo F, sendo 15,4% (2/13) do subgenótipo F2 e 15,4% (2/13) do subgenótipo F4. Nessas 13 amostras, também foram detectados 69,2% (9/13) de subtipos sorológicos adw2 (todos do subgenótipo A1) e 30,8% (4/13) de subtipos adw4 (dois do subgenótipo F2 e dois do F4), conforme apresentado no quadro 1.

NR: Não realizado, por esgotamento da amostra.
Quadro 1 - Genótipos, subgenótipos e subtipos do VHB-DNA identificados entre 14 amostras de indivíduos HBsAg+, em Juruti, estado do Pará, Brasil, de fevereiro de 2007 a novembro de 2010
Quanto à prevalência de genótipos, o subgenótipo A1 foi o mais prevalente 64,3% (9/14), principalmente na faixa etária entre 30 e 39 anos. Houve a detecção dos subgenótipos F2 e F4, sendo que o subgenótipo F2 ocorreu em indivíduos de 25 e 47 anos e o F4 em indivíduos de 46 e 63 anos.
O cladograma desenvolvido para as amostras de VHB teve por base o alinhamento de sequências da região S/Pol (742 pb), utilizando-se o método neighbor-joining (Kimura 2-parâmetros) e o teste de bootstrap de 1.000 réplicas. Nove amostras agruparam com sequências do subgenótipo A1, que é o mais frequente no continente americano. Também foram identificadas quatro sequências de VHB, genótipo F, sendo duas do subgenótipo F2 e duas do F4 (Figura 1).
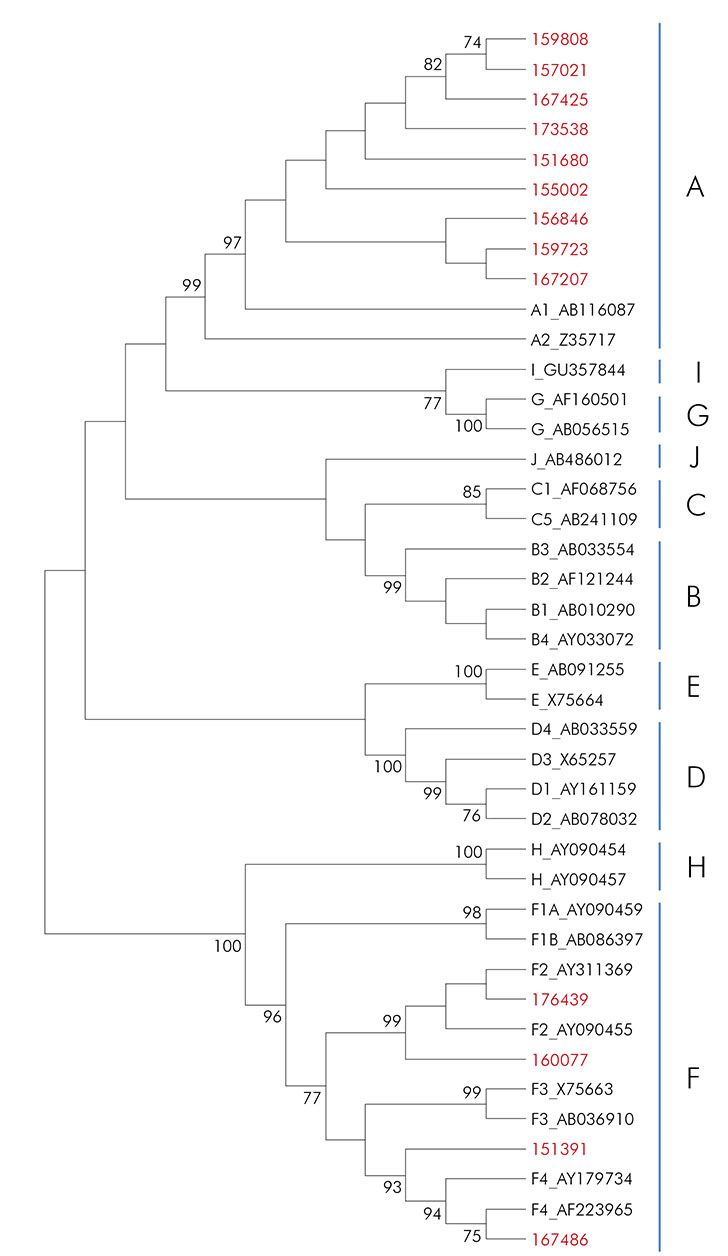
Sequências obtidas do GenBank estão identificadas com o número de acesso. Valores de bootstrap superiores a 70,0% são mostrados na árvore.
Figura 1 - Cladograma da região S/Pol do VHB inferida com método neighborjoining (Kimura 2-parâmetros)
A análise da região do domínio C da polimerase e da determinante "a" do HBsAg não detectou a presença de mutações; entretanto, quando foram realizadas as análises de outras regiões, foram encontradas duas mutações. Uma na posição 169, com substituição de uma arginina por uma prolina (R169P) no gene S, da amostra 151680 (Figura 2). A amostra pertencia a uma paciente de 39 anos de idade, casada, comerciante, natural do município de Oriximiná, oeste do estado do Pará, oligossintomática, com hepatoesplenomegalia, que havia recebido o esquema completo de vacinação e apresentava HBsAg+ desde 2003. Outra mutação ocorreu no domínio D da polimerase, com substituição de uma serina por ácido aspártico (rtS238D) da transcriptase reversa, na amostra 151391 (Figura 3). Essa amostra pertencia a uma paciente com 63 anos de idade, casada, aposentada, procedente de Juruti, oligossintomática, sem história anterior de infecção pelo VHB, e que havia recebido o esquema vacinal completo contra o VHB.
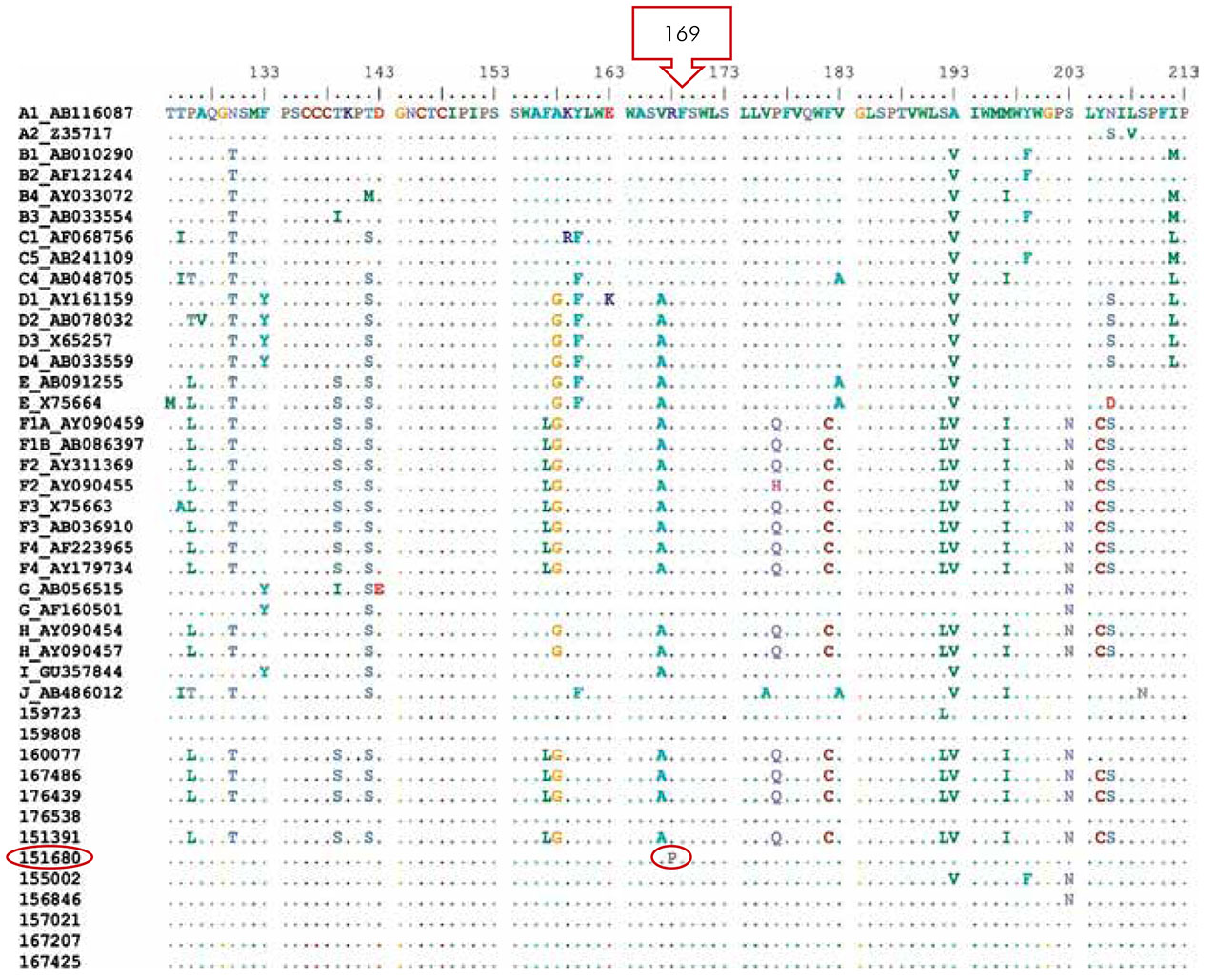
Figura 2 - Alinhamento da sequência de aminoácidos da região S do VHB das amostras do estudo e as obtidas do GenBank
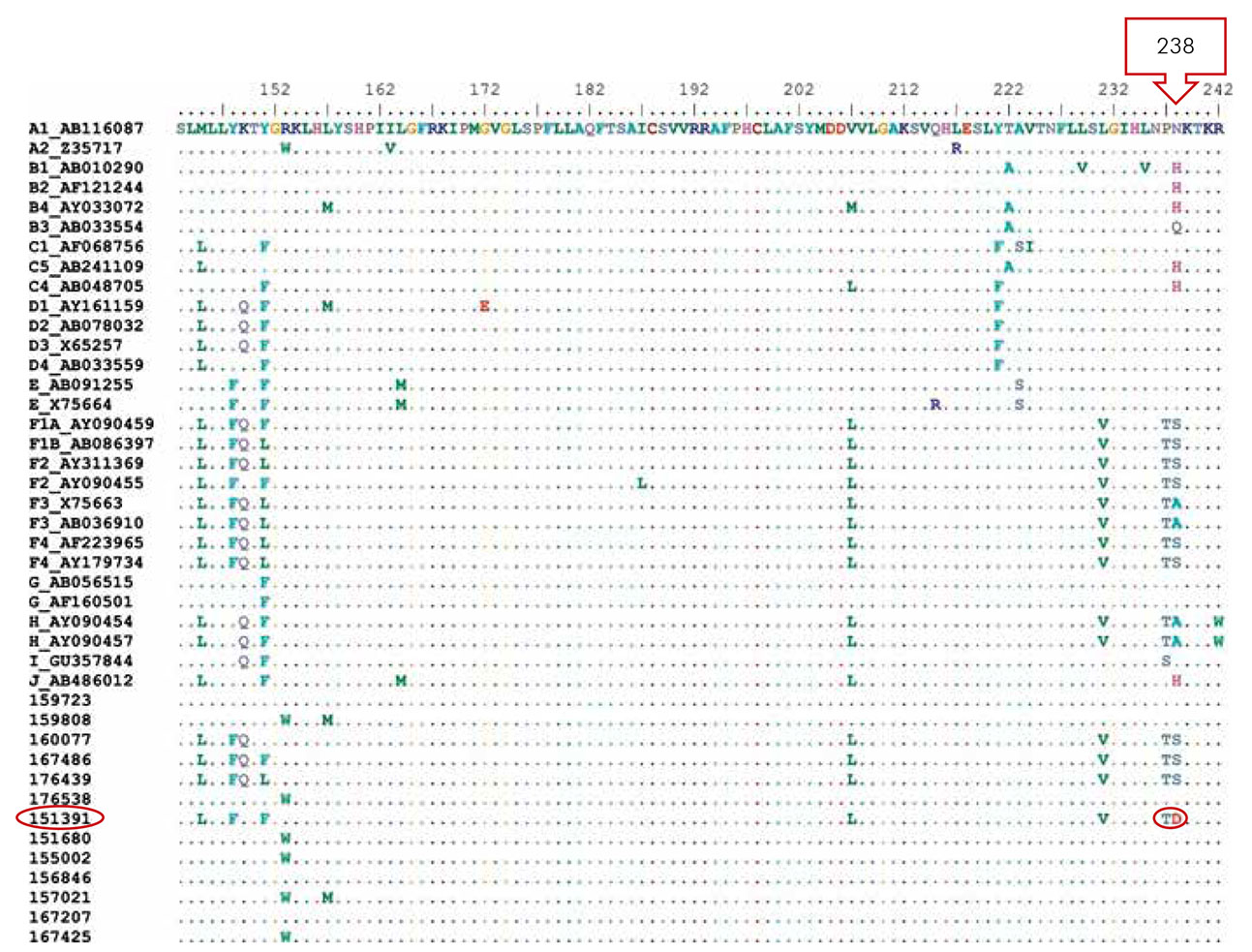
Figura 3 - Alinhamento da sequência de aminoácidos da região Pol do VHB das amostras do estudo e as obtidas do GenBank
A análise das características demográficas dos 14 pacientes HBsAg+ com VHB-DNA+ mostrou ausência de portadores do VHB abaixo dos 10 anos de idade; 50,0% (7/14) eram do sexo masculino; 64,3% (9/14) eram casados; 57,1% (8/14) procediam de Juruti, 21,4% (3/14) de outras cidades do Pará (Óbidos, Oriximiná e Rurópolis) e 21,4% (3/14) dos estados do Amazonas (Parintins), Ceará (Uruburetama) e Paraná (Diamante D'Oeste); 78,6% (11/14) informaram não serem vacinados contra o VHB; 92,9% (13/14) desconheciam se haviam contraído hepatite; e 50,0% (7/14) responderam afirmativamente sobre a presença de sintomas e sinais.
Apenas a variável "vacinado contra a hepatite B" mostrou significância estatística, com p = 0,04, e os indivíduos não vacinados contra o VHB tiveram um risco (razão de prevalência) 0,32 vezes maior de serem infectados pelo VHB, quando comparados aos vacinados.
Do total de 43 amostras anti-HBc total+ isolado, não foi detectado o marcador sorológico anti-HBc IgM. Os testes de biologia molecular dessas amostras detectaram 9,3% (4/43) de indivíduos VHB-DNA+, com carga viral entre < 15 UI/mL e 48 UI/mL. A baixa carga viral encontrada impossibilitou a genotipagem e sequenciamento dessas amostras (Quadro 2).

NR: Não realizado, por esgotamento da amostra.
Quadro 2 - Testes de PCR VHB-DNA qualitativo e quantitativo em quatro amostras anti-HBc total+ isolado, em Juruti, estado do Pará, Brasil, de fevereiro de 2007 a novembro de 2010
Nas amostras anti-HBc total+ isolado, a pesquisa detectou prevalência do anti-VHC de 4,7% (2/43), tendo sido confirmado por RT-PCR, como portador do VHC, genótipo 1a, um indivíduo do sexo masculino, com 80 anos de idade, assintomático, casado, residente na área urbana de Juruti. Nessas amostras, a pesquisa do anti-HD se mostrou negativa. E não foram detectadas sorologias anti-HIV positivo.
Em relação à distribuição de pacientes anti-HBc total+ isolado com VHB-DNA+, a presença do vírus foi detectada a partir dos 40 anos de idade, com maior frequência entre os indivíduos a partir de 60 anos.
DISCUSSÃO
A IOB é uma entidade clínica desafiante, reconhecida por duas principais características: ausência de HBsAg e baixa replicação viral. Entretanto, nas décadas de 1990 e 2000, houve um notável progresso na compreensão de suas implicações clínicas. Percebeu-se que técnicas diagnósticas apropriadas deveriam ser adotadas, pois ensaios sensíveis de amplificação do VHB-DNA são considerados como o padrão ouro para detecção da IOB. Foi identificado que fatores virais e fatores do hospedeiro estariam implicados na patogênese da IOB, embora alguns pesquisadores ainda achem que a infectividade pela IOB por transfusão é limitada. Por essas razões, vários aspectos da transmissão da IOB, sua infecciosidade e relação com o desenvolvimento de doenças crônicas do fígado e CHC ainda necessitam ser investigados28,29.
A IOB, conceituada como a detecção do VHB-DNA no soro ou no fígado por teste diagnóstico sensível, em pacientes HBsAg− com ou sem marcadores sorológicos de exposição prévia viral, parece ser elevada entre pacientes sob alto risco de infectar-se pelo VHB e com doença hepática. Pode originar-se tanto pela contaminação com sangue como pela doação de órgãos e funcionar como elemento desencadeador de reativação após uma hepatite, dependendo das características do vírus e de fatores do hospedeiro30.
Este estudo foi desenvolvido com o objetivo de investigar a ocorrência de IOB em uma amostra de população de Juruti, entre fevereiro de 2007 e novembro de 2010. A presença de portadores do VHB foi comprovada nessa população pela detecção de 0,5% de amostras HBsAg+; 8,3% dos indivíduos apresentaram perfil de infecção pregressa pelo VHB, com anti-HBc total+/anti-HBs+; 1,1% dos examinados apresentaram perfil compatível de infecção pregressa ou atual pelo VHB, com anti-HBc total+ isolado; e 33,6% tiveram resposta vacinal contra o VHB (anti-HBs+ isolado).
A soroprevalência de 0,5% (IC 95% 0,39-0,61) de portadores do vírus (HBsAg+) encontrada na população de Juruti o classificou como de baixa endemicidade para o VHB, resultado semelhante ao encontrado no "Estudo de prevalência de base populacional das infecções pelos vírus das hepatites A, B e C", realizado entre 2005 e 2009, nas 26 capitais brasileiras e no Distrito Federal, que mostrou prevalência sorológica para o HBsAg de 0,37% (IC 95% 0,25-0,50), classificando o conjunto das capitais do Brasil como de baixa endemicidade para o VHB47.
Entre as 21 amostras HBsAg+, não foram detectados casos agudos de infecção pelo VHB, nem foram encontrados indivíduos portadores de infecção por VHC e VHD, o que traduz a baixa endemicidade desses vírus na região. A pesquisa do VHB-DNA dessas amostras foi positiva em 66,7%, e a carga viral das amostras positivas variou entre < 55 UI/mL e > 38.000 UI/mL, possibilitando a realização de genotipagem, constatando-se que nove delas apresentavam subgenótipo A1, duas eram do subgenótipo F2 e duas do subgenótipo F4, concluindo-se que o subgenótipo A1 era o mais prevalente na amostra estudada.
A identificação dos genótipos do VHB é importante para se estimar a progressão da doença e para planejar o tratamento. Segundo levantamento de diversos estudos sobre a distribuição dos genótipos e subgenótipos do VHB no mundo, o genótipo A apresenta tendência para cronicidade e é mais frequente na África Subsaariana, no Norte da Europa e na África Ocidental; os genótipos B e C são característicos da Ásia, e as mutações são mais frequentemente encontradas no genótipo C; o D predomina na África, na Europa, nos países do Mediterrâneo e na Índia, sendo frequente tanto a evolução para cronicidade como para o surgimento de mutações; o genótipo E foi descrito em estudos na África Central e na Arábia Saudita; o F em estudos na Tunísia, no Brasil e na Espanha; o genótipo G foi relatado na França, na Alemanha e nos EUA, em coinfecção com outros genótipos; o H é comumente encontrado nas Américas do Sul e Central, também relacionado a coinfecções; o genótipo I foi recentemente relatado no Vietnã e Laos, e o J foi identificado em ilhas do Japão48.
Um estudo envolvendo 40 hemodialisados, no estado de Santa Catarina, encontrou o genótipo D (57,1%) como o mais prevalente, seguindo-se o A (30,6%) e o F (12,2%); no estado do Rio Grande do Sul, houve maior prevalência do genótipo D (60,0%), e também foram detectados os genótipos A (34,0%) e F (5,0%); no estado do Paraná, os genótipos D (82,9%) e A (14,1%) foram os mais frequentes49,50,51.
O exame de 121 indivíduos, no Rio de Janeiro, detectou 68,0% com genótipo A, 15,0% com genótipo F e 14,0% com genótipo D. A análise de 60 pacientes, em Recife, identificou maior prevalência dos subgenótipos A1 (79,0%) e F2 (12,0%)52,53.
Na Amazônia Oriental, um estudo relatou prevalência do genótipo A de 81,8%, 89,5% e 93,7% em pacientes assintomáticos, sintomáticos com HBeAg+ e sintomáticos com HBeAg−, respectivamente. Outro estudo realizado em Belém, no Pará, encontrou, entre 40 pacientes, os genótipos A1 (87,5%), A2 (7,5%) e D (5,0%)54,55.
Na Amazônia Ocidental, detectou-se, entre 34 portadores de HBsAg+, prevalência dos genótipos A (73,5%) e F (26,5%)56. A análise retrospectiva de 14 amostras de pacientes que desenvolveram hepatite fulminante e óbito na Amazônia Ocidental, entre 1978 e 1989, encontrou os genótipos F (50,0%), A (28,6%) e D (21,4%)41. Outro estudo desenvolvido entre indivíduos HBsAg+ de áreas urbana, rural e indígena do município de Lábrea, Amazônia Ocidental, mostrou que, em 86 amostras HBsAg+, 39 apresentaram VHB-DNA positivo, sendo detectada prevalência do genótipo A (60,0%) e presença dos genótipos D (35,0%) e F (5,0%)57. Nesse mesmo estudo, foi constatado que, entre nove amostras de indígenas, 44,4% eram genótipo A e 55,6% genótipo D57. Todas as pesquisas apresentadas, inclusive a realizada em Juruti, ratificam a informação de que, no Brasil, os genótipos A, D e F são os mais frequentes.
A pesquisa realizada em Juruti detectou nove (69,2%) subtipos sorológicos adw2 (todos de pacientes com subgenótipo A1) e quatro (30,8%) subtipos adw4 (dois do genótipo F2 e dois do F4). Um estudo de prevalência das hepatites B e C entre mineradores da Amazônia brasileira, expostos à malária, encontrou os subtipos adw2 (59,0%), adw4 (8,1%), ayw3 (8,1%) e ayw2 (5,4%)58. Entre pacientes com clínica evidente de hepatite, atendidos no sistema público de saúde de Goiânia, estado de Goiás, sobre a soroprevalência de infecção pelo VHB, foram identificados os subtipos adw2 (62,7%), ayw3 (23,5%), ayw2 (9,8%) e adw4 (3,9%)59. Em contrapartida, em pacientes hospitalizados em Porto Alegre, estado do Rio Grande do Sul, foram encontrados principalmente os subtipos ayw (60,4%) em pacientes com genótipo D, adw (34,0%) em pacientes com genótipo A e adw4 (5,4%) em pacientes com genótipo F, evidenciando que a distribuição dos genótipos e subtipos virais encontrados nos diferentes estudos pode refletir o padrão de ocupação do vírus nas diferentes regiões do país51.
Na presente pesquisa, foram encontradas duas mutações. Uma na posição 169, com substituição de uma arginina por uma prolina (R169P) no gene S, da amostra 151680, localizada na maior região hidrofílica (MHR) da proteína S, entre os aminoácidos 103 e 173; entretanto fora da região da determinante "a" (entre os aminoácidos 124-147), principal epítopo para induzir uma resposta imune protetora, correlacionada com a redução da secreção do HBsAg e da partícula viral.
Mutações na região pré-S/S têm sido relatadas em muitas regiões do mundo, entretanto podem ocorrer naturalmente ou surgir durante terapia antiviral, pelo uso da imunoglobulina ou pela vacinação. Tais mutações estão fortemente relacionados à antigenicidade do HBsAg, podendo resultar em variações antigênicas e permitir o escape vacinal do VHB, sendo conhecidas como "mutações de escape vacinal".
O HBsAg é um importante marcador diagnóstico, estando o seu nível de expressão relacionado com a eficácia do tratamento antiviral. A mutação mais comum encontrada na região S do VHB é a substituição da glicina pela arginina no códon 145 do HBsAg (G145R), ou de aspartato pela alanina no códon 144 (D144A)60. A outra mutação foi encontrada no domínio D, com substituição de uma serina por ácido aspártico (rtS238D) da transcriptase reversa, na amostra 151391, que pode estar potencialmente correlacionada com mutação de resistência aos antivirais adefovir e entecavir, pois alguns estudos relacionaram essas mutações à progressão da doença hepática e às terapias antivirais utilizadas61,62.
Um estudo sobre a resistência ao adefovir e entecavir no tratamento da hepatite B crônica mostrou que a resistência ao adefovir está geralmente associada ao surgimento de mutação no códon 236 (rtN236T) ou no códon 181 (rtA181V) do gene da polimerase do VHB. O adefovir, quando utilizado em monoterapia no primeiro ano de tratamento, costuma desenvolver resistência, e, a partir do segundo, terceiro, quarto e quinto anos, pode-se observar o surgimento de cepas resistentes em 3,0%, 11,0%, 18,0% e 29,0% dos pacientes, respectivamente63. A utilização de métodos mais sensíveis de detecção possibilitou encontrar mutação de resistência ao adefovir, após um ano de uso, chegando a 20,0% após o segundo ano; essa resistência foi encontrada, principalmente, em pacientes resistentes à monoterapia pela lamivudina64.
Quanto ao entecavir, o surgimento de resistência em pacientes que nunca receberam tratamento apresentou-se rara, pela eficiente capacidade de supressão viral e a alta barreira genética proporcionada pelo mesmo. O estudo ETV-60 demonstrou incidência cumulativa de resistência em cinco anos de apenas 1,2%. Em pacientes resistentes à lamivudina, verificou-se resistência em menos de 2,0% dos pacientes durante terapia por um ano65.
Do total de 3.991 amostras examinadas, entre as 43 (1,1%) que apresentavam anti-HBc total+ isolado, foi encontrada prevalência de anti-VHC em 4,7% (2/43) dos indivíduos e confirmado, por RT-PCR, um portador do VHC, genótipo 1a, com VHB-DNA negativo, o que revela que, nessa população, a IOB não era expressiva com relação à hepatite crônica C.
Se a infecção pelo VHC está associada ao aumento do risco de CHC, então a coinfecção ativa VHB/VHC poderia aumentar esse risco, permanecendo indeterminado o papel patogênico da IOB no CHC, relacionado ao VHC. O fato de se haver encontrado o VHB-DNA em 14,8% dos pacientes HBsAg negativo/VHC positivo e em 15,0% de 100 adultos saudáveis HBsAg negativo/VHC negativo indicou que não havia significado clínico com a hepatite crônica C, em áreas onde a infecção pelo VHB era endêmica66.
Nas amostras anti-HBc total+ isolado, a pesquisa do anti-HD foi negativa, à semelhança do encontrado nas amostras HBsAg+, permitindo caracterizar a baixa endemicidade do VHD nessa população. Um estudo sobre a prevalência sorológica e as características moleculares do VHD, dentro de uma comunidade ameríndia da Argentina, identificou, entre 46 amostras VHD negativo por ELISA, três VHD-RNA positivo por RT-nested PCR. Essas amostras eram anti-HBc positivo isolado, e duas delas foram identificadas como IOB. Todas as sequências foram identificadas como VHD genótipo 1, mas exibiam diferenças de nucleotídeos que codificavam a região HDAg-L, com mutações nos códons 197 e 201, responsável, segundo relatado, por promover in vitro uma interação inadequada com HBsAg, evidenciando que a infecção pelo VHD pode ocorrer entre indivíduos com IOB24.
Em todas as amostras anti-HBc total+ isolado, foi pesquisado o anti-HIV, com resultados negativos, muito embora tenha sido demonstrado que coinfectados VHB/HIV podem evoluir para IOB, com baixa carga viral e HBsAg não detectável, necessitando de diagnóstico específico pela pesquisa do VHB-DNA67. Um estudo desenvolvido em Manaus, estado do Amazonas, mostrou que a probabilidade de se encontrar IOB foi quatro vezes maior entre os indivíduos HIV reativos, sugerindo a possibilidade da associação entre indivíduos portadores de HIV e IOB68.
O VHB-DNA foi encontrado em 9,3% (4/43) das amostras anti-HBc total+ isolado, com carga viral entre < 15 UI/mL e 48 UI/mL, impossibilitando a realização da genotipagem e sequenciamento dessas amostras, o que gerou dificuldades para comparar os genótipos das anti-HBc total+ isolado com as HBsAg+ e identificar os genótipos circulantes na população examinada. Essa questão justifica-se tanto pela baixa carga viral como pela diferença na sensibilidade das metodologias, pois a PCR convencional costuma ser menos sensível que a PCR em tempo real, utilizada para a detecção/quantificação68. No presente estudo, a metodologia de PCR utilizada no laboratório tinha sensibilidade de 50 UI/mL.
A prevalência do VHB é definida pelos testes realizados entre os pacientes; entretanto, a aproximação diagnóstica apresenta-se inadequada, pois a descoberta da IOB requer ensaios de alta sensibilidade e especificidade, com um limite de detecção < 10 UI/mL para VHB-DNA e < 0,1 mg/mL para HBsAg69.
A análise das características demográficas das amostras HBsAg+/VHB-DNA+ não revelou significância estatística entre as variáveis analisadas, à exceção da variável relacionada à informação sobre a vacinação contra o VHB, que foi estatisticamente significante. Entre as amostras anti-HBc+/VHB-DNA+, 75,0% dos indivíduos examinados não referiram ter sido vacinados contra o VHB; entretanto, não foi possível realizar testes estatísticos, pelo reduzido número de resultados encontrados.
Um estudo, para investigar a prevalência de IOB e de genótipos de VHB entre crianças mexicanas com hepatite clínica, avaliou 215 delas, por meio de marcadores sorológicos do VHB e do VHB-DNA. A infecção pelo VHB foi encontrada em 11,2% das crianças com hepatite clínica, com VHB-DNA+, e a IOB foi identificada em 87,5% dos casos, entre os quais 12,5% eram VHB-DNA+, com HBsAg−. A IOB foi mais frequente nas que não tinham sido vacinadas contra hepatite B do que naquelas que haviam sido vacinadas, o que ressalta a importância do diagnóstico molecular da infecção pelo VHB em crianças com hepatite clínica, enfatizando a necessidade da vacinação contra a hepatite B70.
A cobertura vacinal contra o VHB registrada pelo Departamento de Informática do Sistema Único de Saúde, no período de fevereiro de 2007 a novembro de 2010, período no qual foram coletadas as amostras do presente estudo, entre menores de 29 anos de idade, foi de 71,2%; na Região Norte, de 85,8%; no estado do Pará, de 79,8%; e de 81,6% para o município de Juruti71. Os percentuais estiveram sempre abaixo do que preconiza o Ministério da Saúde, o qual recomenda que uma série de três doses da vacina deve induzir níveis protetores de anti-HBs em mais de 95,0% das crianças e adolescentes e em cerca de 90,0% dos adultos saudáveis72.
No presente estudo, foram identificados 56,5% de indivíduos suscetíveis ao VHB, que poderiam ser beneficiados por meio da vacinação. A elevada prevalência de suscetíveis associada à baixa prevalência do VHB encontrada identificou a necessidade de ampliação das atividades de prevenção e controle do VHB, principalmente em relação à vacinação que, no Brasil, a partir de 2016, está disponível para toda a população, independentemente de faixa etária e/ou condições de vulnerabilidade72.
Na população geral, poucos estudos sobre a prevalência de IOB são encontrados, que tem sido relatada em várias partes do mundo, inclusive em áreas de baixa endemicidade para o VHB. Estudando-se 487 indivíduos norte-americanos, foi detectada prevalência de IOB em 18,0% dos indivíduos que apresentavam evidência prévia de infecção pelo VHB e em 8,0% de indivíduos soronegativos para esse vírus73. Um estudo realizado em população coreana saudável, com transaminases normais, que eram VHB e VHC negativos, captou 16,0% de prevalência de IOB74. Outro, sobre a prevalência da IOB em 98 amostras de tecido hepático de indivíduos italianos, sem doença hepática, detectou a presença de 16,3% (16/98) de casos de IOB, sendo que 62,5% (10/16) desses eram anti-HBc+ e 7,3% (6/82) eram indivíduos soronegativos para VHB75.
Os métodos sorológicos e de biologia molecular utilizados neste estudo, considerando que a amostra era de 3.991 indivíduos residentes em Juruti, determinaram prevalência de 0,4% de portadores do VHB com HBsAg+/VHB-DNA+ e prevalência de 0,1% de indivíduos com IOB, anti-HBc total+/VHB-DNA+.
No soro de 17.677 indivíduos coreanos, divididos em dois grupos - o grupo do Centro de Promoção de Saúde (grupo HPC, 4.014 soros) e o grupo de pacientes (13.663 soros) de todos os departamentos clínicos do hospital - nos quais foram testados o HBsAg, o anti-HBc e o anti-HBs, a investigação da presença de IOB encontrou prevalência de 8,9% do anti-HBc+ isolado significativamente mais elevada no grupo de pacientes do que no grupo do HPC. O VHB-DNA foi detectado somente em 1,7% (4/230) dos indivíduos com anti-HBc+ isolado, que eram pacientes com condições não relacionadas à doença crônica do fígado76.
Semelhante ao estudo em Juruti, uma investigação sobre a prevalência de IOB entre 1.401 pacientes e hemodialisados crônicos, do Japão oriental, encontrou 0,6% HBsAg+, com VHB-DNA+, entre os 212 pacientes HBsAg− com anti-HBc+; três amostras foram positivas para VHB-DNA, concluindo-se que a prevalência de IOB na amostra japonesa era de 0,3%77. Outro estudo sobre a prevalência de IOB entre 1.451 indivíduos australianos portadores de doença hepática encontrou 0,7% de pacientes que atendiam aos critérios de IOB78.
A prevalência de IOB entre pessoas com história familiar de hepatite crônica pelo VHB não está bem esclarecida. Ao examinarem 747 soros de indivíduos chineses HBsAg−, com história familiar de infecção crônica pelo VHB, e 579 doadores de sangue voluntários com HBsAg−, Zhang et al.79 encontraram prevalência de IOB de 8,0% nos indivíduos com uma história familiar de infecção crônica pelo VHB e de 2,6% entre os doadores de sangue.
Os vários aspectos da IOB ainda são incompreendidos, inclusive a própria definição e a padronização laboratorial. Apesar do desenvolvimento, em todo o mundo, de vários estudos com o objetivo de definir a prevalência e os fatores que podem contribuir para o surgimento da IOB, como área geográfica, testes laboratoriais utilizados e população investigada, ainda não se estabeleceu completamente o seu significado como entidade clínica.
Há que se definir o impacto da IOB na conjuntura clínica e na progressão para cirrose e CHC, se a IOB pode ser reativada sob imunossupressão ou se pode ser transmitida por meio de transfusões de sangue e transplantes de órgãos. Com relação à saúde pública, sua importância clínica está ligada ao risco de transmissão do VHB, sendo importante determinar os grupos de risco para a IOB, visando prevenir a transmissão68.
Deve ser dada a devida importância ao marcador sorológico de infecção prévia ou atual pelo VHB, o anti-HBc, o qual deve ser utilizado na triagem de doadores de sangue e de órgãos, em pacientes submetidos à quimioterapia ou em tratamento com imunossupressores, em indivíduos submetidos à hemodiálise e portadores de infecção por VHC, VHD e HIV, cujo resultado positivo isolado deverá ser acompanhado da pesquisa do VHB-DNA, para se confirmar ou excluir a presença de IOB.
CONCLUSÃO
A prevalência dos marcadores sorológicos da hepatite B encontrada na população examinada caracterizou o município de Juruti como de baixa endemicidade para o VHB.
Os achados deste estudo indicaram a presença de portadores de IOB em 0,1% da população de Juruti. A baixa prevalência de IOB encontrada provavelmente está relacionada à baixa endemicidade do VHB nessa população. Em nenhum dos indivíduos com IOB foi encontrada coinfecção com VHC, VHD e HIV.
Estudos adicionais deverão ser realizados, envolvendo um maior número de amostras em outras localidades, para avaliar qual o papel da IOB na evolução da doença hepática; sua importância entre doadores de sangue e órgãos, imunossuprimidos, hemodialisados e doentes renais; e sua participação nas coinfecções com VHC, VHD e HIV, assim como a respectiva necessidade de desenvolvimento e incorporação nos protocolos de pesquisa e tratamento de novas tecnologias para a sua detecção.











 texto em
texto em 


